La duración anormal del intervalo QT o su dispersión se han asociado con un incremento en el riesgo de arritmias ventriculares. Se analiza el posible efecto arritmogénico de sus variaciones inducidas mediante enfriamiento y calentamiento local epicárdico.
MétodosEn 10 corazones aislados de conejo, se modificó escalonadamente la temperatura de una región epicárdica del ventrículo izquierdo (22 a 42°C), registrando simultáneamente los electrogramas en dicha zona y en otra del mismo ventrículo. En ritmo sinusal, se determinó el QT y el intervalo de recuperación de la activación y, mediante estimulación programada, la velocidad de conducción y la inducción de arritmias ventriculares.
ResultadosEn la zona modificada respecto al valor basal (37°C), el QT se prolongó en hipotermia máxima (195±47 frente a 149±12ms; p<0,05) y se acortó en hipertermia (143±18 frente a 152±27ms; p<0,05). El intervalo de recuperación de la activación tuvo el mismo comportamiento. La velocidad de conducción disminuyó en hipotermia y aumentó en hipertermia. No hubo cambios en la otra zona. Se observaron respuestas repetitivas en cinco experimentos, pero no se encontró dependencia entre su aparición y las condiciones de hipotermia e hipertermia inducidas (p>0,34).
ConclusionesEn el modelo experimental empleado, las variaciones locales de la temperatura epicárdica modulan el intervalo QT, el intervalo de recuperación de la activación y la velocidad de conducción. Las heterogeneidades inducidas no han favorecido la inducción de arritmias ventriculares.
Palabras clave
La utilidad clínica de medir los cambios en la duración del intervalo QT en el electrocardiograma es un tema de creciente interés. La anormal duración de los intervalos QT tanto en acortamiento como alargamiento se ha demostrado asociada a riesgos añadidos por arritmias ventriculares malignas1–8. La dispersión del QT se ha propuesto como índice de heterogeneidad de la repolarización ventricular, predictor de futuras taquiarritmias ventriculares9–12. La dispersión del QT se define como la diferencia entre el más largo y el más corto de los intervalos QT obtenidos de las 12 derivaciones del electrocardiograma. Este indicador se puede corregir en función del ritmo cardiaco13, aunque hay cierta controversia sobre la conveniencia de usar la dispersión del QT corregida.
La modificación controlada del intervalo QT en modelos experimentales puede resultar útil en el estudio de los mecanismos de las arritmias cardiacas. En la electrofisiología cardiaca influyen agentes físicos o farmacológicos; la temperatura es del primer grupo. En consecuencia, tanto la hipotermia como la hipertermia pueden emplearse como herramienta para modificar los valores basales de, entre otros parámetros, el intervalo QT en estudios con corazón aislado. Si las modificaciones térmicas son de carácter localizado, los efectos locales en el intervalo QT tienen como consecuencia un aumento de la dispersión del QT, de modo que se puede reproducir situaciones presuntamente arritmogénicas. En el electrocardiograma de superficie, el alargamiento del intervalo QT y el ensanchamiento del complejo QRS son manifestaciones típicas de situaciones hipotérmicas14,15. También lo es una ralentización del ritmo cardiaco cuando la hipotermia es generalizada, y en tal caso afecta al nódulo sinoauricular. Existen muy pocos estudios, incluso con modelos experimentales, que analicen el efecto en el intervalo QT de las variaciones localizadas de temperatura. En el presente trabajo se empleó un dispositivo que modifica la temperatura en la misma zona de contacto con la superficie epicárdica cuya actividad eléctrica se está registrando. Los aspectos técnicos de este procedimiento se han descrito previamente, y se ha puesto de manifiesto su capacidad para modular localmente el sustrato electrofisiológico del epicardio en una aplicación preliminar16.
En el modelo experimental de corazón aislado, la heterogeneidad en el sustrato electrofisiológico del tejido inducida mediante modificaciones térmicas locales podría facilitar la aparición de respuestas repetitivas o fibrilación ventricular. En el presente trabajo se evalúa el posible efecto arritmogénico de la dispersión inducida en el QT mediante el sistema desarrollado.
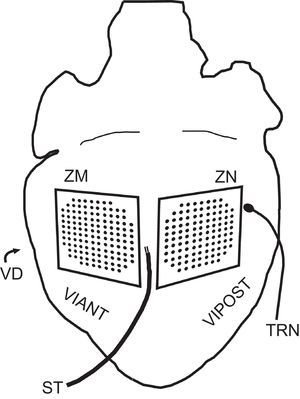
MÉTODOSPreparación experimental. Modificación de la temperaturaLos experimentos se realizaron siguiendo el Real Decreto 1201/2005, de 10 de octubre, sobre utilización de animales17. Se utilizaron 10 conejos de la raza Nueva Zelanda (peso promedio, 2,5±0,3kg). Después de la anestesia con ketamina (intramuscular, 35mg/kg) y heparinización, los animales se sacrificaron por dislocación cervical. Los corazones (peso promedio, 8,9±1,5g) se retiraron y se sumergieron en una solución de Tyrode frío (4°C). Después del aislamiento, la aorta se conectó a un sistema de Langendorff para la perfusión de la solución de Tyrode a una presión de 60mmHg y una temperatura de 37±0,5°C. La composición milimolar del fluido de perfusión fue: 130,0 NaCl, 24,2 NaHCO3, 4,7 KCl, 2,2 CaCl2, 1,2 NaH2PO4, 0,6 MgCl2 y 12,0 glucosa. La oxigenación se llevó a cabo con una mezcla del 95% O2 y 5% CO2. En la pared anterior del ventrículo izquierdo (zona modificada), se situó un electrodo múltiple para cartografía epicárdica con un dispositivo termoeléctrico integrado (128 electrodos unipolares; 1mm de distancia entre electrodos) para la modificación y el control de la temperatura16. En la superficie epicárdica de la pared posterolateral del mismo ventrículo (zona no modificada), se colocó un electrodo múltiple convencional (103 electrodos unipolares; 1mm de distancia entre electrodos). La temperatura de ambas zonas se monitorizó mediante sendos termopares tipo K. El primero de ellos estaba integrado en la superficie de registro del dispositivo modificador; el segundo se dispuso en un área del epicardio ventricular de la pared posterior del ventrículo izquierdo distante de la zona modificada. Se utilizó un electrodo bipolar de estimulación epicárdica (diámetro, 0,125mm; distancia entre electrodos, 1mm) situado entre las áreas cubiertas por los dos electrodos (figura 1) y conectado a un estimulador GRASS S88 provisto de unidad de aislamiento de estímulos. Los estímulos se proporcionaron mediante un tren de impulsos rectangulares de 2ms de duración y voltaje igual al doble del umbral diastólico. Los registros de los electrogramas se obtuvieron mediante un sistema de mapeo eléctrico de la actividad cardiaca (MAPTECH; Waalre, Países Bajos). El electrodo de referencia consistió en una placa de 4×6mm de plata situada sobre la aorta canulada. Todas las señales se amplificaron con una ganancia de 100-300Hz, se filtraron (ancho de banda, 1-400Hz), se multiplexaron y se digitalizaron (resolución, 12 bits). La frecuencia de muestreo por canal fue de 1.000Hz. Las temperaturas de los termopares se registraron por medio de termómetros digitales Fluke® (Fluke Co.; Everett, Washington, Estados Unidos).
Representación esquemática de la situación de los electrodos en la preparación experimental utilizada. ST: estimulador; TRN: termopar; VD: ventrículo derecho; VIANT: pared anterior del ventrículo izquierdo; VIPOST: pared posterior del ventrículo izquierdo; ZM: zona modificada; ZN: zona no modificada.
Transcurridos 15min desde el posicionado de los electrodos, la temperatura en la zona modificada se redujo en escalones de 5°C mediante regulación de la corriente eléctrica del dispositivo termoeléctrico. En cada escalón (en este orden: 37, 32, 27, 22, 37, 42 y 37°C), la temperatura epicárdica se estabilizó durante al menos 2min antes del registro eléctrico previo a la estimulación eléctrica.
Protocolo de estimulación eléctricaEn cada uno de los escalones de temperatura alcanzados, se aplicó el test del extraestímulo ventricular con 10 impulsos de tren base, disminuyendo el intervalo de acoplamiento del estímulo adicional en escalones de 5ms desde el ciclo base hasta la pérdida de captura. La operación se repitió con 1, 2 y 3 extraestímulos, en ese orden. En el caso de 2 y 3 extraestímulos, los anteriores al último se fijaron a un valor 15ms mayor que el intervalo en que produjeron pérdida de captura en el test precedente. La operación se repitió para dos ciclos base: 250 y 150ms.
Datos analizadosEn cada una de las dos regiones analizadas y con cada una de las diferentes temperaturas, se obtuvo en ritmo sinusal: a) el intervalo QT medido desde el inicio de la activación hasta el final de la onda T, considerando el instante en que se produce el cambio en la pendiente de la onda o la intersección con la línea isoeléctrica18 (promedio de cinco determinaciones), y b) el intervalo de recuperación de la activación (IRA) medido desde el instante de máxima pendiente negativa del complejo QRS hasta el instante de máxima pendiente de la onda T19 (promedio de cinco determinaciones). En estimulación programada: a) el número de respuestas repetitivas, contabilizando 1 unidad cuando, tras un extraestímulo, aparecían una o varias despolarizaciones espontáneas no producidas directamente por la estimulación externa o provenientes del nódulo sinusal, y b) la velocidad de conducción (VC) longitudinal a partir de los mapas de activación obtenidos con un ciclo de estimulación básico de 250ms, calculada como el cociente entre la distancia que separa dos electrodos situados en la dirección perpendicular a las isocronas distantes entre sí al menos 5mm, uno de ellos próximo a la estimulación, y la diferencia entre sus instantes de activación20.
Análisis estadísticoLos datos se presentan como media±desviación estándar. Las comparaciones entre dos grupos de datos se han realizado mediante el test de la t de Student para datos apareados, mientras que para las comparaciones en un conjunto de datos se ha empleado el análisis de la varianza de un factor (análisis de la varianza para medidas repetidas). La determinación de la dependencia entre variables se ha realizado mediante el test de la χ2 para tablas de contingencia. Las regresiones lineales entre pares de variables se han efectuado utilizando el método de mínimos cuadrados. Se han considerado significativas las diferencias con valores de p<0,05. En el análisis estadístico se ha empleado el paquete de análisis estadístico SPSS® (SPSS Inc.), así como la hoja de cálculo del paquete Microsoft® Office, Excel 2007.
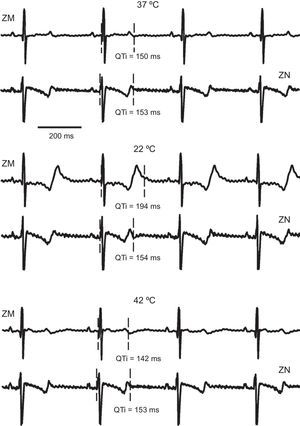
RESULTADOSIntervalo QTLa figura 2 ilustra el efecto de los cambios locales de temperatura en este parámetro. Se muestran señales epicárdicas de un experimento, correspondientes a un electrodo situado en la zona modificada y otro en la no modificada, a la temperatura de perfusión, en hipotermia máxima y en hipertermia. Este efecto se pone de manifiesto al producirse una prolongación del intervalo QT por acción del enfriamiento local en la zona de actuación del dispositivo, mientras que en la otra zona este parámetro no sufre cambios significativos. De igual manera, el calentamiento del área de actuación produce una reducción del intervalo QT que no se refleja en la zona distante.
Segmentos de electrogramas registrados simultáneamente en un canal de la zona modificada y otro de la no modificada, en condiciones de control (37°C), hipotermia (22°C) e hipertermia (42°C), correspondientes a uno de los experimentos. QTi: intervalo QT; ZM: zona modificada; ZN: zona no modificada.
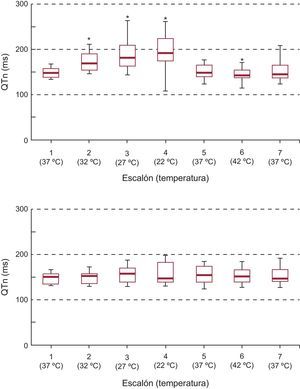
La figura 3 muestra la secuencia de variación del intervalo QT en la zona modificada y no modificada. Las modificaciones térmicas de carácter localizado han producido variaciones en el QT respecto a la situación basal dentro de esa zona. De igual manera, han producido diferencias respecto al QT de la zona distante. Los cambios en el QT de la zona no modificada no fueron significativos (p<0,92).
Diagramas de cajas con la evolución del intervalo QT en las zonas modificada y no modificada en los distintos escalones de temperatura. QTm: intervalo QT en la zona modificada; QTn: intervalo QT en la zona no modificada.
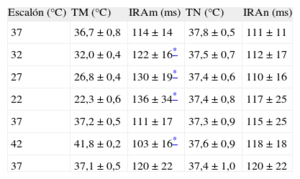
*Diferencias significativas respecto al escalón 1 (37°C) en la zona modificada y respecto a la zona no modificada (p<0,05).
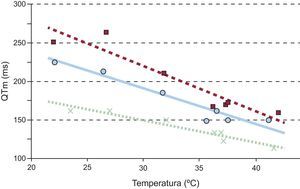
La relación del intervalo QT en la zona modificada con la temperatura se ajustó en todos los casos a una línea recta (0,80<|r|<0,97; p<0,05). La figura 4 muestra dicho ajuste en tres de los experimentos. Aplicando la regresión al conjunto de puntos de todos los experimentos, la recta que se obtiene es: intervalo QT en la modificada=−2,93 · temperatura de la zona modificada+261 (r=−0,67; p<0,0001).
Intervalo de recuperación de la activaciónLos resultados del IRA en la zona modificada y la no modificada, junto con las temperaturas alcanzadas en cada escalón, se muestran en la tabla. Al igual que ocurre con el intervalo QT, las modificaciones térmicas de carácter localizado han producido variaciones en el IRA respecto a la situación basal dentro de esa zona. De igual manera, han producido diferencias respecto al IRA de la zona distante. Los cambios respecto a la situación basal en el IRA de la zona no modificada no alcanzaron significación estadística (p<0,89).
Temperaturas e intervalos de recuperación de la activación durante ritmo sinusal (n=10)
| Escalón (°C) | TM (°C) | IRAm (ms) | TN (°C) | IRAn (ms) |
| 37 | 36,7±0,8 | 114±14 | 37,8±0,5 | 111±11 |
| 32 | 32,0±0,4 | 122±16* | 37,5±0,7 | 112±17 |
| 27 | 26,8±0,4 | 130±19* | 37,4±0,6 | 110±16 |
| 22 | 22,3±0,6 | 136±34* | 37,4±0,8 | 117±25 |
| 37 | 37,2±0,5 | 111±17 | 37,3±0,9 | 115±25 |
| 42 | 41,8±0,2 | 103±16* | 37,6±0,9 | 118±18 |
| 37 | 37,1±0,5 | 120±22 | 37,4±1,0 | 120±22 |
IRAm: intervalo de recuperación de la activación de la zona modificada; IRAn: intervalo de recuperación de la activación de la zona no modificada; TM: temperatura de la zona modificada; TN: temperatura de la zona no modificada.
En la zona modificada, se ha observado una reducción significativa de la VC con la hipotermia (68±16cm/s a 22°C frente a 75±16cm/s a 37°C; p<0,05) y un aumento con la hipertermia (80±18cm/s a 42°C frente a 75±16cm/s a 37°C; p<0,05), mientras que, en la zona no sometida a modificaciones térmicas, los cambios en este parámetro no alcanzaron significación estadística (75±20 frente a 69±15cm/s; p>0,22; y 76±23 frente a 69±15cm/s; p>0,26).
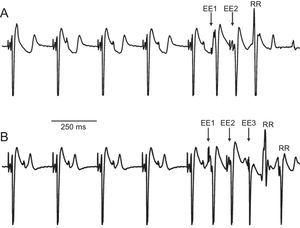
Presencia de respuestas repetitivasEl análisis de las señales obtenidas del total de ejecuciones del test del extraestímulo ventricular tras la aplicación del protocolo experimental dio lugar a la observación de respuestas repetitivas en cinco de los 10 corazones (figura 5). Se contabilizaron en total 49 respuestas repetitivas (37 de ellas concentradas en solo dos de los experimentos). Del conjunto de respuestas repetitivas, 24 se produjeron a la temperatura basal, 16 en alguno de los escalones de hipotermia y 9 durante la hipertermia. Tras la realización de la prueba de la χ2 para tablas de contingencia, no se ha encontrado dependencia entre la aparición de respuestas repetitivas y la condición de hipotermia o hipertermia inducida localmente (p>0,34). La estimulación programada no llegó a inducir fibrilación ventricular, excepto en un único caso (producido a 22°C), en el que, tras la reversión por choque eléctrico y continuación del protocolo, no volvió a reproducirse.
Ejemplo de inducción de respuestas repetitivas mediante protocolo con extraestímulos en dos experimentos diferentes. A: evento de respuesta repetitiva simple tras dos extraestímulos (22°C). B: respuesta repetitiva doble tras tres extraestímulos (27°C). EE: extraestímulos; RR: respuestas repetitivas.
En relación con el intervalo QT, las modificaciones térmicas localizadas efectuadas gradual y escalonadamente en el epicardio producen un progresivo aumento del intervalo QT en la zona modificada con el enfriamiento. De la misma manera, el calentamiento de la zona produce una reducción del intervalo QT. En ambos casos, los cambios se producen sin afectar a la zona del mismo ventrículo no sometida a variaciones de temperatura. Las modificaciones inducidas desaparecen al volver a la temperatura de perfusión, lo que muestra la reversibilidad del efecto. En cuanto a la comparación entre zonas, los cambios observados entre ambas permiten afirmar que las modificaciones locales de temperatura efectuadas en la zona modificada alteran significativamente el intervalo QT respecto a la zona no modificada (figura 3). Los resultados a 22 y 42°C concuerdan con los obtenidos durante la validación técnica del dispositivo modulador, en la que se analizaron únicamente los efectos a esas dos temperaturas16.
Los cambios observados en el intervalo QT se han acompañado de cambios proporcionales en el IRA, que está correlacionado con el periodo refractario21. Por otra parte, la VC ha disminuido durante la hipotermia y ha aumentado durante la hipertermia en la zona de actuación. Esto último estaría relacionado, entre otros factores, con las alteraciones del potencial de reposo y, por lo tanto, de la fase cero del potencial de acción22,23. Las modificaciones en la refractariedad y la VC inducidas térmicamente habrían originado cambios en la propagación de la activación, tal y como se ha observado en trabajos previos22,24–26.
Tanto en hipotermia como en hipertermia, las modificaciones del intervalo QT de carácter localizado han originado heterogeneidad en los valores del QT del miocardio ventricular, más acusada cuanto mayor es el gradiente térmico entre zonas.
Aunque diversos autores14,15 ya habían descrito la alteración del intervalo QT por la temperatura, la flexibilidad del método empleado para modificarla de manera gradual y controlada por encima y por debajo de la situación basal ha permitido analizar la dependencia entre ambos parámetros. Se observa que hay moderada correlación entre el intervalo QT de la zona modificada y la temperatura, y que dicha relación se ajusta a una recta en la franja analizada (figura 4).
Inducción de arritmias ventricularesLa actuación térmica de carácter localizado sobre el epicardio ventricular ha dado lugar a la creación de regiones próximas con diferentes propiedades electrofisiológicas, lo que se ha traducido en dispersión de los parámetros analizados. Diversos estudios han atribuido a la dispersión del intervalo QT un efecto arritmogénico9,11. En el presente estudio se ha investigado la aparición de respuestas repetitivas ventriculares como indicador de la arritmogenicidad del sustrato miocárdico mediante un protocolo de estimulación programada27,28. La aplicación de estímulos con intervalo de acoplamiento corto en la proximidad de la zona alterada durante la realización de las modificaciones térmicas no ha modificado significativamente la producción de este tipo de respuestas.
Los cambios introducidos en el epicardio no han sido, por lo tanto, capaces de instaurar condiciones arritmogénicas que se manifestaran en repuestas repetitivas o taquicardias ventriculares. Ello podría atribuirse a una insuficiente dispersión del QT. Su origen estaría en limitaciones relacionadas con el alcance de las variaciones térmicas inducidas en el miocardio, tanto en extensión como en profundidad, aspecto que se analizó en la evaluación previa del dispositivo16.
En cuanto a las modificaciones inducidas por la temperatura en la propia zona modificada, las variaciones de la VC y la refractariedad (asociada indirectamente al intervalo QT y el IRA), al actuar de manera simultánea y contrapuesta, pueden haber contribuido a pequeños cambios en la longitud de onda. Este hecho también podría explicar, junto con la limitada extensión de la región afectada, la ausencia de incremento en la inducibilidad de arritmias por la hipotermia o la hipertermia en el modelo utilizado.
En otro trabajo, basado en un modelo experimental en el que se enfrió localmente una lámina aislada de epicardio29, se indujeron taquicardias ventriculares mediante estimulación programada con trenes de pulsos de 300ms de ciclo base seguidos de hasta tres extraestímulos. Durante la hipotermia, la generación de estas taquicardias polimórficas fue propiciada por circuitos funcionales de reentrada. Esta discrepancia respecto a los resultados del presente estudio podría tener explicación por tratarse de un modelo bidimensional, en el que la pérdida de vascularización resultado de la ablación practicada haría que el enfriamiento fuese más efectivo, con la consecuente repercusión en la electrofisiología del tejido. Por otra parte, la activación en la lámina de tejido de 1mm de grosor obtenida por crioablación podría diferir sustancialmente de la que se tiene en el sustrato del modelo del presente estudio. En cualquier caso, en este modelo de alteración electrofisiológica las modificaciones térmicas locales no han evidenciado respuestas arritmogénicas, muy probablemente por ser insuficiente el grado de dispersión inducido en el QT.
CONCLUSIONESLa hipotermia localizada induce heterogeneidad en el QT al prolongarlo en el área modificada; dicha prolongación se acompaña de un alargamiento del IRA y una disminución de la VC. De la misma manera, la hipertermia local aumenta la dispersión en el QT por la reducción del intervalo en el área modificada, produciéndose un acortamiento del IRA y un incremento de la VC. Durante la hipotermia, la magnitud del efecto depende del grado de variación térmica alcanzado, y hay relación lineal entre temperatura y QT en el margen estudiado.
En el presente modelo experimental, aunque las variaciones locales de la temperatura epicárdica han modificado significativamente el intervalo QT, junto con la VC y el IRA, la dispersión inducida no ha llegado a tener efectos arritmogénicos, probablemente por no abarcar una zona de tejido lo suficientemente extensa.
FINANCIACIÓNEste trabajo ha sido subvencionado por las ayudas a la investigación: FIS PI12/00993-00407 (Instituto de Salud Carlos III), PROMETEO 2010/093 (Generalitat Valenciana) y VLC Campus de Excelencia «Protección Cardiovascular».
CONFLICTO DE INTERESESNinguno.