El progreso científico ha conducido al descubrimiento de un amplio abanico de nuevos biomarcadores asociados con la evolución de la enfermedad cardiovascular. Estos biomarcadores permiten afinar la evaluación del riesgo y mejorar la morbimortalidad cardiovascular con independencia de los factores de riesgo convencionales identificados hasta el momento, como son la hipercolesterolemia y, en el caso del trasplante cardiaco (TxC), los anticuerpos circulantes específicos contra antígenos del donante (donor-specific antibodies [DSA]). Algunos de estos biomarcadores resultarían herramientas diagnósticas relevantes para la práctica clínica. Por ejemplo, se ha señalado al ST2 como posible biomarcador del rechazo del alotrasplante en receptores de TxC2. Un biomarcador novedoso que se ha identificado en relación con el pronóstico de la insuficiencia cardiaca (IC) es la galectina-3 (Gal-3). La Gal-3 es una lectina de unión a la betagalactosidasa, secretada por los macrófagos activados, que suscita un interés creciente al tratarse de un nuevo biomarcador que expresa la inflamación y la fibrosis tisular. Los valores de Gal-3 elevados se asocian no solo con la disfunción del ventrículo izquierdo y un pronóstico desfavorable de los pacientes con IC3, sino también a un aumento de los riesgos de incidencia de la IC y de mortalidad en la población general4. Sin embargo, se dispone de escasos datos sobre los cambios longitudinales de los valores séricos de Gal-3 en línea con la mejora de la función cardiaca, su cambio con respecto a la reversión del estadio de IC tras el TxC y su valor pronóstico postrasplante.
Se ha detectado fibrosis miocárdica en las biopsias endomiocárdicas seriadas de alotransplante coronario, lo que la convierte en un factor significativo que contribuye a la aparición de la fisiología restrictiva coronaria en los receptores de TxC5. Aunque la Gal-3 haya demostrado correlación con la fibrosis y el remodelado de los pacientes con IC, las concentraciones séricas de Gal-3 más elevadas tras el TxC no se asociaron con la fibrosis miocárdica avanzada del reemplazo ni con el grado de hipertrofia de los cardiomiocitos del alotransplante coronario, según la evaluación de las biopsias endomiocárdicas a los 3 años del TxC6. Así pues, la importancia y la función de la Gal-3 tras el TxC exigen un estudio de mayor calado.
En un artículo publicado recientemente en Revista Española de Cardiología, Suárez-Fuentetaja et al. abordan esta importante cuestión7 al analizar de manera retrospectiva las muestras séricas conservadas de 99 participantes para las determinaciones de Gal-3 antes y 1, 3, 6 y 12 meses tras el TxC, con el fin de establecer su valor pronóstico de muerte por cualquier causa o disfunción del injerto. Su estudio aporta un valioso conocimiento acerca de la importancia futura de la Gal-3 como biomarcador de TxC. En concreto, Suárez-Fuentetaja et al. ponen de manifiesto un declive gradual, en su conjunto, de los valores de Gal-3 al año del TxC. No obstante, una reducción significativa de la concentración del biomarcador se demostró únicamente a los 6 meses, mientras que las concentraciones medidas 1 y 3 meses tras el TxC se mantuvieron inalteradas frente a los valores previos al trasplante7. Estos hallazgos respaldan los datos de los estudios previos que demostraban la persistencia a corto plazo de la Gal-3 aumentada tras el TxC8. La reducción de Gal-3 a lo largo de 1 año apunta a una reversión gradual, aunque progresiva, gracias al trasplante, de las alteraciones hemodinámicas, renales y fisiopatológicas sistémicas propias del estadio de IC avanzada previo al TxC.
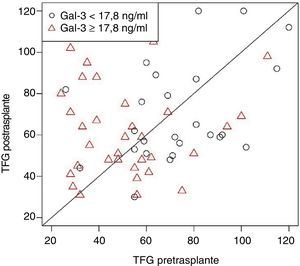
De manera semejante, otros biomarcadores, como el péptido natriurético cerebral y el ST2, mostraron concentraciones plasmáticas tras el TxC inferiores a los valores previos al trasplante6. Sin embargo, es preciso subrayar que este hallazgo difiere de un estudio previo que no demostró cambios en los valores de Gal-3 tras el trasplante6. Según se argumenta más adelante, dicho hallazgo estaría condicionado por las diferencias entre ambos estudios relativas al momento de medir la Gal-3 tras el TxC. Además, se ha demostrado que los valores postrasplante de Gal-3 son superiores entre los pacientes con Gal-3 elevada antes del TxC que entre aquellos con concentraciones inferiores (fig. 1). El porcentaje de los pacientes que presentaban valores elevados de Gal-3 antes del trasplante en el estudio de Grupper et al. (44%) superaba al publicado por Suárez-Fuentetaja et al. (34%), hecho que explicaría la ausencia generalizada de un descenso significativo de las concentraciones de Gal-3 tras el trasplante en el análisis de Grupper et al.
Los valores de galectina-3 extraída al paciente tras un transplante cardiaco son superiores a los de aquellos que presentaban concentraciones elevadas de Gal-3 antes del trasplante cardiaco. El valor de p no resultó significativo después de ajustar por las variables edad, índice de masa corporal y tasa de filtrado glomerular (TFG) pretrasplante. Reproducido con permiso de Grupper A et al.6.
Se ha observado una relación inversa entre los valores séricos de Gal-3 y la función renal de los pacientes con IC9 y TxC6, lo cual implica que el incremento de los valores de Gal-3 en la IC se debería a la disfunción renal y que la capacidad pronóstica de la Gal-3 en la IC reflejaría, parcialmente al menos, las consecuencias del deterioro renal. Se ha demostrado que existe una correlación entre los valores elevados de Gal-3 y la disfunción renal en receptores de TxC y que esta es prevalente, pues la disfunción renal persiste después del TxC, sobre todo tras la administración de inhibidores de la calcineurina6. Una observación que viene a corroborar el estrecho vínculo que se establece entre la función renal y los valores de Gal-3 explicita que es mayor la reducción de las concentraciones de Gal-3 tras realizar conjuntamente un TxC y un trasplante renal que solo uno cardiaco o el transplante cardiaco y hepático combinados6. Los hallazgos de Suárez-Fuentetaja et al. aportan validez a la asociación con la función renal, ya que los análisis de regresión lineal, tanto univariable como multivariable, identificaron una asociación significativa entre la tasa de filtrado glomerular estimada y las concentraciones de Gal-3 al año del TxC7. Los autores de este estudio intentaron así dar respuesta al interrogante aún sin resolver sobre la validez clínica de la Gal-3 sérica como biomarcador pronóstico de la IC, en el contexto de su relativa falta de especificidad al ajustar por otros parámetros clínicos, en particular la función renal. Los autores demostraron que los valores de Gal-3 al año del TxC se asocian de manera significativa con un pronóstico adverso tras el TxC, a pesar del ajuste por la función renal, que se calcula a partir de la medida de la tasa de filtrado glomerular como variable continua. Se desconoce si esta relación mantendría su solidez ante la inclusión de esta disfunción como variable dicotómica en el modelo multivariable, cuestión que resulta particularmente oportuna, ya que la disfunción renal tras el TxC es el principal predictor independiente de morbimortalidad de esta población10.
La vasculopatía coronaria del alotrasplante (VCA), otra causa principal de morbimortalidad tras el TxC, deriva de un daño inicial causado al endotelio del aloinjerto que induce inflamación crónica y estenosis luminal debido a la proliferación celular de la musculatura lisa vascular y al inicio de un proceso fibrótico que frena el remodelado vascular beneficioso, con el resultado de una elevada expresión del factor de crecimiento transformador beta (TGFβ) en la íntima11. Se ha demostrado que los linfocitos T y los macrófagos modulan la patogenia de la VCA, donde los macrófagos desempeñan una función específica de regulación de la respuesta a la fibrosis12. La VCA se manifiesta en un alto porcentaje de receptores de TxC (en torno al 50% en el plazo de 5 años tras el trasplante), y la fibrosis vascular postrasplante se ha asociado con agudización de la VCA y una supervivencia desfavorable a largo plazo12,13. El estudio previo de Coromilas et al. mostró una diferencia significativa en las concentraciones de Gal-3 entre los receptores de TxC con y sin VCA, así como en los valores más elevados de los pacientes con VCA de mayor gravedad, hecho que planteaba una correlación entre la Gal-3 y la fibrosis coronaria8. Por el contrario, los hallazgos de Suárez-Fuentetaja et al. ratifican las conclusiones del estudio realizado anteriormente por Grupper et al. que sostienen que las concentraciones postrasplante de Gal-3 no se asocian de manera significativa con la presencia de VCA o de rechazo celular. Cabe destacar que el diagnóstico de VCA se estableció mediante ecocardiografía intravascular en el estudio de Grupper et al., una técnica diagnóstica de mayor sensibilidad que la coronariografía, empleada para diagnosticar la VCA en otros análisis.
El principal hallazgo del estudio de Suárez-Fuentetaja et al. radica en que los valores séricos de Gal-3 al año del trasplante se asociaron significativamente con aumento del riesgo de la variable combinada principal muerte por cualquier causa o disfunción del injerto durante una media de seguimiento de 6,7 [intervalo intercuartílico, 4,3-9,4] años7. La asociación que se estableció entre las concentraciones de Gal-3 al año del trasplante y la variable combinada del estudio mantuvo su significación estadística tras el ajuste multivariable, donde se usaron los valores de Gal-3 como variable dicotómica o como variable continua, aunque se mostró menos significativa en el primer caso. No obstante, hubo una diferencia estadísticamente significativa en los antecedentes de disfunción del injerto primario entre los grupos de Gal-3 alta y baja, donde los receptores de TxC con valores superiores de Gal-3 mostraron una mayor prevalencia al año no solo de antecedentes de disfunción del injerto, sino también de presión de la aurícula derecha elevada, frente al grupo de TxC con valores inferiores de Gal-3 (respectivamente, el 29 frente al 11%; p = 0,02; y 11 frente a 9 mmHg; p = 0,01). Se ignora si la asociación independiente de las concentraciones de Gal-3 con el objetivo combinado de muerte por cualquier causa o disfunción del injerto mantendría su validez tras el ajuste por antecedentes de disfunción del injerto, puesto que esta variable no se incluyó en el modelo pronóstico multivariable. Hay que añadir que los autores no mencionan si encontraron diferencias en el caso de la presencia de DSA pretrasplante o DSA de novo aparecidos tras el TxC. La presencia de DSA es un predictor independiente y destacado de los principales eventos cardiovasculares adversos que sobrevienen a largo plazo a los receptores de TxC1,13,14 y debe ajustarse en los estudios pronósticos del TxC. El único estudio que evaluó la asociación entre los valores séricos de Gal-3 y la morbimortalidad a largo plazo fue el de Grupper et al., en el que participó una cohorte de 62 receptores de TxC y no se demostró asociación alguna entre las concentraciones de Gal-3 y la función del injerto o la mortalidad a largo plazo tras el TxC durante una media de seguimiento semejante, 6,7 años. El estudio sí probó, en cambio, que había una diferencia significativa en múltiples parámetros relativos a la capacidad de ejercicio físico entre uno y otro grupo de valores elevados y reducidos de Gal-3, aunque esta diferencia no persistió al ajustar por la edad, el índice de masa corporal y la función renal previa al trasplante. Tampoco se halló una diferencia significativa en ninguno de los 2 estudios en relación con la tasa de complicaciones, pues esta se adscribe a la variable mortalidad. La diferencia notable entre ambos estudios, que explicaría estos resultados contradictorios, estriba en que la valoración pronóstica se estima a partir de las concentraciones de Gal-3 antes del trasplante en el estudio de Grupper et al., mientras que en el análisis de Suárez-Fuentetaja et al. se utilizan valores de Gal-3 al año del TxC. Esto sucedió, en parte, debido a la variabilidad del momento de la recogida de las muestras séricas para la determinación de Gal-3 tras el TxC (3657 frente a 365 [54-767] días tras el TxC6). Los hallazgos de estos 2 estudios en lo que respecta a los valores de Gal-3 y los resultados clínicos se ilustran en la figura 2.
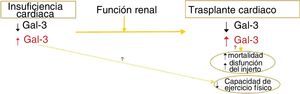
Diagrama de la variabilidad de las concentraciones plasmáticas de galectina-3 (Gal-3) en la insuficiencia cardiaca y tras un trasplante cardiaco, condicionadas parcialmente por la función renal, y de la asociación con el pronóstico postrasplante de los valores de Gal-3 elevados antes y después del trasplante cardiaco.
Si bien el avance de inmunosupresores más eficaces ha mejorado la supervivencia tras el trasplante y la función del aloinjerto, son frecuentes los fracasos a la hora de equilibrar el uso idóneo de la inmunosupresión que reduzca la infección y las neoplasias malignas mientras se previene el rechazo crónico y agudo. El tratamiento inmunosupresor individualizado requiere de una estimación y una predicción del riesgo específico más precisas para cada paciente de las complicaciones postrasplante a largo plazo. Los datos presentados por Suárez-Fuentetaja et al.7 reflejan la búsqueda de una mejor comprensión de la función pronóstica postrasplante de los biomarcadores y destacan la importancia de incorporar dichos biomarcadores para cumplir la promesa de la medicina de precisión. Los resultados aportados en el presente estudio necesitarán, con toda probabilidad, validarse prospectivamente en un entorno multicéntrico tras ajustar por variables como los DSA, pero es un primer paso importante en la identificación de un biomarcador postrasplante que pudiera incorporarse a la práctica clínica. Actualmente, es improbable que un único biomarcador sea de utilidad clínica en el TxC, como ponen de manifiesto las relativamente bajas sensibilidad (57%) y especificidad (75%) de la Gal-3 para la muerte o la disfunción del injerto. Tendría que idearse un modelo multivariable que integrase los factores de riesgo clínicos, bioquímicos y de diagnóstico por la imagen al objeto de mejorar el valor predictivo de dichas pruebas.
FINANCIACIÓNN.L. Pereira recibe financiación parcial de la beca R21AG53512 concedida por el National Institute on Aging estadounidense.
CONFLICTO DE INTERESESNinguno.