Los valores plasmáticos de galectina-3 (Gal-3) están elevados y se correlacionan con la mortalidad total y cardiovascular en pacientes con insuficiencia cardiaca, pero su correlación con el pronóstico tras el trasplante cardiaco (TxC) es desconocida. El objetivo fue describir la tendencia evolutiva y el valor pronóstico de este biomarcador tras el TxC.
MétodosMediante enzimoinmunoensayo, se midieron las concentraciones plasmáticas de Gal-3 en muestras de suero de 122 receptores de TxC, antes y 1, 3, 6 y 12 meses después de este. Mediante regresión de Cox se analizó el valor pronóstico del valor plasmático de Gal-3 a los 12 meses del TxC. El objetivo primario del estudio fue la variable combinada muerte o disfunción del injerto.
ResultadosLas concentraciones de Gal-3 disminuyeron progresivamente durante el primer año tras el TxC (medianas: pretrasplante, 19,1 ng/ml; 1 año postrasplante, 14,6 ng/ml; p<0,001). Los valores de Gal-3 1 año tras el TxC se asociaron con mayor riesgo de muerte o disfunción del injerto (HR por 1 ng/ml: 1.04; IC95%: 1,01-1,08; p=0,008). La capacidad predictiva del biomarcardor fue moderada: área bajo la curva ROC, 0,72 (IC95%: 0,60-0,82; p<0,001).
ConclusionesLas concentraciones plasmáticas de Gal-3 disminuyeron progresivamente durante el primer año tras el TxC. Un valor plasmático elevado de Gal-3 1 año tras el TxC se correlacionó con un pronóstico adverso.
Palabras clave
Vídeo del artículo

La proteína galectina-3 (Gal-3) forma parte de una familia de lectinas que intervienen en la inflamación y la fibrosis en relación con el corazón y el sistema vascular1, así como otros órganos, como los riñones, el hígado y el páncreas2. El interés clínico en la concentración plasmática de Gal-3ha aumentado recientemente porque se ha constatado que esta podría ser un biomarcador útil en pacientes con enfermedad cardiovascular3. Los pacientes con insuficiencia cardiaca (IC) muestran concentraciones plasmáticas de Gal-3 particularmente elevadas4, lo cual se correlaciona significativamente con la mortalidad por cualquier causa y la mortalidad cardiovascular en esta población5.
El trasplante cardiaco (TxC) es el tratamiento de elección para los pacientes con IC avanzada, con una excelente supervivencia y calidad de vida tras la intervención quirúrgica6. La inflamación crónica y la fibrosis intersticial7, junto con la isquemia, la hipertrofia celular y el aumento de rigidez de la pared constituyen determinantes importantes de la remodelación miocárdica a largo plazo del injerto cardiaco trasplantado. La asociación de Gal-3 plasmática con los dos primeros procesos corrobora la exploración de la posible utilidad clínica de este biomarcador en receptores de TxC.
En un estudio llevado a cabo en un único centro, Coromilas et al.8 informaron de una disminución significativa de las concentraciones plasmáticas de Gal-3 tras el TxC y observaron que la elevación persistente de la concentración de Gal-3 tras el TxC se correlacionaba con una mayor ocurrencia de vasculopatía coronaria del alotrasplante (VCA). En cambio, Grupper et al.9 observaron que la concentración plasmática de Gal-3 no cambiaba de manera considerable tras el TxC, y que tampoco establecía una correlación significativa con la intensidad de la expresión miocárdica de Gal-3, el grado de hipertrofia de los cardiomiocitos o la fibrosis del injerto. Al contrario, estos autores afirmaron que la concentración plasmática de Gal-3 se hallaba muy influenciada por la función renal. Franeková et al.10 observaron una correlación significativa entre la concentración plasmática de Gal-3, evaluada 10 días después del TxC, y la fracción de eyección del ventrículo izquierdo reducida al cabo de 1 año de la intervención; no obstante, en este estudio no se halló ninguna asociación entre este biomarcador y la supervivencia.
El objetivo de nuestro estudio fue analizar la tendencia de la concentración plasmática de Gal-3 durante el primer año tras el TxC y explorar su posible valor pronóstico como biomarcador en receptores de TxC.
MÉTODOSPoblación de estudioEste estudio contó con 122 pacientes adultos que sobrevivieron por lo menos durante 1 año tras someterse al TxC ortotópico llevado a cabo en nuestra institución entre 2004 y 2014. A partir de estos pacientes pudieron almacenarse muestras plasmáticas. Estas se obtuvieron tras un protocolo prospectivo cuando el paciente fue añadido a la lista de espera para el TxC y durante las visitas clínicas o ingresos hospitalarios opcionales realizados al cabo de 1, 3, 6 y 12 meses del TxC. La concentración plasmática de Gal-3 se determinó a partir de estas muestras plasmáticas. Todos los participantes en el estudio proporcionaron el consentimiento informado por escrito y el protocolo del estudio fue aprobado por el comité ético de investigación clínica local.
Extracción y procesado de las muestrasLas muestras plasmáticas se obtuvieron por centrifugación de las muestras de sangre periférica durante 15min a 3.000 revoluciones por minuto. Una vez separado el suero de la fracción celular, se dividió en porciones de 0,5 ml y se almacenaron a –80°C.
La concentración de Gal-3 se determinó mediante enzimoinmunoanálisis (enzyme-linked immunosorbent assay, ELISA) de Gal-3 (BMG Lab-Technologies; Offenburg, Alemania). La concentración plasmática inusualmente elevada de Gal-3 se determinó mediante un valor umbral ≥ 17,8 ng/ml, basado en estudios previos8.
Obtención de los datosLos datos clínicos se extrajeron de una base de datos mantenida prospectivamente y completada a través de una revisión retrospectiva individualizada de las historias clínicas de todos los participantes en el estudio. Se registraron variables clínicas relevantes de los receptores del TxC, antes del mismo y hasta 1 año después de la intervención, así como los resultados clínicos a largo plazo. Nuestra base de datos disponía de información sobre las constantes vitales de los pacientes y los episodios de ingreso hospitalario a partir del 31 de agosto de 2016.
Resultados clínicosEl principal resultado clínico de este estudio fue la variable combinada «mortalidad por cualquier causa o ingreso hospitalario debido al fallo del injerto» durante un seguimiento prolongado de más de 1 año tras el TxC. También se analizaron por separado ambas componentes de este principal resultado compuesto. El fallo del injerto se determinó a partir de la primera hospitalización debida a síntomas característicos de la IC, junto con indicios objetivos de alteración considerable de la estructura o función del injerto, tal como reducción de la fracción de eyección del ventrículo izquierdo, fisiología restrictiva o disfunción ventricular derecha, propuestos como causa del cuadro clínico.
Al cabo de 1 año de la realización del TxC, se hizo una angiografía coronaria para determinar la presencia de VCA, que se define como una puntuación ≥ 1 según las directrices actuales de la Sociedad Internacional de Trasplante Cardiaco y Pulmonar11. También se realizaron biopsias endomiocárdicas al cabo de 1 año del TxC para determinar la presencia de rechazo agudo celular, que se define por una puntuación ≥ 1R de acuerdo con la definición consensuada12 de la Sociedad Internacional de Trasplante Cardiaco y Pulmonar.
Análisis estadísticoLas variables categóricas se presentan como proporciones, mientras que las variables continuas se muestran como media±desviación estándar, o mediana e intervalo intercuartílico, dependiendo de su distribución. En todas las comparaciones, se consideró un valor de p<0,05 para indicar la significación. Los análisis estadísticos se realizaron utilizando el programa informático de análisis estadístico SPSS Statistics para Windows, Versión 20.0 (IBM Corp.; Armonk, Nueva York, Estados Unidos).
Para analizar la tendencia de la concentración plasmática de Gal-3 durante el primer año después del TxC se utilizó el método ANOVA (análisis de la varianza) para mediciones repetidas, corregidas con el método Greenhouse-Geisser. También se utilizó el test de Wilcoxon para muestras emparejadas para comparar las concentraciones plasmáticas de Gal-3 antes del trasplante con aquellas obtenidas al cabo de 1, 3, 6 y 12 meses después de la realización del TxC.
Al aplicar el modelo de regresión lineal gradual y retrógrada, se llevó a cabo un análisis exploratorio para identificar los factores clínicos asociados a las concentraciones plasmáticas de Gal-3 al cabo de 1 año del TxC. En el primer paso del análisis de regresión lineal gradual y retrógrada, se introdujeron las variables de los candidatos que reflejaban las características clínicas de los receptores antes del TxC y al cabo de 1 año del trasplante, y se determinó cuáles mostraban una asociación univariable con concentraciones plasmáticas de Gal-3 al cabo de 1 año del trasplante con un valor de p<0,010.
Se utilizó la regresión de Cox para evaluar la posible asociación entre la concentración plasmática de Gal-3 al cabo de 1 año del TxC y el pronóstico a largo plazo más allá de este momento. Los pacientes incluidos en este análisis fueron sometidos a seguimiento durante un tiempo máximo de 10 años. El ajuste multivariable se realizó para controlar el posible sesgo de confusión que podría afectar a la validez de las asociaciones estadísticas detectadas entre la concentración plasmática de Gal-3 posterior al trasplante y los resultados a largo plazo. Se construyó un modelo multivariable de regresión de Cox gradual y retrógrada, que incluía en la fase inicial varias covariables que se consideraban posibles factores de confusión según la experiencia clínica, informes anteriores y/o una asociación estadísticamente significativa con la concentración plasmática de Gal-3 posterior al trasplante en nuestra cohorte. Estas covariables eran: la edad del receptor, la edad del donante, el sexo del receptor, el sexo del donante, la fracción de eyección ventricular izquierda, la presión en la aurícula derecha, el índice de filtración glomerular, la toma de tacrolimus y la de micofenolato de mofetilo.
El modelo multivariable definido se utilizó para estimar el cociente de riesgos instantáneos (hazard ratio, HR) ajustado para el principal resultado clínico del estudio (mortalidad por cualquier causa o fallo del injerto) en pacientes con una concentración plasmática de Gal-3 inusualmente elevada (≥ 17,8 ng/ml) al cabo de 1 año del trasplante comparado con el resto de la cohorte. Se utilizó el método de Kaplan-Meier para estimar la «supervivencia acumulada sin mortalidad o ingreso debido a fallo del injerto» en ambos grupos de pacientes y se utilizó la prueba de rangos logarítmicos para realizar comparaciones entre grupos.
Se evaluó la exactitud en la concentración plasmática de Gal-3 al cabo de 1 año del trasplante para predecir la ocurrencia del principal resultado clínico del estudio, así como sus dos componentes individuales durante el seguimiento a largo plazo, mediante las curvas ROC (receiver operating characteristic). El área bajo curva ROC e evaluó mediante un enfoque no paramétrico.
RESULTADOSPacientesEntre el 2004 y el 2014, 238 pacientes de edades ≥ 18 años se sometieron a TxC en nuestra institución, 202 (84,9%) pacientes sobrevivieron durante como mínimo 1 año después de la intervención. De estos participantes, 122 decidieron participar en el presente estudio.
Había muestras plasmáticas almacenadas de antes del TxC y de al cabo de 1, 3, 6 y 12 meses después del TxC para 105, 102, 102, 100 y 99 pacientes, respectivamente. Para 53 pacientes había juegos completos de mediciones consecutivas.
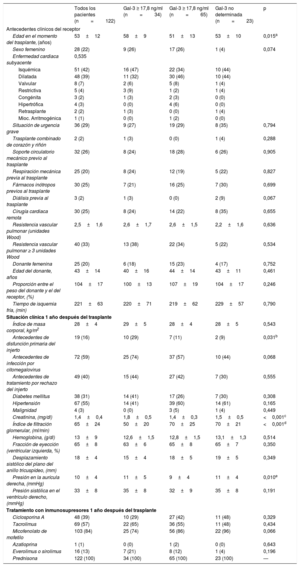
La tabla 1 muestra las características clínicas de los pacientes antes del TxC y en la visita clínica sistemática llevada a cabo 1 año después del trasplante, en ambos casos para toda la población a estudio y también en los subgrupos de pacientes con una concentración plasmática de Gal-3 elevada (≥ 17,8 ng/ml), normal (< 17,8 ng/ml) y desconocida (no determinada) al cabo de 1 año del trasplante.
Comparación de las características clínicas de los pacientes con una concentración plasmática de Gal-3 elevada (≥ 17,8 ng/ml), normal (< 17,8 ng/ml) o desconocida (no determinada) al cabo de 1 año del trasplante cardiaco
| Todos los pacientes (n=122) | Gal-3 ≥ 17,8 ng/ml (n=34) | Gal-3 ≥ 17,8 ng/ml (n=65) | Gal-3 no determinada (n=23) | p | |
|---|---|---|---|---|---|
| Antecedentes clínicos del receptor | |||||
| Edad en el momento del trasplante, (años) | 53±12 | 58±9 | 51±13 | 53±10 | 0,015a |
| Sexo femenino | 28 (22) | 9 (26) | 17 (26) | 1 (4) | 0,074 |
| Enfermedad cardiaca subyacente | 0,535 | ||||
| Isquémica | 51 (42) | 16 (47) | 22 (34) | 10 (44) | |
| Dilatada | 48 (39) | 11 (32) | 30 (46) | 10 (44) | |
| Valvular | 8 (7) | 2 (6) | 5 (8) | 1 (4) | |
| Restrictiva | 5 (4) | 3 (9) | 1 (2) | 1 (4) | |
| Congénita | 3 (2) | 1 (3) | 2 (3) | 0 (0) | |
| Hipertrófica | 4 (3) | 0 (0) | 4 (6) | 0 (0) | |
| Retrasplante | 2 (2) | 1 (3) | 0 (0) | 1 (4) | |
| Mioc. Arritmogénica | 1 (1) | 0 (0) | 1 (2) | 0 (0) | |
| Situación de urgencia grave | 36 (29) | 9 (27) | 19 (29) | 8 (35) | 0,794 |
| Trasplante combinado de corazón y riñón | 2 (2) | 1 (3) | 0 (0) | 1 (4) | 0,288 |
| Soporte circulatorio mecánico previo al trasplante | 32 (26) | 8 (24) | 18 (28) | 6 (26) | 0,905 |
| Respiración mecánica previa al trasplante | 25 (20) | 8 (24) | 12 (19) | 5 (22) | 0,827 |
| Fármacos inótropos previos al trasplante | 30 (25) | 7 (21) | 16 (25) | 7 (30) | 0,699 |
| Diálisis previa al trasplante | 3 (2) | 1 (3) | 0 (0) | 2 (9) | 0,067 |
| Cirugía cardiaca remota | 30 (25) | 8 (24) | 14 (22) | 8 (35) | 0,655 |
| Resistencia vascular pulmonar (unidades Wood) | 2,5±1,6 | 2,6±1,7 | 2,6±1,5 | 2,2±1,6 | 0,636 |
| Resistencia vascular pulmonar ≥ 3 unidades Wood | 40 (33) | 13 (38) | 22 (34) | 5 (22) | 0,534 |
| Donante femenina | 25 (20) | 6 (18) | 15 (23) | 4 (17) | 0,752 |
| Edad del donante, años | 43±14 | 40±16 | 44±14 | 43±11 | 0,461 |
| Proporción entre el peso del donante y el del receptor, (%) | 104±17 | 100±13 | 107±19 | 104±17 | 0,246 |
| Tiempo de isquemia fría, (min) | 221±63 | 220±71 | 219±62 | 229±57 | 0,790 |
| Situación clínica 1 año después del trasplante | |||||
| Índice de masa corporal, kg/m2 | 28±4 | 29±5 | 28±4 | 28±5 | 0,543 |
| Antecedentes de disfunción primaria del injerto | 19 (16) | 10 (29) | 7 (11) | 2 (9) | 0,031b |
| Antecedentes de infección por citomegalovirus | 72 (59) | 25 (74) | 37 (57) | 10 (44) | 0,068 |
| Antecedentes de tratamiento por rechazo del injerto | 49 (40) | 15 (44) | 27 (42) | 7 (30) | 0,555 |
| Diabetes mellitus | 38 (31) | 14 (41) | 17 (26) | 7 (30) | 0,308 |
| Hipertensión | 67 (55) | 14 (41) | 39 (60) | 14 (61) | 0,165 |
| Malignidad | 4 (3) | 0 (0) | 3 (5) | 1 (4) | 0,449 |
| Creatinina, (mg/dl) | 1,4±0,4 | 1,8±0,5 | 1,4±0,3 | 1,5±0,5 | <0,001c |
| Índice de filtración glomerular, (ml/min) | 65±24 | 50±20 | 70±25 | 70±21 | <0,001d |
| Hemoglobina, (g/dl) | 13±9 | 12,6±1,5 | 12,8±1,5 | 13,1±1,3 | 0,514 |
| Fracción de eyección (ventricular izquierda, %) | 65±8 | 63±6 | 65±8 | 65±7 | 0,350 |
| Desplazamiento sistólico del plano del anillo tricuspídeo, (mm) | 18±4 | 15±4 | 18±5 | 19±5 | 0,349 |
| Presión en la aurícula derecha, (mmHg) | 10±4 | 11±5 | 9±4 | 11±4 | 0,010e |
| Presión sistólica en el ventrículo derecho, (mmHg) | 33±8 | 35±8 | 32±9 | 35±8 | 0,191 |
| Tratamiento con inmunosupresores 1 año después del trasplante | |||||
| Ciclosporina A | 48 (39) | 10 (29) | 27 (42) | 11 (48) | 0,329 |
| Tacrolimus | 69 (57) | 22 (65) | 36 (55) | 11 (48) | 0,434 |
| Micofenolato de mofetilo | 103 (84) | 25 (74) | 56 (86) | 22 (96) | 0,066 |
| Azatioprina | 1 (1) | 0 (0) | 1 (2) | 0 (0) | 0,643 |
| Everolimus o sirolimus | 16 (13) | 7 (21) | 8 (12) | 1 (4) | 0,196 |
| Prednisona | 122 (100) | 34 (100) | 65 (100) | 23 (100) | — |
Gal-3; galectina-3.
Salvo otra indicación, los datos expresan n (%), o media ± desviación estándar.
Comparaciones estadísticas entre los subgrupos:
Gal-3 ≥ 17,8 ng/ml frente a < 17,8 ng/ml (p=0,005); determinación de Gal-3 frente a no determinación (p=0,921).
Gal-3 ≥ 17,8 ng/ml frente a < 17,8 ng/ml (p=0,020); determinación de Gal-3 frente a no determinación (p=0,523).
Gal-3 ≥ 17,8 ng/ml frente a < 17,8 ng/ml (p=0,001); determinación de Gal-3 frente a no determinación (p=0,632).
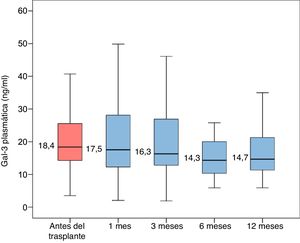
El análisis ANOVA para las mediciones repetidas reveló una tendencia estadísticamente significativa de disminución de la concentración plasmática de Gal-3 durante el primer año después del trasplante (p de tendencia lineal=0,030; figura 1).
Las concentraciones plasmáticas de Gal-3 antes del trasplante eran significativamente mayores que 6 meses después del trasplante (p=0,002) y que 1 año después del TxC (p=0,001). No obstante, las concentraciones plasmáticas de Gal-3 antes del trasplante no difirieron significativamente de las concentraciones obtenidas al cabo de 1 mes del TxC (p=0,787) o al cabo de 3 meses del TxC (p=0,750).
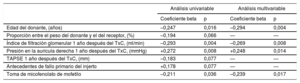
Factores clínicos relacionados con la concentración plasmática de Gal-3La tabla 2 presenta los resultados de los análisis de regresión lineal univariable y multivariable diseñados para identificar los factores clínicos asociados con las concentraciones plasmáticas de Gal-3 al cabo de 1 año del trasplante. Los resultados mostraron que las concentraciones plasmáticas de Gal-3 transcurrido 1 año del trasplante se correlacionaban directamente con la presión en la aurícula derecha e inversamente con la edad del donante, la toma de micofenolato de mofetilo y los índices de filtración glomerular al cabo de 1 año del TxC.
Variables clínicas asociadas con la concentración plasmática de Gal-3 al cabo de 1 año del trasplante
| Análisis univariable | Análisis multivariable | |||
|---|---|---|---|---|
| Coeficiente beta | p | Coeficiente beta | p | |
| Edad del donante, (años) | –0,247 | 0,016 | –0,294 | 0,004 |
| Proporción entre el peso del donante y el del receptor, (%) | –0,194 | 0,066 | — | — |
| Índice de filtración glomerular 1 año después del TxC, (ml/min) | –0,293 | 0,004 | –0,269 | 0,008 |
| Presión en la aurícula derecha 1 año después del TxC, (mmHg) | +0,272 | 0,008 | +0,248 | 0,014 |
| TAPSE 1 año después del TxC, (mm) | –0,183 | 0,077 | — | — |
| Antecedentes de fallo primario del injerto | +0,178 | 0,077 | — | — |
| Toma de micofenolato de mofetilo | –0,211 | 0,036 | –0,239 | 0,017 |
Gal-3; galectina-3; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; TxC: trasplante cardiaco.
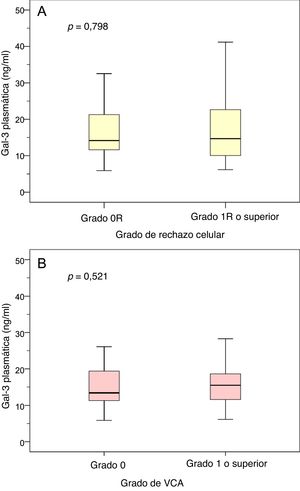
En la visita clínica realizada al cabo de 1 año, 117 pacientes (96%) se sometieron a biopsia endomiocárdica para evaluar el rechazo del injerto y en 31 de estos pacientes (26%) se constató un rechazo celular de grado ≥ 1R. En este momento específico, 95 pacientes (78%) se sometieron a angiografía coronaria para evaluar la VCA y en 17 de estos pacientes (18%) la VCA era de grado ≥ 1. Las concentraciones plasmáticas de Gal-3 al cabo de 1 año del trasplante no difirieron significativamente entre los pacientes con o sin rechazo celular de grado ≥ 1R (p=0,521), o entre los pacientes con o sin una VCA de grado ≥ 1 (p=0,798; figura 2).
Concentraciones plasmáticas de Gal-3 según el grado de rechazo celular y de VCA. A: Concentraciones plasmáticas de Gal-3 en pacientes con y sin rechazo celular de grado 1R o superior en la visita clínica posterior al trasplante realizada al cabo de 1 año. B: Concentraciones plasmáticas de Gal-3 en pacientes con y sin VCA de grado ≥ 1 en la visita clínica posterior al trasplante realizada al cabo de 1 año. Gal-3: galectina-3; VCA: vasculopatía coronaria del alotrasplante.
Un total de 99 pacientes contaban con muestras plasmáticas almacenadas que se habían obtenido 1 año después del TxC, y a estos participantes se les sometió a un seguimiento promedio de 6,7 años (intervalo intercuartílico: 4,3–9,4) más allá de este momento específico. Las características clínicas de los pacientes del estudio según su concentración plasmática de Gal-3 al cabo de 1 año del TxC se detallan en el tabla 1 del material adicional.
Durante este periodo, 22 pacientes (22%) fueron hospitalizados por fallo del injerto y 17 pacientes (17%) fallecieron. Las causas del ingreso debido a fallo del injerto fueron VCA (n=6), rechazo celular (n=5), VCA y rechazo celular (n=4), rechazo mediado por anticuerpos (n=4), pericarditis constrictiva (n=1), amiloidosis cardiaca (n=1) y desconocidas (n=1). Las causas de la mortalidad fueron fallo del injerto (n=6), muerte cardiaca repentina (n=5), cáncer (n=4), cirrosis hepática (n=1) y demencia (n=1).
El análisis univariable de la regresión de Cox reveló que las concentraciones plasmáticas de Gal-3 al cabo de 1 año del trasplante se asociaban considerablemente con un mayor riesgo del principal resultado combinado de mortalidad por cualquier causa o fallo del injerto durante el seguimiento posterior (por ng/ml, HR=1,04; IC95%, 1,01–1,06; p=0,004). Las concentraciones plasmáticas de Gal-3 al cabo de 1 año del TxC también se asociaron con un mayor riesgo de cada componente individual del resultado compuesto, mortalidad por cualquier causa (por ng/ml, HR=1,05; IC95%, 1,02–1,08; p=0,002) y fallo del injerto (por ng/ml, HR=1,03, IC95%, 1,01–1,07; p=0,020).
Tras el ajuste multivariable (tabla 1 del material adicional), las concentraciones plasmáticas de Gal-3 al cabo de 1 año del trasplante mantenían una asociación independiente y estadísticamente significativa con un mayor riesgo del resultado compuesto (por ng/ml, HR ajustado=1,04; IC95%, 1,01–1,06; p=0,008) y con un mayor riesgo de los dos componentes individuales, mortalidad por cualquier causa (por ng/ml, HR ajustado=1,15; IC95%, 1,07–1,25; p<0,001) y fallo del injerto (por ng/ml, HR ajustado=1,06; IC95%, 1,01–1,09; p=0,010).
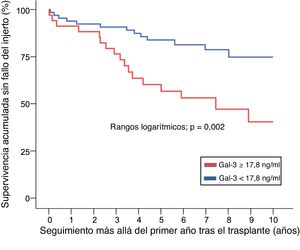
La figura 3 muestra la supervivencia acumulada a largo plazo sin fallo del injerto entre pacientes cuya concentración plasmática de Gal-3 al cabo de 1 año del trasplante se halla por encima del intervalo de referencia (≥ 17,8 ng/ml), comparado con aquellos cuya concentración es normal (< 17,8 ng/ml). Mediante análisis multivariable de regresión de Cox (tabla 2 del material adicional), el HR estimado y ajustado para el principal resultado compuesto de mortalidad por cualquier causa o fallo del injerto fue 2,74 (IC95%, 1,07–7,02; p=0,035).
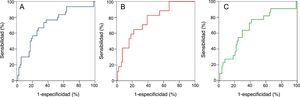
Valor predictivo de las concentraciones plasmáticas de Gal-3 tras el trasplanteLa figura 4 muestra la curva ROC concebida para investigar con qué exactitud la concentración plasmática de Gal-3 al cabo de 1 año del trasplante podía predecir el principal resultado compuesto de mortalidad por cualquier causa o fallo del injerto, y de sus dos componentes individuales, a lo largo del posterior seguimiento a largo plazo. El área bajo la curva ROC era 0,72 (IC95%, 0,60-0,82; p<0,001) para el principal resultado compuesto, 0,76 (IC95%, 0,64-0,88; p<0,001) para la mortalidad por cualquier causa y 0,67 (IC95%, 0,54-0,80; p=0,014) para el fallo del injerto. El valor umbral preseleccionado de concentración plasmática de Gal-3 (≥ 17,8 ng/ml) detectó la ocurrencia del principal resultado combinado, mortalidad por cualquier causa y fallo tardío del injerto, con sensibilidades del 57%, el 65% y el 55%; y especificidades del 75%, el 72% y el 71%, respectivamente.
Exactitud predictiva de las concentraciones de galectina-3, determinada 1 año después del trasplante, en relación con los principales resultados del estudio: curvas ROC. A: mortalidad por cualquier causa o fallo del injerto. B: mortalidad por cualquier causa. C: fallo del injerto. ROC: receiver operating characteristic.
El principal descubrimiento de este estudio es que las concentraciones plasmáticas de Gal-3, un conocido marcador de inflamación, fibrosis y resultados adversos en pacientes con IC, mostraron una tendencia decreciente estable durante el primer año tras el TxC. Esta disminución reflejaba probablemente una inversión progresiva de la situación de IC previa a la intervención tras el trasplante. Además, este es el primer estudio que corrobora el valor pronóstico de la Gal-3 plasmática en receptores de TxC. En nuestra cohorte, los pacientes que mostraron de forma persistente concentraciones elevadas de Gal-3 al final del primer año tras el trasplante mostraron resultados clínicos considerablemente peores a lo largo del posterior seguimiento a largo plazo.
Los resultados que mostraron una tendencia decreciente de las concentraciones plasmáticas de Gal-3 tras el TxC diferían de las observaciones de Grupper et al.9. En su estudio, se determinaron las concentraciones plasmáticas de Gal-3 antes y después del TxC de 62 pacientes con IC avanzada de la Clínica Mayo. Aunque las concentraciones plasmáticas medias de Gal-3 antes del trasplante eran congruentes con las descritas en nuestra población (20,3 ng/ml en el estudio norteamericano frente a 19,1 ng/ml en nuestro estudio), ellos no observaron ninguna disminución significativa tras la intervención. Su conclusión fue que las concentraciones plasmáticas de Gal-3 dependían enormemente de la evolución de la función renal tras el trasplante, y cuestionaron la utilidad de este biomarcador en los receptores de TxC. Otro estudio examinó a 85 receptores de TxC estables y comunicó concentraciones plasmáticas medias de Gal-3 tras el trasplante de 17,8 ng/ml, que eran parecidas al valor medio determinado en una cohorte paralela de 55 pacientes con IC estable pero significativamente inferiores a las de una cohorte paralela de 63 pacientes con IC grave8.
La discrepancia entre nuestros resultados y las observaciones de Grupper et al.9 se deben probablemente a diferencias en las poblaciones examinadas, así como a los distintos momentos específicos de medición de la concentración plasmática de Gal-3 tras el TxC. En el estudio norteamericano9 se constataba una prevalencia elevada de miocardiopatía restrictiva entre los candidatos a TxC, probablemente porque se llevó a cabo en un gran centro de derivación de este trastorno cardiaco específico. Además, se constataba una amplia variabilidad interindividual en el intervalo desde el TxC hasta la medición de la concentración plasmática de Gal-3, con un intervalo intercuartílico de 54–767 días. En cambio, nosotros realizamos mediciones en momentos específicos acordados para todos los participantes a lo largo del primer año tras el trasplante. Esta era una diferencia importante, ya que el implante reciente de un injerto cardiaco tiene un efecto progresivo más que inmediato con respecto a normalizar la hemodinámica e invertir las alteraciones fisiopatológicas y la disfunción orgánica, inherente a la situación de IC sistémica y a veces prolongada previa a la intervención. Además, en las primeras etapas tras el TxC, los receptores pueden mostrar considerable actividad inflamatoria sistémica causada por varios desencadenantes, tales como agresión quirúrgica, isquemia fría, transfusiones sanguíneas, infección y respuestas inmunitarias del huésped contra el injerto. Acorde con estos argumentos, nuestras observaciones no indicaron que las concentraciones plasmáticas de Gal-3 disminuyeran de inmediato tras el TxC. Comparado con los valores preoperatorios, la primera disminución significativa de la concentración plasmática de Gal-3 se detectó a los 6 meses del TxC.
Nuestros resultados identificaron varias variables clínicas que estaban asociadas con las concentraciones plasmáticas de Gal-3 posteriores al trasplante. Como en estudios anteriores3,9,13, la concentración plasmática de Gal-3 se hallaba en correlación inversa con el índice de filtración glomerular, probablemente debido a un menor aclaramiento del biomarcador en pacientes con disfunción renal. Las concentraciones plasmáticas de Gal-3 tras el trasplante se correlacionaban positivamente con una presión en la aurícula derecha elevada, un marcador sensible de disfunción del injerto cardiaco y un determinante importante de síndrome cardiorrenal14. La toma de micofenolato de mofetilo se asoció con una menor concentración plasmática de Gal-3 tras el trasplante, lo cual era congruente con los efectos beneficiosos de este tratamiento en la tolerancia inmunitaria, la función del injerto y la supervivencia global de los receptores de TxC15. También se observó que una edad inferior del donante se asociaba con una mayor concentración plasmática de Gal-3 tras el trasplante, lo cual no pudo explicarse. En cambio, en estudios anteriores se ha observado de manera consistente que los injertos cardiacos de donantes jóvenes son menos propensos a fallar que los de donantes mayores.
El presente estudio corrobora la importancia pronóstica de la concentración plasmática de Gal-3 en los receptores de TxC. Los pacientes con concentraciones plasmáticas de Gal-3 superiores al límite de referencia de 17,8 ng/ml después de 1 año del trasplante mostraron un riesgo tres veces mayor de mortalidad por cualquier causa u hospitalización debida a fallo del injerto (es decir, IC sintomática causada por disfunción del injerto) durante el posterior seguimiento a largo plazo. Esta asociación independiente entre la concentración plasmática de Gal-3 tras el trasplante y los resultados clínicos a largo plazo siguió siendo significativa incluso después del ajuste multivariable extensivo para varias características clínicas, como la función renal.
Nuestras observaciones son congruentes con el valor pronóstico comunicado anteriormente de la concentración plasmática de Gal-3 en varios subgrupos de pacientes con enfermedad cardiovascular, en especial entre los pacientes con IC4,5. Sin embargo, sigue siendo necesario reexaminar las posibles razones de por qué la concentración plasmática de Gal-3, elevada de forma persistente, se asocia con un mayor riesgo de mortalidad y fallo del injerto en receptores de TxC. La concentración plasmática de Gal-3 se ha propuesto como biomarcador cardiaco basándose en su correlación directa con el grado de inflamación y, lo que es más importante, la fibrosis del tejido cardiaco1–3,16. Así pues, podría establecerse la hipótesis de que esta elevación persistente de la concentración plasmática de Gal-3 tras el TxC puede ser un indicador sensible de cambios estructurales asintomáticos y sutiles en el injerto cardiaco que se reflejan en las respuestas inmunológicas del huésped. En nuestro estudio, las concentraciones plasmáticas de Gal-3 al cabo de 1 año del trasplante no se asociaban de forma significativa con la presencia de rechazo celular o VCA en el mismo momento específico. No obstante, esto podría ser un reflejo de la baja sensibilidad de las pruebas diagnósticas utilizadas para detectar rechazo del injerto y VCA, a las biopsias endomiocárdicas y a la angiografía coronaria. En realidad, Coromilas et al.8 observaron con anterioridad que las concentraciones plasmáticas elevadas de Gal-3 tras el trasplante se asociaban significativamente con la aparición de VCA.
Los informes anteriores han cuestionado la utilidad clínica de la Gal-3 plasmática como biomarcador cardiaco dada su falta relativa de especificidad y su dependencia de otras variables biológicas, principalmente la función renal8,11. A este respecto, las concentraciones plasmáticas de Gal-3 podrían reflejar el grado de inflamación y fibrosis a niveles biológicos distintos del sistema cardiovascular, tales como en los riñones, el hígado, o el páncreas1. Notablemente, también se ha descrito un aumento significativo de la Gal-3 plasmática en pacientes con algún tipo de cáncer17. En pacientes con IC crónica, la concentración plasmática de Gal-3 se correlaciona con la gravedad de la disfunción orgánica. En consecuencia, es posible que la elevación persistente de la Gal-3 plasmática tras el TxC se deba, al menos en parte, a la incapacidad del injerto cardiaco recientemente implantado de invertir las alteraciones fisiopatológicas sistémicas inherentes al síndrome de IC preexistente. En particular, en nuestro estudio, la Gal-3 plasmática predijo la mortalidad por cualquier causa con mayor exactitud que el fallo del injerto, en contra de su especificidad como biomarcador cardiaco.
Este estudio tiene varias limitaciones. En primer lugar, se trataba de un estudio observacional para el cual los datos clínicos se obtuvieron retrospectivamente; en consecuencia, los resultados están sujetos a posibles sesgos de selección, información y confusión. Segundo, aunque la población total del estudio incluyó a 122 receptores de TxC, las muestras almacenadas de Gal-3 solo estaban disponibles para 99 a 105 pacientes, dependiendo del momento específico. Tercero, la VCA y el rechazo agudo se detectaron a partir de las biopsias endomiocárdicas y las angiografías coronarias, respectivamente, que se programaron de acuerdo con el protocolo de seguimiento clínico estándar de nuestro centro. No se utilizaron de forma sistemática otros métodos más sensibles, como la ecografía intravascular, que podría haber producido un número considerable de diagnósticos falsos negativos en este estudio. Cuarto, actualmente se carece de información con respecto a la dinámica posterior al trasplante de otros biomarcadores clínicamente relevantes, tales como la fracción aminoterminal del propéptido natriurético cerebral, y su comparación no era algo que formara parte de este estudio. Por último, se reconoce que la estrategia estadística de este estudio con respecto a la exactitud predictiva de la concentración plasmática de Gal-3 en receptores de TxC tiene un valor limitado y debería confirmarse mediante validación externa en una cohorte prospectiva de mayor tamaño.
CONCLUSIONESLos resultados de este estudio demuestran que las concentraciones plasmáticas de Gal-3 disminuyeron progresivamente durante el primer año tras el TxC, con una reducción significativa pasados 6 meses del trasplante. Además, en los receptores de TxC con una concentración plasmática de Gal-3 elevada de forma persistente al cabo de 1 año del trasplante se constató una menor supervivencia sin fallo del injerto durante el posterior seguimiento a largo plazo. Notablemente, la concentración plasmática de Gal-3 establecía mejor correlación con el riesgo de mortalidad por cualquier causa que con el riesgo de acontecimientos relacionados con el injerto, VCA, rechazo u hospitalización debida a IC; esta observación sugiere que esta podría considerarse un biomarcador específico sistémico antes que cardiaco. En un futuro convendrían más estudios prospectivos y realizados en varios centros para esclarecer el valor de la Gal-3 plasmática como biomarcador en el tratamiento clínico habitual de los receptores de TxC.
FINANCIACIÓNEste estudio fue financiado por el Project N.° PI12/02670, integrado en el Plan Nacional de Investigación Científica, Desarrollo e Innovación Tecnológica 2008-2011 y por el ISCIII (Instituto de Salud Carlos III), Subdirección General de Evaluación y Promoción para la Investigación-FEDER (Fondo Europeo de Desarrollo Regional) «Una forma de hacer Europa».
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La Gal-3 plasmática es un marcador de fibrosis cardiaca y sistémica que se ha asociado a malos resultados en pacientes con IC; no obstante, se desconocen su valor pronóstico y perfil a largo plazo en receptores de TxC. Hasta ahora, solo en un estudio publicado se ha descrito la tendencia de la Gal-3 plasmática tras el TxC, que muestra que no se produce una disminución significativa de este parámetro tras la intervención.
- –
En esta cohorte, las concentraciones plasmáticas de Gal-3 siguieron una tendencia descendente durante el primer año tras el TxC, probablemente como resultado de la resolución progresiva de la IC sistémica tras la intervención. Además, el presente estudio sugiere que las concentraciones plasmáticas de Gal-3 elevadas de forma persistente 1 año después del TxC se asociaban con menor supervivencia sin fallo del injerto a largo plazo.