Aún no se conoce la función endotelial de los nuevos stents farmacoactivos diseñados para promover el recubrimiento y la reendotelización. El objetivo principal es comparar la función endotelial de la arteria responsable del infarto (ARI) tratada con stents bioactivos liberadores de sirolimus captadores de células progenitoras endoteliales circulantes (SES; COMBO) frente a la tratada con stents sin polímero liberadores de biolimus (BES; Biofreedom), así como comparar la función microvascular de la ARI y el grado de cicatrización de ambos dispositivos a los 6 meses.
MétodosSe aleatorizó a 60 pacientes con infarto agudo de miocardio con elevación del ST (IAMCEST) a tratamiento con SES o BES. Tras 6 meses, todos los pacientes se sometieron a pruebas vasomotora mediante acetilcolina y nitroglicerina y de función microvascular mediante técnicas de termodilución y exploración con tomografía de coherencia óptica (OCT). Una respuesta vasoconstrictora a la acetilcolina ≥ 4% se definió como disfunción endotelial.
ResultadosAmbos grupos presentaron similares porcentajes de disfunción endotelial (el 64,0 frente al 62,5%; p=0,913) y función microvascular. La reserva coronaria de flujo fue de 3,23±1,77 frente a 3,23±1,62 (p=0,992) y el índice de resistencia microvascular, 24,8±16,8 frente a 21,3±12,0 (p=0,440). Los hallazgos de la OCT fueron parecidos e indicaban una cicatrización avanzada: proporciones de struts sin recubrir (el 2,3 frente al 3,2%; p=0,466), con mala aposición (el 0,1 frente al 0,3%; p=0,519) y de evaginaciones coronarias mayores (el 7,1 frente al 5,6%; p=0,708).
ConclusionesTras 6 meses, los nuevos stents farmacoactivos presentaron con frecuencia parecidas disfunciones endoteliales de la ARI. La disfunción endotelial se observó a pesar de la adecuada función microvascular y la cicatrización avanzada.
Registrado en ClinicalTrials.gov: NCT04202172
Palabras clave
Vídeo del artículo

La intervención coronaria percutánea primaria es la estrategia de reperfusión preferida para los pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST). La función endotelial de la arteria responsable del infarto (ARI) a menudo presenta un deterioro en el segmento distal contiguo1. La disfunción endotelial después del implante de un stent farmacoactivo (SFA) se ha asociado con angina persistente y resultados clínicos adversos2.
Los SFA de nueva generación tienen como objetivo potenciar la cicatrización y la reendotelización del stent. Los stents bioactivos liberadores de sirolimus (SES) (COMBO, OrbusNeich, Países Bajos) combinan un polímero bioabsorbible recubierto de sirolimus abluminal y una capa de anticuerpo CD34+ adluminal, diseñada para captar las células progenitoras endoteliales circulantes. En un modelo porcino preclínico, el SES bioactivo mostró un grado de reendotelización de los struts superior al del SFA de polímero duradero a los 14 días3. El stent liberador de biolimus A9 (BES) no polimérico (BioFreedom, Biosensors, Suiza) se ha diseñado para liberar el fármaco antiproliferativo unos pocos días después del implante del stent4. Por esta razón, se considera que el BES tiene una reendotelización similar a la de los stents metálicos (SM). Sin embargo, no se conoce todavía la función vasomotora epicárdica y microvascular de la ARI tratada con SFA de nueva generación diseñados para potenciar la reendotelización del stent.
El objetivo principal del presente estudio es describir y comparar a los 6 meses la función endotelial del segmento distal de la ARI tratada con un SES bioactivo (COMBO) o un BES no polimérico (BioFreedom). Los objetivos secundarios, describir y comparar a los 6 meses la función microvascular y la cicatrización del stent con los 2 dispositivos.
MÉTODOSDiseño y población del estudioEste estudio es un ensayo descriptivo iniciado por los investigadores, pivotal, de prueba de concepto, multicéntrico y aleatorizado, promovido por la Sociedad Española de Cardiología y financiado por Orbus Neich (Países Bajos). El financiador y el promotor del estudio no intervinieron en modo alguno en el diseño del estudio, la gestión y el análisis de los datos o la elaboración del informe final.
Los criterios de inclusión y exclusión del estudio se detallan en «Métodos» del material adicional. En resumen, se aleatorizó a todos los pacientes con IAMCEST documentado y las características clínicas y anatómicas apropiadas para la inclusión en el estudio, en relación 1:1, al tratamiento con un SES bioactivo (COMBO) o un BES no polimérico (BioFreedom). Se incluyó a los pacientes en la aleatorización si presentaban un flujo Thrombolysis in Myocardial Infarction ≥ 2 tras el paso de la guía, la predilatación o la tromboaspiración según el criterio del operador. Los tratamientos antiagregante plaquetario y antitrombótico se dejaron al criterio del operador, según los métodos ordinarios aplicados en cada centro participante. A los 6 meses se solicitó una nueva coronariografía para todos los pacientes incluidos en el estudio, según lo establecido en el protocolo. El estudio se llevó a cabo según lo establecido por la Declaración de Helsinki, y el protocolo del estudio fue aprobado por el comité de ética de cada centro participante. Se obtuvo el consentimiento informado por escrito de todos los pacientes.
Intervención coronaria invasiva a los 6 mesesSe solicitó a los pacientes que suspendieran toda la medicación vasomotora como mínimo 24 h antes de la coronariografía. En el caso de abordaje radial, no se permitió la administración de fármacos vasomotores antes de la prueba vasomotora.
El protocolo de la intervención invasiva a los 6 meses constaba de 3 partes. En primer lugar, se llevaba a cabo una prueba vasomotora epicárdica de la ARI para evaluar las respuestas dependiente e independiente del endotelio en el segmento coronario distal. La función dependiente del endotelio se examinó mediante la infusión intracoronaria de acetilcolina en dosis incrementales de 10–6 y 10–4 M según lo indicado en publicaciones previas5. La infusión de acetilcolina se realizó a través de un microcatéter (Teleport, OrbusNeich, Países Bajos) a una distancia ≥ 5mm proximal al borde proximal del stent. La función independiente del endotelio se investigó mediante una inyección intracoronaria en bolo de 200 μg de nitroglicerina a través de un catéter guía. Puede consultarse una explicación detallada de la prueba vasomotora en «Métodos» del material adicional.
En segundo lugar, la evaluación de la función microvascular se llevaba a cabo con una guía intracoronaria específica para ello, dotada de sensores de presión y temperatura (PressureWire X Guidewire, Abbott, Estados Unidos). Según lo indicado en publicaciones previas5, se evaluaron el índice de resistencia microvascular, la reserva de flujo coronario y la reserva fraccional de flujo con una infusión intravenosa de adenosina (140μg/kg/min).
Por último, se obtenían imágenes de tomografía de coherencia óptica (OCT) con un catéter específico para ello (Dragonfly OPTIS, Abbott, Estados Unidos) utilizando procedimientos estándares.
Análisis angiográficoEl análisis angiográfico se llevó a cabo en un laboratorio central (BARCICORE-Lab, Barcelona, España) con un programa informático específico para el análisis de angiografía coronaria cuantitativa (CASS 5.9; Pie Medical BV, Países Bajos). Se ocultó a los evaluadores la asignación a los grupos de estudio.
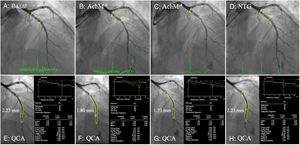
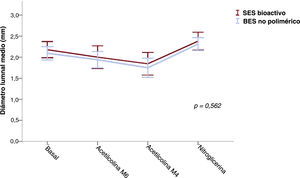
Las respuestas vasomotoras del segmento coronario distal a los estímulos dependientes e independientes del endotelio se evaluaron teniendo en cuenta la variabilidad de las mediciones repetidas del diámetro medio de la luz en el laboratorio central. La diferencia de 2 desviaciones estándares entre las mediciones de angiografía cuantitativa de los segmentos coronarios emparejados es del 3,9%5,6. Por consiguiente, la respuesta vasoconstrictiva a la infusión de dosis bajas o altas de acetilcolina (que indica disfunción endotelial) se definió por una vasoconstricción observada a los 6 meses ≥ 4% del diámetro luminal medio basal. El segmento coronario distal se definió como el comprendido entre el borde del stent y una distancia de hasta 20-40mm basándose en puntos de referencia naturales. En la figura 1 se muestra la evaluación de los cambios vasomotores.
Análisis por coronariografía cuantitativa del segmento distal. A-D: imágenes angiográficas de la prueba vasomotora a los 6 meses, basal, con distintas dosis de acetilcolina y con nitroglicerina. Los bordes del stent se indican con líneas amarillas. E-H: coronariografía cuantitativa de los segmentos distales emparejados entre diferentes fármacos vasomotores; en cada imagen se muestra el respectivo diámetro luminal medio de los segmentos emparejados. Ach: acetilcolina; NTG: nitroglicerina; QCA: coronariografía cuantitativa. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
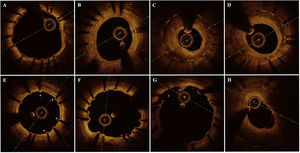
El análisis de OCT se llevó a cabo en un laboratorio central (BARCICORE-Lab, Barcelona, España) con un programa informático específico para dicho análisis (LightLab Imaging, Estados Unidos). Se pidió a 2 evaluadores, que no conocían el grupo de tratamiento asignado, que analizaran los siguientes resultados cualitativos de la OCT durante la totalidad del pullback (retirada) (a intervalos de 0,2mm) según lo indicado por un estudio previo7: patrón de neoíntima en el corte transversal con mayor área de neoíntima; observación de cortes con un cociente de struts sin recubrir respecto al total de struts del stent ≥ 30%; presencia de evaginaciones coronarias mayores y placas neoateroescleróticas. En la figura 2 se muestran los principales resultados de la OCT cualitativa observados en el estudio. Los datos de la OCT cuantitativa se analizaron cada 1mm según los métodos estándares del laboratorio central7. En el apartado «Métodos» del material adicional se presenta una descripción detallada del análisis de OCT cuantitativa.
Principales resultados cualitativos de la tomografía de coherencia óptica. A: ausencia de neoíntima. B: neoíntima homogénea. C: neoíntima heterogénea. D: neoíntima en capas. E: RUTTS (cociente de struts sin recubrir respecto al total de struts del stent) ≥ 30%; los struts sin recubrir se indican con *. F: evaginación coronaria mayor. G: aposición incompleta del stent. H: placa neoateroesclerótica fibrolipídica.
Este es un estudio inicial para generación de hipótesis; en consecuencia, no se realizó un cálculo del tamaño muestral, ya que no había datos previos relativos a la función endotelial de los SFA de nueva generación. Las variables discretas se presentan como recuento y porcentaje y las continuas, en forma de media ± desviación estándar. Las comparaciones de variables discretas se llevaron a cabo con la prueba de la χ2 o la prueba exacta de Fisher, según procediera. Las comparaciones de grupos en cuanto a las variables continuas se evaluaron con la prueba de la t de Student o las pruebas no paramétricas de Mann-Whitney y Kruskal-Wallis, según procediera. Las comparaciones del mismo parámetro en puntos temporales diferentes (como las de los cambios del diámetro luminal medio durante la prueba vasomotora) se realizaron con modelos lineales generalizados para medidas repetidas. Para el análisis a nivel de los struts en la OCT, se tuvo en cuenta el carácter agrupado de los datos de OCT y se utilizaron ecuaciones de estimación generalizada. Todos los struts se clasificaron en los siguientes tipos: con aposición y recubierto, con aposición y sin recubrir, mala aposición y recubierto, y mala aposición y sin recubrir. Cada tipo de strut se introdujo en el modelo como una variable dependiente, utilizando el modelo logístico binario. Cada modelo se elaboró introduciendo el tipo de stent como covariable y la identificación del paciente como variable del sujeto. Se consideró estadísticamente significativo un valor de p bilateral < 0,05. El análisis estadístico se llevó a cabo con el programa informático SPSS, versión 20.0 (SPSS Inc, Estados Unidos).
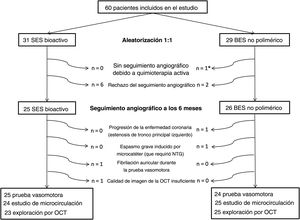
RESULTADOSPoblaciónSe incluyó a un total de 60 pacientes (31 con el SES bioactivo COMBO y 29 con el BES no polimérico BioFreedom) en 3 centros entre noviembre de 2018 y septiembre de 2019. No se documentaron eventos clínicos ni seguimientos angiográficos no programados en un plazo de 6 meses. Ocho pacientes rechazaron el seguimiento con coronariografía y se excluyó a 1 a causa de un tratamiento con quimioterapia en curso. Así pues, a los 6 meses se realizó el examen invasivo a 51 pacientes (25 con un SES bioactivo y 26 con un BES no polimérico) según lo establecido en el protocolo.
Un paciente mostró progresión de la enfermedad coronaria (estenosis del tronco coronario izquierdo) y se lo excluyó de los ulteriores exámenes invasivos. Otro paciente sufrió fibrilación auricular paroxística sintomática durante la infusión de acetilcolina, por lo cual no se estudiaron la prueba de la función microvascular y la imagen de OCT. En la figura 3 se muestra el diagrama de flujo del estudio.
Diagrama de flujo del estudio. BES: stent liberador de biolimus; NTG: nitroglicerina; OCT: tomografía de coherencia óptica; SES: stent liberador de sirolimus. *A 1 paciente se le diagnosticó un cáncer de colon 1 mes después de la intervención inicial y se trató con quimioterapia durante el periodo de seguimiento angiográfico, por lo que se lo excluyó del seguimiento con angiografía invasiva.
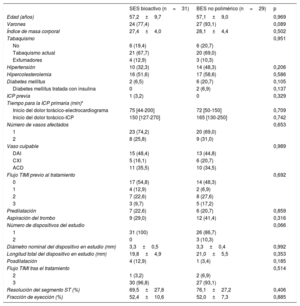
Las características clínicas basales y las características de la intervención se muestran en la tabla 1. Las características clínicas principales fueron similares en los 2 grupos. La mayoría de los pacientes presentaban oclusión completa de la ARI (el 54,8% de los tratados con SES bioactivo frente al 48,3% de los tratados con BES no polimérico; p=0,692). La ARI más frecuente fue la descendente anterior izquierda (el 48,4 frente al 44,8%; p=0,989).
Características clínicas basales y de la intervención
| SES bioactivo (n=31) | BES no polimérico (n=29) | p | |
|---|---|---|---|
| Edad (años) | 57,2±9,7 | 57,1±9,0 | 0,969 |
| Varones | 24 (77,4) | 27 (93,1) | 0,089 |
| Índice de masa corporal | 27,4±4,0 | 28,1±4,4 | 0,502 |
| Tabaquismo | 0,951 | ||
| No | 6 (19,4) | 6 (20,7) | |
| Tabaquismo actual | 21 (67,7) | 20 (69,0) | |
| Exfumadores | 4 (12,9) | 3 (10,3) | |
| Hipertensión | 10 (32,3) | 14 (48,3) | 0,206 |
| Hipercolesterolemia | 16 (51,6) | 17 (58,6) | 0,586 |
| Diabetes mellitus | 2 (6,5) | 6 (20,7) | 0,105 |
| Diabetes mellitus tratada con insulina | 0 | 2 (6,9) | 0,137 |
| ICP previa | 1 (3,2) | 0 | 0,329 |
| Tiempo para la ICP primaria (min)* | |||
| Inicio del dolor torácico-electrocardiograma | 75 [44-200] | 72 [50-150] | 0,709 |
| Inicio del dolor torácico-ICP | 150 [127-270] | 165 [130-250] | 0,742 |
| Número de vasos afectados | 0,653 | ||
| 1 | 23 (74,2) | 20 (69,0) | |
| 2 | 8 (25,8) | 9 (31,0) | |
| Vaso culpable | 0,989 | ||
| DAI | 15 (48,4) | 13 (44,8) | |
| CXI | 5 (16,1) | 6 (20,7) | |
| ACD | 11 (35,5) | 10 (34,5) | |
| Flujo TIMI previo al tratamiento | 0,692 | ||
| 0 | 17 (54,8) | 14 (48,3) | |
| 1 | 4 (12,9) | 2 (6,9) | |
| 2 | 7 (22,6) | 8 (27,6) | |
| 3 | 3 (9,7) | 5 (17,2) | |
| Predilatación | 7 (22,6) | 6 (20,7) | 0,859 |
| Aspiración del trombo | 9 (29,0) | 12 (41,4) | 0,316 |
| Número de dispositivos del estudio | 0,066 | ||
| 1 | 31 (100) | 26 (86,7) | |
| 2 | 0 | 3 (10,3) | |
| Diámetro nominal del dispositivo en estudio (mm) | 3,3±0,5 | 3,3±0,4 | 0,992 |
| Longitud total del dispositivo en estudio (mm) | 19,8±4,9 | 21,0±5,5 | 0,353 |
| Posdilatación | 4 (12,9) | 1 (3,4) | 0,185 |
| Flujo TIMI tras el tratamiento | 0,514 | ||
| 2 | 1 (3,2) | 2 (6,9) | |
| 3 | 30 (96,8) | 27 (93,1) | |
| Resolución del segmento ST (%) | 69,5±27,8 | 76,1±27,2 | 0,406 |
| Fracción de eyección (%) | 52,4±10,6 | 52,0±7,3 | 0,885 |
ACD: arteria coronaria derecha; BES: stent liberador de biolimus; CXI: circunfleja izquierda; DAI: descendente anterior izquierda; ICP: intervención coronaria percutánea; SES: stent liberador de sirolimus; TIMI: Thrombolysis In Myocardial Infarction.
Los valores expresan n (%) o, media ± desviación estándar.
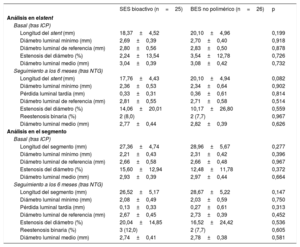
El análisis angiográfico del segmento del stent se muestra en la tabla 2. Los resultados tras la intervención fueron similares en los 2 grupos. A los 6 meses, la pérdida de luz fue similar en ambos grupos (0,33 ± 0,31 frente a 0,36 ± 0,61mm; p=0,814). Se observó una reestenosis binaria en el 8,0 frente al 7,7% (p=0,967).
Análisis por angiografía coronaria cuantitativa del segmento del stent
| SES bioactivo (n=25) | BES no polimérico (n=26) | p | |
|---|---|---|---|
| Análisis en elstent | |||
| Basal (tras ICP) | |||
| Longitud del stent (mm) | 18,37±4,52 | 20,10±4,96 | 0,199 |
| Diámetro luminal mínimo (mm) | 2,69±0,39 | 2,70±0,40 | 0,918 |
| Diámetro luminal de referencia (mm) | 2,80±0,56 | 2,83±0,50 | 0,878 |
| Estenosis del diámetro (%) | 2,24±13,54 | 3,54±12,78 | 0,726 |
| Diámetro luminal medio (mm) | 3,04±0,39 | 3,08±0,42 | 0,732 |
| Seguimiento a los 6 meses (tras NTG) | |||
| Longitud del stent (mm) | 17,76±4,43 | 20,10±4,94 | 0,082 |
| Diámetro luminal mínimo (mm) | 2,36±0,53 | 2,34±0,64 | 0,902 |
| Pérdida luminal tardía (mm) | 0,33±0,31 | 0,36±0,61 | 0,814 |
| Diámetro luminal de referencia (mm) | 2,81±0,55 | 2,71±0,58 | 0,514 |
| Estenosis del diámetro (%) | 14,06±20,01 | 10,17±26,80 | 0,559 |
| Reestenosis binaria (%) | 2 (8,0) | 2 (7,7) | 0,967 |
| Diámetro luminal medio (mm) | 2,77±0,44 | 2,82±0,39 | 0,626 |
| Análisis en el segmento | |||
| Basal (tras ICP) | |||
| Longitud del segmento (mm) | 27,36±4,74 | 28,96±5,67 | 0,277 |
| Diámetro luminal mínimo (mm) | 2,21±0,43 | 2,31±0,42 | 0,396 |
| Diámetro luminal de referencia (mm) | 2,66±0,58 | 2,66±0,48 | 0,967 |
| Estenosis del diámetro (%) | 15,60±12,94 | 12,48±11,78 | 0,372 |
| Diámetro luminal medio (mm) | 2,93±0,39 | 2,97±0,44 | 0,664 |
| Seguimiento a los 6 meses (tras NTG) | |||
| Longitud del segmento (mm) | 26,52±5,17 | 28,67±5,22 | 0,147 |
| Diámetro luminal mínimo (mm) | 2,08±0,49 | 2,03±0,59 | 0,750 |
| Pérdida luminal tardía (mm) | 0,13±0,33 | 0,27±0,61 | 0,313 |
| Diámetro luminal de referencia (mm) | 2,67±0,45 | 2,73±0,39 | 0,452 |
| Estenosis del diámetro (%) | 20,04±14,85 | 16,52±24,42 | 0,536 |
| Reestenosis binaria (%) | 3 (12,0) | 2 (7,7) | 0,605 |
| Diámetro luminal medio (mm) | 2,74±0,41 | 2,78±0,38 | 0,581 |
BES: stent liberador de biolimus; ICP: intervención coronaria percutánea; NTG: nitroglicerina; SES: stent liberador de sirolimus.
Los valores expresan n (%) o media ± desviación estándar.
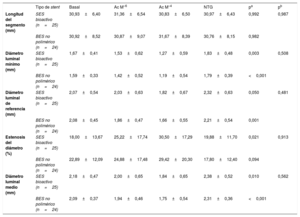
Pasaron la prueba vasomotora 49 pacientes (25 con SES bioactivo y 24 con BES no polimérico). Las respuestas vasomotoras dependientes e independientes del endotelio a los 6 meses se muestran en la tabla 3. Tanto el SES bioactivo como el BES no polimérico mostraron vasoconstricción a la infusión de acetilcolina en dosis bajas (el −8,3% ± 20,1% frente al −7,6% ± 14,2%; p = 0,890) y altas (el −16,0% ± 20,2% frente al −16,1% ± 21,6%; p = 0,983). La disfunción endotelial fue frecuente y se observó de manera similar en los 2 grupos (el 64,0 frente al 62,5%; p=0,913). Los cambios del diámetro luminal medio del segmento coronario distal a los 6 meses se presentan en la figura 4.
Resultados de las pruebas vasomotoras del segmento coronario distal
| Tipo de stent | Basal | Ac M–6 | Ac M–4 | NTG | pa | pb | |
|---|---|---|---|---|---|---|---|
| Longitud del segmento (mm) | SES bioactivo (n=25) | 30,93±6,40 | 31,36±6,54 | 30,83±6,50 | 30,97±6,43 | 0,992 | 0,987 |
| BES no polimérico (n=24) | 30,92±8,52 | 30,87±9,07 | 31,67±8,39 | 30,76±8,15 | 0,982 | ||
| Diámetro luminal mínimo (mm) | SES bioactivo (n=25) | 1,67±0,41 | 1,53±0,62 | 1,27±0,59 | 1,83±0,48 | 0,003 | 0,508 |
| BES no polimérico (n=24) | 1,59±0,33 | 1,42±0,52 | 1,19±0,54 | 1,79±0,39 | <0,001 | ||
| Diámetro luminal de referencia (mm) | SES bioactivo (n=25) | 2,07±0,54 | 2,03±0,63 | 1,82±0,67 | 2,32±0,63 | 0,050 | 0,481 |
| BES no polimérico (n=24) | 2,08±0,45 | 1,86±0,47 | 1,66±0,55 | 2,21±0,54 | 0,001 | ||
| Estenosis del diámetro (%) | SES bioactivo (n=25) | 18,00±13,67 | 25,22±17,74 | 30,50±17,29 | 19,88±11,70 | 0,021 | 0,913 |
| BES no polimérico (n=24) | 22,89±12,09 | 24,88±17,48 | 29,42±20,30 | 17,80±12,40 | 0,094 | ||
| Diámetro luminal medio (mm) | SES bioactivo (n=25) | 2,18±0,47 | 2,00±0,65 | 1,84±0,65 | 2,38±0,52 | 0,010 | 0,562 |
| BES no polimérico (n=24) | 2,09±0,37 | 1,94±0,46 | 1,75±0,54 | 2,31±0,36 | <0,001 |
Ac: acetilcolina; BES: stent liberador de biolimus; NTG: nitroglicerina; SES: stent liberador de sirolimus.
Los valores expresan media±desviación estándar.
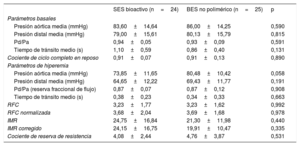
En la tabla 4 se muestra la función microvascular a los 6 meses. El SES bioactivo y el BES no polimérico presentaron similares características funcionales en reposo. Los parámetros de microcirculación hiperémicos también fueron similares en los dos grupos y estuvieron dentro de los límites normales de referencia. Las medias de reserva de flujo coronario fueron 3,23 ± 1,77 y 3,23 ± 1,62 (p=0,992) y el índice de resistencia microvascular, 24,75 ± 16,84 y 21,30 ± 11,98 respectivamente (p=0,440).
Resultados en función microvascular
| SES bioactivo (n=24) | BES no polimérico (n=25) | p | |
|---|---|---|---|
| Parámetros basales | |||
| Presión aórtica media (mmHg) | 83,60±14,64 | 86,00±14,25 | 0,590 |
| Presión distal media (mmHg) | 79,00±15,61 | 80,13±15,79 | 0,815 |
| Pd/Pa | 0,94±0,05 | 0,93±0,09 | 0,591 |
| Tiempo de tránsito medio (s) | 1,10±0,59 | 0,86±0,40 | 0,131 |
| Cociente de ciclo completo en reposo | 0,91±0,07 | 0,91±0,13 | 0,890 |
| Parámetros de hiperemia | |||
| Presión aórtica media (mmHg) | 73,85±11,65 | 80,48±10,42 | 0,058 |
| Presión distal media (mmHg) | 64,65±12,22 | 69,43±11,77 | 0,191 |
| Pd/Pa (reserva fraccional de flujo) | 0,87±0,07 | 0,87±0,12 | 0,908 |
| Tiempo de tránsito medio (s) | 0,38±0,23 | 0,34±0,33 | 0,663 |
| RFC | 3,23±1,77 | 3,23±1,62 | 0,992 |
| RFC normalizada | 3,68±2,04 | 3,69±1,68 | 0,978 |
| IMR | 24,75±16,84 | 21,30±11,98 | 0,440 |
| IMR corregido | 24,15±16,75 | 19,91±10,47 | 0,335 |
| Cociente de reserva de resistencia | 4,08±2,44 | 4,76±3,87 | 0,531 |
BES: stent liberador de biolimus; IMR: índice de resistencia microvascular; Pd/Pa: presión distal/presión aórtica; RFC: reserva de flujo coronario; SES: stent liberador de sirolimus.
Los valores expresan media ± desviación estándar.
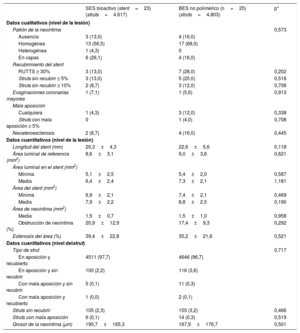
Pasaron el examen de OCT 48 pacientes (23 con SES bioactivo y 25 con BES no polimérico). Los resultados de la OCT realizada a los 6 meses se muestran en la tabla 5. Todos los parámetros cualitativos y cuantitativos de la OCT fueron similares en ambos grupos y mostraron alto grado de cicatrización del stent a los 6 meses. Así, por ejemplo, el porcentaje de struts sin recubrir (el 2,3 frente al 3,2%; p=0,466), los pacientes con más del 5% de los struts sin recubrir (el 13,0 frente al 20,0%; p=0,518) y las evaginaciones coronarias mayores (el 7,1 frente al 5,6%; p=0,708) se observaron tan solo en unos pocos casos. Se identificó neoateroesclerosis en el stent en el 8,7 frente al 16,0% (p=0,445).
Resultados de la tomografía de coherencia óptica
| SES bioactivo (stent=23) (struts=4.617) | BES no polimérico (n=25) (struts=4.803) | p* | |
|---|---|---|---|
| Datos cualitativos (nivel de la lesión) | |||
| Patrón de la neoíntima | 0,573 | ||
| Ausencia | 3 (13,0) | 4 (16,0) | |
| Homogénea | 13 (56,5) | 17 (68,0) | |
| Heterogénea | 1 (4,3) | 0 | |
| En capas | 6 (26,1) | 4 (16,0) | |
| Recubrimiento del stent | |||
| RUTTS ≥ 30% | 3 (13,0) | 7 (28,0) | 0,202 |
| Struts sin recubrir ≥ 5% | 3 (13,0) | 5 (20,0) | 0,518 |
| Struts sin recubrir ≥ 10% | 2 (8,7) | 3 (12,0) | 0,708 |
| Evaginaciones coronarias mayores | 1 (7,1) | 1 (5,6) | 0,913 |
| Mala aposición | |||
| Cualquiera | 1 (4,3) | 3 (12,0) | 0,338 |
| Struts con mala aposición ≥ 5% | 0 | 1 (4,0) | 0,708 |
| Neoateroesclerosis | 2 (8,7) | 4 (16,0) | 0,445 |
| Datos cuantitativos (nivel de la lesión) | |||
| Longitud del stent (mm) | 20,3±4,3 | 22,6±5,6 | 0,118 |
| Área luminal de referencia (mm2) | 8,6±3,1 | 9,0±3,6 | 0,621 |
| Área luminal en el stent (mm2) | |||
| Mínima | 5,1±2,5 | 5,4±2,0 | 0,587 |
| Media | 6,4±2,4 | 7,3±2,1 | 1,181 |
| Área del stent (mm2) | |||
| Mínima | 6,9±2,1 | 7,4±2,1 | 0,469 |
| Media | 7,9±2,2 | 8,8±2,5 | 0,190 |
| Área de neoíntima (mm2) | |||
| Media | 1,5±0,7 | 1,5±1,0 | 0,958 |
| Obstrucción de neoíntima (%) | 20,9±12,9 | 17,4±9,3 | 0,292 |
| Estenosis del área (%) | 39,4±22,8 | 35,2±21,6 | 0,521 |
| Datos cuantitativos (nivel delstrut) | |||
| Tipo de strut | 0,717 | ||
| En aposición y recubierto | 4511 (97,7) | 4646 (96,7) | |
| En aposición y sin recubrir | 100 (2,2) | 116 (3,6) | |
| Con mala aposición y sin recubrir | 5 (0,1) | 11 (0,3) | |
| Con mala aposición y recubierto | 1 (0,0) | 2 (0,1) | |
| Struts sin recubrir | 105 (2,3) | 155 (3,2) | 0,466 |
| Struts con mala aposición | 6 (0,1) | 14 (0,3) | 0,519 |
| Grosor de la neoíntima (μm) | 190,7±165,3 | 167,9±176,7 | 0,501 |
BES: stent liberador de biolimus; RUTTS: cociente de struts sin recubrir respecto al total de struts del stent; SES: stent liberador de sirolimus.
Los valores expresan n (%) o media ± desviación estándar.
Los resultados principales de este estudio son: a) a los 6 meses, tanto el SES bioactivo (COMBO) como el BES no polimérico (BioFreedom) mostraron principalmente un deterioro de la función vasomotora dependiente del endotelio y una función independiente del endotelio conservada en la ARI epicárdica distal; b) la función microvascular de la ARI mostró una respuesta a la hiperemia casi totalmente conservada, sin diferencias entre los grupos de estudio, y c) tanto el SES bioactivo como el BES no polimérico mostraron un estado de cicatrización avanzado en las evaluaciones por OCT a los 6 meses.
El endotelio coronario es la barrera de monocapa celular natural entre la sangre y la pared arterial. Según lo indicado por los estudios anatomopatológicos, el implante de un stent causa una denudación del endotelio y una respuesta inflamatoria. En la fase muy inicial tras el implante de un SM (< 30 días), se observan normalmente infiltración de células inflamatorias, agregación plaquetaria y depósito de fibrina8. Simultáneamente, a menudo se produce una migración de células de músculo liso acompañada de depósito de matriz extracelular alrededor de los struts del stent, que los recubre. Por esta razón, según lo indicado por la OCT, a los 30 días los SM muestran recubrimiento en la mayor parte de los struts. Sin embargo, la reendotelización del stent después del implante de un SM se produce 3-4 meses después mediante la proliferación y migración de las células de endotelio vascular circundantes y mediante la adhesión y maduración de células progenitoras endoteliales circulantes9. Por desgracia, la OCT no permite evaluar la reendotelización del stent debido a la escasa resolución de la imagen.
Los procesos de cicatrización de los SFA de polímeros duradero y bioabsorbible difieren sustancialmente en su evolución temporal del que se observa con un SM. El fármaco antiproliferativo inhibe la migración de las células de músculo liso y las células de endotelio vascular en la fase muy inicial, con lo que retrasa el proceso de cicatrización del stent incluso en un seguimiento a muy largo plazo8. Los SFA no poliméricos se han diseñado para potenciar el proceso de cicatrización del stent mediante una liberación rápida del fármaco antiproliferativo (la mayor parte del fármaco se libera en menos de 48 h). En consecuencia, el proceso de cicatrización del BES no polimérico es similar al observado con el SM. En un estudio que utilizó BES no poliméricos, se observó un recubrimiento casi completo del stent en la evaluación realizada mediante OCT a los 4 meses4. El SES bioactivo es un paso más con el objetivo de adherir células progenitoras endoteliales circulantes a la superficie endoluminal del stent, al tiempo que la superficie abluminal inhibe la proliferación de las células de músculo liso. Los estudios preclínicos pusieron de manifiesto una reendotelización casi completa de la superficie interna del stent a los 14 días3. Según lo indicado por varios grandes ensayos controlados con un seguimiento por coronariografía electiva a los 6-13 meses, los tipos actuales de SFA de polímero duradero y polímero bioabsorbible muestran una pérdida luminal angiográfica < 0,20mm. En cambio, los SFA que tienen como objetivo potenciar la cicatrización del stent, como los BES no poliméricos y los SES bioactivos, muestran una pérdida luminal > 0,20mm. Aunque serán necesarios nuevos estudios con un mayor número de pacientes, los SFA diseñados para potenciar la reendotelización del stent parecen mostrar una respuesta de neoíntima y una reestenosis mayores que las que se observan con las versiones actuales de los SFA de polímero duradero y polímero bioabsorbible. La tabla 1 del material adicional resume los resultados observados en el interior del stent en la mayoría de los estudios que emplean SFA de la actual generación y disponen de un seguimiento angiográfico.
Varios ensayos aleatorizados han mostrado la existencia de diferencias en cuanto a la función endotelial con diferentes tipos de stent en pacientes sin IAMCEST. Con frecuencia se da por supuesto que los SM conservan en su mayor parte la función endotelial normal del segmento coronario distal (vasodilatación) cuando el stent ha completado el proceso de cicatrización (aproximadamente a los 6 meses). Se ha descrito que el cambio del diámetro luminal medio frente a estímulos dependientes del endotelio en el segmento coronario distal tras el tratamiento con un SM está entre el −2,5 y el +8,6%10–12. Sin embargo, el bajo número de pacientes, el uso de pruebas vasomotoras diferentes (como las de estimulación de ritmo rápido, ejercicio en decúbito supino o infusión de acetilcolina) y los distintos métodos empleados para el análisis de la angiografía coronaria cuantitativa hacen que sea necesaria una interpretación cuidadosa de estos datos. Con frecuencia se acepta que los SFA de polímero duradero de primera generación son los que producen una peor función endotelial (vasoconstricción entre el 23,6 y el 3,4%)10,11 y que los SFA de polímero duradero de segunda generación (vasoconstricción entre el 9,4 y el 3,1%) y los SFA de polímero bioabsorbible (vasoconstricción próxima al 8,6%) muestran cierto grado de disfunción endotelial1,6,12,13.
La disfunción endotelial parece ser más intensa en los pacientes con un IAMCEST14. En primer lugar, los pacientes con un IAMCEST muestran inflamación sistémica y una disfunción microvascular de varios órganos y de los vasos coronarios que afecta a la función endotelial epicárdica normal2. En segundo lugar, el implante de un stent modifica la geometría del vaso y las fuerzas de tensión de cizalladura en el endotelio, sobre todo en los segmentos contiguos al stent. Los segmentos coronarios con una tensión de cizalladura endotelial baja, como los segmentos del borde del stent, muestran un grado de disfunción endotelial mayor que el de los segmentos con una tensión de cizalladura endotelial normal o alta15. Por último, el implante de un stent causa denudación del endotelio coronario y, por consiguiente, suele observarse disfunción endotelial en los segmentos coronarios distales inmediatamente después del implante del stent16. Los SFA se han diseñado para retrasar la cicatrización y la reendotelización del stent y se asocian con mayor grado de mala aposición y protrusión de los struts del stent en comparación con los SM. La mala aposición y la protrusión de los struts del stent dan lugar a alteraciones del flujo similares a las observadas en los segmentos con una tensión de cizalladura endotelial baja15. Es de destacar que las lesiones de IAMCEST tratadas con un SFA muestran una cicatrización del stent peor que la de las lesiones sin IAMCEST17,18. Además, la acción directa del fármaco en los SFA actuales, la reacción inflamatoria a diferentes polímeros de los stents y el grado de reendotelización del stent apuntan posibles mecanismos de la disfunción endotelial15.
Según lo indicado por los pocos estudios de la función endotelial realizados en pacientes con IAMCEST, los segmentos distales de la ARI tratada con SM mostraron una vasoconstricción del 7,9% frente a la acetilcolina intracoronaria a los 6 meses19, los SES de polímero bioabsorbible (Orsiro, Biotronik, Suiza) mostraron una vasoconstricción del 18,1% ± 15,4% a 1 año20, y los stents de polímero duradero liberadores de everolimus (XIENCE, Abbott, Estados Unidos) mostraron una vasoconstricción del 8,7% ± 14,8% a los 3 años5. En consecuencia, teniendo en cuenta las limitaciones de una comparación de diferentes estudios con diferentes seguimientos angiográficos, los SES bioactivos (vasoconstricción del 16,0% ± 20,2%) y los BES no poliméricos (vasoconstricción del 16,1% ± 21,6%) parecen tener una respuesta vasomotora a los 6 meses similar a la de los SES de polímero bioabsorbible a 1 año, pero con una función endotelial peor que la de los stents de polímero duradero liberadores de everolimus a los 3 años. La función endotelial de los 4 SFA en los pacientes con IAMCEST se resume en la tabla 2 del material adicional.
LimitacionesEn primer lugar, para el presente estudio no se ha calculado el tamaño muestral. Por consiguiente, todas las comparaciones entre dispositivos son tan solo generadoras de hipótesis. En segundo lugar, para este estudio se reclutó a menos del 10% de los pacientes sometidos a ICP primaria durante el periodo de tiempo del estudio, por lo que la muestra no es representativa del total de pacientes no seleccionados (all comers) de la población con IAMCEST. En tercer lugar, la prueba vasomotora se llevó a cabo a los 6 meses. Aunque teóricamente ambos dispositivos del estudio han pasado por el periodo de cicatrización observado en los estudios preclínicos, es posible que los modelos humanos hayan tenido una cicatrización más lenta, con lo que la función endotelial con ambos dispositivos podría ser mejor en un seguimiento a más largo plazo. Por último, dada la metodología empleada en el presente estudio, no se evaluó la angina vasoespástica microvascular y epicárdica. Para prevenir las complicaciones asociadas con las pruebas de provocación vasoespásticas, como la oclusión de segmentos coronarios proximales, se decidió realizar selectivamente una infusión intracoronaria de acetilcolina a través de un microcatéter.
CONCLUSIONESLas ARI tratadas con un SES bioactivo (COMBO) o un BES no polimérico (BioFreedom) mostraron a los 6 meses una respuesta vasomotora endotelial distal epicárdica similar que con la infusión de acetilcolina y una respuesta microcirculatoria similar a la hiperemia. Se observó con frecuencia una disfunción endotelial a pesar de unos parámetros microvasculares funcionales de la ARI conservados y un recubrimiento casi completo del stent en la evaluación realizada mediante OCT a los 6 meses. Serán necesarios estudios más amplios para evaluar el papel de la disfunción endotelial en los pacientes con IAMCEST.
FINANCIACIÓNEste estudio fue financiado por OrbusNeich.
CONFLICTO DE INTERESESJ. Gómez-Lara recibió pagos de BARCICORE-Lab. S. Brugaletta declara haber recibido pagos por consultoría de Boston Scientific e iVascular. M. Sabaté declara haber recibido pagos por consultoría de Abbott Vascular e iVascular. Los demás autores no declaran ningún conflicto de intereses.
- –
Los segmentos distales a los stents coronarios muestran diversidad de respuestas vasomotoras a los estímulos dependientes del endotelio. En general, los SM muestran una función endotelial mejor que los SFA, lo cual se ha atribuido a mejores cicatrización y reendotelización del stent con los SM. Además, en los pacientes con IAMCEST, los SFA actuales presentan una cicatrización del stent peor que la de los stents implantados en otras situaciones clínicas. Los SFA de nueva generación, como los SFA no poliméricos y los bioactivos, se han diseñado para potenciar el recubrimiento del stent y la reendotelización. Sin embargo, se conoce muy poco de la función endotelial de los segmentos coronarios distales de pacientes con IAMCEST tratados con estos stents.
- –
Este es el primer estudio sobre la función coronaria con nuevas tecnologías de stents destinadas a fomentar la reendotelización del stent en los pacientes con IAMCEST. Aunque cabe plantear la hipótesis de que haya diferencias menores entre los diferentes tipos de stent, la función endotelial observada en los pacientes con IAMCEST mostró un grave deterioro y es posible que tenga múltiples causas. Además, la disfunción endotelial se observó a pesar de una cicatrización del stent y una función microvascular óptimas. Serán necesarios nuevos estudios para abordar el papel de la disfunción endotelial relacionada con el stent en los pacientes con IAMCEST.