La cardiopatía isquémica es la causa de muerte más frecuente en el mundo. En Europa, las tasas de infarto agudo de miocardio con elevación del segmento ST (IAMCEST) oscilan entre 43 y 144 personas/100.000 hab./año1. A pesar de que la intervención coronaria percutánea primaria (ICP) ha llevado a una tendencia general a la reducción de la mortalidad en los últimos 30 años2, la mortalidad hospitalaria sigue siendo elevada, con tasas que van del 4 al 12% en algunos países europeos3.
Al cabo de 1 año tras el infarto de miocardio (IM), alrededor de 1 de cada 5 pacientes sufre angina. La edad más joven, ser varón no blanco, la historia clínica (cirugía de revascularización coronaria previa o angina a la presentación), las características de la hospitalización índice (angina recurrente) y las características ambulatorias (persistencia del tabaquismo, revascularización tras la hospitalización índice y depresión, incluidas la de nueva aparición, la persistente o la transitoria en el año siguiente a la hospitalización por IM) se asocian con angina a 1 año4. De los pacientes con síndrome coronario agudo que refirieron angina a las 6 semanas de la ICP, el 92,0% recibió tratamiento con bloqueadores beta el primer año tras el IM, pero solo se trató al 23,3% con otros medicamentos antianginosos. Al año, el 33,1% de los pacientes con angina a las 6 semanas refirieron síntomas de angina persistentes. De estos pacientes, solo al 31,2% se le habían prescrito otras medicaciones antianginosas distintas de los bloqueadores beta en algún momento del año anterior. De los pacientes sometidos a revascularización durante el seguimiento, solo el 25,9% estaba en tratamiento con al menos 1 medicamento antianginoso distinto de los bloqueadores beta en el momento de la intervención5. Por lo tanto, la angina persistente y su tratamiento óptimo son una cuestión problemática después de la ICP. Se necesitarán nuevos estudios para evaluar este reto e identificar las estrategias adecuadas para mitigar la angina persistente tras la ICP.
En el tratamiento de la estenosis de arterias coronarias, antes se utilizaban stents metálicos. Sin embargo, implicaban una alta tasa de complicaciones por reestenosis del stent. En el contexto del IAMCEST, el estado procoagulante y proinflamatorio que se da a continuación, junto con la estimulación de la proliferación de las células de músculo liso vascular y la acumulación de proteínas de la matriz extracelular a causa del traumatismo causado por el despliegue del stent, progresa y da lugar a hiperplasia de la íntima, reducción del diámetro de la luz y finalmente reestenosis del stent6.
Para combatir este importante problema de la reestenosis del stent tras su implante en las arterias coronarias, se introdujeron aún se utilizan los stents farmacoactivos (SFA), que liberan fármacos antiproliferativos para inhibir la proliferación de las células de músculo liso y la migración de células del endotelio vascular7. El implante de stents coronarios da lugar a lesión endotelial e inflamación de la arteria culpable en la que se implanta el stent, debido a la fricción y la distensión física de la pared vascular, lo cual conlleva una denudación de células endoteliales6. Esto culmina en una alteración aguda del medio endotelial, que lleva a cabo numerosas funciones fisiológicas que van de la hemostasia y la regulación vasomotora a la acción antiinflamatoria. En un periodo de 30 días, la alteración del endotelio da lugar a la pérdida de la homeostasis en el interior de la pared vascular, lo que desencadena fenómenos como el depósito de plaquetas o de fibrina y la atracción de leucocitos, que pueden contribuir a la aparición de trombosis del stent7. Los fármacos antiproliferativos presentes en el SFA retrasan en mayor medida la cicatrización del stent debido a sus efectos farmacodinámicos en el ciclo celular, con los consiguientes efectos en la función endotelial, lo cual plantea la necesidad de fármacos antiagregantes plaquetarios potentes para reducir la incidencia de trombosis del stent.
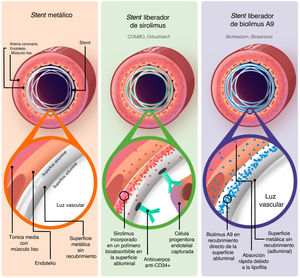
Los SFA de última generación se han diseñado para mejorar la cicatrización y aumentar la reendotelización de los stents respecto a los stents de la generación anterior. El sirolimus es un macrólido que actúa como inmunosupresor y a menudo se emplea en los SFA para inhibir la activación de los linfocitos dependiente de la interleucina 2 (IL-2) a través del bloqueo de la vía de mTOR8. Un derivado lipófilo del sirolimus, denominado biolimus, presenta una potencia inmunosupresora similar, pero tiene la ventaja de una mayor tasa de absorción a través de la pared vascular debido a su lipofilia, y que entra con mayor rapidez en las células de músculo liso vascular y da lugar a la detención del ciclo celular, lo cual facilita la inhibición de la proliferación de células de músculo liso vascular que induce la hiperplasia9. Dado que ambos fármacos afectan al ciclo celular, producen el efecto adverso de retrasar la reendotelización. Los stents liberadores de sirolimus (SLS) (figura 1) se han diseñado con un polímero recubierto de sirolimus bioabsorbible en la cara que contacta con el endotelio y una capa de anticuerpos anti-CD34 en la cara luminal, que hace que las células progenitoras endoteliales circulantes se unan a ella, lo cual fomenta la reendotelización10. En cambio, los stents liberadores de biolimus A9 (SLB) (figura 1) son stents bioactivos con un recubrimiento de biolimus que no incorporan polímero absorbible ni capa de anticuerpos, y se han diseñado para que liberen rápidamente la mayor parte del fármaco en un plazo de 48 h tras el implante, para minimizar el retraso en la cicatrización causado por el fármaco. El SLB se convierte básicamente en un stent metálico tras la elución del biolimus A9 de la superficie abluminal a los 28 días, con lo cual muestra una reendotelización similar a la de los stents metálicos11. Varios ensayos clínicos controlados y aleatorizados han investigado las repercusiones de los SFA de la anterior generación en la disfunción endotelial a lo largo de los años12, pero no se conocen las repercusiones de los SLS y SLB más recientes en la función endotelial y vasomotora.
El proceso de la enfermedad en el IAMCEST lleva de por sí a una disfunción endotelial multifactorial más intensa que la que se da en otras formas de enfermedad coronaria, lo cual se agrava por el retraso en la endotelización y el hecho de que los struts del SFA estén expuestos, características estas que son propiedades intrínsecas ligadas a su función de prevención de la reestenosis en el stent13. En consecuencia, la investigación sobre las repercusiones endoteliales de los stents en la población de pacientes con IAMCEST tiene una importancia crucial, ya que el endotelio es una estructura compleja con multitud de funciones homeostáticas importantes en la arteria coronaria12. Una disfunción aguda del endotelio puede favorecer una actividad procoagulante y una propensión a la vasoconstricción (cuyas consecuencias se pusieron claramente de manifiesto en la asociación de la disfunción endotelial relacionada con los SFA con la angina persistente y un mal resultado clínico)14.
En el ensayo FUNCOMBO se investigó la función microvascular y endotelial coronaria distal a los SLS y los SLB sin polímero, y los resultados se presentan en un artículo reciente de Gómez-Lara et al., publicado en Revista Española de Cardiología15. En este estudio de generación de hipótesis, se aleatorizó a 60 pacientes con IAMCEST en relación 1:1 a tratamiento de la lesión culpable mediante ICP con un SLS (COMBO, OrbusNeich, Países Bajos) o un SLB sin polímero (BioFreedom, Biosensors, Suiza), y se dispuso de datos de 51 pacientes para el análisis. El objetivo principal fue comparar la función endotelial en una zona distal de la arteria coronaria en la que se implantó el stent a los 6 meses con los 2 tipos de stent, mediante una evaluación invasiva repitiendo una coronariografía funcional con infusiones intracoronarias de acetilcolina y nitroglicerina. Como objetivo secundario, se evaluó la función microvascular mediante de sensores intracoronarios para medir la resistencia microcirculatoria, la reserva fraccional de flujo y la reserva de flujo coronario. Se realizaron exploraciones mediante tomografía de coherencia óptica para evaluar el patrón de cicatrización del stent.
El SLS bioactivo y el SLB sin polímero investigados en este estudio muestran similares grados de disfunción endotelial en la arteria distal a los 6 meses (el 64,0 frente al 62,5%; p=0,913). Se observaron también niveles similares (p> 0,05) de vasoconstricción dependiente del endotelio en respuesta a la acetilcolina con los 2 tipos de stent, así como una función microvascular y un grado de pérdida de la luz similares. Los autores investigaron la endotelización del stent como posible factor etiológico de la disfunción endotelial de la arteria culpable, teniendo en cuenta que la exposición de los struts del stent es un mecanismo establecido por el que el aumento de la tensión tangencial causa una disfunción endotelial distal16. El papel del endotelio se pone claramente de manifiesto, ya que las funciones no dependientes de este se mantienen normales. Aunque la disfunción endotelial sigue siendo una dificultad con estos SFA de nueva generación, la tomografía de coherencia óptica obtenida a los 6 meses mostró alto grado de cicatrización del stent con ambos tipos de dispositivos, con un nivel muy bajo de falta de cobertura de los struts del stent tanto con el SLS bioactivo (2,3%) como con el SLB sin polímero (3,2%). Asimismo, la función microvascular se conservó con los 2 tipos de stent. En conjunto, estos resultados indican que los cambios en los procesos homeostáticos endoteliales complejos persisten después de la ICP primaria a pesar de la reendotelización satisfactoria del stent a los 6 meses.
El estudio es un ensayo clínico exploratorio de generación de hipótesis, por lo que, acertadamente, los autores no presentan un cálculo del tamaño muestral; sin embargo, estos resultados aportan una interesante perspectiva respecto a la repercusión de las tecnologías de stents más recientes y la disfunción endotelial en los pacientes con IAMCEST. Es de destacar que no se midieron, y por consiguiente no se presentan, las características de la función endotelial o microvascular después de la ICP.
El paso de los stents metálicos a los SFA como los SLS y los SLB ha reducido al mínimo las tasas de complicaciones como la reestenosis en el stent. Sin embargo, durante los últimos 20 años, ha aumentado el interés por el papel del endotelio arterial coronario en la evolución natural del IAMCEST tras una ICP primaria. Se observó una gran incidencia de disfunción endotelial a los 6 meses en los 2 grupos en este estudio (el 64,0% con SLS frente al 62,5% con SLB). No parece que los SLS bioactivos, que contienen un polímero recubierto de sirolimus bioabsorbible abluminal con una capa de anticuerpo anti-CD34+ adluminal diseñada para capturar las células progenitoras endoteliales circulantes, reduzcan la disfunción endotelial en comparación con los SLB sin polímero. Sin embargo, se desconocen las repercusiones en los resultados clínicos de la disfunción endotelial demostrada en este estudio.
Una vez identificada la persistencia de la disfunción endotelial, para reducir al mínimo la angina persistente o recurrente tras una ICP por un IAMCEST, es crucial ofrecer a estos pacientes estrategias de tratamiento apropiadas que incluyan un control de los factores de riesgo en el estilo de vida y un tratamiento antianginoso adecuado, en especial uno que no incluya bloqueadores beta, por ejemplo con antagonistas del calcio, nitratos de acción prolongada o nicorandil17. Lamentablemente, no hay información relativa a la farmacoterapia de estos pacientes en la situación basal del estudio FUNCOMBO. Dada la persistencia de la disfunción endotelial en la inmensa mayoría de los pacientes, no se sabe si se les prescribió una farmacoterapia adicional para el espasmo o si se evaluó la presencia de angina a los 6 meses.
Es de destacar que, en este estudio, la mayoría de los pacientes eran varones y en su mayoría presentaban afección de un solo vaso. Se sabe que la disfunción endotelial y la disfunción microvascular coronaria se dan con más frecuencia en las mujeres, lo que resalta la necesidad de incluir a más mujeres en estos estudios.
Es bien sabido que el índice de resistencia microvascular tras una ICP primaria tiene una clara relación inversa con la viabilidad miocárdica evaluada mediante tomografía de emisión de positrones con flúor-18-fluorodesoxiglucosa y predice el tamaño del infarto, la fracción de eyección del ventrículo izquierdo, la recuperación de miocardio, la presencia y el grado de obstrucción microvascular y la hemorragia miocárdica determinada por cardiorresonancia magnética18. Resulta alentador saber que el entorno microcirculatorio de estos pacientes estaba conservado a los 6 meses, según indican las evaluaciones de la reserva de flujo coronario y del índice de resistencia microvascular, si bien es de destacar que no se prevé que el empleo de SLS o SLB en los vasos epicárdicos influya en los parámetros microcirculatorios.
Aunque este estudio es importante y cuenta con una evaluación detallada y amplia de la función epicárdica y microvascular después del IAMCEST, serán necesarios estudios más grandes para investigar con mayor profundidad las repercusiones de las tecnologías de stents en la disfunción endotelial distal y la repercusión de esta disfunción endotelial en los eventos cardiovasculares.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESNinguno.