Palabras clave
INTRODUCCIÓN
La miocardiopatía secundaria al depósito de hierro en la talasemia mayor es la principal causa de muerte de estos pacientes1,2. Por ello, es importante la identificación precoz de los depósitos tisulares de hierro, especialmente los cardíacos, con el fin de iniciar el tratamiento quelante cuando el proceso es todavía reversible. En este sentido, la resonancia magnética (RM) es una técnica útil, al ser capaz de detectar los depósitos férricos en los diferentes órganos e incluso realizar una estimación cuantitativa de éstos3-5. Por otra parte, en trabajos recientes se ha demostrado que el tratamiento combinado con deferoxamina y deferiprona es eficaz cuando se ha establecido la disfunción cardíaca a pesar del tratamiento quelante estándar con deferoxamina.
CASO CLÍNICO
Un varón de 22 años con β-talasemia homocigota (β/δβ) en tratamiento con soporte transfusional cada 3 semanas y deferoxamina subcutánea desde los 14 años fue ingresado por clínica de disnea de esfuerzo progresiva y edemas en los miembros inferiores. El ecocardiograma transtorácico mostró una miocardiopatía dilatada biventricular con afección grave de la función sistólica del ventrículo izquierdo y fracción de eyección (FE) del 20%. La ferritina sérica en el momento del ingreso fue de 1.645 ng/ml y en la analítica destacaba la alteración de la función hepática (GOT 84, U/l; GPT, 110 U/l; fosfatasa alcalina, 467 U/l; LDH, 687 U/l; γGPT, 36 U/l).
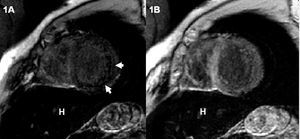
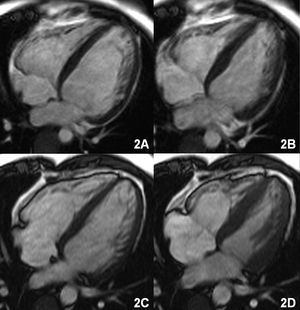
Con la finalidad de objetivar la hemocromatosis cardíaca se realizó una RM, que mostró en las secuencias anatómicas de eco de gradiente (FLASH, TR/TE 700/11, flip angle 30°) una disminución de la señal miocárdica global, aunque más marcada en los segmentos posteriores y laterales y, sobre todo, en el hígado (fig. 1A). Las secuencias funcionales confirmaron el aumento de volúmenes de ambos ventrículos con depresión grave de la función biventricular (volumen telediastólico [VTDVI] y telesistólico [VTSVI] del ventrículo izquierdo de 130 y 87 ml/m², respectivamente, con FE del 32%) (fig. 2 A y B).
Fig. 1. A: secuencia anatómica de eco de gradiente, eje corto, que muestra una disminución de la señal miocárdica más marcada en los segmentos posteriores y laterales (flechas), así como en el hígado (H). B: secuencia anatómica de eco de gradiente, eje corto, tras el tratamiento que muestra la normalización de la señal miocárdica con persistencia de la hipointensidad de señal en el hígado.
Fig. 2. A (diástole) y B (sístole): secuencia de cinerresonancia magnética, eje de 4 cavidades, que muestra el aumento de volúmenes de ambos ventrículos con afección de la función sistólica. C (diástole) y D (sístole): reducción de volúmenes y mejoría de la función sistólica tras el tratamiento.
Se instauró tratamiento sintomático con diuréticos, captopril y digoxina, y se modificó el tratamiento quelante habitual con deferoxamina por el tratamiento combinado con deferoxamina y deferiprona con la siguiente pauta semanal: deferiprona 75 mg/kg/día vía oral durante 4 días y deferoxamina 3 g/día subcutánea + deferiprona 50 mg/kg/día los 3 días restantes.
El paciente experimentó una mejoría progresiva de sus síntomas, con valores de ferritina sérica a los 6 meses de iniciado el tratamiento de 331 ng/ml y mejoría de la función hepática (GOT, 35 U/l; GPT, 46 U/l; fosfatasa alcalina, 119 U/l; LDH, 541 U/l; γGPT, 28 U/l). El estudio de RM un año después mostró una marcada reducción de los volúmenes ventriculares, así como una notable mejoría de la función biventricular (VTDVI, 100 ml/m²; VTS, 50 ml/m²; FE del 52%) (fig. 2 C y D). Las secuencias anatómicas de eco de gradiente pusieron de manifiesto la normalización en la señal miocárdica, aunque persistía una marcada hipointensidad de señal en el hígado (fig. 1B).
DISCUSIÓN
La detección del depósito de hierro en los diferentes órganos por RM se basa en el efecto que produce la ferritina y la hemosiderina sobre el tiempo de relajación tisular de los protones, acortándolo, lo que conlleva una disminución de la intensidad de señal (áreas más oscuras), sobre todo con las secuencias potenciadas en T26. En concreto, las secuencias de eco de gradiente son especialmente sensibles para detectar incluso casos leves de sobrecarga férrica tisular. Aunque hay una correlación entre la disminución de señal (en especial T2*) y el grado de sobrecarga del hierro, en la actualidad no hay ningún método estándar aceptado para la cuantificación de la sobrecarga férrica en los diferentes órganos y especialmente en el corazón, por la dificultad de obtener muestras de biopsia para su correlación7.
La deferiprona es una molécula 5 veces más pequeña y más lipofílica que la deferoxamina, lo que permite una mejor penetración intracelular al tiempo que, una vez unida al hierro, constituye un complejo más hidrofílico que facilita su rápido flujo extracelular y su eliminación, mostrándose más eficaz que la deferoxamina, especialmente para eliminar el hierro miocárdico4,8. Además, la terapia combinada (deferiprona + deferoxamina) conlleva una mayor actividad quelante y, por tanto, mejores resultados que la terapia aislada, con una buena tolerancia y sin que hayan sido comunicados efectos secundarios mayores9.
Por tanto, la RM es una modalidad diagnóstica útil en la detección precoz de la hemocromatosis cardíaca, posibilitando así la instauración del tratamiento quelante profiláctico y también el control de la respuesta al tratamiento una vez se ha establecido la disfunción cardíaca. Por otra parte, se debería valorar una pauta combinada con deferoxamina y deferiprona en los casos en que el tratamiento aislado con deferoxamina intravenosa no es eficaz.
Correspondencia: Dr. J. Estornell Erill.
Unidad de Tomografía Computarizada y Resonancia Magnética.
ERESA. Hospital General Universitario.
Avda Tres Cruces, s/n. 46014 Valencia. España.
Correo electrónico: jestornell@eresa.com
Recibido el 23 de marzo de 2005.
Aceptado para su publicación el 8 de junio de 2005.