Palabras clave
INTRODUCCIÓN
La ablación por radiofrecuencia (RF) es un tratamiento muy eficaz para el aleteo auricular típico, dirigido a la región del istmo septal o lateral entre la válvula tricúspide y la vena cava inferior o la válvula de Eustaquio1-3. El objetivo del procedimiento de ablación es lograr el bloqueo bidireccional del istmo. Sin embargo, hay un grupo de pacientes en quienes la ablación del istmo cavotricuspídeo (ICT) con catéteres estándar de punta de 4 mm no se puede conseguir y al menos un 10% de los pacientes tienen recurrencias posteriores, después de haberse logrado el bloqueo agudo completo del ICT4-7.
Hay múltiples razones para la resistencia a los catéteres estándar: que el miocardio en la zona del istmo tenga un grosor mayor del habitual y, por tanto, que las lesiones no sean transmurales, que sean transitorias o bien la propia topografía del lugar (recesos muy amplios)8-11. Esto puede conducir a líneas de bloqueo incompletas o a lesiones transitorias. Todas estas razones son una limitación de los catéteres estándar, debido al pequeño tamaño de la lesión creada con ellos. Por este motivo se han utilizado varios diseños de catéteres para la búsqueda de un método de ablación más efectivo12-18. De ellos, se ha propuesto que los catéteres con punta irrigada, al crear mayores lesiones y más profundas, pueden ser útiles para la ablación del aleteo auricular19-26. Sin embargo, al realizar lesiones más profundas se corre el riesgo de poder dañar la arteria coronaria derecha (ACD) en su paso por debajo del istmo, en el interior de la grasa del surco AV, ya que la profundidad a la que se encuentra habitualmente es menor que la distancia teórica de muchas lesiones descritas provocadas por los catéteres irrigados, con energías de empleo común en la clínica humana27.
El propósito de este estudio fue comparar la ablación realizada utilizando catéteres con punta irrigada con la efectuada mediante catéteres estándar, analizando posteriormente las características anatómicas subagudas de las lesiones creadas y el árbol coronario postablación, en un modelo experimental en el cerdo. El animal de experimentación elegido fue el cerdo debido a múltiples razones, entre las que destacan su tamaño similar al humano, lo que facilita el empleo de las mismas técnicas y catéteres, la propia experiencia del grupo en este animal y las facilidades de nuestro animalario y servicio de veterinaria para su manejo.
MATERIAL Y MÉTODOS
Preparación experimental
El protocolo experimental fue aprobado por el comité de ética del hospital y siguió las guías estándar para el cuidado y uso de animales de laboratorio. Se anestesiaron 16 cerdos con 25 mg/kg de pentobarbital sódico intravenoso, se intubaron endotraquealmente y recibieron ventilación mecánica con aporte de oxígeno. La anestesia general se mantuvo con isofluorano al 2-3%. Se introdujeron vainas hemostáticas por la vena yugular y la vena femoral derechas. El ECG de superficie y los electrogramas intracardíacos se visualizaron y grabaron en un polígrafo multicanal (Cardiac Pathways Corp., Sunnyvalley, CA, EE.UU.). Se registraron cualquier cambio en el estado clínico y las modificaciones del segmento ST, así como la incidencia de arritmias durante y después del procedimiento.
Estudio electrofisiológico
Se empleó un catéter electrodo Halo de 20 polos (Cordis-Webster con intervalos 2-7-2 mm) para valorar la activación del anillo tricúspide durante la estimulación auricular. La posición correcta del catéter Halo se comprobó en la posición oblicua anterior izquierda a 45º. Se registraron electrogramas de la aurícula derecha lateral y del septo auricular. Previo a la ablación, el mapeo de la secuencia de activación auricular se realizó en ritmo sinusal y durante estimulación auricular a longitudes de ciclo de 300-500 ms a cada lado del istmo. El bloqueo del istmo se documentó por la secuencia de activación auricular con estimulación auricular a ambos lados del istmo, antes y después de 30 min de finalizar el procedimiento de ablación.
Catéteres de ablación y generadores de radiofrecuencia
La ablación por radiofrecuencia estándar se realizó con un catéter con punta deflectable de 4 mm, calibre 7 Fr, modelo Marinr (Medtronic Inc., Minneapolis, EE.UU.). El generador de radiofrecuencia fue un Atakr de Medtronic. La aplicación se realizó con modo de control de temperatura, con una temperatura diana de 70 ºC. El catéter de punta irrigada fue un deflectable de calibre 7 Fr, con punta de 4 mm modelo Chilli® (Cardiac Pathways Corp, Sunnyvalley, CA, EE.UU.). La luz central de este catéter contiene dos canales para la circulación de la solución salina. Durante la aplicación de radiofrecuencia, la bomba de infusión (modelo 8004, Cardiac Pathways) hizo circular solución salina a través del electrodo con un flujo de 36 ml/min. El medio de enfriamiento fue solución salina normal heparinizada (0,9%) a temperatura ambiente. Elegimos una potencia media de 25 W (que empleamos más frecuentemente en el humano) y máxima de 50 W (para observar lesiones a la máxima energía proporcionada por este generador) con el fin de realizar la ablación con este catéter, de forma aleatorizada.
Protocolo de ablación por radiofrecuencia
Los dos tipos de catéteres de ablación (estándar y catéter enfriado) se eligieron de forma aleatorizada. Los catéteres se avanzaron hasta el ventrículo derecho bajo guía radioscópica. El contacto catéter-tejido se evaluó con radioscopia. Se realizó una línea de lesiones secuenciales comenzando en el anillo valvular tricuspídeo con la retirada escalonada del catéter hasta la vena cava inferior, intentando siempre la ablación lateral del istmo. Los sitios secuenciales de la aurícula para realizar la ablación fueron cuidadosamente seleccionados observando la morfología y amplitud de los potenciales registrados en el par distal de electrodos del catéter de ablación. El objetivo fue realizar una única línea continua de ablación en el ICT, con cada catéter en cada animal. El éxito de la ablación se documentó por la demostración de una línea de bloqueo bidireccional de la conducción por el istmo entre el anillo tricuspídeo y la vena cava inferior.
La corriente de radiofrecuencia se aplicó entre el electrodo distal del catéter de ablación y un parche adhesivo externo. La aplicación se interrumpió si se observaba un incremento en la impedancia o la temperatura. Para cada ablación, el voltaje, corriente, temperatura e impedancia se monitorizaron de forma continua y se registraron. Inmediatamente después de la ablación se registraron la frecuencia cardíaca y el electrograma del sitio de ablación. El ECG de superficie de 12 derivaciones se analizó durante y después de cada aplicación de energía, así como al final del procedimiento para monitorizar los cambios del segmento ST. Tras la retirada de los catéteres, la punta se examinó cuidadosamente para comprobar evidencias de coágulo o carbonización.
Estudio anatomopatológico
Los especímenes de corazón se extrajeron después de una semana, para valorar los cambios subagudos. Después de examinar la superficie epicárdica para verificar la presencia de posibles lesiones transmurales, la aurícula derecha se abrió y se examinó con cuidado. Cada lesión se examinó para analizar el aspecto macroscópico y la presencia de trombos en el lado endocárdico. Se analizó el tejido para medir la dimensión de la lesión, la extensión del daño por ablación, la contigüidad de lesión, la transmuralidad y evidencia de daño pericárdico o vascular. La relación entre la ACD y el istmo ablacionado fue cuidadosamente analizada. Medimos la distancia más corta entre la ACD y el endocardio ablacionado, el espesor del músculo auricular justo encima de la ACD, y la distancia entre el endocardio encima de la ACD y la inserción de la válvula tricúspide. Tras el examen macroscópico, el corazón se fijó en formol neutro al 10% hasta la realización del examen microscópico. El istmo se incrustó entonces en un bloque de parafina, cortado en rodajas de 3,5 µm de espesor y teñidas con hematoxilina-eosina, y orceína para analizar las fibras elásticas, y fue analizado con el microscopio óptico posteriormente.
Análisis estadístico
Las variables continuas se expresaron como media y desviación estándar. Para comparar las variables discretas se utilizó el test de la *2. La correlación entre distintas variables se realizó con el test de Pearson. Las diferencias de medias entre variables cuantitativas con distribución normal se analizaron con el test de la t de Student. Se consideró significativo un valor de p < 0,05.
RESULTADOS
No hubo diferencias significativas en el peso de los animales en cada grupo (35 ± 5 estándar frente a 34 ± 6 kg irrigados). El peso de los corazones no fue tampoco diferente entre ambos grupos: 212 ± 54 g, 145-245 g para estándar y 205 ± 28 g, 152-250 g para irrigados.
Datos de la ablación
La duración total del procedimiento (47 ± 18 estándar, 35 ± 19 min para irrigados) y el tiempo de escopia (14 ± 8 estándar, 14 ± 5 min irrigados), así como el número de aplicaciones (7,3 ± 3 estándar, 7,5 ± 4,4 min irrigados), no fueron diferente en cada grupo (tabla 1). Como se indicó previamente, el propósito de este estudio experimental fue crear una sola línea, no repetir múltiples aplicaciones en el mismo sitio.
Se realizaron un total de 139 aplicaciones de radiofrecuencia en los 16 animales, empleando los dos catéteres (58 irrigados, 61 estándar). Se observó un aumento brusco de impedancia en ambos casos, que en los catéteres irrigados se produjo a una temperatura mucho menor que con los catéteres estándar. Se observaron 17 (12,2%) interrupciones prematuras de la aplicación debidas a: aumento de impedancia en 10 (10 con irrigados), dos por baja impedancia (dos estándar), cinco por aumento de temperatura (cinco irrigados) y cinco por desplazamiento del catéter (dos irrigados, tres estándar). Cuando se emplearon energías de 25 vatios, con los catéteres irrigados, sólo observamos dos aumentos de impedancia bruscos (8%); en cuanto al resto, 8 de 10 se observaron con 50 vatios (p < 0,001). Se escuchó un plop en 2 de 139 aplicaciones (1,4%). Se encontraron restos de coágulo en la superficie de la punta del catéter tras 6 aplicaciones del catéter estándar y tras ninguna con catéteres irrigados. La temperatura alcanzada con los catéteres estándar se consideró adecuada (62 ± 6 ºC) y superior a la registrada con los catéteres irrigados (34 ± 7 ºC). Sin embargo, la energía liberada con los catéteres irrigados fue superior (39 ± 12 W) a la liberada con los catéteres estándar (22 ± 13 W). La impedancia media no fue diferente significativamente (97 ± 16 ohmios estándar, 95 ± 12 ohmios irrigados) (tabla 2).
No hubo complicaciones significativas durante o tras el procedimiento, evaluadas clínicamente y con electrocardiograma de 12 derivaciones, ni evidencia de isquemia miocárdica aguda o arritmias. Por tanto, el riesgo de que los animales sufrieran una trombosis aguda coronaria sería muy raro y puede descartarse en nuestra serie. Ninguno de los animales presentaba derrame pericárdico cuando se extrajo el corazón.
En 12 cerdos se consiguió bloqueo completo bidireccional del istmo tras realizar la primera línea de ablación, documentado mediante la secuencia de activación del anillo tricúspide con estimulación auricular (ocho ablacionados con el catéter irrigado y cuatro con el catéter estándar). En 2 animales, se documentó persistencia de conducción lenta a través del ICT (con catéter estándar).
Análisis anatomopatológico macroscópico
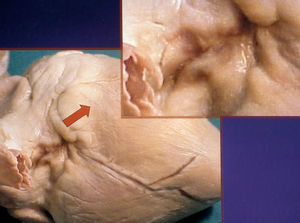
Cuando la lesión del miocardio auricular era totalmente transmural se podía observar, en el aspecto epicárdico del corazón, lo que ocurrió en 14 casos. Se apreciaba una lesión blanquecina-rojiza de bordes geográficos con unas dimensiones variables. Por debajo de dicha lesión salía, desde la grasa del surco AV, la coronaria derecha, dando lugar posteriormente a la arteria descendente posterior, en la que no se observaban alteraciones macroscópicas. En la figura 1 se expone una lesión de estas características producida con un catéter irrigado y potencia de 50 W.
Fig. 1. Superficie externa cardíaca, en el istmo cavotricuspídeo. Se observa una lesión blanquecina-rojiza de bordes geográficos con unas dimensiones de 2,5 * 0,7 cm. Adyacente, por debajo de la lesión, sale desde la grasa del surco AV la arteria descendente posterior, en la que no se observan alteraciones macroscópicas. Esta lesión se produjo con un catéter irrigado y potencia de 50 W.
Tras la apertura de la aurícula derecha en su cara posterior se analizaron las lesiones y se documentaron las dimensiones anatómicas del istmo. Las dimensiones medias del istmo fueron: 22 ± 7 mm en longitud, con un espesor máximo en la zona de la lesión de 4,25 ± 0,91 mm. Se valoró la lesión lineal a través del ICT en todos los animales. Esta línea era anatómicamente completa en 10 animales (cuatro estándar y seis irrigados). La lesión era por completo transmural en 14 animales. La lesión subaguda aparecía como una región rojiza, de bordes geográficos claramente delimitada del endocardio sano adyacente, con una depresión ligera. Las lesiones provocadas por los catéteres irrigados tenían unas dimensiones en superficie superiores a las provocadas con catéteres estándar (4 ± 2 mm de anchura para estándar frente 7 ± 3 mm para irrigados). No se identificó ningún trombo mural en lesión alguna, ni tampoco perforación miocárdica. La superficie endocárdica estaba preservada en 13 animales y con cratering (disrupción de la superficie endocárdica) en 3 animales (dos con estándar, uno irrigado). En 3 animales (dos con catéter irrigado y uno con catéter estándar) las lesiones se extendieron a la base del ventrículo derecho. No se observaron alteraciones estructurales en la válvula tricúspide.
Análisis microscópico
La imagen histológica era similar en todos los casos, con áreas extensas de necrosis de coagulación del músculo estriado auricular, con un infiltrado inflamatorio rodeando las zonas necróticas, constituido por linfocitos, células plasmáticas, monocitos y macrófagos, con neutrófilos y algún eosinófilo y reacción granulomatosa con presencia de células gigantes. En 3 casos, la reparación se observó más fibroblástica. El citoplasma en la zona de ablación se encontraba condensado, hipereosinofílico, en las tinciones de hematoxilina-eosina, con retracción nuclear y signos de apoptosis. Se observó una homogeneización del citoplasma y pérdida de las estrías transversales del miocito, con picnosis o pérdida de los núcleos y focos de desintegración celular. Esta necrosis es distinta de la necrosis en bandas, que presenta estriaciones en el citoplasma debidas a la contractura del sarcolema. Entre ellas se observan células inflamatorias de tipo monocitario y macrófago, para fagocitar los restos de las fibras miocárdicas. Se aprecia edema entre las fibras necrosadas. Ocasionalmente, se observó vasculitis de pequeño vaso en las zonas más inflamadas, con necrosis fibrinoide de la pared.
Evaluación macroscópica de la arteria coronaria derecha
Se realizó una sección longitudinal del surco AV derecho para observar cómo se extendía la lesión desde el sitio endocárdico de ablación a la ACD. En todos los animales, la ACD se encontraba justo por debajo del ICT ablacionado, rodeada de la grasa epicárdica. La distancia media entre la ACD y la superficie endocárdica ablacionada era de 5,7 ± 1,9 mm, y el grosor medio del miocardio auricular por encima de la coronaria de 3,7 ± 1,0 mm. Tres (18%) de los animales tenían una distancia endocardio-coronaria inferior o igual a 4 mm (tabla 3). El grosor de la almohadilla grasa, en el surco AV, interpuesta entre la superficie epicárdica auricular y la propia coronaria era variable en cada caso, oscilando entre 2 y 8 mm. En ninguna arteria se observó daño o alteración visible macroscópicamente, aunque la lesión era por completo transmural justo por encima, en el miocardio auricular. No se detectó en ningún caso la presencia de trombosis oclusiva, suboclusiva ni mural.
Evaluación microscópica de la arteria coronaria
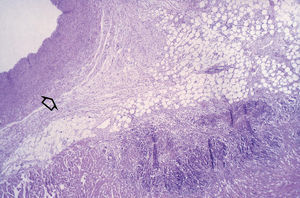
La sección microscópica de la arteria coronaria puso de manifiesto la disposición normal de una arteria muscular, con íntima, media y adventicia. Se observaba un infiltrado inflamatorio en la grasa epicárdica que rodeaba la arteria coronaria, que alcanzaba en 14 casos (todos los transmurales) la adventicia de la arteria coronaria, pero sin que se apreciara necrosis; se observó cierta desestructuración de dicha capa adventicia por el infiltrado inflamatorio (fig. 2). Éste era de predominio linfomonocítico (linfocitos, monocitos, algún macrófago), con formación de pequeños microabscesos (constituidos de polimorfonucleares). La capa muscular de la arteria presentaba infiltrado inflamatorio con carácter focal, en su porción más cercana a la adventicia en tan sólo 2 casos, también sin ningún signo de necrosis. En estos casos, la lámina elástica externa se observaba de forma desestructurada, debido a la presencia del infiltrado inflamatorio. Se apreciaron zonas de fibrosis en la adventicia de la arteria coronaria derecha en 2 casos, con localización preferente alrededor de la propia coronaria, así como alrededor de pequeñas arteriolas.
Fig. 2. Preparación microscópica del miocardio auricular ablacionado (tinción de hematoxilina-eosina, *10). Vista del miocardio auricular en continuidad al epicardio con la arteria coronaria derecha. Está cortada en el istmo cavotricuspídeo. Se observa en el seno del epicardio, en la grasa del surco AV, la arteria coronaria derecha. En la porción más externa del miocardio auricular se aprecia una zona de necrosis con una disposición irregular patológica de las fibras miocárdicas en la periferia de dicha lesión. Hay cierta fibrosis en la adventicia de la arteria coronaria derecha y un infiltrado inflamatorio que se extiende a la grasa epicárdica. Este infiltrado inflamatorio afectaba focalmente a la capa media. No se observa ningún foco de necrosis en la pared arterial ni en la grasa epicárdica. En el endotelio no se aprecian alteraciones patológicas. Obsérvense en el interior de la propia grasa epicárdica arteriolas y vénulas epicárdicas, acompañando a la coronaria derecha en las que no se observaban alteraciones histológicas significativas.
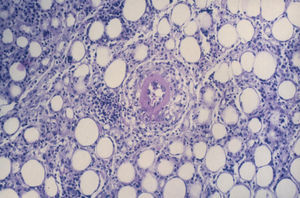
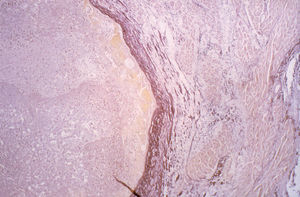
No se observó ningún foco de necrosis en la grasa epicárdica. Las células inflamatorias se disponían alrededor de los lobulillos grasos, sin producir necrosis de los mismos. Los adipocitos eran bastante uniformes y no se apreciaban histiocitos espumosos, como sería característico si hubiera habido necrosis grasa (fig. 3). En el interior de la propia grasa epicárdica se observaban las arteriolas y vénulas epicárdicas acompañando a la coronaria derecha, en las que no se apreciaron alteraciones histológicas significativas, salvo en un caso, con necrosis de la vena. Una vena de mediano tamaño, epicárdica, cercana a una lesión, resultó completamente necrosada en sus 3 capas, como se observa en la figura 4, que es una preparación teñida con orceína para resaltar las fibras elásticas. En el endotelio de la arteria no se observaron alteraciones patológicas en ningún caso.
Fig. 3. Vista a mayor aumento (*40). Detalle del infiltrado inflamatorio en la grasa epicárdica. Dicho infiltrado es de predominio linfomonocítico (linfocitos, monocitos, algún macrófago), con formación de pequeños microabscesos (constituidos de polimorfonucleares). Las células inflamatorias se disponen alrededor de los lobulillos grasos, sin producir necrosis de los mismos. Los adipocitos son bastante uniformes, sin que se observen histiocitos espumosos, como sería característico si hubiera necrosis grasa. En el centro del campo se observa una arteriola de pequeño tamaño, en la que está afectada exclusivamente la adventicia. La luz de la arteriola está revestida por las células endoteliales, con los núcleos de las mismas de aspecto normal. En el interior de la misma se observan los elementos formes de la sangre, hematíes y algún polimorfonuclear.
Fig. 4. Preparación teñida con orceína para resaltar las fibras elásticas. En esta imagen se observa un detalle de la pared de una vena a gran aumento. En él llaman la atención el desdoblamiento y la frecuente disrupción de la elástica, que incluso se extiende por el espesor de la capa media. Alrededor de la vena se encuentra el miocardio auricular desestructurado
DISCUSIÓN
La ablación con catéter por radiofrecuencia del aleteo auricular
Desde la introducción, en 1982, de la ablación con catéter de las arritmias cardíacas28, el desarrollo tecnológico y los excelentes resultados obtenidos han hecho posible que se hayan ampliado las indicaciones de esta técnica, siendo el tratamiento curativo de elección en gran número de arritmias cardíacas y una opción terapéutica alternativa o paliativa en otros casos.
Cosío et al29 propusieron la aplicación de energía de radiofrecuencia secuencialmente en el istmo entre la vena cava inferior y la válvula tricúspide. Aunque la ablación por catéter del aleteo auricular típico es un procedimiento establecido, la compleja estructura anatómica y las variaciones del ICT pueden dificultar algunos casos. La ablación por radiofrecuencia es apropiada no solamente en pacientes con aleteo auricular refractario al tratamiento farmacológico, sino también en aquellos que desean una alternativa a los fármacos antiarrítmicos o a la cardioversión eléctrica30,31.
Algunas porciones del circuito del aleteo auricular típico en el ICT pueden estar próximas al epicardio, más allá de la profundidad de penetración de las lesiones por radiofrecuencia estándar. La topografía local es también importante: puede haber una compleja anatomía del istmo, recesos grandes donde puede no haber un buen enfriamiento convectivo y, por tanto, una limitada entrega de energía. Cuando encontramos a un paciente que es resistente a la ablación por radiofrecuencia estándar hay varias alternativas terapéuticas: repetición de las líneas en una zona más septal o lateral, aplicación de múltiples lesiones, o bien tratar de identificar los gaps analizando la presencia de dobles potenciales en la línea de ablación4.
Estudios experimentales previos han demostrado que empleando catéteres de punta irrigada se consiguen lesiones más profundas y anchas18-25,31-33. La irrigación de la punta con solución salina mantiene una pequeña interface electrodo-tejido, permitiendo una mayor entrega de energía de radiofrecuencia y lesiones más profundas. La lesión creada por los catéteres de punta irrigada puede alcanzar más de 10 mm en diámetro y profundidad. Las ventajas potenciales de los catéteres de punta irrigada en el tratamiento del aleteo auricular podrían incluir una ablación más rápida del istmo, con menor tiempo de fluoroscopia (y sus riesgos inherentes), una mayor tasa de éxito (menos gaps y más pequeños) y, posiblemente, un número reducido de recurrencias de aleteo auricular34. Para expandir el uso de los catéteres irrigados, un problema importante a evaluar previamente es la posible afección coronaria, dada la anatomía del istmo y la posición de la arteria coronaria derecha en el surco AV derecho. La arteria coronaria derecha está ubicada justo debajo del istmo, rodeando la unión auriculoventricular derecha, y las lesiones mayores creadas con estos catéteres podrían potencialmente dañarla27.
Hay distintas técnicas para el enfriamiento activo de la punta del catéter. El sistema de lumen cerrado («enfriado»), en el que el circuito está completamente dentro de la punta del catéter enfriado, y el sistema de lumen abierto («propiamente irrigado») en el que la solución salina fluye fuera de la punta del catéter hacia la sangre del paciente. Estudios experimentales han demostrado que usando ambos tipos de catéteres de punta irrigada21 se obtienen con seguridad lesiones más profundas y más anchas. El centro de calentamiento máximo se mueve a mayor profundidad en el miocardio y la transmuralidad se logra mucho más fácilmente, sin aumentar la incidencia de erosión endotelial. Una desventaja importante es la pérdida de mediciones válidas de la temperatura, ya que ésta se mide en la superficie. El sensor de temperatura ubicado dentro del electrodo no reflejará la interface electrodo-tejido o la temperatura tisular debido a los efectos refrigerantes de la irrigación salina del electrodo. La temperatura reflejada es la del electrodo refrigerado, no la tisular. De todas formas, el registro de la temperatura desde el electrodo durante la aplicación de la corriente de radiofrecuencia asegura que el flujo de irrigación está mantenido.
Dimensiones anatómicas del istmo cavotricuspídeo y su relación con la ablación
Tabuchi et al35 publicaron una serie de ablación lineal del istmo entre la vena cava inferior y el anilllo tricuspídeo para el tratamiento del aleteo auricular en un modelo canino (11 perros). Estos autores realizaron la ablación con un catéter estándar 7 Fr, 4 mm (catéter Elecath). La longitud media del istmo en esta serie fue de 11 mm (rango, 9-15) y el espesor promedio del músculo auricular fue de 2 mm (rango, 1,7-2,2). Los autores produjeron lesiones transmurales en todos los animales. No obstante, debemos recordar que los animales eran perros, con un músculo del miocardio auricular más fino que el usualmente encontrado en seres humanos (que puede ser hasta 10 mm)9,10 . Existen considerables variaciones en la anatomía humana de la pared auricular y del ICT. La longitud del istmo inferior puede variar desde 19 a 40 mm y el espesor del músculo auricular puede ser de hasta 9-10 mm9,10. Considerando que las lesiones típicas creadas durante la ablación por radiofrecuencia con catéter estándar no son usualmente mayores de 5-7 mm13,14, un miocardio del istmo de mayor espesor que el habitual puede dificultar la producción de una lesión completa transmural.
En el paciente con aleteo auricular, la longitud del ICT puede ser mayor, más de 3 cm en pacientes con aleteo auricular, según describen Cabrera et al10 y, por lo tanto, la ablación por radiofrecuencia de un sitio específico con un catéter estándar con electrodo distal grande puede ser insuficiente para eliminar el circuito. El catéter de punta irrigada crea lesiones más grandes y profundas, y reduce la necesidad de líneas extra para conseguir el bloqueo del ICT36. Esto se corresponderá probablemente en el futuro con menores recurrencias de aleteo auricular, menor tiempo total del procedimiento y reducción del tiempo de exposición a fluoroscopia y, por tanto, a radiación. En 12 animales se consiguió bloqueo del istmo. Sin embargo, en sólo 10 se vio una línea anatómicamente completa. En 2 casos, con catéter de punta irrigada se consiguió el bloqueo completo del istmo con la línea anatómicamente incompleta. Esta discrepancia anatómico-electrofisiológica puede ser otro factor que influya en la alta tasa de recurrencia postablación del aleteo en comparación con la de otras arritmias, a pesar de que se ha demostrado bloqueo del istmo al terminar el procedimiento. Las lesiones mayores y más profundas pueden, al menos teóricamente, ser peligrosas en algunos casos, y sentimos una fuerte necesidad de ser más cuidadosos que con los catéteres estándar.
Alteraciones macroscópicas y microscópicas de los vasos coronarios
La proximidad de la arteria coronaria derecha advierte de la posibilidad de daño directo o indirecto. En nuestro estudio observamos la afectación por el infiltrado inflamatorio procedente de la grasa perilesión miocárdica de la propia adventicia coronaria y focalmente de la capa media. Sin embargo, en ningún caso se documentó necrosis en ninguna capa, ni fenómenos estenóticos de la coronaria. Algunos autores han postulado, para explicar la baja incidencia de eventos isquémicos clínicos tras la ablación del ICT, que la adventicia y el tejido conectivo en general podrían proteger a la arteria. Otra explicación es que la arteria puede estar protegida por el elevado flujo sanguíneo, conservando la pared arterial fría, cuando el tejido circundante es calentado. Otra hipótesis alternativa podría ser que el tejido adiposo que rodea a la arteria en el interior del surco AV podría dificultar el calentamiento de la arteria.
Complicaciones de la ablación con radiofrecuencia en la bibliografía
Tras la ablación con radiofrecuencia se han descrito distintas complicaciones, relacionadas en su mayoría con la propia técnica de cateterización vascular y en menor número con la propia energía de radiofrecuencia37-39. Estas complicaciones dependen en gran parte de la propia experiencia del equipo de electrofisiólogos y del operador, y se reducen de forma considerable tras la llamada curva de aprendizaje. Una de las series más recientes que ha descrito las complicaciones de la ablación con radiofrecuencia es la de Calkins et al38, pero en ella no se incluyó la ablación de aleteo auricular, sino que se describieron complicaciones importantes en 32 de 1.050 pacientes. En cuanto a la incidencia de infarto agudo de miocardio o eventos isquémicos, en esta serie fue de tan sólo un 0,20% (un infarto de miocardio y un espasmo coronario). En otras series, las complicaciones descritas para la ablación del aleteo auricular típico han sido bajas1,34,36, salvo cuando se intenta la ablación del aleteo con aplicaciones en el septo bajo, en torno a la boca del seno coronario, en el que hay mayor riesgo de bloqueo AV40. En el estudio MEradiofrecuenciaS37 se incluyeron un total de 141 procedimientos de ablación de taquicardia auricular y aleteo (se consideraron de forma conjunta ambos procedimientos) y se comunicaron un 5% de complicaciones (porcentaje similar al de las otras técnicas en aquel momento, antes de 1993), de las cuales un 0,7% correspondía a un evento isquémico, el resto era derrame pericárdico, perforaciones, bloqueo AV, trombosis venosa y embolismo. En series importantes más recientes no se ha descrito eventos isquémicos agudos con catéteres estándar1 o irrigados34.
Limitaciones de nuestro estudio
En nuestro estudio se evaluaron los cambios subagudos a la semana de la ablación. Haber elegido realizar la extracción del corazón de forma aguda tras la radiofrecuencia nos hubiera permitido valorar la presencia de trombosis arterial. Sin embargo, clínica y electrocardiográficamente no se documentó ninguna alteración, lo que hace improbable que pudiera ocurrir. De igual forma, se podrían haber estudiado los cambios crónicos, tras 2 meses de la ablación. Sin embargo, esto no era logísticamente posible en nuestro medio, por lo que elegimos realizar el análisis a la semana. Muchos de los cambios que se podrían producir en la arteria y el tejido lesionado, aparte de la fibrosis, pueden comenzar a desarrollarse de forma tardía, por expresión de determinados genes y proteínas que tardarían más tiempo en manifestarse. Por ejemplo, el factor tisular, una glucoproteína ligada a membrana que es uno de los iniciadores primarios de la coagulación, está presente en la adventicia de los vasos normales y puede ser inducido por las lesiones en la misma. El factor tisular puede desempeñar un papel importante en el desarrollo de neoíntima en las lesiones arteriosclerosas, favoreciendo el trombo mural y acelerando con posterioridad el crecimiento del endotelio. Este proceso puede depender de mecanismos dependientes o independientes de la coagulación. Se sabe que la sobreexpresión de factores de crecimiento y estimulación del crecimiento de células musculares lisas, con proliferación y migración de las mismas, se puede detectar desde las 2 semanas después de un evento activador41. Por otra parte, la adventicia evidenció signos inflamatorios, y ésta es la capa que lleva la inervación y la irrigación de la pared de la arteria. No se sabe si con el tiempo podrán existir problemas derivados de ese daño en forma de alteraciones espásticas u orgánicas. El grosor del miocardio auricular no es uniforme en el área ístmica, y el área medial es la de menor grosor; aunque se intentó en todos los animales la realización de la línea de ablación en el istmo lateral, la peculiar disposición anatómica fluoroscópica del corazón del cerdo hizo que éste se desplazara a la región septal en algunos animales. Quizá debemos recordar que esto también puede pasar en el hombre, al menos de forma teórica. En el septo, el índice de bloqueo AV, dadas las mayores dimensiones de las lesiones provocadas con el catéter irrigado, podría ser mayor, pudiendo afectar a la propia arteria del nodo AV, de localización variable42. La última limitación con posible significado clínico es que, en el modelo experimental utilizado, las lesiones son sobre arterias sanas; sin embargo, un porcentaje importante de pacientes sometidos a ablación con radiofrecuencia presentan enfermedad arterial coronaria, por lo que los efectos de las lesiones en estas arterias, con peor flujo sanguíneo, podrían ser distintos. La edad es otro factor limitante, dadas las menores distancias a medida que el corazón es más pequeño y de hecho se han descrito casos de oclusiones de la arteria coronaria derecha con catéter convencional43.
CONCLUSIONES
A pesar de la proximidad de la arteria coronaria derecha a las lesiones provocadas durante la ablación con catéter del ICT, no hemos observado necrosis de ninguna capa estructural ni con catéteres estándar ni con irrigados a la semana del procedimiento. Hemos apreciado signos inflamatorios en la adventicia que, como máximo, han alcanzado la capa media, sin aproximarse al endotelio. La pared venosa sí es susceptible de lesión con radiofrecuencia, así como las pequeñas arteriolas en el interior de la propia lesión, y esto podría explicarse en parte por el distinto flujo de cada vaso.
Este trabajo obtuvo un accésit del Premio de la Fundación Española del Corazón 2000 a la mejor comunicación del Congreso Nacional celebrado en Granada en octubre del 2000. Correspondencia: Dra. C. Moro. Unidad de Arritmias. Hospital Ramón y Cajal. Ctra. Colmenar Viejo, km 9,100. 28034 Madrid. Correo electrónico: cmoro@hrc.insalud.es Recibido el 2 de noviembre del 2000. Aceptado para su publicación el 22 de enero del 2001.