Palabras clave
INTRODUCCIÓN
La fibrilación auricular (FA) está presente en los pacientes con valvulopatía mitral con una prevalencia del 40-80% en el momento de su cirugía1,2. El tamaño auricular es uno de los factores relacionados con la génesis y posterior mantenimiento de la FA3-6. El procedimiento quirúrgico laberinto o maze es, por el momento, el tratamiento más efectivo en la FA con una cardioversión a ritmo sinusal superior al 75% en pacientes con valvulopatía mitral7-11. Entre los factores predictivos de fracaso del maze están el tamaño auricular superior a 50 mm y el tiempo de evolución de la FA11,12. Es probable que si con las atriotomías del maze quedan amplias zonas de tejido auricular sin dividir se reproduzcan las reentradas focales y perdure la FA. Diversos grupos quirúrgicos han planteado asociar al procedimiento maze la reducción de tejido auricular, aunque por el momento se desconoce cómo puede este factor modificar el resultado final de una intervención de por sí compleja11,13. Se han descrito casos en la bibliografía con reducción de tejido auricular como procedimiento quirúrgico para la FA asociado con el aislamiento de las venas pulmonares13,14.
Este estudio valora la reducción del tamaño auricular como procedimiento quirúrgico alternativo en la cardioversión quirúrgica de los pacientes en FA crónica. Para ello estudiamos de forma prospectiva los efectos de una auriculectomía parcial en un grupo de pacientes en FA crónica con lesión mitral que precisaban de reparación valvular quirúrgica.
PACIENTES Y MÉTODO
El estudio fue aprobado por el Comité de Ensayos Clínicos del hospital en junio de 1998, y forma parte del proyecto de investigación FIS 99/0484. Durante un año, 19 pacientes en FA crónica por valvulopatía mitral fueron intervenidos para reparación de su valvulopatía. Todos los enfermos fueron informados del procedimiento y dieron por escrito su consentimiento. De forma prospectiva y aleatorizada, los pacientes fueron divididos en dos grupos: 10 enfermos (grupo I) en los que al procedimiento valvular se asoció una reducción auricular izquierda quirúrgica, y 9 pacientes que formaban el grupo control (grupo II) en los que sólo se realizó el procedimiento valvular mitral. Fueron excluidos los enfermos que presentaban de forma asociada otros procesos patológicos, como cardiopatía isquémica, miocardiopatía obstructiva crónica, valvulopatía aórtica, y/o pacientes con fracción de eyección menor del 35%. Aceptaron participar en el estudio 3 varo nes y 16 mujeres, con edades comprendidas entre 37 y 76 años (57 ± 11 años, media ± desviación estándar). La etiología de la valvulopatía mitral fue reumática en 15 casos, y degenerativa en cuatro. Se hallaron cinco dobles lesiones, dos estenosis y tres insuficiencias mitrales en el grupo I, y cuatro dobles lesiones, cuatro estenosis y una insuficiencia mitral en el grupo II. En 4 pacientes la intervención fue una reoperación mitral. La FA fue crónica en todos los casos, con más de 3 meses de duración. La antigüedad de la FA se documentó electrocardiográficamente y osciló entre 5 meses y 26 años, con una media de 10 ± 7,2 años. Dos pacientes (10,5%) presentaban una FA crónica con menos de un año, dos (10,5%) entre uno y 3 años, y 15 (78,9%) con más de 3 años de antigüedad. El voltaje electrocardiográfico de la onda f en precordial V1 fue 0,12 ± 0,06 mV, entre 0,05 y 0,2 mV. La mayoría de pacientes habían tomado al menos 2 fármacos antiarrítmicos para el control de la FA, sobre todo digital y amiodarona. El promedio de antiarrítmicos por paciente fue de 2,1 ± 0,8 (rango, 2-4). Dos pacientes tuvieron antecedentes de intoxicación digitálica y otros tres efectos adversos por la amiodarona (dos hipertiroidismos y una trombopenia). En el momento de la intervención todos los pacientes tomaban alguna clase de antiarrítmico. El sexo, la edad, la duración de la FA, el número de fármacos antiarrítmicos empleados antes de la intervención, la amplitud de la onda f, la reintervención mitral y las dimensiones de aurícula izquierda fueron similares en ambos grupos, sin que se detectaran diferencias estadísticamente significativas entre ellos (tabla 1). Sólo en el tipo de valvulopatía hubo diferencias entre los grupos.
Clínicamente todos los pacientes presentaban disnea al esfuerzo, con pérdida de su capacidad funcional durante los últimos años. Tres pacientes referían palpitaciones frecuentes, cuatro de ellos mareos en relación con las palpitaciones y dos tenían antecedentes de síncope. Dos pacientes presentaron como antecedente episodio embolígeno cerebral, con hemiparesia residual en un caso y afasia motora en otro. Un paciente del grupo control tenía implantado un marcapasos VVI previo a la intervención.
La ecocardiografía (ECO) preoperatoria y los controles postoperatorios se realizaron por los tres mismos ecocardiografistas con ecocardiógrafo Doppler Hewlett-Packard Sonos 1500. En cada paciente se midieron, además de los parámetros ecocardiográficos habituales en la valvulopatía mitral, los tres principales diámetros auriculares en mm, así como los respectivos patrones de llenado mitral y tricuspídeo en m/s. El diámetro anteroposterior de la aurícula izquierda (AI) se midió en el eje paraesternal, y los diámetros mediolateral y superoinferior de la AI en el eje apical cuatro cámaras. El área de la AI se planimetró ecocardiográficamente en el eje apical cuatro cámaras, y el volumen auricular se calculó aplicando la fórmula de la elipse15. Todas las medidas fueron realizadas en telesístole. Se consideró la AI como gigante cuando el diámetro anteroposterior fue mayor de 80 mm. La contribución auricular en el llenado ventricular izquierdo fue valorada mediante ECO Doppler, midiendo la velocidad pico de la contracción auricular (onda A) en m/s, velocidad de llenado auricular protodiastólica (onda E) en m/s, y la razón A/E.
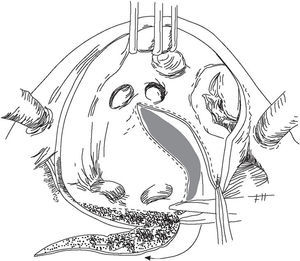
Para reducir el tamaño de la AI se realizó una au riculectomía parcial en su porción posterior (fig. 1). Después de iniciar la circulación extracorpórea se abordó la válvula mitral de forma habitual a través del surco interauricular. Finalizada la reparación valvular se procedió a la reducción auricular. Para ello se amplió la auriculotomía prolongando el extremo inferior de la incisión por debajo de la cava inferior a lo largo de la pared posterior de la AI, hasta alcanzar las venas pulmonares izquierdas. Una nueva incisión paralela a la anterior permitió resecar el tejido auricular deseado en función del tamaño auricular preoperatorio. No se aislaron las venas pulmonares ni se realizó exéresis de la orejuela izquierda. En 7 pacientes se procedió al cierre de la orejuela izquierda mediante sutura interna. Una vez finalizada la auriculectomía se cerró la cavidad con sutura doble continua de 3/0 polipropileno y se dio por finalizado el procedimiento quirúrgico.
Fig. 1. Auriculectomía parcial de la cara posterior de la aurícula izquierda.
El ritmo cardíaco fue monitorizado de forma continua durante las primeras 48 h en la unidad de cuidados intensivos (Hewlett-Packard System model 64S). Se emplearon electrodos temporales epicárdicos auricu lares y ventriculares en todos los pacientes para estimulación o registro de ritmos cardíacos, y/o sobres timulación auricular (Myo/WireTM size 2-0, Temporary Cardiac Pacing Wire, A&E Medical Corp., EE.UU.). Las arritmias postoperatorias fueron tratadas con cardioversión si tenían repercusión hemodinámica o no respondían al tratamiento farmacológico.
Los controles postoperatorios durante el seguimiento se realizaron a los 3, 6 y 12 meses mediante elec trocardiograma y ECO. Todos los pacientes fueron tratados durante los tres primeros meses con su antiarrítmico habitual. Posteriormente, éste fue retirado si el paciente se mantenía en ritmo sinusal, y la anticoagulación en los pacientes con plastia mitral o bioprótesis y con contracción auricular presente en los controles ecocardiográficos.
Los datos se expresan en media ± desviación estándar. El análisis estadístico entre grupos se calculó mediante la prueba no paramétrica de Mann-Whitney para las variables cuantitativas, y la prueba exacta de Fisher para las variables cualitativas. Se consideró una diferencia estadísticamente significativa con un valor de p menor de 0,05.
RESULTADOS
Se realizaron 15 sustituciones y cuatro reparaciones mitrales (dos plastias, una comisurotomía y una recomisurotomía mitral). No hubo mortalidad hospitalaria o tardía durante el seguimiento medio de 12 meses (rango, 8-16). En el grupo I el tiempo medio de isquemia cardíaca para la reparación mitral y la reducción auricular fue de 69 ± 24 min (rango, 38-114 min) y de circulación extracorpórea de 111 ± 31 min (rango, 65-170 min). No hubo diferencias significativas con el grupo II con un tiempo de isquemia cardíaca de 63 ± 16 min (rango, 30-88 min) y de circulación extracorpórea de 95 ± 38 min (rango, 33-151 min). Todos los pacientes fueron extubados durante las primeras 48 h y no hubo ninguna reintervención por hemorragia. El sangrado postoperatorio fue 1.023 ± 592 ml para el grupo I, y 553 ± 223 ml en el grupo II; p = 0,14. Una paciente con 44 años del grupo I requirió balón intra aórtico de contrapulsación durante las primeras 24 h por disfunción ventricular izquierda aguda atribuida inicialmente a una incorrecta protección miocárdica intraoperatoria; la coronariografía realizada al décimo día descartó una lesión coronaria asociada, y en el control ecocardiográfico del primer mes se constató una recuperación de la función ventricular preoperatoria. Un paciente del grupo I presentó durante los primeros 2 días postoperatorios una insuficiencia renal con oliguria que respondió muy bien con espironolactona; aunque no se midieron las concentraciones de factor natriurético, creemos que éste podría haber sido el mecanismo implicado. La estancia media hospitalaria fue de 9,2 ± 3 días (rango, 7-20 días), 10,7 en los pacientes del grupo I y 7,6 en los del grupo II (p = 0,006).
Electrocardiográficamente, durante la primera hora posterior a la salida de la circulación extracorpórea 2 pacientes se mantuvieron en FA, ambos con AI gigante preoperatoria (un paciente del grupo I y otro del II). Durante el resto de estancia hospitalaria, 7 enfermos del grupo II y dos del grupo I (uno de ellos con AI gigante preoperatoria) reiniciaron la FA. En el seguimiento, el único paciente del grupo II en ritmo sinusal pasó de nuevo a FA crónica al tercer mes y todos los pacientes de este grupo en FA permanecían de este modo en el momento del cierre del seguimiento. Un paciente del grupo II reingresó por flúter paroxístico al tercer mes a pesar del tratamiento farmacológico. Los 7 pacientes del grupo I han permanecido sin FA, seis en ritmo sinusal y uno con ritmo auricular bajo. Al final del seguimiento 7 pacientes del grupo I permanecen sin FA frente a los nueve con FA del grupo II (p = 0,003). Ningún paciente precisó de marcapasos (tabla 2).
Mediante este tipo de auriculectomía se consiguió reducir el tamaño de la AI en un 57%. Con un volumen de AI preoperatorio de 180 ± 181 ml, el volumen final en el grupo I fue de 77 ± 52 ml. En el grupo control el volumen auricular se redujo en un 26%, con un volumen AI preoperatorio de 140 ± 102 ml y postoperatorio de 103 ± 51 ml. En este grupo de control la reducción se debió a la inevitable plicatura de tejido auricular producida durante el cierre y no a su exéresis. La medición del área AI fue un parámetro menos preciso para valorar la reducción auricular, quizá por ser un parámetro bidimensional con el que se valoró el resultado de la reducción en dos de los planos auriculares. El área preoperatoria de la AI del grupo I fue 49 ± 25 cm2, y la postoperatoria de 29 ± 10 cm2, y del grupo II, el área preoperatoria fue de 40 ± 18 cm2, y la postoperatoria de 31 ± 12 cm2. No llegó a haber diferencias estadísticamente significativas entre los volúmenes y las áreas ecocardiográficas posquirúrgicas de ambos grupos. Esto sería probablemente diferente si los pacientes del grupo de control no hubieran tenido una reducción auricular por la plicatura producida durante el cierre.
Ecocardiográficamente, al final del seguimiento se documentó una recuperación de la contracción auricular en los 6 pacientes del grupo I que recuperaron el ritmo sinusal, con una nueva onda A transmitral 0,98 ± 0,5 m/s y una razón A/E de 0,66 ± 0,4 (tabla 2). El paciente con ritmo auricular bajo no presentaba onda A.
Se compararon los pacientes que habían recuperado ritmo auricular con los que permanecieron en FA (tabla 3). Aquellos que siguieron en FA tras la intervención tenían un área AI de 33,8 ± 12,3 cm2 y un volumen AI de 98,5 ± 53,9 ml, frente a los que recuperaron el ritmo auricular, con un área AI de 24,5 ± 5,3 cm2 y volúmenes AI de 60,3 ± 21,2 ml (p de 0,1 y 0,09). De los 3 pacientes a los que se redujo la AI y se mantuvieron en FA, dos presentaban preoperatoriamente una AI gigante con una AI final de 180 y 163 ml, aunque el tercer paciente tenía una AI final de 57 ml.
DISCUSIÓN
Ante el carácter únicamente paliativo del tratamiento farmacológico, anticoagulación y antiarrítmicos, se han planteado diversas opciones quirúrgicas en el tratamiento de la FA. En un principio se recurrió a la ablación del nodo auriculoventricular y posteriormente a procedimientos como el aislamiento eléctrico de la aurícula izquierda, la operación del corredor, o la compartimentación auricular16-19. En 1987, Cox et al describen la intervención del maze (laberinto) en pacientes con FA idiopática20 basada en la división del tejido auricular en segmentos que se mantienen interconectados, reconduciendo la despolarización sinusal al nodo auriculoventricular y eliminando la posibilidad de circuitos de reentrada por su reducida área. En la actualidad es el procedimiento más efectivo en pacientes con FA crónica por valvulopatía mitral, capaz de restablecer en más de un 75% el ritmo sinusal con contracción auricular efectiva9,21-23. Sin embargo, por su complejidad técnica y mayor morbilidad es aún hoy día un procedimiento poco empleado por la mayoría de grupos quirúrgicos. Posteriores estudios electrofisiológicos intraoperatorios en pacientes con valvulopatía mitral han permitido simplificar el procedimiento maze al localizar en la AI el origen de la mayoría de circuitos de reentrada24-26.
Numerosos estudios han demostrado cómo el crecimiento auricular es un factor pronóstico independiente relacionado con la FA, de modo que cuanto mayor es el tamaño auricular más elevada es la prevalencia en FA3-5. Entre los pacientes a los que se realiza maze, el tamaño auricular es también uno de los parámetros predictivos de fracaso si su diámetro es superior a 50 mm11,12. Diversos grupos han recomendado asociar una reducción de tejido auricular durante el procedimiento maze, aunque se desconoce la importancia que pueda tener este factor como procedimiento aislado11,13. Este estudio ha pretendido valorar la repercusión de la reducción tisular auricular en la FA por valvulopatía mitral.
Existen diversas técnicas quirúrgicas empleadas en la plicatura y reducción de la AI, desarrolladas para aquellos casos con compresión extrínseca auricular sobre una estructura vecina27-29. Nosotros decidimos prolongar la incisión empleada para el abordaje mitral a lo largo de la pared posterior de la aurícula y, sobre ella, realizar una auriculectomía parcial que nos permitiese reducir su tamaño. Se eligió este tipo de auriculectomía en primer lugar por la simplicidad y rapidez con que puede realizarse al finalizar la reparación mitral, y en segundo lugar por realizar la reducción en la porción posterior de la AI, lugar donde los estudios electrofisiológicos intraoperatorios de Harada y Sueda han demostrado que se localiza el origen de la mayoría de los frentes de ondas, concretamente en la base de su orejuela y en su pared posterior, próxima a las venas pulmonares izquierdas24,26. Por tanto, nuestro objetivo fue reducir el tamaño de la AI resecando el área en que se presupone que asientan con mayor probabilidad las reentradas de la FA. Nuestros resultados iniciales tras la reducción del tamaño auricular izquierdo son satisfactorios en un 70% de pacientes, cifra algo menor a las obtenidas con el maze en pacientes con valvulo patía mitral, con el que se alcanza una efectividad superior al 75%7-11. Por su simplicidad técnica es, en nuestra experiencia, más fácil de realizar que el procedimiento maze. Es conocido que el procedimiento quirúrgico del maze requiere unos 40 min suplementarios de isquemia y alarga unos 70 min el tiempo de circulación extracorpórea30,31. La auriculectomía parcial posterior apenas prolongó el procedimiento, con 6 min más de isquemia y 16 de circulación extracorpórea. Es un procedimiento simple y rápido que puede ser asociado sin complicaciones a la reparación mitral. Las pérdidas hemáticas fueron superiores en el grupo I, aunque no significativas, y similares a las descritas por otros autores con el procedimiento maze.
Desconocemos el mecanismo fisiopatológico exacto por el que, reduciendo el tamaño auricular, desapareció la FA. Podríamos suponer diversos mecanismos, como la reducción del área para los circuitos de reentrada mediante la auriculectomía parcial, la propia auriculotomía posterior que, aun no siendo una incisión del maze, también divide el tejido auricular, la auriculectomía selectiva dirigida a las zonas con mayor probabilidad de focos arritmogénicos y reentradas y, por último, la disminución de la tensión de la pared auricular tras la corrección valvular y la reducción del radio auricular.
Con la auriculectomía posterior conseguimos reducir el volumen auricular en el 57% de sus dimensiones preoperatorias. Sin embargo, no se consiguió normalizar el tamaño auricular en muchos de los pacientes, quizás por la simplicidad en el tipo de auriculectomía practicada. Aunque en nuestro análisis la comparación de las dimensiones de la AI entre los grupos I y II no alcanzó diferencias significativas, sí ha sido uno de los parámetros más predictivos de persistencia de FA poscirugía (tabla 3).
Durante el seguimiento se confirmó la estabilidad electrocardiográfica de los pacientes en ritmo sinusal, sin la aparición de nuevas arritmias supraventriculares. Por el corto período de seguimiento no sabemos si el tamaño poscirugía de la AI podrá ser un factor predictivo a largo plazo de recidiva de FA.
Feinberg et al demostraron, con el maze modificado, una recuperación ecocardiográfica de la función contráctil auricular en el 94% de pacientes que recuperaron el ritmo sinusal32. Kosakai et al comunicaron una recuperación de la contracción auricular en el 73% de los pacientes con FA crónica no idiopática, resultados muy similares a los descritos por otros autores30,33,34. En nuestra serie, de los 7 pacientes sin FA, en seis se confirma por Doppler cardíaco la presencia de una onda A de flujo transmitral, lo que demuestra que el tipo de auriculectomía empleada no ha limitado la contracción auricular.
El presente estudio tiene importantes limitaciones, como el reducido número de pacientes, la falta de un estudio electrofisiológico intraoperatorio de la AI, la inclusión de pacientes exclusivamente con FA crónica secundaria a valvulopatía mitral, el subestimar a la aurícula derecha como potencial área de tejido implicada en las reentradas, etc. No hemos asociado a la reducción auricular otros procedimientos, como el aislamiento de las venas pulmonares, los cuales ya han demostrado su eficacia y probablemente podrían mejorar los resultados obtenidos con la reducción. Ampliando la experiencia podremos conocer con mayor exactitud los mecanismos implicados en la resolución de la FA y, de esta forma, definir qué subgrupo pueden beneficiarse de esta técnica. Además, será necesario compararla con otros procedimientos quirúrgicos para la FA, como el propio maze.
Nuestra experiencia inicial ha alcanzado unos resultados óptimos aplicando una simple auriculectomía parcial, sin incrementar el riesgo quirúrgico en los pacientes con FA crónica que precisan reparación quirúrgica mitral. La reducción auricular en pacientes con aurícula grande podría ser un mecanismo implicado en la eliminación de la FA y suponer un nuevo planteamiento en su tratamiento quirúrgico. Futuros estudios permitirán seleccionar qué pacientes pueden beneficiarse de este procedimiento y conocer sus resultados a largo plazo.
Correspondencia: Dr. Dr. F. Hornero Sos. Servicio de Cirugía Cardíaca. Hospital General Universitario de Valencia. Avda. Tres Cruces, s/n. 46014 Valencia. Correo electrónico: fernando.hornero@hguv.org Recibido el 16 de mayo del 2000. Aceptado para su publicación el 30 de noviembre del 2000.