Hasta un 25% de los pacientes sometidos a intervencionismo coronario percutáneo presentan alguna limitación para la utilización de los stents farmacoactivos. Nuestro objetivo es evaluar si el stent bioactivo de titanio y óxido nítrico podía ser una buena alternativa al stent de everolimus para pacientes diabéticos.
MétodosSe aleatorizó a 173 pacientes diabéticos con lesiones de riesgo de reestenosis intermedio (criterios de exclusión: diámetro<2,5 mm o longitud>28 mm en vasos<3 mm, oclusión crónica): 83 pacientes en el grupo con titanio y 90 en el grupo con everolimus.
ResultadosLas variables basales estaban bien equilibradas, el 28,3% eran insulinodependientes. Al año, las incidencias de eventos adversos cardiacos mayores (muerte, infarto de miocardio no fatal, ictus o nueva revascularización del vaso tratado) eran significativamente más frecuente en el grupo con titanio que en el grupo con everolimus (total, el 14,5 frente al 4,4%; p=0,02; subgrupo no insulinodependiente, el 9,7 frente al 3,2%; p=0,14; insulinodependiente, el 28,6 frente al 7,1%; p=0,04) y de muerte, infarto de miocardio no fatal, ictus o cualquier revascularización, del 16,9% en el grupo con titanio y el 7,8% en el grupo con everolimus (p=0,06). La revascularización de la lesión diana se produjo en el 8,4 frente al 3,3% (p=0,15), y la del vaso tratado, el 13,3 frente al 3,3% (p=0,01). El seguimiento angiográfico a 9 meses mostró una pérdida luminal tardía significativamente menor en el grupo con everolimus (en el segmento, 0,52±0,58 frente a –0,05±0,32 mm; en el stent, 0,76±0,54 frente a 0,13±0,31 mm; p<0,0001).
ConclusionesEl stent de everolimus fue superior al titanio en pacientes diabéticos incluso con lesiones de riesgo de eventos clínicos y angiográficos intermedio.
Palabras clave
En aproximadamente un 25% de los pacientes a los que se practica intervencionismo coronario percutáneo (ICP), el implante de stents farmacoactivos (SFA) puede no estar recomendado debido a situaciones como anticoagulación crónica, sangrado previo, intervenciones programadas, etc., que contraindicarían la doble antiagregación prolongada1,2. Esto se sigue recomendando en las guías a pesar de los últimos avances en los SFA que podrían limitar la doble antiagregación a 6 meses3.
Aunque se suele indicar en estos casos un stent convencional, esta decisión sería más compleja para los pacientes con diabetes mellitus (DM). Debido a su mayor riesgo de reestenosis, la DM es una indicación aceptada para el uso de un SFA4 basada en estudios que compararon SFA con stent convencional de antigua generación5–9. El stent bioactivo de titanio y óxido nítrico (SBT) presenta algunas características que podrían resultar beneficiosas, tales como ausencia de liberación de cromo, níquel y molibdeno, lo que se ha relacionado con una reducción de la hiperplasia intimal y menores depósitos de fibrina, agregación plaquetaria e inflamación10–13. En este sentido, algunos estudios con el SBT han descrito menores porcentajes de reestenosis y de oclusión que con los stents convencionales9,10 y menos oclusiones que con el stent de paclitaxel en pacientes con infarto agudo de miocardio12. El SBT también ha sido comparado recientemente con el SFA de everolimus en pacientes con síndrome coronario agudo. A los 12 meses, se obtuvieron resultados clínicos de no inferioridad y ausencia de diferencias significativas en la revascularización de la lesión diana (RLD) (el 6,5 frente al 4,9%; p=0,39)13. Sin embargo, no existen estudios aleatorizados con el SBT y SFA en una situación clínica que predisponga tanto a la reestenosis como la DM.
Tras participar en un estudio previo con el SBT en pacientes diabéticos con resultados favorables14, nos planteamos realizar un estudio aleatorizado para comparar el SBT con un SFA de última generación, el stent de everolimus (Xience V®, Abbott Laboratories; Santa Clara, Illinois, Estados Unidos), para ver si podría ser una alternativa equivalente, al menos en lesiones sin alto riesgo de reestenosis. Secundariamente comparamos de manera indirecta los resultados del SBT con los de los stents convencionales utilizados en estudios aleatorizados con los mismos criterios de inclusión que el nuestro.
MÉTODOSDiseño y selección de pacientesEl TITANIC XV es un estudio multicéntrico, aleatorizado, con 2 grupos de comparación: SBT (Titan-2®, Hexacath; París, Francia) y SFA de everolimus (SLE) (Xience-V®, Abbott Vascular, Santa Clara, Illinois, Estados Unidos) en pacientes diabéticos sometidos a ICP. Los criterios de inclusión fueron: pacientes diabéticos, edad>18 años y al menos una lesión de novo significativa (estenosis ≥ 50% de diámetro) en una arteria coronaria nativa. En cada paciente todas las lesiones tratadas debían serlo con el stent que correspondía en la aleatorización. Los criterios de exclusión fueron: embarazo, alergia a ácido acetilsalicílico clopidogrel, heparina o abciximab, sangrado activo o riesgo de sangrado importante, insuficiencia renal significativa (creatinina ≥ 2mg/dl), disfunción ventricular izquierda grave (fracción de eyección ≤ 35%), shock cardiogénico, síndrome coronario agudo con elevación del segmento ST en las primeras 48 h, ictus isquémico en los 6 meses previos, contraindicación para SFA (tratamiento anticoagulante crónico, cirugía programada en los 12 meses siguientes, etc.), incapacidad para dar el consentimiento informado y esperanza de vida<12 meses. Los criterios de exclusión angiográficos fueron: enfermedad de tronco coronario, lesiones reestenóticas, lesiones que precisaran stent con un diámetro<2,5 mm o>3,5 mm o una longitud del stent>28 mm en vasos<3 mm, y oclusiones crónicas. Se aleatorizó a los pacientes elegibles a recibir SBT o SLE en una relación 1:1. La aleatorización a cada grupo era centralizada y la realizaba una persona independiente y según una tabla a la que se accedía cada vez que se recibía una solicitud. Este estudio no fue patrocinado por la industria. El protocolo del estudio fue revisado y aprobado por los comités éticos de todos los centros participantes y todos los pacientes firmaron el correspondiente consentimiento informado; el estudio se desarrolló según las normas éticas de la declaración de Helsinki y está registrado en ClinicalTrials.gov (NCT01510509).
Tratamiento farmacológico adjuntoLos pacientes que ya tomaban ácido acetilsalicílico o clopidogrel no recibieron carga adicional. A los que no lo tomaban, se les dio una dosis de ácido acetilsalicílico de 300 mg oral o 250-500 mg intravenosa durante el ICP, y 100mg/día después. La dosis de carga de clopidogrel fue de 600 mg y posteriormente 75mg/día. A los pacientes que recibían SLE, se les recomendó clopidogrel al menos 6 meses y a los del grupo SBT, al menos 1 mes, pudiendo extenderse según criterio de su cardiólogo. Durante el procedimiento, se administró heparina sódica no fraccionada (100 mg/kg; 70 mg/kg si se administraba abciximab). El uso de abciximab se dejó a criterio del investigador, pero en el protocolo se recomendaba para los pacientes con síndrome coronario agudo.
Seguimiento clínicoSe siguió de manera prospectiva a los pacientes tras el alta y 1, 6, 12 y 24 meses tras el procedimiento. Todos los datos se recogieron en una base de datos electrónica común que se revisó al final del periodo de seguimiento de cada paciente. Un comité de acontecimientos clínicos asignó todos los acontecimientos clínicos a ciegas e independientemente.
Seguimiento angiográficoEl seguimiento angiográfico se realizó a los 9 meses solo a los pacientes reclutados en el centro coordinador. Analizaron la angiografía basal, tras el ICP y a los 9 meses de seguimiento, con enmascaramiento respecto al tratamiento asignado y mediante angiografía cuantitativa (Xcelera®, Philips Healthcare; Best, Países Bajos) 2 personas experimentadas e independientes. Las medidas de angiografía cuantitativa de la lesión diana se obtenían tanto en la zona en el stent como en la zona en el segmento (incluidos los márgenes 5 mm proximal y distal al stent).
Definiciones y variables del estudioEl éxito del procedimiento se definió como implante exitoso del stent en la lesión diana con estenosis residual<20% y flujo TIMI 3, sin disección ni trombosis. La variable clínica principal fue el evento adverso cardiaco mayor (MACE) definido como muerte, infarto agudo de miocardio no fatal, ictus o nueva revascularización del vaso tratado (RVT; MACE-1) a los 12 meses de seguimiento. Las variables secundarias incluían muerte, RLD, RVT, nueva revascularización aparte de la RLD, evento combinado de muerte, infarto agudo de miocardio no fatal, ictus, nueva revascularización de cualquier territorio (MACE-2), trombosis del stent y reestenosis clínica. La muerte cardiaca se definió como muerte de causa cardiovascular o muerte sin otra causa conocida. El infarto de miocardio se diagnosticaba por dolor torácico típico persistente con elevación de los marcadores bioquímicos de necrosis miocárdica (isoenzima MB de la creatincinasa y troponina) al menos 2 veces el límite superior de los valores de referencia del laboratorio y/o los criterios electrocárdiográficos de aparición de ondas Q patológicas o desviaciones del segmento ST en al menos 2 derivaciones contiguas. La RLD se definió como nueva intervención (quirúrgica o percutánea) para tratar una estenosis luminal>50% dentro del stent o de los 5 mm adyacentes del segmento proximales y distales tras documentarse isquemia. La RVT se definió como la debida a isquemia secundaria a afección del vaso tratado. La revascularización total incluía la debida a reestenosis o a progresión por arteriosclerosis. En el subgrupo de pacientes con seguimiento angiográfico, la pérdida luminal tardía (PLT) se definió como la diferencia entre el diámetro luminal mínimo (DLM) al finalizar el procedimiento de implante de stent y el medido en el seguimiento. La variable primaria principal en este subanálisis de ese grupo era la PLT en el segmento a los 9 meses. La reestenosis binaria se definió como una estenosis ≥ 50% del diámetro en la lesión diana. La trombosis del stent se definió según los criterios del Academic Research Consortium.
Análisis estadísticoEl tamaño muestral de nuestro estudio tendría suficiente potencia estadística (riesgo beta, 20%) para detectar una reducción de riesgo absoluto del 15% en el acontecimiento principal (asumiendo una incidencia de MACE en el grupo con SLE del 8%), presumida la superioridad. El cálculo del tamaño muestral requerido para el análisis de la variable primaria en el subgrupo angiográfico (PLT a los 9 meses) se realizó según hipótesis de no inferioridad, considerando una diferencia en la PLT>0,4 mm para ser clínicamente relevante. Este umbral de no inferioridad se determinó a partir de estudios previos que demostraron que la PLT no tendría impacto clínico siendo<0,5-0,6 mm15, con una PLT esperada del SLE de aproximadamente 0,15 mm. Dado que la desviación estándar de la PLT es aproximadamente 0,6 mm según estudios previos, se exigía al menos 50 lesiones en cada grupo de tratamiento (n=100) para un riesgo alfa del 2,5% (intervalo de confianza del 95% [IC95%]) y un poder del 85%.
El análisis de las variables se realizó según el principio de intención de tratar incluyendo a todos los pacientes sometidos al procedimiento índice. Las variables continuas se presentan como media±desviación estándar, y las categóricas se describen como frecuencias absolutas y relativas. Las comparaciones entre ambos grupos se realizaron usando la prueba de la t de Student para variables continuas y la de la χ2 de Pearson o la exacta de Fisher para las variables categóricas. Las curvas de supervivencia se obtuvieron utilizando el método de Kaplan-Meier, y se compararon con el log rank test. Para identificar los predictores independientes de MACE, se utilizó regresión logística binaria y regresión de Cox, y de estos modelos se obtuvieron las odds ratio (OR) y razón de tasas (RT) con sus IC95%. Para el análisis multivariable, se seleccionó para evaluarlas en el modelo como covariables todas las variables independientes que se asociaron con la respuesta estudiada (variable dependiente) con p<0,2. Todos los tests fueron de 2 colas y se consideró estadísticamente significativo el valor de p<0,05. Todos los datos se analizaron con el programa SPSS versión 16.
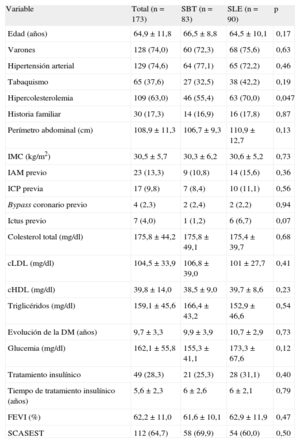
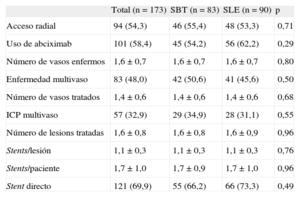
RESULTADOSEntre enero de 2009 y octubre de 2011, se incluyó a un total de 173 pacientes en 8 centros (7 centros de España y 1 centro de Finlandia). En la tabla 1 se muestran las principales características basales del grupo con SBT (83 pacientes, 124 lesiones) y el grupo con SLE (90 pacientes, 134 lesiones). La media de edad era 64,9±11,8 años; el 74% eran varones y el 28,3% eran insulinodependientes. Ambos grupos estaban bien equilibrados (excepto en cuanto a la variable dislipemia), incluso en fracción de eyección del ventrículo izquierdo y número de vasos enfermos. Había un alto porcentaje de pacientes con síndrome coronario agudo sin elevación del ST (64,7%). En la tabla 2 se presentan las variables relacionadas con el procedimiento. Más de la mitad de los procedimientos se realizaron por vía radial, y el uso de abciximab fue del 54,2% en el grupo de SBT y el 62,22% en el de SLE. No había diferencias significativas en cuanto al número de lesiones tratadas (1,6±0,8) y el número de stents por lesión (1,1±0,3) o por paciente (1,7±1,0).
Características basales del grupo total y por grupo de aleatorización
| Variable | Total (n=173) | SBT (n=83) | SLE (n=90) | p |
| Edad (años) | 64,9±11,8 | 66,5±8,8 | 64,5±10,1 | 0,17 |
| Varones | 128 (74,0) | 60 (72,3) | 68 (75,6) | 0,63 |
| Hipertensión arterial | 129 (74,6) | 64 (77,1) | 65 (72,2) | 0,46 |
| Tabaquismo | 65 (37,6) | 27 (32,5) | 38 (42,2) | 0,19 |
| Hipercolesterolemia | 109 (63,0) | 46 (55,4) | 63 (70,0) | 0,047 |
| Historia familiar | 30 (17,3) | 14 (16,9) | 16 (17,8) | 0,87 |
| Perímetro abdominal (cm) | 108,9±11,3 | 106,7±9,3 | 110,9±12,7 | 0,13 |
| IMC (kg/m2) | 30,5±5,7 | 30,3±6,2 | 30,6±5,2 | 0,73 |
| IAM previo | 23 (13,3) | 9 (10,8) | 14 (15,6) | 0,36 |
| ICP previa | 17 (9,8) | 7 (8,4) | 10 (11,1) | 0,56 |
| Bypass coronario previo | 4 (2,3) | 2 (2,4) | 2 (2,2) | 0,94 |
| Ictus previo | 7 (4,0) | 1 (1,2) | 6 (6,7) | 0,07 |
| Colesterol total (mg/dl) | 175,8±44,2 | 175,8±49,1 | 175,4±39,7 | 0,68 |
| cLDL (mg/dl) | 104,5±33,9 | 106,8±39,0 | 101±27,7 | 0,41 |
| cHDL (mg/dl) | 39,8±14,0 | 38,5±9,0 | 39,7±8,6 | 0,23 |
| Triglicéridos (mg/dl) | 159,1±45,6 | 166,4±43,2 | 152,9±46,6 | 0,54 |
| Evolución de la DM (años) | 9,7±3,3 | 9,9±3,9 | 10,7±2,9 | 0,73 |
| Glucemia (mg/dl) | 162,1±55,8 | 155,3±41,1 | 173,3±67,6 | 0,12 |
| Tratamiento insulínico | 49 (28,3) | 21 (25,3) | 28 (31,1) | 0,40 |
| Tiempo de tratamiento insulínico (años) | 5,6±2,3 | 6±2,6 | 6±2,1 | 0,79 |
| FEVI (%) | 62,2±11,0 | 61,6±10,1 | 62,9±11,9 | 0,47 |
| SCASEST | 112 (64,7) | 58 (69,9) | 54 (60,0) | 0,50 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo; IMC: índice de masa corporal; SBT: stent bioactivo de titanio; SCASEST: síndrome coronario agudo sin elevación del ST; SLE: stent liberador de everolimus.
Los datos expresan n (% del total) o media±desviación estándar.
Variables relacionadas con el procedimiento de implante del stent en ambos grupos de aleatorización
| Total (n=173) | SBT (n=83) | SLE (n=90) | p | |
| Acceso radial | 94 (54,3) | 46 (55,4) | 48 (53,3) | 0,71 |
| Uso de abciximab | 101 (58,4) | 45 (54,2) | 56 (62,2) | 0,29 |
| Número de vasos enfermos | 1,6±0,7 | 1,6±0,7 | 1,6±0,7 | 0,80 |
| Enfermedad multivaso | 83 (48,0) | 42 (50,6) | 41 (45,6) | 0,50 |
| Número de vasos tratados | 1,4±0,6 | 1,4±0,6 | 1,4±0,6 | 0,68 |
| ICP multivaso | 57 (32,9) | 29 (34,9) | 28 (31,1) | 0,55 |
| Número de lesions tratadas | 1,6±0,8 | 1,6±0,8 | 1,6±0,9 | 0,96 |
| Stents/lesión | 1,1±0,3 | 1,1±0,3 | 1,1±0,3 | 0,76 |
| Stents/paciente | 1,7±1,0 | 1,7±0,9 | 1,7±1,0 | 0,96 |
| Stent directo | 121 (69,9) | 55 (66,2) | 66 (73,3) | 0,49 |
ICP: intervencionismo coronario percutáneo; SBT: stent bioactivo de titanio; SLE: stent liberador de everolimus.
Los datos expresan n (% del total) o media±desviación estándar.
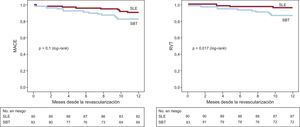
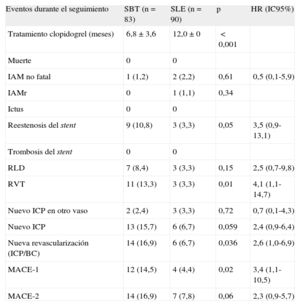
Los resultados clínicos del seguimiento a los 12 meses se presentan en la tabla 3. La incidencia de MACE-1 (muerte, infarto agudo de miocardio no fatal, ictus o nueva RVT) fue significativamente más frecuente en el grupo de SBT que en el de SLE (el 14,5 frente al 4,4%; p=0,02; OR=3,6; IC95%, 1,1-11,7); HR=3,4 (IC95%, 1,1-10,6). La incidencia de MACE-2 (muerte, infarto agudo de miocardio no fatal, ictus o cualquier revascularización) fue del 16,9 en el grupo de SBT y el 7,8% en el de SLE (SBT: OR=2,4; IC95%, 0,9-6,3; HR=2,3; IC95%, 0,92-5,7; p=0,06). Observamos que, aunque la RLD era mayor en el grupo de SBT (el 8,4 frente al 3,3%), la diferencia no alcanzaba significación. Sin embargo, sí había diferencia significativa en RVT (el 13,3 frente al 3,3%; p=0,01) y nueva revascularización (el 16,9 frente al 6,7%; p=0,036) (tabla 3). Las curvas de supervivencia de los distintos acontecimientos se muestran en la figura.
Eventos tras 1 año de seguimiento, dicotomizados por tipo de stent
| Eventos durante el seguimiento | SBT (n=83) | SLE (n=90) | p | HR (IC95%) |
| Tratamiento clopidogrel (meses) | 6,8±3,6 | 12,0±0 | <0,001 | |
| Muerte | 0 | 0 | ||
| IAM no fatal | 1 (1,2) | 2 (2,2) | 0,61 | 0,5 (0,1-5,9) |
| IAMr | 0 | 1 (1,1) | 0,34 | |
| Ictus | 0 | 0 | ||
| Reestenosis del stent | 9 (10,8) | 3 (3,3) | 0,05 | 3,5 (0,9-13,1) |
| Trombosis del stent | 0 | 0 | ||
| RLD | 7 (8,4) | 3 (3,3) | 0,15 | 2,5 (0,7-9,8) |
| RVT | 11 (13,3) | 3 (3,3) | 0,01 | 4,1 (1,1-14,7) |
| Nuevo ICP en otro vaso | 2 (2,4) | 3 (3,3) | 0,72 | 0,7 (0,1-4,3) |
| Nuevo ICP | 13 (15,7) | 6 (6,7) | 0,059 | 2,4 (0,9-6,4) |
| Nueva revascularización (ICP/BC) | 14 (16,9) | 6 (6,7) | 0,036 | 2,6 (1,0-6,9) |
| MACE-1 | 12 (14,5) | 4 (4,4) | 0,02 | 3,4 (1,1-10,5) |
| MACE-2 | 14 (16,9) | 7 (7,8) | 0,06 | 2,3 (0,9-5,7) |
BC: bypass coronario; IAM: infarto agudo de miocardio; IAMr: IAM relacionado con el vaso tratado; ICP: intervencionismo coronario percutáneo; MACE: eventos adversos cardiacos mayores; MACE-1: muerte, IAM no fatal, ictus o nueva revascularización del vaso tratado; MACE-2: muerte, IAM no fatal, ictus o cualquier revascularización; RLD: revascularización de lesión diana; RVT: revascularización de vaso tratado; SBT: stent bioactivo de titanio; SLE: stent liberador de everolimus.
Los datos expresan n (% del total) o media±desviación estándar.
Curvas de Kaplan-Meier que muestran la supervivencia libre de MACE (izquierda) y RVT (derecha) durante los 12 meses de seguimiento según el grupo de tratamiento. MACE: eventos adversos cardiacos mayores; RVT: revascularización del vaso tratado; SBT: stent bioactivo de titanio; SLE: stent liberador de everolimus.
Los resultados fueron menos eficaces para el subgrupo de pacientes insulinodependientes y las diferencias fueron mayores en este grupo cuando se comparaban el SBT y el SLE. La incidencia de MACE-1 fue mayor entre los pacientes diabéticos tratados con SBT (diabéticos no insulinodependientes, el 9,7 frente al 3,2%; p=0,14; diabéticos insulinodependientes, el 28,6 frente al 7,1%; p=0,04), como la de MACE-2 (diabéticos no insulinodependientes, el 12,9 frente al 9,7%; p=0,57; diabéticos insulinodependientes, el 28,6 frente al 7,1%; p=0,045). De hecho, la DM insulinodependiente resultó predecir de manera independiente una nueva ICP (OR=2,9; p=0,03) en el análisis multivariable, junto con el uso de SLE (OR=0,25; p=0,02) y la edad (OR=6,09; p=0,01). Los resultados para nueva ICP fueron el triple en los pacientes con DM insulinodependiente con el uso del SBT (el 33,3 frente al 10,3%; p=0,04).
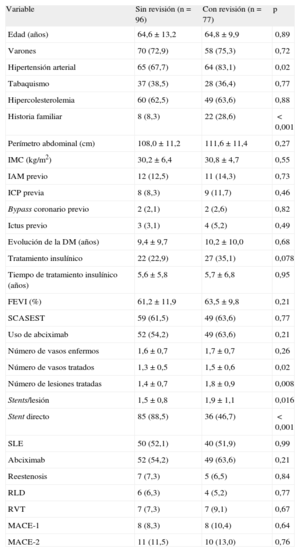
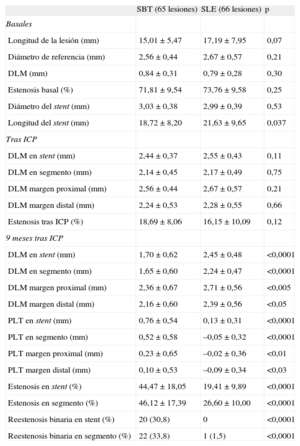
Seguimiento angiográficoSe realizó seguimiento angiográfico de 77 de los 80 pacientes (96,3%) incluidos en el centro coordinador (el 44,5% del grupo total). No había diferencias basales entre los pacientes a los que se realizó seguimiento angiográfico y los que no (tabla 4). Se analizaron un total de 131 lesiones (65 en el grupo de SBT y 66 en el de SLE). La tabla 5 resume los datos basales y las medidas tras el procedimiento y a los 9 meses de los pacientes con seguimiento angiográfico. No había diferencias significativas entre los grupos en longitud de la lesión, diámetro de referencia, DLM, estenosis basal y diámetro del stent y longitud. Del mismo modo, las medidas tras el procedimiento no mostraron diferencias en el DLM entre los grupos en el segmento del stent ni en los márgenes. El DLM en el segmento a los 9 meses de seguimiento era significativamente mayor en el grupo de SLE (1,65±0,60 frente a 2,24±0,47 mm; p<0,0001), y la PLT era significativamente menor en el grupo de SLE (PLT en el stent, 0,76±0,54 frente a 0,13±0,31mm; p<0,0001; PLT en el segmento, 0,52±0,58 frente a –0,05±0,32mm; p<0,0001). La diferencia observada en la media de PLT en el segmento, por lo tanto, fue 0,57±0,08 (IC95% de la diferencia, 0,41-0,73) mm. Dado que ambos límites del IC95% de la diferencia en las medias de PLT en el segmento son mayores que el umbral establecido de no inferioridad (0,4 mm) en esta diferencia, rechazamos la hipótesis de no inferioridad.
Comparación de características basales y eventos entre los subgrupos de pacientes con y sin revisión angiográfica
| Variable | Sin revisión (n=96) | Con revisión (n=77) | p |
| Edad (años) | 64,6±13,2 | 64,8±9,9 | 0,89 |
| Varones | 70 (72,9) | 58 (75,3) | 0,72 |
| Hipertensión arterial | 65 (67,7) | 64 (83,1) | 0,02 |
| Tabaquismo | 37 (38,5) | 28 (36,4) | 0,77 |
| Hipercolesterolemia | 60 (62,5) | 49 (63,6) | 0,88 |
| Historia familiar | 8 (8,3) | 22 (28,6) | <0,001 |
| Perímetro abdominal (cm) | 108,0±11,2 | 111,6±11,4 | 0,27 |
| IMC (kg/m2) | 30,2±6,4 | 30,8±4,7 | 0,55 |
| IAM previo | 12 (12,5) | 11 (14,3) | 0,73 |
| ICP previa | 8 (8,3) | 9 (11,7) | 0,46 |
| Bypass coronario previo | 2 (2,1) | 2 (2,6) | 0,82 |
| Ictus previo | 3 (3,1) | 4 (5,2) | 0,49 |
| Evolución de la DM (años) | 9,4±9,7 | 10,2±10,0 | 0,68 |
| Tratamiento insulínico | 22 (22,9) | 27 (35,1) | 0,078 |
| Tiempo de tratamiento insulínico (años) | 5,6±5,8 | 5,7±6,8 | 0,95 |
| FEVI (%) | 61,2±11,9 | 63,5±9,8 | 0,21 |
| SCASEST | 59 (61,5) | 49 (63,6) | 0,77 |
| Uso de abciximab | 52 (54,2) | 49 (63,6) | 0,21 |
| Número de vasos enfermos | 1,6±0,7 | 1,7±0,7 | 0,26 |
| Número de vasos tratados | 1,3±0,5 | 1,5±0,6 | 0,02 |
| Número de lesiones tratadas | 1,4±0,7 | 1,8±0,9 | 0,008 |
| Stents/lesión | 1,5±0,8 | 1,9±1,1 | 0,016 |
| Stent directo | 85 (88,5) | 36 (46,7) | <0,001 |
| SLE | 50 (52,1) | 40 (51,9) | 0,99 |
| Abciximab | 52 (54,2) | 49 (63,6) | 0,21 |
| Reestenosis | 7 (7,3) | 5 (6,5) | 0,84 |
| RLD | 6 (6,3) | 4 (5,2) | 0,77 |
| RVT | 7 (7,3) | 7 (9,1) | 0,67 |
| MACE-1 | 8 (8,3) | 8 (10,4) | 0,64 |
| MACE-2 | 11 (11,5) | 10 (13,0) | 0,76 |
DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo; IMC: índice de masa corporal; MACE: eventos adversos cardiacos mayores; MACE-1: muerte, IAM no fatal, ictus o nueva revascularización del vaso tratado; MACE-2: muerte, IAM no fatal, ictus o cualquier revascularización; RLD: revascularización de lesión diana; RVT: revascularización de vaso tratado; SCASEST: síndrome coronario agudo sin elevación del ST; SLE: stent liberador de everolimus.
Los datos expresan n (% del total) o media±desviación estándar.
Datos de las lesiones y los stents: basales, tras el implante y a los 9 meses
| SBT (65 lesiones) | SLE (66 lesiones) | p | |
| Basales | |||
| Longitud de la lesión (mm) | 15,01±5,47 | 17,19±7,95 | 0,07 |
| Diámetro de referencia (mm) | 2,56±0,44 | 2,67±0,57 | 0,21 |
| DLM (mm) | 0,84±0,31 | 0,79±0,28 | 0,30 |
| Estenosis basal (%) | 71,81±9,54 | 73,76±9,58 | 0,25 |
| Diámetro del stent (mm) | 3,03±0,38 | 2,99±0,39 | 0,53 |
| Longitud del stent (mm) | 18,72±8,20 | 21,63±9,65 | 0,037 |
| Tras ICP | |||
| DLM en stent (mm) | 2,44±0,37 | 2,55±0,43 | 0,11 |
| DLM en segmento (mm) | 2,14±0,45 | 2,17±0,49 | 0,75 |
| DLM margen proximal (mm) | 2,56±0,44 | 2,67±0,57 | 0,21 |
| DLM margen distal (mm) | 2,24±0,53 | 2,28±0,55 | 0,66 |
| Estenosis tras ICP (%) | 18,69±8,06 | 16,15±10,09 | 0,12 |
| 9 meses tras ICP | |||
| DLM en stent (mm) | 1,70±0,62 | 2,45±0,48 | <0,0001 |
| DLM en segmento (mm) | 1,65±0,60 | 2,24±0,47 | <0,0001 |
| DLM margen proximal (mm) | 2,36±0,67 | 2,71±0,56 | <0,005 |
| DLM margen distal (mm) | 2,16±0,60 | 2,39±0,56 | <0,05 |
| PLT en stent (mm) | 0,76±0,54 | 0,13±0,31 | <0,0001 |
| PLT en segmento (mm) | 0,52±0,58 | –0,05±0,32 | <0,0001 |
| PLT margen proximal (mm) | 0,23±0,65 | –0,02±0,36 | <0,01 |
| PLT margen distal (mm) | 0,10±0,53 | –0,09±0,34 | <0,03 |
| Estenosis en stent (%) | 44,47±18,05 | 19,41±9,89 | <0,0001 |
| Estenosis en segmento (%) | 46,12±17,39 | 26,60±10,00 | <0,0001 |
| Reestenosis binaria en stent (%) | 20 (30,8) | 0 | <0,0001 |
| Reestenosis binaria en segmento (%) | 22 (33,8) | 1 (1,5) | <0,0001 |
DLM: diámetro luminal mínimo; ICP: intervencionismo coronario percutáneo; PLT: pérdida luminal tardía; SBT: stent bioactivo de titanio; SLE: stent liberador de everolimus.
Los datos expresan n (% del total) o media±desviación estándar.
Se observó un remodelado positivo en los bordes tanto proximal como distal del grupo de SLE. La reestenosis binaria del stent, tanto en el stent como en el segmento, fue significativamente mayor en el grupo SBT que en el de SLE (p<0,0001).
Finalmente, se analizó el posible efecto de realizar la angiografía de seguimiento solo en el centro coordinador (el 44% de todos los pacientes y el 50% de todas las lesiones). No hubo diferencia significativa en la reestenosis clínica ni en la RLD entre pacientes con y sin angiografía de seguimiento (el 6,55 frente al 6,3%) (tabla 4).
DISCUSIÓNImportancia del estudioEl principal hallazgo de nuestro estudio es que el SLE ofrece mejores resultados que el SBT en pacientes diabéticos, incluso cuando se seleccionan lesiones de riesgo de reestenosis intermedio. Así, para la variable principal del estudio, MACE-1, alcanzaba significación estadística (el 14,5 frente al 4,4%; p=0,02). Y la variable compuesta MACE-2 mostraba una incidencia en el grupo de SBT casi el doble que en el grupo de SLE (el 16,9 frente al 7,8%; p=0,06) y rozaba la significación estadística sin alcanzarla debido al escaso número de pacientes. No hubo ninguna trombosis del stent en ningún grupo (aunque hubo un infarto agudo de miocardio en vaso tratado en el grupo de SLE).
Más de un 25% de los pacientes a los que se realiza ICP actualmente tienen DM16; este porcentaje puede llegar a ser mayor a medio plazo porque la prevalencia de la DM está aumentando, y se estima que en los próximos años pueden llegar a ser un 10% de la población adulta de Estados Unidos17. Metanálisis recientes han mostrado que el uso de nuevos SFA ha reducido los porcentajes de reestenosis tanto en la población general como en la de diabéticos, sin comprometer la seguridad, y el SLE ha mostrado mejores resultados que los SFA de primera generación18,19.
El stent de titanio se presenta como un stent bioactivo con propiedades específicas, que podrían tener ciertas ventajas adicionales sobre las del stent convencional. De hecho, ha recibido considerable atención recientemente, ya que algunos estudios han mostrado que se comporta de manera superior que otros stents convencionales, mientras que otros lo han descrito como equivalente a los SFA en algunas poblaciones de pacientes. El estudio aleatorizado de Moschovitis et al. sobre lesiones de novo en población general mostraba un 9% de necesidad de revascularización a los 5 años en el grupo de pacientes con SBT, comparado con un 25% en el grupo control con stent convencional. Sin embargo, solo un 15% de los pacientes de ese estudio eran diabéticos10. Más recientemente, el estudio en pacientes con síndrome coronario agudo BASE ACS aleatorizó a 827 pacientes a recibir un SBT o un SLE. A los 12 meses, no había diferencias significativas en los MACE entre ambos grupos (SBT frente a SLE, el 9,6 frente al 9%; p=0,89). El porcentaje de pacientes diabéticos también era bajo (17%) en ese estudio13. Así, una comparación directa entre SBT y un SFA de última generación como el SLE en un estudio aleatorizado específicamente en pacientes diabéticos es de gran interés. En nuestro conocimiento, de hecho, este sería el primer estudio aleatorizado con una comparación directa en este sentido.
Nuestro estudio mostró que el SLE es superior al SBT en pacientes diabéticos, incluso cuando se seleccionan lesiones de riesgo de reestenosis intermedio. A pesar de realizar angiografía solo en el hospital coordinador, no hubo diferencias significativas en la reestenosis clínica ni en la RLD de los pacientes con y sin angiografía de seguimiento (el 6,55 frente al 6,3%), lo que refleja la disciplina de nuestro protocolo de tratar solo cuando hay isquemia, pero al mismo tiempo demuestra la correlación de reestenosis con isquemia, al menos en este estudio.
Es bien conocido que los pacientes insulinodependientes tienen DM de más larga duración y, por ello, aterosclerosis coronaria de mayor gravedad7. Como era de esperar, pues, los pacientes con DM insulinodependientes tenían 2-3 veces más necesidad de nuevo ICP y mayor probabilidad de MACE, tal y como se comentó en el análisis multivariable, en el apartado «Resultados», en el que resultó que la DM insulinodependiente es predictor independiente de nueva ICP (OR=2,9; p=0,03), aspecto que por otro lado coincide con otros estudios sobre el tema20. Los resultados para nueva ICP fueron el triple entre los pacientes con DM insulinodependientes con el uso de SBT (el 33,3 frente al 10,3%; p=0,04), a pesar de que nuestro estudio incluía un alto porcentaje de pacientes tratados con abciximab, particularmente diabéticos insulinodependientes (el 72 frente al 52,8%). Precisamente, estos pacientes insulinodependientes son los que resultaron más beneficiados con este tratamiento, según los resultados de nuestro grupo20. Así pues, la implantación de SFA en este subgrupo de pacientes con DM insulinodependiente debe ser la elección siempre que sea posible.
El efecto de remodelado positivo en el grupo de pacientes con SLE (PLT negativa en los bordes proximal y distal) podría explicar que hubiera más RVT en el grupo con SBT (el 13,3 frente al 3,3%; p=0,01). La PLT en el segmento con SLE fue –0,05 mm debido a un remodelado positivo de los márgenes proximal y distal. Este hallazgo es interesante y confirma los de estudios previos como el DIABETES21, en el que los bordes del stent de sirolimus mostraban aumento intraluminal, con un incremento del volumen del vaso, mientras que en el grupo del stent convencional había un efecto de remodelado negativo y de reducción de luz. Es decir, en el grupo de sirolimus, el efecto antirreestenótico se extendía a los bordes.
Este efecto de remodelado positivo en los bordes con el stent de sirolimus en pacientes diabéticos no ocurre, sin embargo, en los SFA de paclitaxel22. Nuestro estudio indica, pues, el mismo tipo de efecto positivo con el everolimus.
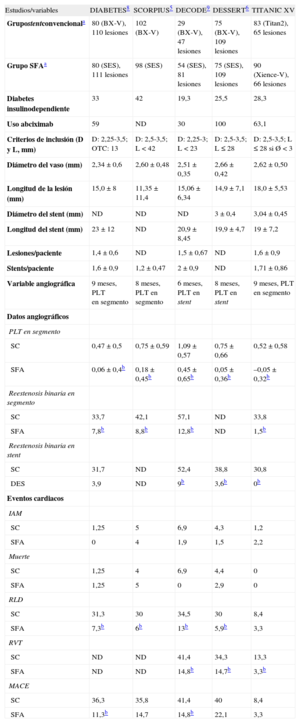
Comparaciones indirectas del stent de titanio con otros estudios de similar diseñoExisten algunas evidencias indirectas de que el SBT podría funcionar mejor que otros stents convencionales también en poblaciones de pacientes diabéticos. Entre 2005 y 2008, se publicaron 4 estudios aleatorizados específicos que compararon el SFA de sirolimus Cypher y el stent convencional Bx Velocity (ambos de Johnson & Johnson) en diabéticos5,6,8,9. Estos estudios tenían gran similitud entre sí y con nuestro estudio en el número de pacientes y los criterios de inclusión y exclusión (tabla 6). La PLT en el segmento del stent convencional en estos cuatro estudios oscilaba entre 0,47 y 1,02mm, con una media de 0,76, frente a 0,52mm en el grupo de SBT de nuestro estudio, lo que se compara favorablemente. Asimismo, la reestenosis clínica media del stent convencional de estos estudios era del 31,4 frente al 8,4% en nuestro estudio.
Comparación con otros estudios aleatorizados y específicos en pacientes diabéticos
| Estudios/variables | DIABETES8 | SCORPIUS5 | DECODE9 | DESSERT6 | TITANIC XV |
| Grupostentconvencionala | 80 (BX-V), 110 lesiones | 102 (BX-V) | 29 (BX-V), 47 lesiones | 75 (BX-V), 109 lesiones | 83 (Titan2), 65 lesiones |
| Grupo SFAa | 80 (SES), 111 lesiones | 98 (SES) | 54 (SES), 81 lesiones | 75 (SES), 109 lesiones | 90 (Xience-V), 66 lesiones |
| Diabetes insulinodependiente | 33 | 42 | 19,3 | 25,5 | 28,3 |
| Uso abciximab | 59 | ND | 30 | 100 | 63,1 |
| Criterios de inclusión (D y L, mm) | D: 2,25-3,5; OTC: 13 | D: 2,5-3,5; L<42 | D: 2,25-3; L<23 | D: 2,5-3,5; L ≤ 28 | D: 2,5-3,5; L ≤ 28 si Ø<3 |
| Diámetro del vaso (mm) | 2,34±0,6 | 2,60±0,48 | 2,51±0,35 | 2,66±0,42 | 2,62±0,50 |
| Longitud de la lesión (mm) | 15,0±8 | 11,35±11,4 | 15,06±6,34 | 14,9±7,1 | 18,0±5,53 |
| Diámetro del stent (mm) | ND | ND | ND | 3±0,4 | 3,04±0,45 |
| Longitud del stent (mm) | 23±12 | ND | 20,9±8,45 | 19,9±4,7 | 19±7,2 |
| Lesiones/paciente | 1,4±0,6 | ND | 1,5±0,67 | ND | 1,6±0,9 |
| Stents/paciente | 1,6±0,9 | 1,2±0,47 | 2±0,9 | ND | 1,71±0,86 |
| Variable angiográfica | 9 meses, PLT en segmento | 8 meses, PLT en segmento | 6 meses, PLT en stent | 8 meses, PLT en stent | 9 meses, PLT en segmento |
| Datos angiográficos | |||||
| PLT en segmento | |||||
| SC | 0,47±0,5 | 0,75±0,59 | 1,09±0,57 | 0,75±0,66 | 0,52±0,58 |
| SFA | 0,06±0,4b | 0,18±0,45b | 0,45±0,65b | 0,05±0,36b | –0,05±0,32b |
| Reestenosis binaria en segmento | |||||
| SC | 33,7 | 42,1 | 57,1 | ND | 33,8 |
| SFA | 7,8b | 8,8b | 12,8b | ND | 1,5b |
| Reestenosis binaria en stent | |||||
| SC | 31,7 | ND | 52,4 | 38,8 | 30,8 |
| DES | 3,9 | ND | 9b | 3,6b | 0b |
| Eventos cardiacos | |||||
| IAM | |||||
| SC | 1,25 | 5 | 6,9 | 4,3 | 1,2 |
| SFA | 0 | 4 | 1,9 | 1,5 | 2,2 |
| Muerte | |||||
| SC | 1,25 | 4 | 6,9 | 4,4 | 0 |
| SFA | 1,25 | 5 | 0 | 2,9 | 0 |
| RLD | |||||
| SC | 31,3 | 30 | 34,5 | 30 | 8,4 |
| SFA | 7,3b | 6b | 13b | 5,9b | 3,3 |
| RVT | |||||
| SC | ND | ND | 41,4 | 34,3 | 13,3 |
| SFA | ND | ND | 14,8b | 14,7b | 3,3b |
| MACE | |||||
| SC | 36,3 | 35,8 | 41,4 | 40 | 8,4 |
| SFA | 11,3b | 14,7 | 14,8b | 22,1 | 3,3 |
BX-V: stent convencional Bx Velocity; D: diámetro; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; IGP: inhibidores de la glucoproteína IIb/IIIa; MACE: eventos adversos cardiacos mayores; ND: no disponible; OTC: oclusión total crónica; PLT: pérdida luminal tardía; RLD: revascularización de la lesión diana; SBT: stent bioactivo de titanio; SC: stent convencional; SES: stent liberador de sirolimus; SFA: stent farmacoactivo.
Los datos expresan % o media±desviación estándar.
Si comparamos estudios con los mismos criterios de inclusión pero ya de SFA de primera generación (y por ello con mayor PLT que los SFA actuales), como fueron los stents de zotarolimus Endeavor® (Medtronic; Indianapolis, Indiana, Estados Unidos) frente al de paclitaxel Taxus® (Boston Scientific, Indianapolis, Indiana, Estados Unidos), en pacientes diabéticos23, los porcentajes de reestenosis fueron del 6,9 y el 5,8% respectivamente, con lo que el 8,4% del SBT no es una comparación muy desfavorable. Aunque estos datos son interesantes, se derivan de comparaciones indirectas y, por ello, hay que interpretarlos con esa limitación.
Limitaciones del estudioEl número de pacientes de nuestro estudio es relativamente pequeño, especialmente para eventos clínicos como trombosis de stent, etc., pero a pesar de ello refleja claramente los principales objetivos. Las lesiones eran de riesgo de reestenosis intermedio, con lo que seguramente las diferencias habrían sido mayores de haber incluido lesiones con mayor riesgo de reestenosis. Los resultados con el SBT en nuestro trabajo se comparan favorablemente con otros stents convencionales de otros estudios de similar diseño para pacientes con DM. Aunque estas comparaciones indirectas hay que tomarlas con la debida cautela, la PLT del SBT medida en nuestro estudio es muy similar a la medida en otro estudio de SBT en DM. Los resultados en el subanálisis del grupo insulinodependiente deben ser vistos como orientativos, ya que tienen las limitaciones de los análisis post-hoc.
Otra limitación es la posible diferencia en el tiempo de doble antiagregación, pero esto no afecta a la RLD y seguramente queda diluida en los pacientes con síndrome coronario agudo, en quienes los cardiólogos generales suelen mantenerla 6 meses. Además, no había diferencias en otras lesiones aparte de las del vaso tratado.
CONCLUSIONESEl SLE se mostró superior al SBT en pacientes diabéticos incluso con lesiones de riesgo intermedio, con menos PLT, menor RVT y menos MACE, diferencia particularmente marcada en pacientes con DM insulinodependiente. Los resultados favorables del SBT en las comparaciones con otros stents convencionales o con el SLE en síndrome coronario agudo no son extrapolables a la población diabética, para la que es recomendable siempre que sea posible el implante de SFA de nueva generación.
FINANCIACIÓNEste trabajo ha recibido una beca de la Asociación Sociedad Extremeña de Cardiología.
CONFLICTO DE INTERESESNinguno.
| Hospital Universitario Infanta Cristina. Badajoz | Reyes González-Fernandez, Ginés Martínez-Cáceres, José R. López-Mínguez, Juan M. Nogales-Asensio, Luis J. Doncel-Vecino, Antonio Merchán-Herrera |
| Hospital Universitario General. Valencia | Francisco Pomar-Domingo |
| Hospital Puerto Real. Cádiz | Pedro Martínez-Romero |
| Hospital Puerta de Hierro. Madrid | José A. Fernández-Díaz |
| Hospital Virgen de la Arrixaca. Murcia | Raúl Valdesuso-Aguilar |
| Hospital Virgen de la Salud. Toledo | José Moreu-Burgos |
| Hospital Juan Ramón Jiménez. Huelva | José Díaz-Fernández |
| Heart Center, Satakunta. Pori, Finlandia | Pasi Karjalainen |