Palabras clave
INTRODUCCIÓN
La disfunción renal está aceptada como un predictor independiente de mal pronóstico en los pacientes con insuficiencia cardiaca. Este hecho adquiere gran relevancia, pues la disfunción renal es un hallazgo frecuente en los pacientes con insuficiencia cardiaca. En los grandes registros de pacientes internados por insuficiencia cardiaca aguda descompensada (ICAD), tiene disfunción renal de grado moderado o severo alrededor de un 30% de los pacientes y este valor puede superar el 50% si se considera también la disfunción renal leve1-5.
Los pacientes internados por ICAD, pueden presentar empeoramiento de la función renal (EFR). El EFR puede causar hospitalizaciones más prolongadas y en algunos estudios se ha asociado con aumento de la mortalidad y de los reingresos en el seguimiento6,7.
El objetivo de este estudio fue determinar, en una serie actual de pacientes, la incidencia, los predictores y el pronóstico a 1 año de los pacientes ingresados por ICAD que presentan EFR durante su hospitalización.
MÉTODOS
En este estudio observacional de cohortes, retrospectivo, se incluyó a 200 pacientes consecutivos que ingresaron con diagnóstico de ICAD en la Unidad Coronaria del Hospital Italiano de Buenos Aires, desde el 1 de enero de 2006 al 31 de marzo de 2007. Los criterios de ingreso en la Unidad Coronaria fueron: a) hipotensión arterial; b) requerimiento de medicación intravenosa en infusión continua (inotrópicos, diuréticos, vasodilatadores), o c) requerimiento de oxígeno suplementario. Se clasificó a los pacientes según las categorías que estipulan las guías para el diagnóstico y el tratamiento de la Sociedad Europea de Cardiología (tipo I: descompensada, de novo o por descompensación de una insuficiencia crónica; tipo II: hipertensiva; tipo III: edema agudo de pulmón; tipo IV: shock cardiogénico; tipo V: alto volumen minuto, y tipo VI: insuficiencia derecha predominante)8,9. La capacidad funcional habitual previa al ingreso se categorizó según la clasificación de la New York Heart Association (NYHA). Se excluyó a los pacientes que presentaban un síndrome isquémico agudo, valvulopatías primarias severas, tromboembolia pulmonar, taponamiento cardiaco, insuficiencia cardiaca tras cirugía cardiaca o con trasplante de órganos en tratamiento inmunosupresor. Se excluyó a los pacientes con fallo multiorgánico o sepsis y a quienes se practicaron estudios con material de contraste durante la hospitalización. Se decidió excluir a los pacientes en tratamiento dialítico crónico o que lo requirieran durante las primeras 24 h del ingreso, por tratarse de un grupo particular con un grado mayor de enfermedad renal.
A todos los pacientes se les realizaron los análisis de laboratorio habituales, que incluían la determinación de uremia y creatinina sérica diarias. La tasa de filtrado glomerular (TFG) se estimó según la ecuación simplificada MDRD (Modification of Diet in Renal Disease), aceptada como una estimación validada del filtrado glomerular en los pacientes con insuficiencia cardiaca10,11.
La función renal basal, al ingreso, se consideró12 normal cuando la TFG era > 90 ml/min/1,73 m2, disminuida en forma leve entre 60 y 90 ml/ min/1,73 m2, moderada entre 60 y 30 ml/min/1,73 m2 y severa cuando la TFG era < 30 ml/min/1,73 m2.
El EFR se definió por un doble requisito: que la creatinina sérica aumentara su valor absoluto al menos 0,3 mg/dl y que además aumentara al menos un 25% con respecto al valor basal13. La función ventricular izquierda, evaluada por ecocardiografía, se consideró conservada cuando la fracción de eyección era ≥ 50%.
Los objetivos del estudio fueron determinar: a) la frecuencia y los predictores de EFR durante la hospitalización; b) la frecuencia y los predictores de mortalidad o reingreso por insuficiencia cardiaca a 1 año de seguimiento en los grupos con o sin EFR, y c) los días de hospitalización según tuvieran EFR o no.
Análisis estadístico
Asumiendo una relación de 2:1 de los pacientes sin EFR con respecto a los con EFR y con una frecuencia estimada de eventos (muerte o reingreso por insuficiencia cardiaca) a 1 año del 40% en los pacientes con EFR, se calculó que el tamaño muestral debería ser de 200 pacientes para detectar, con una confianza del 95% y una potencia del 80%, una reducción del riesgo de un 50% en el grupo sin EFR con respecto al grupo con EFR.
Las variables continuas se expresan con su media aritmética y su desviación estándar o con la mediana y su intervalo intercuartílico, según la distribución fuera gaussiana o no, y las discretas, por su porcentaje. Los datos continuos con distribución gaussiana se compararon con el test de la t de Student y aquellos sin distribución gaussiana, con el test rank-sum de Wilcoxon; los datos discretos se compararon con la prueba de la χ2 o el test de Fisher. Todas las variables que en el análisis univariable presentaron una p < 0,1 fueron incluidas en los modelos multivariables. Para identificar las variables independientes predictoras de EFR, se empleó un modelo multivariable de regresión logística y para la predicción de muerte o reingreso por insuficiencia cardiaca se aplicó un análisis multivariable de riesgos proporcionales de Cox. Debido a la participación de la creatinina en el cálculo de la TFG, en el análisis multivariable, tanto para predecir el EFR como la muerte o reingreso, se probaron dos modelos, uno que incluye sólo la creatinina y otro que incluye sólo la TFG, y se seleccionó el modelo que mostrara mejor asociación con el punto final analizado.
La frecuencia de mortalidad o reingreso por insuficiencia cardiaca al año se analizó con las curvas de Kaplan-Meier, y las diferencias entre los grupos con y sin EFR se compararon con el log-rank test.
Se aceptó como estadísticamente significativa una diferencia con valor de p < 0,05. Todos los análisis fueron realizados con el programa estadístico Stata 7.0 (Stata Statistical Software, versión 7.0, Stata Corporation).
RESULTADOS
Características de la población total
El promedio de edad de los 200 pacientes incluidos era 78 ± 14 años y el 43% eran mujeres. La creatinina sérica promedio al ingreso fue 1,57 ± 0,6 mg/dl y la TFG, 59,5 ± 17 ml/min/1,73 m2.
Presentaron TFG normal al ingreso el 18% de los pacientes; deterioro leve, el 27% y deterioro moderado o severo, el 55%. Otras características se exponen en la tabla 1. La presentación clínica de la insuficiencia cardiaca según la Sociedad Europea de Cardiología y la capacidad funcional habitual previa a la hospitalización se describen en la tabla 2.
Según los criterios preestablecidos, sufrieron un EFR durante la hospitalización 46 pacientes (23%).
Características de los pacientes con empeoramiento de la función renal
Sometidos al análisis univariable, los pacientes que sufrieron un EFR eran de edad más avanzada, en promedio 10 años más que aquellos sin EFR, con mayor porcentaje de mayores de 80 años y más frecuente etiología isquémica. La función renal al ingreso medida por el valor de creatinina sérica y la TFG fue significativamente peor en el grupo con EFR y la presión arterial sistólica al ingreso también fue menor en estos pacientes. No se observaron diferencias en otras variables analizadas (tabla 1). La presentación clínica según la Sociedad Europea de Cardiología fue similar en los grupos con y sin EFR, salvo para el tipo IV (shock cardiogénico) que en todos los casos se asoció con EFR. Con respecto a la capacidad funcional de la NYHA previa a la hospitalización, no hubo diferencias entre los dos grupos (tabla 2).
Antes de su hospitalización, el grupo que luego sufrió EFR utilizaban significativamente menos inhibidores de la enzima de conversión de angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA-II) y antialdosterónicos, sin que se observara diferencia en el resto de la medicación (tabla 3).
Durante la hospitalización, todos los pacientes recibieron furosemida intravenosa, pero la dosis total fue significativamente mayor en los que desarrollaron EFR. Se usaron inotrópicos intravenosos en el 23% de los pacientes, con una tendencia no significativa a mayor uso en el grupo con EFR; se mantuvo la menor utilización de IECA o ARA-II y antialdosterónicos (tabla 4).
Se incorporaron en el análisis multivariable las variables con valor de p < 0,1 en el univariable y aquellas con reconocida importancia biológica (edad, sexo).
Las variables consideradas para incluirlas en el análisis multivariable fueron: edad mayor de 80 años, sexo, etiología isquémica, diabetes mellitus, enfermedad pulmonar obstructiva crónica, fibrilación auricular, fracción de eyección ventricular izquierda < 50%, creatinina sérica, TFG, presión arterial sistólica < 90 mmHg al ingreso, capacidad funcional de la NYHA > II, uso de IECA o ARA-II, antialdosterónicos, dosis de furosemida intravenosa y uso de inotrópicos intravenosos.
Los predictores independientes de EFR fueron: la edad mayor de 80 años, la insuficiencia renal al ingreso definida por una TFG < 60 ml/min/1,73 m2 y la presión arterial sistólica al ingreso < 90 mmHg (tabla 5).
Pronóstico
El promedio de seguimiento fue de 416 ± 143 días y se dispuso de la información del seguimiento en el 96% de los casos.
El punto final combinado de muerte o reingreso por insuficiencia cardiaca acumulativo a 1 año se observó en 66 pacientes (33%), 22 (47,8%) en el grupo con EFR y 44 (28,2%) en el grupo sin EFR. Fallecieron 37 pacientes (18,5%), 12 (26%) en el grupo con EFR y 25 (16%) en el grupo sin EFR. Excluidos los 20 pacientes (10%) fallecidos durante la hospitalización inicial, 7 (5,2%) del grupo con EFR y 13 (8,3%) sin EFR, y 8 pacientes perdidos en el seguimiento, se rehospitalizaron 29 pacientes (16,9%), 10 (29,4%) que habían presentado EFR y 19 sin EFR (13,7%).
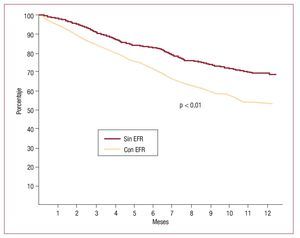
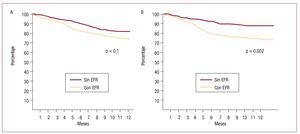
La supervivencia libre de internaciones por insuficiencia cardiaca analizada con las curvas de Kaplan-Meier y evaluada con el log-rank test fue significativamente inferior (p < 0,01) en el grupo que sufrió EFR (fig. 1). No hubo diferencias significativas en la supervivencia analizada en forma aislada (hazard ratio [HR] = 1,61; intervalo de confianza [IC] del 95%, 0,75-2,23; p = 0,1), pero sí en las rehospitalizaciones, que fueron más frecuentes en el grupo con EFR (HR = 2,38; IC del 95%, 1,68-2,95; p = 0,002) (fig. 2).
Fig. 1. Curva de Kaplan-Meier de supervivencia libre de rehospitalizaciones por insuficiencia cardiaca analizada por log-rank test. EFR: empeoramiento de la función renal.
Fig. 2. Curvas de Kaplan-Meier analizadas por log-rank test. A: análisis de supervivencia. B: pacientes libres de rehospitalizaciones por insuficiencia cardiaca. EFR: empeoramiento de la función renal.
La mediana [intervalo intercuartílico] de hospitalización fue de 9 [6-16] días para los pacientes con EFR y 4 [2-8] días para los pacientes sin EFR (p < 0,05).
En el análisis multivariable para mortalidad o reingreso, se consideraron las mismas variables analizadas para el EFR y se agregó como otra variable el EFR. Las variables con un valor de p < 0,1 y aquellas con reconocida importancia biológica se incluyeron en el modelo multivariable. El EFR se mantuvo asociado en forma independiente con el punto final combinado (HR ajustada = 1,65; IC del 95%, 1,12-2,67). Otras variables asociadas en forma independiente fueron la edad mayor de 80 años, la TFG < 60 ml/min/1,73 m2, y la capacidad funcional previa > II (todas, p < 0,05) (tabla 6).
DISCUSIÓN
Es incuestionable la importancia social y económica de la insuficiencia cardiaca. Se trata de una afección muy prevalente y con alto impacto económico en el sistema de salud14.
La insuficiencia renal es una comorbilidad que se asocia frecuentemente con la insuficiencia cardiaca y está demostrada su asociación negativa con el pronóstico2-5,15-17. En los pacientes internados por ICAD puede producirse EFR por varios mecanismos: la situación hemodinámica, la activación de mecanismos neurohumorales, la acción de citocinas inflamatorias y la utilización de fármacos que alivian los síntomas pero pueden empeorar la función renal18,19.
La hipotensión arterial y el bajo volumen minuto, con la consiguiente disminución del flujo renal, intervienen como mecanismos fundamentales para alterar la función renal; la congestión renal observada en la insuficiencia derecha también produce alteraciones de la hemodinamia intrarrenal20. Los mecanismos compensadores pueden empeorar la función renal, y la estimulación del sistema renina-angiotensina-aldosterona y del sistema nervioso simpático puede disminuir aún más el flujo renal. La retención de sodio exacerbada por los mecanismos compensadores mencionados y la retención hídrica por el aumento de secreción de vasopresina pueden agravar la congestión renal18,21,22. La concentración de citocinas, más elevada en la insuficiencia cardiaca grave, puede producir hipotensión arterial y empeorar la perfusión renal23. En esta serie de pacientes consecutivos internados por ICAD, que por edad, distribución por sexos, función ventricular y comorbilidades es una muestra representativa de los pacientes ingresados en las unidades de cuidados intensivos cardiológicos de hospitales generales, un 78% presentaba al ingreso algún grado de insuficiencia renal y en el 55% fue al menos moderado (TFG < 60 ml/min/1,73 m2). En esta frágil situación es fácil comprender que los mismos mecanismos desencadenantes de la ICAD, como una taquiarritmia, anemia o infección, pueden empeorar la función renal y que los fármacos utilizados, como los diuréticos y los vasoactivos, puedan llevar al EFR. Se observó EFR en el 23% de los casos. La frecuencia del EFR coincide con la observada en otros estudios7,13,24-26.
La definición de EFR no es homogénea, algunos trabajos usaron el aumento absoluto de la cratinina en 0,3 mg/dl6,27; otros, 0,5 mg/dl24 o un aumento del 25% con respecto al valor basal o que excediera 2 mg/dl25, y en un estudio se exigió un aumento del 25% de la urea plasmática o una caída del 25% de la TFG26. En nuestro estudio, al igual que en otro de reciente publicación, se requirió que la creatinina sérica aumentara al menos 0,3 mg/dl y además un 25% del valor basal, lo que permite corregir las diferencias en la caída de la TFG que se produce de acuerdo con el valor basal de la creatinina13.
Predictores de empeoramiento de la función renal
En la bibliografía se mencionan diferentes predictores. La disfunción renal previa o en el momento del ingreso se señala en la mayoría de los estudios6,7,13,24,25. Otros predictores son la fibrilación auricular y el edema agudo de pulmón6, la edad avanzada7, la capacidad funcional previa y la fracción de eyección13, la diabetes mellitus, la hiponatremia, la insuficiencia diastólica24, la necesidad de altas dosis de diuréticos13,25,27 y el uso de antagonistas de los canales del calcio27. En un estudio retrospectivo con más de 1.000 pacientes, el antecedente de insuficiencia cardiaca, diabetes mellitus, creatinina > 1,5 mg/dl o presión arterial sistólica > 160 mmHg al ingreso permitió construir una puntuación para estratificar el riesgo de EFR: a mayor puntuación, mayor la probabilidad de EFR28.
En nuestro análisis, por la relación entre la creatinina y el cálculo de la TFG, estas dos variables se incorporaron de forma aislada a distintos modelos multivariables, y la TFG presentó mayor asociación con EFR que el valor de creatinina. Los pacientes que tenían al ingreso disfunción moderada o severa de la función renal (TFG < 60 ml/ min/1,73 m2) duplicaron el riesgo de EFR respecto a aquellos con una mejor TFG. Aunque la mayoría de los estudios coinciden con esta información, en un análisis del estudio ESCAPE (Evaluation Study of Congestive Heart Failure and Pulmonary Artery Catheterization Effectiveness) el EFR no mostró asociación con la creatinina ni con la TFG al ingreso, y al dicotomizar a la población por la TFG, los pacientes con TFG < 60 ml/min/1,73 m2 tuvieron sólo una tendencia no significativa a mayor EFR. La diferencia con nuestro estudio puede deberse a que excluyeron a los pacientes con creatinina > 3,5 mg/dl y que la TFG promedio fue muy superior a la de nuestra población29.
La edad se constituyó en otro de los predictores independientes del EFR. Los pacientes que sufrieron EFR eran significativamente más viejos y el riesgo de EFR aumentaba a medida que aumentaba la edad. La tercera variable asociada en forma independiente con EFR fue la hipotensión arterial. Esta asociación es explicable por los fenómenos hemodinámicos y los mecanismos compensadores que se desencadenan en la insuficiencia cardiaca.
Un tema en discusión es si el mayor uso de fármacos ocasiona el EFR o estos pacientes están más graves y tienen más probabilidad de EFR. Algunos estudios mostraron que el EFR se asoció con mayor uso de diuréticos13. En nuestra serie, aunque el grupo con EFR recibió más diuréticos de asa, al aplicar el análisis multivariable se perdió esta asociación. El grupo con EFR, antes de su ingreso y durante la hospitalización, recibió con menos frecuencia IECA o ARA-II y antialdosterónicos, probablemente por el mayor deterioro de la función renal basal y porque el EFR limitó su uso. Nuestros datos apoyan la hipótesis de que se trataba de una población en mayor riesgo y más anciana, la etiología isquémica fue más frecuente, el cuadro de shock se observó exclusivamente en este grupo, que recibió más diuréticos, y hubo tendencia a mayor uso de inotrópicos en la hospitalización.
Valor pronóstico del empeoramiento de la función renal
Los pacientes con EFR permanecieron más tiempo hospitalizados. Este resultado coincide con la información publicada hasta la fecha6,7,13,24,25,27. Aunque no hemos analizado los mayores costes de la prolongación de la hospitalización, resulta obvia la respuesta y se ha comunicado que, corregido por potenciales confusores, el EFR se asocia con una mayor estancia hospitalaria y mayores costes económicos30.
Basados en el número de ingresos en nuestro centro y los cálculos de tamaño muestral, hemos elegido utilizar un objetivo combinado de muerte o reingreso por insuficiencia cardiaca a los 12 meses de seguimiento. Más allá de la limitación dada por el número de pacientes y reconociendo que la variable mortalidad es la más importante, se considera que combinarla con un evento no fatal como las hospitalizaciones por insuficiencia cardiaca tiene importancia clínica y económica y se asocia con un mayor riesgo futuro de muerte31.
El EFR, aún ajustado por otras variables clínicas, mantuvo el valor independiente para predecir muerte o reingreso por insuficiencia cardiaca, esto fue debido a la mayor frecuencia de reingresos. La mortalidad fue menor, sin alcanzar significación estadística en el grupo con EFR, pero el estudio carecía de potencia estadística suficiente para detectar cambios en la mortalidad.
Varios estudios han mostrado un aumento de la mortalidad en la etapa hospitalaria7,24,27 o hasta 60 días del alta26; sin embargo, varios de ellos no realizaron análisis multivariable para identificar el valor independiente del EFR7,24,26. Pocos estudios continuaron el seguimiento más allá de la etapa hospitalaria e incluyeron un análisis multivaria ble13,25.
No todas las publicaciones concuerdan con este resultado; en un estudio multicéntrico europeo, los pacientes que tuvieron EFR, aunque tuvieron un tiempo de hospitalización más prolongado, no presentaron mayor mortalidad o mayor frecuencia de reingresos6. El EFR se definió por un aumento de la creatinina sérica > 0,3 mg/dl, pero debe mencionarse que en el estudio de Metra et al13, cuando utilizaron como definición sólo el aumento de la creatinina sérica > 0,3 mg/dl, el EFR perdió valor independiente para predecir muerte o reingresos por insuficiencia cardiaca. En el estudio ESCAPE29, la función renal basal, como en nuestra serie, se asoció con peor pronóstico a largo plazo (muerte o reinternación a 6 meses), pero el EFR no predijo los eventos a largo plazo. Esto puede explicarse por tratarse de una población diferente, con edad promedio de 56 años (en nuestra serie, 78 años) y la TFG promedio, 71,4 ml/min/1,73 m2 (en nuestra serie, 59,5).
Un dato interesante, aunque sin valor estadístico, que merecería estudiarse en una serie más numerosa es que los pacientes que sufrieron EFR, si ya tenían una TFG al ingreso < 60 ml/min/1,73 m2, tuvieron mayor riesgo del evento combinado que aquellos con mejor función renal basal (HR = 2,55; IC del 95%, 0,6-4,3; p = 0,1); esto respalda el concepto de la importancia pronóstica de la función renal en esa población.
Las otras variables con valor pronóstico independiente, la edad avanzada y la peor capacidad funcional previa, son un hallazgo habitual en los estudios pronósticos en insuficiencia cardiaca.
Las limitaciones de este estudio son las propias de un estudio retrospectivo, pero debe mencionarse que en parte están minimizadas por disponer de una única historia clínica electrónica, lo que permitió obtener con precisión la información. Obviamente, la falta de inclusión en el análisis multivariable de algunas variables no disponibles o variables de confusión desconocidas podría modificar los resultados. Aunque existen normativas para la medicación durante la etapa ambulatoria, no disponemos de todos los datos, por lo que no se puede excluir la influencia de la medicación en la evolución a largo plazo. Las conclusiones de este estudio no pueden generalizarse a todos los pacientes ingresados por insuficiencia cardiaca, sino sólo a los que ingresaron a unidad coronaria con características similares a las de esta población.
CONCLUSIONES
El EFR es una complicación frecuente en los pacientes hospitalizados por ICAD y se asocia con mayor tiempo de hospitalización y mayor frecuencia de muerte o reingresos por insuficiencia cardiaca al año, mediada fundamentalmente por los reingresos. Existen predictores clínicos y de laboratorio que permiten identificar, al momento del ingreso hospitalario, a la población con mayor riesgo de EFR.
ABREVIATURAS
EFR: empeoramiento de la función renal.
IC: intervalo de confianza.
ICAD: insuficiencia cardiaca aguda descompensada.
TFG: tasa de filtrado glomerular.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. C.A. Belziti.
Avda. Rivadavia 4216, Piso 3, Depto. 4. Ciudad de Buenos Aires (1205). Argentina.
Correo electrónico: cesar.belziti@hospitalitaliano.org.ar
Recibido el 8 de julio de 2009.
Aceptado para su publicación el 25 de noviembre de 2009.