El déficit de hierro (DH) es una condición frecuente en pacientes con cardiopatía isquémica o insuficiencia cardiaca. Pero se desconoce su impacto en la capacidad funcional y la calidad de vida (CdV) tras un síndrome coronario agudo (SCA).
MétodosSe evaluó prospectivamente el impacto del DH en la capacidad funcional y la CdV de 244 pacientes 30 días después de haber sufrido un SCA. La CdV se evaluó mediante el test EuroQol-5 dimensiones, la escala visual analógica y el Heart-QoL. La capacidad funcional se midió mediante ergometría en cinta sin fin o con la prueba de los 6 min de marcha. Se evaluó el impacto del DH en la morbimortalidad cardiovascular.
ResultadosSe documentó DH en el 46% de los pacientes. Estos pacientes realizaban ejercicio menos tiempo (366±162 frente a 462±155 s; p<0,001), presentaban peores tasas metabólicas de consumo (7,9±2,9 frente a 9,3±2,6 equivalentes metabólicos; p=0,003) y peor CdV, con puntuaciones más bajas en el EuroQol-5 dimensiones (0,76±0,25 frente a 0,84±0,16), la escala visual analógica (66±16 frente a 72±17) y el Heart-QoL (1,9±0,6 frente a 2,2±0,6) (todas, p<0,05). El DH fue un predictor independiente de peor capacidad funcional (OR=2,9; IC95%, 1,1-7,6; p=0,023) y peor CdV (OR=1,9; IC95%, 1,1-3,3; p<0,001). No se observó efecto en la morbimortalidad cardiovascular.
ConclusionesEl DH implica peor capacidad funcional y peor calidad de vida a medio plazo tras un SCA.
Palabras clave
El hierro es un micronutriente esencial para el transporte y el almacenamiento del oxígeno, el metabolismo de los músculos cardiaco y esquelético y la síntesis y la degradación de las proteínas1. En los últimos años se ha observado que el déficit de hierro (DH) es una comorbilidad frecuente en algunas enfermedades cardiovasculares, y en la insuficiencia cardiaca crónica su presencia se ha asociado a peor evolución clínica y deterioro de la capacidad de ejercicio2,3. Las repercusiones pronósticas del DH en los pacientes con insuficiencia cardiaca son independientes de su asociación con anemia; además, la reversión del DH con la administración de hierro por vía intravenosa mejora la capacidad funcional, con independencia del posible aumento de las concentraciones de hemoglobina (Hb)4.
Son pocos los estudios que han analizado la prevalencia y los determinantes clínicos del DH en pacientes con cardiopatía isquémica, y los datos disponibles se centran en su fase crónica5–8. En una de estas series, el DH se asoció a un aumento de la mortalidad en los pacientes con cardiopatía isquémica estable tratados con angioplastia coronaria; sin embargo, el DH no se analizó por separado, ya que en todos los casos se asoció a anemia7.
Hasta la fecha no se ha establecido la influencia del DH en la evolución clínica de los pacientes que han sufrido un síndrome coronario agudo (SCA). Nuestra hipótesis era que el DH impide una recuperación funcional adecuada a medio plazo tras un SCA, evaluada mediante la capacidad de ejercicio y la calidad de vida (CdV), con independencia de su posible asociación con anemia. Con fines exploratorios, se describe también el efecto del déficit de hierro en la mortalidad y la morbilidad cardiovasculares a medio plazo.
MÉTODOSPoblación en estudio y reclutamiento de los pacientesEste estudio fue aprobado por el comité local de ética de investigación clínica y se llevó a cabo según los principios establecidos en la Declaración de Helsinki.
Se consideró prospectivamente para su posible inclusión a los pacientes consecutivos ingresados en nuestro hospital por un SCA. Todos los participantes dieron su consentimiento informado por escrito en el momento de la inclusión. Se excluyó a los pacientes cuyo estado de DH no se pudo determinar el día 5 después del SCA y a los dados de alta o fallecidos antes de la inclusión en el estudio. También se excluyó a los pacientes tratados con hierro o con hemoderivados durante el ingreso hospitalario.
Se recogió la información relativa a las variables clínicas, biológicas, ecocardiográficas y demográficas, así como la del tratamiento farmacológico crónico al ingreso. Durante la hospitalización, también se incluyó en la base de datos la distribución de la enfermedad arterial coronaria (cuando se dispuso de ello) y la información sobre otras intervenciones terapéuticas.
Análisis del déficit de hierroSe determinaron las concentraciones de Hb al ingreso. El día 5 después del episodio de SCA, se llevó a cabo una evaluación hematológica completa que incluía una nueva determinación de la Hb, el volumen corpuscular medio, los índices del hierro (es decir, ferritina sérica, transferrina, saturación de transferrina y hierro sérico) y los parámetros inflamatorios (proteína C reactiva [PCR] de alta sensibilidad e interleucina 6 [IL-6]). La decisión de no realizar estos análisis en la fase aguda inicial del SCA se basó en la presunción de que los valores lábiles de IL-6/PCR y la variabilidad y la dependencia temporal de los fármacos antitrombóticos administrados durante las primeras 48 h del SCA impedirían una caracterización homogénea del estado inflamatorio y hematológico.
El DH se definió según las guías de la Kidney Disease Outcomes Quality Initiative como una concentración de ferritina < 100 ng/ml o un porcentaje de saturación de transferrina (definida como hierro sérico (μg/dl)/[transferrina sérica (mg/dl)×1,25])<20% cuando la ferritina era < 800 ng/ml9,10. Esta definición doble tiene en cuenta tanto los aspectos funcionales como los absolutos del DH. La anemia se definió como una concentración de Hb < 13g/dl (varones) o < 12g/dl (mujeres), según la guía de la Organización Mundial de la Salud11.
Seguimiento: evaluación de la calidad de vida y la capacidad de ejercicioEl seguimiento de los pacientes a los 30 días del episodio de SCA por el que se les había incluido en el estudio se realizó ambulatoriamente en las consultas externas. Se repartieron cuestionarios de calidad de vida y se realizó una prueba de esfuerzo en cinta sin fin con el protocolo de Bruce, y se repitió la evaluación hematológica completa. Si el paciente no podía ejecutar la prueba de esfuerzo en cinta sin fin, y siempre que fuera posible, se realizaba una prueba de 6 min de marcha. El seguimiento mínimo consistió en el registro del estado clínico por teléfono.
Se utilizaron 2 cuestionarios de CdV diferentes: el cuestionario genérico de calidad de vida europeo de 5 dimensiones (EQ-5D) junto con el cuestionario de escala visual analógica y el más específico Heart-QoL12–14. El EQ-5D es un cuestionario que responde el propio paciente y evalúa la CdV relacionada con la salud en 5 dimensiones de la vida cotidiana (movilidad, autocuidado, actividades habituales, dolor/molestias y ansiedad/depresión). El sistema de puntuación de este cuestionario clasifica 5 niveles de deterioro de la CdV (ausencia de problemas, problemas leves, problemas moderados, problemas graves, problemas extremos)12. En el cuestionario de la escala visual analógica, el paciente evalúa por sí mismo su estado de CdV relacionado con la salud en una línea vertical de 20 cm. En este estudio, para contextualizar las puntuaciones obtenidas en la escala visual analógica por nuestra población, se eligió la mediana descrita para la población española general (78 puntos)13. El cuestionario Heart-QoL de 14 ítems aborda específicamente a los pacientes con cardiopatía isquémica. Los pacientes que notifican un estado físico y emocional peor que el de los demás presentan también unas puntuaciones más bajas del cuestionario Heart-QoL14.
Análisis estadísticoPara el cálculo del tamaño muestral, se tomaron como referencia los datos previos del análisis de la CdV en pacientes con enfermedad coronaria y un infarto de miocardio previo (0,80 puntos en el cuestionario EQ-5D) y se consideró también la prevalencia de DH en esta población6,15. Según estos datos, se planteó la hipótesis de que los pacientes con SCA-DH tendrían una media de 0,75±0,1 puntos en el cuestionario EQ-5D15. Se aceptó un riesgo alfa de 0,05 y un riesgo beta de 0,20 en una prueba bilateral, y se estimó que se perdería el seguimiento en un porcentaje del 5% de los pacientes. En consecuencia, el cálculo del tamaño muestral estableció una muestra estimada de 63 casos y 63 controles (tamaño muestral total: un mínimo de 132 pacientes consecutivos). Se permitió la inclusión adicional de pacientes para disponer de datos descriptivos adicionales respecto al efecto del DH en la morbilidad y la mortalidad cardiovasculares.
Los datos se expresan en forma de media±desviación estándar cuando tienen una distribución normal y como mediana [intervalo intercuartílico] cuando no. Las variables discretas se expresan mediante frecuencia y porcentaje. Las diferencias clínicas entre los grupos con DH y sin DH se analizaron con la prueba de la t de Student, la prueba de la U de Mann-Whitney, la prueba de la χ2 o la prueba exacta de Fisher según fuera apropiado.
Se utilizó un modelo de regresión logística para establecer los determinantes clínicos del DH y un modelo de regresión lineal multivariable para analizar el efecto del DH y las demás variables analizadas en la capacidad de ejercicio. En ambos modelos, los determinantes clínicos del DH que alcanzaban un valor de p < 0,10 en el modelo univariable se incorporaron al análisis multivariable. Se utilizó un modelado retrógrado para evaluar la asociación independiente entre las variables clínicas, el DH y la capacidad de ejercicio. Se eliminaba cada variable una a una si su exclusión no modificaba de manera significativa el parámetro estadístico de cociente de verosimilitudes (likelihood ratio) del modelo. Cuando la exclusión de determinada variable modificaba los parámetros estimados de las variables restantes en más del 15%, se consideraba que había un efecto de confusión y la variable se mantenía en el modelo con independencia de su significación estadística. La calibración se determinó con la prueba de Hosmer-Lemeshow y la capacidad diagnóstica, con el área bajo la curva de características operativas del receptor.
Se aplicó una transformación logarítmica a los valores de IL-6 y PCR (log-IL-6 y log-PCR). Con objeto de verificar la linealidad, se aplicó una suavización a los valores de log-IL-6 en un modelo aditivo generalizado y se calcularon los valores de p para los efectos no lineales.
Se consideró estadísticamente significativo un valor de p bilateral < 0,05. El análisis estadístico se realizó con el programa SPSS 19.0.
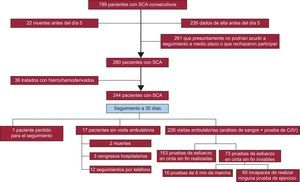
RESULTADOSPoblación del estudioEntre noviembre de 2012 y octubre de 2015, ingresaron en nuestro hospital 789 pacientes con un diagnóstico de SCA, de los que se incluyó en el estudio a 244. Los motivos para no incluir a un paciente fueron el traslado temprano a otro centro (266 pacientes) y la probabilidad de un seguimiento subóptimo a medio plazo (261, incluidos turistas, personas con alguna barrera idiomática y pacientes con deterioro de la función cognitiva o que rechazaron participar). El diagrama de flujo de la inclusión de pacientes se muestra en la figura 1.
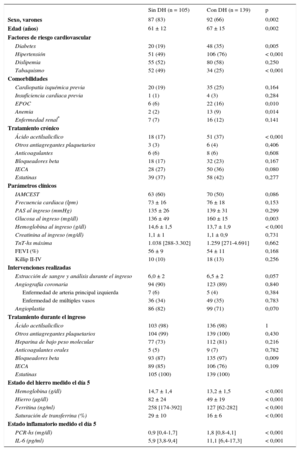
Se diagnosticó DH a 139 pacientes (57%) el día 5 y se diagnosticó anemia a 50 de esos pacientes (el 20% de la población total en estudio). El DH mostró asociación significativa con la edad avanzada y con la mayoría de los factores de riesgo cardiovascular y comorbilidades (p ≤ 0,01, excepto con la dislipemia y la enfermedad renal), así como con el consumo crónico de ácido acetilsalicílico (tabla 1). La existencia de una insuficiencia cardiaca previa estaba infrarrepresentada en esta serie (solo 4 pacientes) y carecía de significación estadística.
Características clínicas de los pacientes con y sin déficit de hierro
| Sin DH (n = 105) | Con DH (n = 139) | p | |
|---|---|---|---|
| Sexo, varones | 87 (83) | 92 (66) | 0,002 |
| Edad (años) | 61 ± 12 | 67 ± 15 | 0,002 |
| Factores de riesgo cardiovascular | |||
| Diabetes | 20 (19) | 48 (35) | 0,005 |
| Hipertensión | 51 (49) | 106 (76) | < 0,001 |
| Dislipemia | 55 (52) | 80 (58) | 0,250 |
| Tabaquismo | 52 (49) | 34 (25) | < 0,001 |
| Comorbilidades | |||
| Cardiopatía isquémica previa | 20 (19) | 35 (25) | 0,164 |
| Insuficiencia cardiaca previa | 1 (1) | 4 (3) | 0,284 |
| EPOC | 6 (6) | 22 (16) | 0,010 |
| Anemia | 2 (2) | 13 (9) | 0,014 |
| Enfermedad renal* | 7 (7) | 16 (12) | 0,141 |
| Tratamiento crónico | |||
| Ácido acetilsalicílico | 18 (17) | 51 (37) | < 0,001 |
| Otros antiagregantes plaquetarios | 3 (3) | 6 (4) | 0,406 |
| Anticoagulantes | 6 (6) | 8 (6) | 0,608 |
| Bloqueadores beta | 18 (17) | 32 (23) | 0,167 |
| IECA | 28 (27) | 50 (36) | 0,080 |
| Estatinas | 39 (37) | 58 (42) | 0,277 |
| Parámetros clínicos | |||
| IAMCEST | 63 (60) | 70 (50) | 0,086 |
| Frecuencia cardiaca (lpm) | 73 ± 16 | 76 ± 18 | 0,153 |
| PAS al ingreso (mmHg) | 135 ± 26 | 139 ± 31 | 0,299 |
| Glucosa al ingreso (mg/dl) | 136 ± 49 | 160 ± 15 | 0,003 |
| Hemoglobina al ingreso (g/dl) | 14,6 ± 1,5 | 13,7 ± 1,9 | < 0,001 |
| Creatinina al ingreso (mg/dl) | 1,1 ± 1 | 1,1 ± 0,9 | 0,731 |
| TnT-hs máxima | 1.038 [288-3.302] | 1.259 [271-4.691] | 0,662 |
| FEVI (%) | 56 ± 9 | 54 ± 11 | 0,168 |
| Killip II-IV | 10 (10) | 18 (13) | 0,256 |
| Intervenciones realizadas | |||
| Extracción de sangre y análisis durante el ingreso | 6,0 ± 2 | 6,5 ± 2 | 0,057 |
| Angiografía coronaria | 94 (90) | 123 (89) | 0,840 |
| Enfermedad de arteria principal izquierda | 7 (6) | 5 (4) | 0,384 |
| Enfermedad de múltiples vasos | 36 (34) | 49 (35) | 0,783 |
| Angioplastia | 86 (82) | 99 (71) | 0,070 |
| Tratamiento durante el ingreso | |||
| Ácido acetilsalicílico | 103 (98) | 136 (98) | 1 |
| Otros antiagregantes plaquetarios | 104 (99) | 139 (100) | 0,430 |
| Heparina de bajo peso molecular | 77 (73) | 112 (81) | 0,216 |
| Anticoagulantes orales | 5 (5) | 9 (7) | 0,782 |
| Bloqueadores beta | 93 (87) | 135 (97) | 0,009 |
| IECA | 89 (85) | 106 (76) | 0,109 |
| Estatinas | 105 (100) | 139 (100) | |
| Estado del hierro medido el día 5 | |||
| Hemoglobina (g/dl) | 14,7 ± 1,4 | 13,2 ± 1,5 | < 0,001 |
| Hierro (μg/dl) | 82 ± 24 | 49 ± 19 | < 0,001 |
| Ferritina (ng/ml) | 258 [174-392] | 127 [62-282] | < 0,001 |
| Saturación de transferrina (%) | 29 ± 10 | 16 ± 6 | < 0,001 |
| Estado inflamatorio medido el día 5 | |||
| PCR-hs (mg/dl) | 0,9 [0,4-1,7] | 1,8 [0,8-4,1] | < 0,001 |
| IL-6 (pg/ml) | 5,9 [3,8-9,4] | 11,1 [6,4-17,3] | < 0,001 |
DH: déficit de hierro; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IECA: inhibidores de la enzima de conversión de la angiotensina; IL-6: interleucina 6; PAS: presión arterial sistólica; PCR-hs: proteína C reactiva de alta sensibilidad; TnT-hs: troponina T de alta sensibilidad.
Los valores expresa n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
No se observaron diferencias en la incidencia de complicaciones hemorrágicas entre los grupos con y sin DH. En comparación con el grupo sin DH, los pacientes con DH eran de más edad y tenían concentraciones de Hb inferiores y de IL-6/PCR mayores (p < 0,001) (tabla 1). Se estableció una correlación lineal entre cifras superiores de IL-6 y mayor riesgo de DH (para el componente no lineal, p = 0,461).
En consonancia con la observación preliminar, el modelo de regresión logística multivariable confirmó que las cifras superiores de IL-6 (odds ratio [OR] = 1,048 por cada 1 pg/ml de aumento; intervalo de confianza del 95% [IC95%], 1,013-1,084; p = 0,007) y el consumo previo de ácido acetilsalicílico (OR = 3,254; IC95%, 1,373-7,716; p = 0,007) tenían asociación independiente con el DH.
Seguimiento: déficit de hierro, capacidad de ejercicio y calidad de vidaEl DH persistía en 102 (46%) de los 226 pacientes con SCA evaluados el día 30; el seguimiento fue limitado en los 18 pacientes restantes (figura 1). En este seguimiento a medio plazo, el grupo de DH siguió presentando unas concentraciones de Hb inferiores a las del grupo sin DH (p < 0,01). Se perdió el seguimiento de 1 de los 244 pacientes y 5 no acudieron al control a los 30 días por haber fallecido o por reingreso hospitalario (figura 1). En total, el día 30 había habido 7 eventos adversos cardiovasculares mayores, incluidas 2 muertes y 5 reingresos hospitalarios (4 a causa de una insuficiencia cardiaca y 1 por un reinfarto de miocardio). Esta baja incidencia de eventos adversos cardiovasculares mayores no permitió que se observaran diferencias significativas entre los grupos de pacientes con y sin DH.
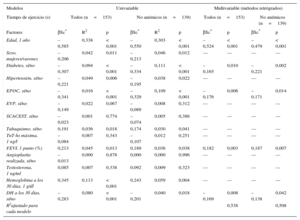
Déficit de hierro y capacidad de ejercicioUn total de 60 (27%) de los 226 pacientes no realizaron pruebas de ejercicio debido a artrosis grave, enfermedad arterial periférica, falta de equilibrio o adaptación subóptima a la cinta sin fin. De los demás pacientes (figura 1), 153 completaron la prueba de esfuerzo y 13 realizaron en su lugar la prueba de 6 min de marcha. Tenían DH el 41% de este grupo y el 66% de los que no pudieron realizar ninguna prueba de ejercicio (p < 0,001). En el grupo que realizó la prueba de esfuerzo en cinta sin fin, los pacientes con DH persistente mostraron menor capacidad de ejercicio según lo determinado por el tiempo total de ejercicio y la menor tasa de consumo metabólico en comparación con los pacientes sin DH en el seguimiento (respectivamente, 7,9±2,9 frente a 9,3±2,6 MET; p = 0,003 y 366±162 frente a 462±155 s; p < 0,001) (figura 2). Estas diferencias no se veían influidas por la proporción de pacientes con o sin DH que estaban tomando bloqueadores beta (el 93 frente al 92%; p = 0,80). Los pacientes con DH que realizaron la prueba de 6 min de marcha recorrieron también menos distancia que los pacientes sin DH (277 frente a 423 m respectivamente; p = 0,009). Tras aplicar un ajuste respecto a otras comorbilidades, el DH presentó una asociación significativa con una menor capacidad de ejercicio en el modelo de regresión lineal multivariable (p = 0,008), al igual que ocurrió con la edad mayor, la diabetes, la enfermedad pulmonar obstructiva crónica y los valores bajos de fracción de eyección del ventrículo izquierdo (tabla 2). Es importante señalar que la asociación entre el DH y la menor capacidad de ejercicio se acompañaba de un aumento significativo del coeficiente R2 en este modelo de regresión multivariable (de 0,510 a 0,538) y siguió siendo estadísticamente significativo cuando se analizó a los pacientes no anémicos de manera independiente (p = 0,048) (tabla 2).
Tiempo de ejercicio alcanzado por los grupos de pacientes con y sin DH. En cada recuadro, la línea media horizontal corresponde a la mediana; el límite inferior, al primer cuartil y el límite superior, al tercer cuartil. Las líneas de extensión corresponden al intervalo de confianza del 95% de la media. DH: déficit de hierro.
Capacidad de ejercicio en la prueba de esfuerzo en cinta sin fin. Modelos de regresión lineal univariable y multivariable para el análisis de las características demográficas y los factores clínicos relacionados con el ejercicio en todos los pacientes y en los pacientes no anémicos
| Modelos | Univariable | Multivariable (métodos retrógrados) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Tiempo de ejercicio (s) | Todos (n=153) | No anémicos (n=139) | Todos (n=153) | No anémicos (n=139) | ||||||
| Factores | βSc* | R2 | p | βSc* | R2 | p | βSc* | p | βSc* | p |
| Edad, 1 año | –0,585 | 0,338 | < 0,001 | –0,550 | 0,303 | < 0,001 | –0,524 | < 0,001 | –0,479 | < 0,001 |
| Sexo, mujeres/varones | –0,206 | 0,042 | 0,011 | –0,213 | 0,046 | 0,012 | — | — | — | — |
| Diabetes, sí/no | –0,307 | 0,094 | < 0,001 | –0,334 | 0,111 | < 0,001 | –0,165 | 0,010 | –0,221 | 0,002 |
| Hipertensión, sí/no | –0,221 | 0,049 | 0,006 | –0,195 | 0,038 | 0,022 | — | — | — | — |
| EPOC, sí/no | –0,341 | 0,016 | < 0,001 | –0,329 | 0,109 | < 0,001 | –0,176 | 0,006 | –0,171 | 0,014 |
| EVP, sí/no | –0,149 | 0,022 | 0,067 | –0,089 | 0,008 | 0,312 | — | — | — | — |
| SCACEST, sí/no | –0,023 | 0,001 | 0,774 | –0,074 | 0,005 | 0,386 | — | — | — | — |
| Tabaquismo, sí/no | 0,191 | 0,036 | 0,018 | 0,174 | 0,030 | 0,041 | — | — | — | — |
| TnT-hs máxima, 1 ng/l | –0,084 | 0,007 | 0,343 | –0,107 | 0,012 | 0,251 | — | — | — | — |
| FEVI, 1 punto (%) | 0,213 | 0,045 | 0,013 | 0,189 | 0,036 | 0,038 | 0,182 | 0,003 | 0,187 | 0,007 |
| Angioplastia realizada, sí/no | –0,013 | 0,000 | 0,878 | 0,000 | 0,000 | 0,996 | — | — | — | — |
| Testosterona, 1 ng/ml | 0,085 | 0,007 | 0,338 | 0,092 | 0,009 | 0,323 | — | — | — | — |
| Hemoglobina a los 30 días, 1 g/dl | 0,345 | 0,113 | < 0,001 | 0,243 | 0,059 | 0,004 | — | — | — | — |
| DH a los 30 días, sí/no | –0,283 | 0,080 | < 0,001 | –0,201 | 0,040 | 0,018 | –0,169 | 0,008 | –0,138 | 0,042 |
| R2ajustado para cada modelo | 0,538 | 0,508 | ||||||||
DH: déficit de hierro; EPOC: enfermedad pulmonar obstructiva crónica; EVP: enfermedad vascular periférica; FEVI: fracción de eyección del ventrículo izquierdo; SCACEST: síndrome coronario agudo con elevación del segmento ST; TnT-hs: troponina T de alta sensibilidad.
De igual modo, al analizar la capacidad de ejercicio como variable binaria, tomando como referencia la mediana del tiempo de ejercicio (418 s), la mayoría de los pacientes con DH presentaron unos tiempos de ejercicio inferiores a esta mediana y el DH se asoció a un deterioro de la capacidad funcional (es decir, tiempo de ejercicio < 418 s) tanto en el análisis univariable (OR = 2,8; IC95%, 1,4-5,5; p = 0,004) como en el multivariable (OR = 2,9; IC95%, 1,1-7,6; p = 0,023).
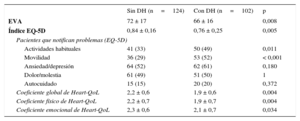
Déficit de hierro y calidad de vidaSe realizó análisis de sangre y se dispuso de las respuestas a los cuestionarios de CdV el día 30 de un total de 226 pacientes. El grupo con DH presentó unas puntuaciones inferiores a las del grupo sin DH en el cuestionario EQ-5D (p = 0,005), el cuestionario de escala visual analógica (p = 0,008) y el cuestionario Heart-QoL (p = 0,004) (tabla 3). El DH influyó principalmente en los dominios de «movilidad» y de «actividades habituales» en el cuestionario EQ-5D. En el cuestionario de escala visual analógica, el 75% de los pacientes del grupo con DH presentaron una puntuación inferior al valor de corte preliminar de 78 puntos, en comparación con el 49% de los pacientes del grupo sin DH (p < 0,001). De modo análogo, el 60% de los pacientes con DH presentaron una puntuación inferior a la mediana (2,21 puntos) en el cuestionario Heart-QoL, en comparación con tan solo un 42% de los pacientes del grupo sin DH (p = 0,009). Tras aplicar un ajuste por edad, sexo, anemia, enfermedad pulmonar obstructiva crónica, insuficiencia renal, hipertensión y diabetes, el DH continuó siendo un factor independiente predictivo de la CdV según el cuestionario de la escala visual analógica (OR = 3,021; IC95%, 1,672-5,457; p < 0,001) y el cuestionario Heart-QoL (OR = 1,9; IC95%, 1,079-3,348; p < 0,001).
Calidad de vida a los 30 días
| Sin DH (n=124) | Con DH (n=102) | p | |
|---|---|---|---|
| EVA | 72 ± 17 | 66 ± 16 | 0,008 |
| Índice EQ-5D | 0,84 ± 0,16 | 0,76 ± 0,25 | 0,005 |
| Pacientes que notifican problemas (EQ-5D) | |||
| Actividades habituales | 41 (33) | 50 (49) | 0,011 |
| Movilidad | 36 (29) | 53 (52) | < 0,001 |
| Ansiedad/depresión | 64 (52) | 62 (61) | 0,180 |
| Dolor/molestia | 61 (49) | 51 (50) | 1 |
| Autocuidado | 15 (15) | 20 (20) | 0,372 |
| Coeficiente global de Heart-QoL | 2,2 ± 0,6 | 1,9 ± 0,6 | 0,004 |
| Coeficiente físico de Heart-QoL | 2,2 ± 0,7 | 1,9 ± 0,7 | 0,004 |
| Coeficiente emocional de Heart-QoL | 2,3 ± 0,6 | 2,1 ± 0,7 | 0,034 |
DH: déficit de hierro; EQ-5D: cuestionario de calidad de vida europeo de 5 dimensiones; EVA: escala visual analógica; Heart-QoL: cuestionario de salud cardiaca-calidad de vida.
Los valores se expresan en forma de media ± desviación estándar o n (%).
La significación estadística se fijó en p < 0,05.
En el presente estudio se identificó que el DH es un determinante principal del deterioro de la capacidad funcional (p < 0,01) y la CdV (p < 0,01) tras un SCA, con independencia de la presencia o ausencia de anemia. Este estudio define el DH como una comorbilidad frecuente en el contexto de un SCA y que podría constituir una posible diana terapéutica en la fase de recuperación tras un evento coronario. En ese sentido, deberá investigarse con mayor detalle el papel que puede desempeñar la repleción del hierro en estos pacientes. Las tasas muy bajas de eventos adversos observadas en esta serie impidieron confirmar que el DH sea un predictor clínico de mortalidad y morbilidad cardiovasculares después de un SCA.
Aspectos fisiopatológicosLa definición del DH procede inicialmente de series publicadas de pacientes con enfermedad renal crónica, para quienes con frecuencia está indicada la repleción del hierro. Recientemente, se ha observado DH en otras enfermedades crónicas, como la artritis reumatoide y otras enfermedades inflamatorias, la insuficiencia cardiaca y la cardiopatía isquémica.
La identificación de un DH plantea un verdadero reto en los procesos patológicos que se acompañan de inflamación, como es el caso del SCA. En esta situación, una definición que utilice más de un marcador (estrategia «multimarcador») y que incluya también la saturación de la transferrina puede representar el estado del hierro mejor que la utilización de un único marcador como la sideremia o la ferritina (parámetros que además tienen una repercusión pronóstica controvertida en diversas enfermedades cardiovasculares)9,10,16–19.
El DH tiene alta prevalencia en los pacientes con enfermedad cardiovascular, sobre todo en la enfermedad coronaria estable y aguda y en la insuficiencia cardiaca crónica5,6,20–23. No hay evidencia clara respecto a los mecanismos involucrados en la aparición del DH en los pacientes cardiacos. El presente estudio ha confirmado lo indicado previamente por un estudio de nuestro grupo de trabajo, en cuanto a que el uso crónico de ácido acetilsalicílico y un mayor estado inflamatorio (demostrado por un aumento de las concentraciones de PCR/IL-6) son determinantes independientes del DH en los pacientes con SCA6. La hemorragia digestiva crónica y la inflamación que se produce en la enfermedad coronaria (especialmente implicada en el proceso de desestabilización de la placa) podría ser común en el proceso fisiopatológico del DH16,24,25. El estado proinflamatorio reduciría la absorción/disponibilidad del hierro y participaría en la desestabilización de la placa coronaria que causa el episodio de SCA26–34.
Déficit de hierro, capacidad funcional y calidad de vidaEl DH implica una disminución de la capacidad oxidativa del músculo esquelético y un aumento de la dependencia de los hidratos de carbono como sustrato energético, con lo que se produce un deterioro de la resistencia. Este principio es independiente de la asociación entre DH y anemia35,36. La presencia de DH se ha asociado a una peor capacidad física y un menor consumo de oxígeno (VO2máx) tanto en deportistas jóvenes como en mujeres sedentarias sin anemia37–39. Además, en los pacientes con insuficiencia cardiaca, el DH produce un deterioro de la capacidad de ejercicio2. Nuestras observaciones indican que el DH también empeora la capacidad de trabajo aeróbico a medio plazo después de un SCA. Es importante señalar que las bajas concentraciones de Hb no se asociaron de manera independiente con el DH en el análisis multivariable (datos no presentados) y que el DH se asoció también a una disminución de la capacidad de ejercicio en los pacientes que no estaban anémicos. Estas observaciones resaltan el papel clave del DH en la recuperación funcional del paciente después de un SCA, independientemente de que tengan anemia.
En este estudio, los pacientes con DH refirieron una CdV peor, básicamente por las limitaciones percibidas en la movilidad y en la capacidad de realizar actividad física. El deterioro funcional implica efectos importantes en el estado de salud autopercibido17,40. A la vista de nuestros resultados, esta presunción puede extrapolarse al contexto clínico de la fase de recuperación de un SCA.
Déficit de hierro: ¿una diana terapéutica después del síndrome coronario agudo?Hay muchos factores no modificables, como el sexo, la edad, el nivel de estudios y el estado civil o laboral, que pueden influir en la capacidad funcional y la CdV percibidas por el propio paciente41. La identificación de una variable potencialmente modificable, como el DH, podría implicar la aparición de una nueva diana terapéutica en la búsqueda de una recuperación funcional óptima tras un evento coronario. Se sabe que la corrección del DH en los pacientes con insuficiencia cardiaca mejora tanto la CdV como la capacidad de ejercicio40,42,43. En ese contexto se necesitan nuevas investigaciones que determinen si la normalización del DH aporta una mejora significativa en la CdV y la capacidad de ejercicio después de un SCA.
Limitaciones del estudioDado que el DH y los parámetros inflamatorios se evaluaron el día 5 después del SCA, los pacientes que fallecieron en la fase aguda del SCA no estuvieron representados en este estudio, lo que conlleva la posibilidad de un sesgo de selección. La decisión de retrasar la determinación del estado del hierro y de la inflamación se tomó para evitar que influyeran en los resultados el tiempo de hipoxia, los fenómenos de isquemia-reperfusión y el tratamiento antitrombótico administrado durante las fases iniciales del SCA44.
El coeficiente beta estandarizado que evalúa la repercusión del DH en la recuperación funcional del paciente, aunque es coherente con lo descrito en pacientes con insuficiencia cardiaca, podría considerarse algo bajo3,21. De manera análoga, el valor de R2 de 0,54, aunque es superior al descrito en los pacientes con insuficiencia cardiaca y DH, podría considerarse discreto21,45.
El número significativo de pacientes que rechazaron participar o a los que se excluyó debido a la previsión de dificultades en el seguimiento a medio plazo (261 pacientes) puede poner en peligro la representatividad de la muestra de estudio. Además, no se pudieron realizar pruebas de esfuerzo en una cuarta parte de los pacientes debido a los problemas de movilidad. Consideramos que esta limitación es una consecuencia natural del fenómeno del envejecimiento progresivo de los pacientes con SCA en los países occidentales.
El presente estudio carece de la potencia estadística necesaria para demostrar un efecto pronóstico del DH en los eventos cardiovasculares después de un SCA. Los datos relativos a la morbilidad y mortalidad cardiovasculares se presentan en este estudio únicamente con fines descriptivos y exploratorios.
CONCLUSIONESEl DH es un trastorno muy frecuente en el contexto del SCA y persiste a medio plazo en gran número de pacientes. La persistencia del DH compromete de manera significativa la capacidad de ejercicio y la CdV de los pacientes con SCA, con independencia de que tengan anemia. Dada la posibilidad de revertir el DH mediante tratamiento, es posible que estemos ante una nueva diana terapéutica para los pacientes con SCA, de manera que se podría optimizar la recuperación funcional después de un evento coronario. No se han determinado aún las repercusiones a largo plazo del DH (y su tratamiento) en la mortalidad y la morbilidad cardiovasculares en este contexto.
CONFLICTO DE INTERESESJ. Comín-Colet formó parte del comité directivo del FAIR-HF y participó en el ensayo CONFIRM-HF (ambos patrocinados por Vifor Pharma Ltd.), y ha recibido honorarios por conferencias de Vifor Pharma Ltd. Todos los demás autores no tienen conflictos de intereses que declarar.
- –
El DH es un trastorno subyacente muy prevalente en los pacientes con SCA.
- –
El uso previo de ácido acetilsalicílico, las bajas concentraciones de Hb y el estado proinflamatorio se asocian a la aparición del DH en estos pacientes.
- –
Se sabe poco sobre la influencia del DH en los resultados clínicos y funcionales de los pacientes después de un SCA, puesto que esta información pronóstica no se ha presentado anteriormente.
- –
Este estudio revela que el DH se asocia a un deterioro de la capacidad funcional y peor CdV en los pacientes con SCA, con independencia de la presencia o ausencia de anemia.
- –
Dada la posibilidad de revertir el DH mediante tratamiento farmacológico, es posible que el DH sea una nueva diana terapéutica en esta situación clínica.
La realización de este estudio contó con el apoyo de la Sociedad Catalana de Cardiología, por medio de la beca Servier 2012.