Palabras clave
La identificación de factores de riesgo para evaluar los cambios degenerativos de la corteza cerebral que conducen a distintos tipos de demencia1,2 o deterioros cognitivos3 en modelo experimental ha constituido un importante avance en su prevención al intentar establecer mecanismos de control sobre los mismos4. Uno de estos factores de riesgo ya identificados, que origina importantes cambios neurodegenerativos, es la hipercolesterolemia2. Otro de los factores de riesgo recientemente implicados es la isoforma Apo E4, cuyo papel en el sistema nervioso central es particularmente importante en relación con el sistema colinérgico, induciendo un fallo en la biología molecular de las neuronas del córtex cerebral5,6.
Estudios en pacientes sanos desde el punto de vista neurológico4 han permitido correlacionar las concentraciones plasmáticas elevadas de colesterol con un aceleramiento de fenómenos atróficos corticosubcorticales a los que se sumaba un declive perfusional de dichas áreas.
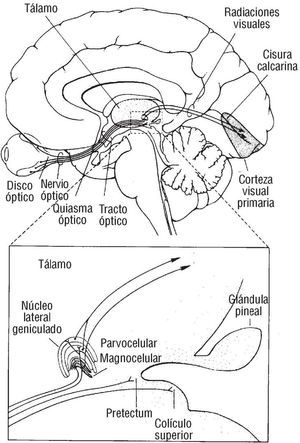
El objetivo de este trabajo fue aislar uno de estos factores de riesgo, la hipercolesterolemia, en un grupo extenso de pacientes y tratar de encuadrar las posibles alteraciones en la biología celular del córtex cerebral en las áreas de asociación visuales in vivo (fig. 1). Tratamos de comprobar si esos cambios neurodegenerativos en el córtex, anunciados por otros autores2 en modelo animal experimental, se correspondían en el ser humano con algún patrón de lesión funcional en las áreas 18 y 19. Adicionalmente, tratamos de determinar si este patrón permitía identificar el riesgo cardiovascular asociado al colesterol7, por la simple identificación de su existencia en las concentraciones plasmáticas no aceptables, para ser utilizado como predictor precoz de la enfermedad coronaria8.
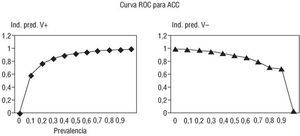
Fig. 1. Representación del porcenta-je de acierto por curva ROC ante la prevalencia de hipercolesterolemia en una determinada población del 40 y del 50%. Dicho porcentaje de acierto se sitúa en el 89,9 y el 93,1%, respectivamente.
Para este fin nos centramos en el análisis computarizado de la visión cromática (ACC)9, la más elevada función visual, sólo poseída por primates y humanos, buscando la mínima saturación percibida de estos 4 colores: amarillo, rojo, verde y azul por separado, en cada uno de los sujetos explorados, tratando de visualizar un secuencia numérica de afección celular testada in vivo.
PACIENTES Y MÉTODO
Estudiamos a 208 pacientes (grupo 1) con cifras inferiores a 200 mg/dl de colesterol total (153 varones y 55 mujeres, con un intervalo de edad entre 37 y 66 años), y a 208 pacientes como grupo control (grupo 2) con cifras mayores de 200 mg/dl de colesterol (153 varones y 55 mujeres, con un intervalo de edad entre 37 y 66 años). Ninguno de estos pacientes tenía evidencia clínica o analítica de ninguna enfermedad respiratoria, endocrina, hepática, renal o hematológica. Un total de 389 pacientes (93,51%) presentaba sobrepeso y 27 de ellos (6,49%) tenían un índice de masa corporal calificado como de obesidad. Los criterios de exclusión fueron: diabetes mellitus, hipotiroidismo, síndrome nefrótico, colestasis hepática, angina de pecho o infarto agudo de micocardio, accidentes isquémicos transitorios, accidentes cerebrovasculares (ACV), excesiva ingesta de alcohol, tratamiento farmacológico por hipolipemiantes, estrógenos, corticoides, fármacos inmunodepresores y tabaquismo. La presión arterial fue medida antes de iniciar el protocolo de estudio por esfigmomanometría por técnicas estándar, después de que cada paciente hubiera estado en sedestación durante 5 min. Cada medida de presión arterial fue la media aritmética de 3 medidas.
Procedimientos
Los parámetros de bioquímica clínica fueron obtenidos de acuerdo con las recomendaciones de la European Atherosclerosis Society. Las muestras de sangre fueron obtenidas tras un período de ayuno de 12 h, después de una cena ligera. El colesterol total se midió usando el método enzimático CHOD-PAP (Boehringer Mannheim, Alemania)10. Los triglicéridos se midieron por métodos enzimáticos GPO-PAP (Boehringer Mannheim, Alemania)11. El colesterol unido a lipopoteínas de alta densidad (cHDL) fue medido por métodos de precipitación de heparina cálcica (Boehringer Mannheim, Alemania)12. Las tomas de glucosa, creatinina, urea, ácido úrico, GOT, GPT, GGT fueron obtenidas por procedimientos de rutina clínica y analizados por un analizador automático (Hitachi 704, Boehringer Mannheim, Alemania).
Protocolo de estudio oftalmológico
En primer lugar se realizó una exhaustiva inspección externa de sujetos que presentaran enfermedad palpebral tipo ptosis, cejas prominentes o apéndices nasales suficientemente grandes como para producir defectos de campo visual, superiores, inferiores, temporales o nasales. Posteriormente se exploró la vía pupilar13,14 buscando defectos aferentes o deferentes, congénitos o iatrogénicos, de dicha vía.
Tras conseguir una midriasis máxima con tropicamida al 1%15, se utilizó el oftalmoscopio binocular indirecto de Keeler para explorar la retina central y la periférica15 y la lente de 90 Dp16 de Nikon, para detalles del polo posterior.
Se observó cualquier alteración de la morfología de la papila óptica, vascular retiniana y del parénquima retiniano, todo ello descartando previamente cualquier enfermedad vítrea17.
El polo anterior fue examinado con una lámpara de hendidura Haag-Streit BQ 900 buscando opacidades corneales o cristalinianas o cualquier afección de polo anterior que produjera una alteración de la transparencia de medios. Ante cualquier anomalía biomicroscópica el paciente quedaba eliminado del estudio.
Se realizaron 3 medidas de presión intraocular sobre cada ojo usando el tonómetro de Goldman18, hallando la media artimética en mmHg. Todo ello se efectuó tras haber verificado su precisión con 3 tonómetros más del mismo tipo. Ante una presión mayor de 21 mmHg, o menor, pero con excavación papilar y/o defectos campimétricos y excavación papilar susceptible de ser considerado como glaucoma de baja tensión19, el paciente quedaba excluido del estudio.
Todas las pruebas practicadas no tienen valor alguno, o al menos muy escaso, si el paciente padece alguna discromatopsia adquirida o congénita o no lleva perfectamente corregida su ametropía si la hubiere20. Para este fin se procedió excluyendo a todo sujeto discromatópsico. Para corregir las ametropías se utilizó una esquiascopia, oftalmometría con Javal, y se practicó refractometría con el automático de Canon. Se utilizaron los optotipos de Snellen. Se consideró que el paciente alcanzaba su refracción óptima al dar unidad de visión ± 0,2. Si la visión que se alcanzaba era < de 0,7 o, por la razón que fuere, tenía un defecto refractivo moderado que pudiera incidir en las pruebas, bien por escotomas refractivos, bien por lesiones miópicas, bien por los angioescotomas típicos de los pacientes hipermétropes, el paciente era eliminado del estudio.
Por tanto, cualquier anomalía oftalmológica implicaba la eliminación automática del paciente, ya fuera por cualquier anomalía palpebral o pupilar, defectos de refracción > 6, episodios transitorios de pérdida de visión, ya fuera por alguna anomalía fundoscópica, biomicroscópica, tonométrica o de otra índole.
Análisis computarizado de la visión cromática
Se realizó sobre el mismo analizador Humphrey 640. Consiste en colocar al paciente en posición de exploración, como siempre en visión monocular corregida, y determinar el umbral foveal para cada uno de los colores, amarillo, rojo, verde y azul9. El rojo, verde y azul pueden ser explorados automáticamente por el Humphrey 640, pero para el amarillo utilizamos luz blanca anteponiendo un filtro Cibachrome Y II9.
Los valores para cada uno de los colores se expresan en decibelios (db), con los que construimos una gráfica formando un polígono de frecuencias. La exploración se realiza en 60 s, como preámbulo de la campimetría computarizada. A cada paciente se le practicó la prueba en ambos ojos, pero sólo se tomó la medida del segundo para obviar el supuesto efecto aprendizaje de dicha prueba.
Los valores patrones encontrados fueron de 38, 28, 24 y 25 db para los colores mencionados, amarillo, rojo, verde y azul9. Al sumar estos valores y dividir por el número de colores explorados obtenemos el índice medio cromático o IMC9. Según nuestra muestra, el IMC fue de 28,7 db. Consideramos, pues:
- Alteración leve: IMC de 27 a 25 db.
- Alteración moderada: IMC de 25 a 24 db.
- Alteración severa: IMC < 24 db.
Análisis estadístico
Con objeto de encontrar, del conjunto total de variables tanto metabólicas como oftalmológicas, aquellas que pudieran presentar diferencias significativas entre los 2 grupos de pacientes estudiados (hipercolesterolémicos y sanos) se aplicó el test paramétrico de la t de Student, ya que todas seguían una distribución normal.
Determinadas éstas y establecidos los intervalos de confianza (IC) para cada grupo, se calcularon para cada parámetro los puntos de corte que pudieran ser determinantes en la separación de los 2 grupos de pacientes. Considerando como posibles tests diagnósticos para la enfermedad aquellos en que el sujeto tuviera un valor inferior o superior a dichos puntos de corte, se calcularon, a modo orientativo, la sensibilidad y la especificidad de la prueba individualmente.
Centrándonos en el estudio de las variables oftalmológicas, se llevó a cabo un análisis discriminante. Para dicho análisis, la variable dependiente fue la concentración de colesterol dicotomizada, por el punto de corte que consideramos como normal y patológico. Se introdujo como conjunto de variables independientes las correspondientes a la prueba, utilizándose el método stepwise de manera que seleccionara el conjunto mínimo de variables explicativas. Tras obtener los coeficientes no estandarizados de la función lineal discriminante se calcularon las puntuaciones discriminantes para cada sujeto, a partir de la cual se determinaron las probabilidades de pertenecer a uno u otro grupo y se asignaron al de mayor probabilidad.
El nivel de separación de la función discriminante fue medido por el valor final del coeficiente lambda de Wilks (Wilk's lambda) y el coeficiente de correlación canónica.
La tabla de clasificación de los resultados indica el porcentaje de sujetos bien clasificados, a partir de la cual se puede deducir la sensibilidad y especificidad del método diagnóstico.
El mapa territorial ha sido utilizado para ilustrar la separación de los 2 grupos. En aquellos casos en los que la sensibilidad y la especificidad no fue del 100% se calcularon los valores predictivos de índices verdaderos positivos y verdaderos negativos para distintos valores de la prevalencia de la enfermedad (curvas ROC).
Con la intención de corroborar mediante otra metodología los resultados obtenidos en el primer análisis se llevó a cabo un análisis de regresión múltiple. En éste se consideró como variable dependiente el colesterol total del paciente, sin distinguir entre normocolesterolemico o hipercolesterolémico, y como variables independientes el total de las variables del análisis computarizado de la visión cromática.
Igual que en el caso anterior, se utilizó el modelo stepwise. La función de regresión obtenida con el conjunto final de variables predictoras aportó un coeficiente de correlación múltiple R = 0,89839 y un coeficiente de determinación de 0,80711, lo que equivale a decir que las variables predictoras finales explican aproximadamente el 81% de la variabilidad del colesterol total.
Las correlaciones entre las variables bioquímicas y las neuroftalmológicas fueron calculadas usando el coeficiente de correlación de Spearman. Para intentar comparar y replicar los resultados obtenidos del modelo de estudio se escogió un subgrupo aleatorizado de 263 sujetos del grupo de la población de estudio (n = 416). El modelo de predicción, con el colesterol total como variable dependiente, se creó usando una regresión múltiple lineal.
RESULTADOS
Los 2 grupos de pacientes estudiados, con sus características clínicas y bioquímicas, se exponen en la tabla 1.
El peso, la glucemia basal y las presiones sistólica y diastólica en sedestación fueron significativamente elevadas en el grupo 1 en comparación con el grupo control.
En la tabla 2 se aprecian los resultados del ACC para la capacidad de saturación del color, expresados en db, para los 4 colores estudiados (amarillo, rojo, verde y azul) más el índice medio cromático. Se demuestra claramente la significación de las comparaciones estadísticas de los 2 grupos, con un valor de p < 0,001.
En la tabla 3 se exponen las secuencias numéricas medidas en las áreas 17, 18 y 19 de Brodman (como estación final), en relación con la saturación del color expresados en db. Pueden observarse diferentes secuencias para diferentes concentraciones de colesterol plasmático y, por tanto, secuencias numéricas que predicen riesgo cardiovascular y otras que no.
En la tabla 4 se observa, mediante un análisis discriminante, la relación directa entre la concentración de colesterol y la vía óptica, alcanzando una correlación canónica de 0,825 con una sensibilidad del 90% y una especificidad del 93%.
En la tabla 5 se exponen los resultados de la regresión múltiple con el colesterol total como variable independiente, y el parámetro de campimetría computarizada más significativo como variable dependiente fue de R = 0,89 (p < 0,001), una variabilidad del test del 81%.
En la figura 1 se aprecia una curva ROC, con los porcentajes de acierto de la prueba, en relación con la prevalencia supuesta de una hipercolesterolemia. Así pues, observamos que, ante una supuesta prevalencia en una determinada población del 40 y del 50%, el porcentaje de acierto era del 0,899 y el 0,931, respectivamente.
En la tabla 6 se expone la correlación entre los 4 colores del ACC y el colesterol total plasmático, que fue de 0,44 para el amarillo, de 0,62 para el rojo, de 0,61 para el verde y, por último, de 0,67 para el azul.
DISCUSION
Hasta el momento existen numerosos patrones de lesión neuronal de la vía óptica que producen una afectación de la visión cromática. Desde los tradicionalmente conocidos como traumatismos21, destrucción por presión22-24 o metabólicos25, recientemente se han incorporado distintos modelos de lesión tóxica neuronal por sobrestimulación del factor de agregación plaquetaria (PAF)26 por la acción directa del óxido nítrico27, incluso por peroxidación lipídica28 como resultado de liberación de radicales libres.
Sin embargo, aunque existe constancia de que la hipercolesterolemia es un factor de riesgo para el envejecimiento neuronal2,4,6, nunca hasta este trabajo se había demostrado que la primera, por sí sola o actuando por otras vías indirectas desconocidas, pudiera ser un factor neurotóxico y neurodegenerativo, que produjera una afectación en la visión cromática.
Sugerimos que este alejamiento de la función neuronal cromática no sólo indicaría por sí sola la existencia de una hiperlipemia, sino también la traducción de mecanismos celulares conducentes a un fallo en su biología molecular29,30, que puede traducirse clínicamente y por método computarizado en una secuencia numérica del funcionamiento del córtex cerebral de las áreas 17, 18 y 19 (fig. 2). En estado de normalidad de las cifras plasmáticas de colesterol total, dicha secuencia es distinta a la de funcionamiento en condiciones de hipercolesterolemia, de manera que los cambios son cuantificables y cualificables y pudieran ser muy útiles como marcadores de riesgo cardiovascular precoz.
Fig. 2. En el dibujo se observa un corte lateral del cerebro, donde se clarifica el recorrido total de la vía óptica, desde la retina (5% del recorrido) hasta el córtex cerebral de las áreas 17, 18 y 19 de Brodman. La ampliación en la zona media muestra el tejido parvocelular (canal P) responsable de la transmisión del color, la luz y la alta sensibilidad al contraste. Cortesía de Kandel y Schwartz. Principles of Neuroscience (3.ª ed.). Elsevier.
Las diferencias de colesterol total plasmático entre el grupo 1 (254,10 ± 31,74) y el grupo 2 (171,0 ± 7,05), repercuten en la visión cromática en todos los colores analizados y en el índice medio cromático. Como pone de manifiesto el análisis discriminante tomando como base las cifras de colesterol total se obtiene una sensibilidad del 90% y una especificidad del 93%, siendo su correlación canónica del 0,825.
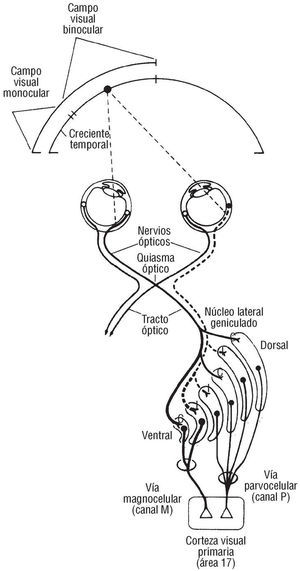
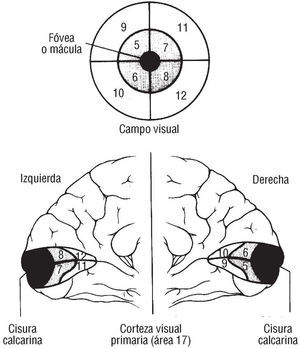
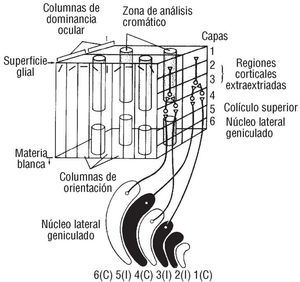
En primer lugar, la relación directa entre la concentración de colesterol y las neuronas del córtex visual queda suficientemente demostrada en nuestro estudio. Por tanto, esto nos permite postular que pudiera existir un mecanismo tóxico sobre la neurobiología de esa ona cerebral, mediado por la hiperlipemia, en primera instancia, que se tradujera en una pérdida de visión cromática cuantificable que afectara las células P31 (fig. 3) de las áreas 17, 18 y 19 de Brodman, a sus estaciones de análisis cromático32 (figs. 4 y 5). Sugerimos asimisimo que ese fallo celular expresa también la susceptibilidad individual a las concentraciones lipídicas en sangre, medidas intracelular e intratisularmente en el más especializado de los tejidos (fig. 6). Dicho fallo como consecuencia de una disfunción neurobiológica pudiera estar correlacionado con la susceptibilidad genética a padecer una enfermedad cardiovascular, puesto que estudios como el Framingham33 revelaron que el 35% de los infartos de miocardio se producían con concentraciones por debajo de los 200 mg/dl; así mismo, otros autores apuntan a la inexistencia de factores de riesgo cardiovascular en determinados individuos que presentan un infarto34.
Fig. 3. Dibujo en el que se aprecia un corte en sentido anteroposterior y desde arriba, donde se comprueban las conexiones sinápticas sobre la vía parvocelular (canal P). El autor sugiere que la integridad de estas conexiones queda comprometida ante una hipercolesterolemia, traduciendo un fallo de la visión cromática, que en realidad, traduce un riesgo cardiovascular que se predice de forma precoz. Cortesía de Kandel y Schwartz. Principles of Neuroscience (3.ª ed.). Elsevier.
Fig. 4. El dibujo en el que aprecia una visión posterior del córtex occipital donde se observa la perfecta correlación entre el resultado de la campimetría computarizada (prueba desde donde se realiza el análisis computarizado de la visión cromática ACV-C) y las áreas 17,18 y 19 de Brodman. Cortesía de Kandel y Schwartz. Principles of Neuroscience (3.ª ed.). Elsevier.
Fig. 5. Dibujo en el que se observa la estación de análisis final de la visión cromática, los Blobs. Estas estructuras tienen un valor añadido porque, además de su función principal visual, el autor sugiere que actúan como sensores específicos y sensibles del riesgo cardiovascular personalizado asociado a la hipercolesterolemia. Cortesía de Kandel y Schwartz. Principles of Neuroscience (3.ª ed.). Elsevier.
En segundo lugar, estudios epidemiológicos de referencia7,35,8,36 han probado de manera convincente la evidencia de que cuanto más elevadas son las cifras de colesterol plasmático mayor es el riesgo de padecer una enfermedad coronaria. Dichos estudios apoyan una
reducción de la enfermedad coronaria cuando se disminuyen las concentraciones de colesterol total o de colesterol unido a lipoproteínas de baja densidad (cLDL)7. El control efectivo de las dislipidemias es ahora universalmente aceptado como una útil herramienta en la prevención de las enfermedades cardiovasculares. Otros estudios han demostrado con firmeza que identificar y actuar sobre las concentraciones de colesterol puede salvar vidas35,8,36. Por tanto, un método diagnóstico con suficiente fiabilidad, como el ACC, podría revelar un número indeterminado de hipercolesterolemias que pasan desapercibidas para la población y cuya identificación redundaría en una mejor estrategia global para la prevención primaria, pudiendo además utilizarse como prueba de rastreo de amplios grupos poblacionales.
El hecho, además, de que se realice en 4 min por ojo, 8 min en total, que sea indolora, no invasiva y que proporcione información no sujeta a la variabilidad de la analítica plasmática37,38 hace que sea lo suficientemente atractiva como para incluirla dentro del protocolo clínico y terapéutico de pacientes con o sin enfermedad coronaria.
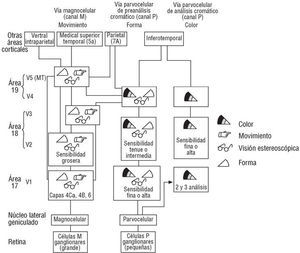
Adicionalmente, este estudio demuestra que los sujetos con hipercolesterolemia no tienen una buena visión cromática (fig. 6) y también que mediante el ACC podemos analizar el eje azul-amarillo y reconocer si el proceso desencadenado es antiguo o incipiente39, técnica que bajo la forma de perimetría azul-amarillo se está utilizando desde 1996 para el diagnóstico precoz de glaucoma40.
Fig. 6. En el dibujo se obsevan las diferentes vías de entrada de información visual hacia la corteza occipital de las áreas 17, 18 y 19 de Brodman (como estación final), que vienen desde la retina. Puede apreciarse cómo la vía cromática sigue el canal parvocelular, independientemente de las otras funciones físicas que viajan en el mismo canal, y que acaban produciendo la sensación cortical de visión en la estación final. Cortesía de Kandel y Schwartz. Principles of Neuroscience (3.ª ed.). Elsevier
Conclusiones e implicaciones clínicas
1. El estudio determina una fuerte asociación entre la hipercolesterolemia y las áreas visuales de la corteza cerebral.
2. Esa fuerte asociación traduce un fallo en la visión cromática cuantificable.
3. El fallo queda expresado in vivo en una secuencia numérica de alta fiabilidad que podría adicionalmente predecir de manera precoz un riesgo cardiovascular asociado a la hipercolesterolemia.
AGRADECIMIENTO
Nuestro más sincero agradecimiento al Dr. Emilio González Cocina, Jefe de Servicio de Cardiología del Hospital Costa del Sol, Marbella, Málaga, por sus valiosísimas aportaciones al diseño y discusión de este trabajo.
Correspondencia: Dr. A. Alcalá Malavé. Liborio García, 8, 2º. 29005 Málaga. Correo electrónico: glia127@teleline.es Recibido el 15 de febrero de 2001. Aceptado para su publicación el 16 de julio de 2001.