La miocardiopatía inducida por el bloqueo de rama izquierda (BRI) se produce en pacientes con BRI de larga duración. Es característico que muestren hiperrespuesta a las terapias de resincronización cardiaca (TRC). Sin embargo, existe poca información sobre su respuesta al tratamiento médico. El objetivo de este estudio es evaluar el cambio en la fracción de eyección del ventrículo izquierdo (FEVI) después de un periodo de 3 meses tras la dosificación del tratamiento médico recomendado por la guía de insuficiencia cardiaca.
MétodosSe trata de un análisis retrospectivo, en el que se incluyó a todos los pacientes valorados en la unidad de insuficiencia cardiaca de un hospital universitario español entre 2020 y 2021, que presentaban disfunción ventricular de novo (FEVI <40%) y tenían antecedentes de BRI de larga evolución sin otras posibles causas de miocardiopatía.
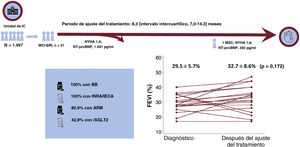
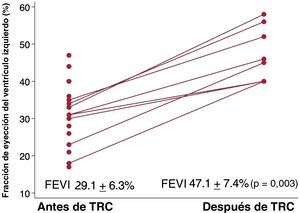
ResultadosSe analizó a un total de 1.497 pacientes, de los que resultaron elegibles 21. El tiempo medio desde el primer diagnóstico de BRI a la primera consulta fue de 4,05±4,1 años. La FEVI media desde la primera consulta hasta el final de la dosificación mejoró del 29,5±5,7% al 32,7±8,6% (p=0,172); ninguno recuperó la función ventricular al final del seguimiento. La clase funcional de la New York Heart Association mejoró de 1,91±0,46 a 1,81±0,53 (p=0,542). Tras el implante del dispositivo de TRC en 8 pacientes, la FEVI mejoró un 18,1±6,4% (p=0,003).
ConclusionesEl tratamiento médico recomendado por la guía parece ser ineficaz para mejorar la FEVI y la clase funcional en pacientes con insuficiencia cardiaca de novo y miocardiopatía inducida por BRI. Basándose en la respuesta positiva a la TRC en la mejora de la FEVI, el implante temprano de TRC podría ser una estrategia razonable para estos pacientes.
Palabras clave
La miocardiopatía dilatada es una cardiopatía que consiste en la dilatación de la cavidad del ventrículo izquierdo (VI) o de ambos ventrículos y se acompaña de una disfunción ventricular sistólica. Puede ser consecuencia de diversas predisposiciones genéticas o noxas ambientales1. Las elevadas prevalencia e incidencia del bloqueo de rama izquierda (BRI) en este grupo de pacientes (el 30% de los casos)2 contrastan vivamente con la prevalencia del 1% observada en la población general. Además, la prevalencia aumenta progresivamente con la edad, hasta alcanzar un 3% de los mayores de 80 años, a menudo en relación con una cardiopatía estructural subyacente3,4. Estas observaciones respaldan la idea de que el BRI pueda ser un trastorno adquirido debido a alteraciones de la conducción que aparecen durante la evolución natural de la enfermedad. Sin embargo, se ha descrito un pequeño grupo de pacientes con antecedentes de BRI de larga evolución y sin ningún signo de cardiopatía estructural en el momento del diagnóstico que presentan un deterioro progresivo de la función ventricular, con una marcada asincronía intraventricular durante el seguimiento, y una hiperrespuesta a las terapias de resincronización cardiaca (TRC). Esto podría indicar la existencia de una entidad clínica bien diferenciada, en la que la disincronía electromecánica causada por el BRI sea la causa y no la consecuencia de la miocardiopatía5–8, a la que se denomina miocardiopatía inducida por BRI (MCPI-BRI).
Las recomendaciones actuales indican que el tratamiento médico es la piedra angular para los pacientes con IC y fracción de eyección del ventrículo izquierdo (FEVI) <40% y proponen iniciar una combinación con bloqueadores beta, antagonistas del receptor de mineralocorticoides (ARM), inhibidores de la enzima de conversión de la angiotensina (IECA)/antagonistas del receptor de la angiotensina II (ARA-II) o inhibidores de la neprilisina y el receptor de la angiotensina (INRA). Recientemente se han añadido los inhibidores del cotransportador 2 de sodio y glucosa (SGLT2) a esta estrategia terapéutica. Sin embargo, la evidencia relativa al efecto de estos fármacos en los pacientes con MCPI-BRI es escasa, aunque parece que su respuesta podría ser peor que la de los pacientes con un QRS estrecho9. En cambio, varios estudios retrospectivos han analizado la respuesta de los pacientes con MCPI-BRI a la TRC y la estimulación fisiológica (ritmo de haz de His o BRI); tras la corrección de la asincronía generada por el BRI10, casi todos los pacientes mejoraron en su clase funcional y recuperaron una FEVI normal, incluso con beneficios demostrados en su pronóstico a largo plazo5,11.
En este contexto, el objetivo principal de este estudio es evaluar el efecto en la FEVI del nuevo tratamiento médico recomendado por la guía (TMRG) en los pacientes con IC y FEVI reducida en casos de MCPI-BRI.
MÉTODOSEn este análisis retrospectivo se incluyó a todos los pacientes con MCPI-BRI ingresados por un episodio de IC o evaluados por una disfunción ventricular de aparición reciente en la unidad ambulatoria de IC del Hospital Universitario de Santiago de Compostela entre 2020 y 2021.
Los criterios de inclusión fueron: a) antecedentes de BRI durante un mínimo de 2 años, con una FEVI > 50% en el momento del diagnóstico; b) ritmo sinusal; c) FEVI <40% en la primera evaluación previa al inicio del tratamiento médico; d) ingreso por IC o clase funcional de la New York Heart Association (NYHA) ≥ 2, y e) ausencia de otras causas identificables de miocardiopatía, como valvulopatía mitral o aórtica grave. Los criterios de exclusión fueron los siguientes: a) pacientes menores de edad; b) pérdida del seguimiento durante el proceso de ajuste individualizado de la medicación, y c) falta de información sobre la FEVI del paciente en la situación inicial o al final del periodo de estudio.
Personal especializado de la unidad de IC se encargó del seguimiento ambulatorio de los pacientes tras el alta hospitalaria o después de la primera consulta de evaluación. La vigilancia de los eventos clínicos y el ajuste del tratamiento neurohormonal según lo establecido en las guías de práctica clínica hasta las dosis máximas pretendidas de cada fármaco o hasta la dosis máxima tolerada por el paciente corrieron a cargo de personal médico y de enfermería especializado.
Del estudio etiológico de la miocardiopatía se ocuparon cardiólogos especialistas por medio de la información de la historia clínica, los parámetros analíticos, los electrocardiogramas, la ecocardiografía transtorácica, la resonancia magnética cardiaca (RMC) y la coronariografía, entre otros.
Los criterios electrocardiográficos utilizados para diagnosticar el BRI fueron la duración del QRS > 130ms, la ausencia de onda Q en las derivaciones I, V5 y V6, la onda R monomórfica en las derivaciones I, V5 y V6, y la desviación del segmento ST y la onda T en sentido contrario al de la desviación principal del complejo QRS12, y cada uno de ellos fue evaluado por un electrofisiólogo (MRM).
La FEVI se evaluó en la situación inicial y al final del periodo de ajuste de dosis de la medicación con el método de biplano de Simpson mediante ecocardiografía transtorácica o RMC en los pacientes con una ventana acústica subóptima para una cuantificación adecuada de los volúmenes ventriculares. Esto se hace de manera sistemática en nuestro centro a los 3 meses del primer contacto médico, para evaluar la posible conveniencia de una derivación a TRC/estimulación fisiológica.
La información sobre los antecedentes personales y las comorbilidades se obtuvo de la historia clínica electrónica de cada paciente. Los parámetros analíticos registrados fueron los obtenidos en los análisis de sangre realizados para la primera consulta.
Todos los pacientes están incluidos en un registro cuyo protocolo ha sido aprobado por el comité de ética de nuestro hospital. Se obtuvo el consentimiento informado de los pacientes que participaron en el estudio.
Tratamiento médico recomendado por la guíaEl TMRG reconocido por la guía de insuficiencia cardiaca con fracción de eyección reducida de la Sociedad Europea de Cardiología en el momento de realizar el estudio consistía en bloqueadores beta, IECA/ARA-II/INRA y ARM ± inhibidores de SGLT2. Todas las evaluaciones del TMRG se llevaron a cabo 12 meses después de la inclusión del paciente en el registro. Para cada medicación, el inicio se definió como el momento de comienzo del tratamiento en los pacientes que no estaban siendo tratados en el momento de la inclusión. La escalada de dosis se definió como un aumento hasta una dosis diaria media al menos un 10% superior a la dosis diaria media en el momento de la inclusión en el estudio de los pacientes que estaban tomando una dosis inferior a la pretendida al inicio o un cambio del tratamiento con IECA/ARA-II a INRA. El logro de la dosis pretendida se definió como un aumento hasta una dosis igual o superior a la dosis diaria recomendada en la guía para los pacientes que estaban tomando una dosis inferior a la pretendida en el momento de la inclusión. Se clasificó a los pacientes como en TMRG si se había documentado la medicación entre los electrocardiogramas durante al menos 90 días.
Análisis estadísticoLas variables cualitativas se presentan en forma de porcentajes y las variables continuas en forma de media ± desviación estándar o mediana [intervalo intercuartílico]. Las comparaciones de los grupos se realizaron con la prueba de la χ2 de Pearson y la prueba exacta de Fisher para las variables cualitativas. Para las variables continuas se utilizó la prueba de la t de Student y la prueba de Mann-Whitney no paramétrica y la regresión lineal multivariante tras haber determinado que la distribución era normal con la prueba de Kolmogorov-Smirnov. La significación estadística se estableció en un valor de p <0,05. Los datos se registraron en Microsoft Excel 2016 y los análisis estadísticos y gráficos se realizaron con el programa informático Stata/IC versión 16.1 (StataCorp, Estados Unidos).
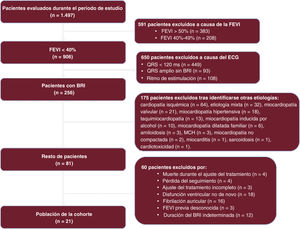
RESULTADOSEntre enero de 2020 y diciembre de 2021, se evaluó a un total de 1.497 pacientes del servicio ambulatorio de IC. De ellos, 854 tenían un QRS <130 ms; 314, BRI; 162, ritmo de marcapasos y 168, QRS ancho sin BRI. Solo 21 pacientes con BRI cumplieron los criterios de inclusión en el estudio, y en 10 de ellos el evento inicial fue un ingreso por IC (figura 1). Las características basales y analíticas y el porcentaje de pacientes tratados con cada una de las medicaciones analizadas se muestran en la tabla 1.
Características basales de la población del estudio
| Características basales | |
| Edad (años) | 67,9±13,0 |
| Mujeres | 12 (57,1) |
| IMC | 29,9±3,7 |
| Hipertensión | 13 (61,9) |
| Dislipemia | 10 (47,6) |
| Diabetes mellitus | 7 (33,3) |
| ERC | 5 (23,8) |
| Ictus/AIT | 3 (13,3) |
| EPOC | 1 (4,8) |
| EAP | 1 (4,8) |
| Variables del análisis de sangre | |
| Hemoglobina (g/dl) | 14,0±1,2 |
| TFG (ml/min/1,73 m2) | 66,9±23,1 |
| Sodio (mEq/l) | 139,6±2,2 |
| Potasio (mEq/l) | 4,5±0,6 |
| Triglicéridos (mg/dl) | 97,3±58,3 |
| LDL (mg/dl) | 96,2±39,7 |
| Albúmina (g/dl) | 4,3±0,4 |
| HbA1c | 5,9±0,8 |
| Medicación después de ajuste de dosis | |
| BB | 21 (100) |
| INRA | 20 (95,2) |
| IECA | 1 (4,8) |
| ARM | 17 (80,9) |
| iSGLT2 | 9 (42,9) |
| Diuréticos | 7 (33,3) |
AIT: accidente isquémico transitorio; ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; EAP: enfermedad arterial periférica; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; iSGLT2: inhibidores del cotransportador 2 de sodio y glucosa; LDL: lipoproteínas de baja densidad; TFG: tasa de filtrado glomerular.
Los valores expresan n (%) o media ± desviación estándar.
Para completar el estudio etiológico, se llevó a cabo como mínimo 1 ecocardiografía transtorácica en todos los pacientes, mientras que en 4 se realizó 1 coronariografía, que no mostró signos de lesiones coronarias significativas en ninguno de ellos. Se realizó una RMC en 19 pacientes, de los que 11 no presentaron realce tardío de gadolinio (RTG); 6 mostraron RTG en la inserción ventricular derecha basal (signo inespecífico) y 1, un patrón septal intramiocárdico y en ambas inserciones septales del ventrículo derecho.
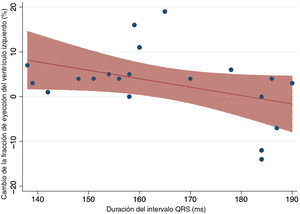
El promedio de tiempo transcurrido entre el primer diagnóstico de BRI y la primera consulta fue de 4,05±4,1 años. La media de duración del QRS en la primera consulta fue de 163,7 ± 17,2ms, con un eje de -3,6° y una media de duración del QTc de 478,7ms. Hubo una tendencia a una disminución de la respuesta al tratamiento farmacológico en los pacientes con un QRS más largo, si bien esto no alcanzó la significación estadística (r=-0,4128; p=0,07) (figura 2).
Después de una mediana de seguimiento de 8,3 [7,0-14,3] meses, hubo una reducción de las concentraciones de la fracción aminoterminal del propéptido natriurético cerebral, que pasaron de una mediana de 1.081 [651,5-2.619] pg/ml en la primera consulta a 383 [169-1.084] pg/ml (p=0,027). Sin embargo, esto no comportó un cambio significativo en la clase de la NYHA (1,91±0,46 en la situación inicial frente a 1,81±0,53 al final del ajuste del tratamiento; p=0,542). La mejora absoluta de la FEVI fue de 3,12±2,27% (del 29,5±5,7% al 32,7%±8,5%; p=0,172) y la media de reducción del volumen telediastólico del VI fue de 17,5 ± 39,9ml (de 189,5 ± 69,7 a 172,0 ± 43,7ml; p=0,055). Ningún paciente alcanzó la normalización de la FEVI (FEVI > 50%), 2 mantuvieron un valor estable y 3 presentaron un empeoramiento (figura 3). Se llevó a cabo un análisis multivariante secundario con la inclusión de la FEVI y el seguimiento del volumen telediastólico inicial, el tratamiento médico y la duración de ese; la FEVI previa al tratamiento y la duración del tratamiento farmacológico no mostraron una asociación significativa con la mejora de la FEVI (el -0,52% por cada 1% de aumento de la FEVI previa al tratamiento; intervalo de confianza del 95% [IC95%], -1,64 a +0,60; p=0,323; y un -0,41% por cada mes de seguimiento; IC95%, -1,90 a +1,08; p=0,548).
Ilustración central. Cambio en la FEVI de los pacientes tras el ajuste del tratamiento farmacológico a lo establecido por la guía para el tratamiento médico y porcentaje de pacientes tratados con cada fármaco. ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; MCPI-BRI: miocardiopatía inducida por bloqueo de rama izquierda; MSC: muerte súbita cardiaca; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association.
Durante el seguimiento, 2 pacientes ingresaron en el hospital a causa de una descompensación de la IC. Un paciente fue hospitalizado durante el periodo de ajuste del tratamiento y el otro, varios meses después de finalizado este periodo en el contexto de fibrilación auricular y respuesta ventricular rápida, y fue remitido para ablación percutánea.
Tras el ajuste del tratamiento farmacológico, se implantaron dispositivos de TRC-desfibrilador a 7 pacientes (33,3%) y un dispositivo de TRC a 1 (4,8%). Todas las intervenciones se realizaron con éxito y no hubo ninguna complicación durante el implante del dispositivo. Solo 1 paciente sufrió infección de la herida del marcapasos en los meses siguientes al implante. De los demás, 2 rechazaron el implante del dispositivo, 3 estaban pendientes de decisión, 3 no eran candidatos adecuados a causa de las comorbilidades, 3 no cumplían los criterios para la TRC a causa de una FEVI > 40%, 1 no cumplía los criterios tras la mejoría a NYHA I y 1 paciente sufrió muerte súbita antes de que se tomara una decisión.
Tras una mediana de 8,7 [5,9-9,4] meses desde el implante del dispositivo de TRC, la mejora observada en la media de la FEVI en el grupo con implante de dispositivo fue del 18,1±6,4% (p=0,003) (figura 4) y la reducción del volumen telediastólico fue de 37,4±23,7ml (p=0,003).
DISCUSIÓNNuestro estudio resalta la probable mala respuesta al TMRG óptimo de los pacientes con una disfunción ventricular de novo secundaria a una asincronía producida por BRI avanzado de larga evolución. Tras el ajuste del tratamiento farmacológico, no se observó una mejoría significativa de la clase funcional, el volumen telediastólico o la FEVI de los pacientes. De hecho, ningún paciente mostró recuperación de la FEVI tras el ajuste del tratamiento farmacológico y 3 presentaron un empeoramiento de la FEVI al final del proceso. Es importante señalar que se produjo la muerte súbita cardiaca de 1 paciente durante el periodo de ajuste del tratamiento. En cambio, hubo una mejora significativa de la FEVI y una reducción del volumen telediastólico en los pacientes derivados a TRC.
AntecedentesUno de los principales problemas de este estudio es la dificultad para identificar a los pacientes con MCPI-BRI. Esta entidad no se ha incluido formalmente en las miocardiopatías no clasificadas ni en las formas adquiridas/no genéticas de miocardiopatía dilatada, y los criterios utilizados son diferentes en función de la definición empleada. Por consiguiente, suele tratarse de un diagnóstico de exclusión tras haber descartado otras posibles etiologías y haber evaluado la respuesta del paciente a la TRC. En los últimos años, Sanna et al.13 propusieron unos criterios diagnósticos basados en los parámetros clínicos, genéticos, ecocardiográficos y de RMC, que diferencian las características de los pacientes con MCPI-BRI. En nuestro estudio, tan solo 1 de los 19 pacientes explorados por RMC para completar el estudio etiológico presentó un patrón de RTG septal intramiocárdico; en los demás no hubo RTG. La RMC es clave para los pacientes con miocardiopatía dilatada, no solo para identificar algunas etiologías con patrones de RTG característicos, sino también para identificar a los pacientes que pueden responder mejor a la TRC y a los que tienen un mayor riesgo de muerte súbita cardiaca. Los pacientes con mayor cociente de grosor diastólico lateral/septal y un engrosamiento de la pared lateral pueden presentar una mayor respuesta a la TRC, y estos parámetros podrían ser indicadores de la secuencia temporal del BRI y la miocardiopatía14.
La MCPI-BRI se describió por primera vez hace más de una década, tras la publicación de los primeros ensayos con tratamientos de TRC en pacientes con IC. Se observó que un subgrupo de los pacientes con miocardiopatía dilatada no isquémica y BRI presentaban una hiperrespuesta a la TRC y alcanzaban una recuperación funcional plena junto con normalización de la FEVI. Estos resultados apuntaban a que la asincronía causada por el BRI podía ser la causa etiológica de la miocardiopatía6,11. Vernooy et al.15 observaron un empeoramiento de la FEVI, un aumento del volumen de la cavidad del VI y un aumento de la masa de la pared lateral del VI en un modelo animal con 8 perros para evaluar los efectos del BRI en la función cardiaca. El mecanismo fisiopatológico se basa en el bloqueo de la conducción en el sistema de Purkinje, que causa una disincronía mecánica debida a una contracción más temprana de la pared libre y el tabique interventricular del ventrículo derecho respecto a la de la pared lateral del VI. Esta disincronía y el desequilibrio de las presiones intraventriculares conducen a una disfunción de la microcirculación septal y afectan no solo a la función sistólica, con un aumento del volumen del VI y una disminución de la FEVI, sino también a la función diastólica del VI, lo que causa un acortamiento del llenado ventricular y contribuye, por lo tanto, al remodelado cardiaco16,17.
A lo largo de las últimas 2 décadas se han publicado varios ensayos clínicos que han demostrado los efectos beneficiosos de la TRC por lo que respecta a la reducción de las hospitalizaciones por IC y la mortalidad de los pacientes con FEVI <35% y un BRI > 130ms18–20. De hecho, en la versión más reciente de la guía clínica se incluye con un nivel de evidencia A I el implante de un dispositivo de TRC para los pacientes con IC sintomáticos, en ritmo sinusal y con FEVI <35%, QRS > 150ms y una morfología del QRS de BRI a pesar del tratamiento médico óptimo, con objeto de aliviar los síntomas y reducir la morbilidad y la mortalidad8,21. Por lo que respecta al momento óptimo para indicar la TRC/estimulación fisiológica, el estudio NEOLITH evaluó la respuesta de la FEVI al TMRG a los 3 meses y la TRC temprana en el BRI relacionado con una miocardiopatía dilatada no isquémica idiopática. La mejora de la FEVI después del TMRG en el grupo de BRI fue del 3,3%±10,7%, con una superrespuesta a la TRC en un 35% de los participantes con BRI, que se definió por una FEVI ≥ 50% después de la TRC22. En una cohorte retrospectiva de 123 pacientes con MCPI-BRI de reciente aparición a los que se implantó un dispositivo de TRC, el ensayo NEOLITH II comparó las diferencias de pronóstico clínico y ecocardiográfico en función del tiempo transcurrido desde el diagnóstico hasta la TRC (≤ 9 meses frente a > 9 meses). Los resultados clínicos fueron similares en los 2 grupos, pero la mejora de la FEVI hasta un valor > 35% fue más probable en los pacientes con implante en un periodo ≤ 9 meses23. En el subgrupo de pacientes con MCPI-BRI, Vaillant et al.5 demostraron en 6 pacientes que el implante de un dispositivo de TRC produjo una mejoría significativa de la clase funcional de la NYHA, una normalización de las dimensiones del VI, una casi desaparición de la disincronía mecánica y una mejora de la FEVI (que pasó del 31 ± 12 al 56 ± 8%). Con los tratamientos de estimulación fisiológica también se ha mostrado una eficacia en la mejora de la FEVI en los pacientes con MCPI-BRI, y podría ser una alternativa a la TRC convencional24,25. Sin embargo, el TMRG, y no la TRC, es el tratamiento de primera línea para los pacientes con FEVI reducida y BRI, a pesar de que hay pocos datos sobre cómo responden al TMRG los pacientes con FEVI reducida y BRI. La guía actual recomienda un mínimo de 3 meses de TMRG antes del implante de TRC, con la esperanza de que el tratamiento médico por sí solo mejore la FEVI. No obstante, conviene resaltar que ninguno de los ensayos clínicos principales que respaldan el tratamiento médico utilizó una estratificación de los análisis en función de la presencia o ausencia de BRI ni presentó la morfología del QRS como característica clínica inicial que considerar26–36. Es importante señalar que no hay datos relativos a los INRA y la MCPI-BRI. Aunque se basa en un pequeño número de pacientes, el 95,7% de nuestra población estaba en tratamiento con INRA y no se observaron diferencias notables en cuanto a la mejora de la FEVI. En cambio, hubo una proporción importante de pacientes no tratados con iSGLT2 debido al cambio en las recomendaciones de la guía de práctica clínica publicada durante el periodo de estudio.
Trascendencia clínicaLa MCPI-BRI es una enfermedad infrecuente37 y es probable que se infradiagnostique. En la mayor parte de los casos, su diagnóstico se establece de manera retrospectiva y tras la exclusión de otras posibles causas de la miocardiopatía. La baja prevalencia y la falta de unos criterios establecidos para el diagnóstico temprano dificultan la realización de estudios prospectivos para analizar la respuesta a diferentes estrategias terapéuticas con controles y un tamaño muestral suficiente. Sin embargo, con los resultados del presente estudio y la evidencia de una respuesta excelente a la TRC con beneficios clínicos y pronósticos a corto y a largo plazo, es posible que los pacientes con MCPI-BRI puedan obtener un beneficio con una estrategia temprana de TRC o estimulación del BRI, ya que estos son los únicos tratamientos con los que se ha demostrado hasta ahora una mejora clínicamente trascendente en ese perfil de pacientes. Un retraso en el implante de estos dispositivos podría implicar una importante pérdida de tiempo en detener la progresión de la enfermedad. Es importante señalar que, como en nuestra muestra, hay un posible riesgo de muerte súbita cardiaca (1 entre 21 pacientes).
LimitacionesEste estudio tiene ciertas limitaciones. En primer lugar, se trata de un estudio observacional retrospectivo, sin grupo de control, en el que se realizaron análisis de comparación pre-post en un solo grupo de pacientes, con todos los posibles sesgos inherentes a este tipo de diseño. Además, para poder analizar la respuesta al tratamiento farmacológico e incluir prospectivamente a los pacientes, la respuesta a la TRC no se tomó como criterio para la MCPI-BRI; en consecuencia, las características de los pacientes de este estudio podrían diferir ligeramente de las de otros estudios en los que se ha analizado este trastorno. El estudio genético solo se pudo llevar a cabo en una pequeña parte de los pacientes. La empagliflozina y la dapagliflozina se recomiendan actualmente para el tratamiento de la IC con fracción de eyección reducida, según la actualización de los últimos 5 años de la Sociedad Europea de Cardiología. En nuestro estudio, varios pacientes completaron el periodo de ajuste del tratamiento antes de la publicación de esta guía, y este es el motivo de que solo el 43% de ellos estuvieran en tratamiento con inhibidores de SGLT2. Aunque esto constituye una limitación del presente estudio, el resto de los elementos clave del tratamiento de la IC se optimizaron al máximo, de tal manera que un 100% de nuestros pacientes estaban en tratamiento con bloqueadores beta; el 95%, con INRA y el 80%, con ARM a las dosis máximas toleradas. En nuestro centro, por protocolo, el intervalo entre el implante del dispositivo y la realización de la ecocardiografía es de 6 meses, mientras que el periodo de ajuste del tratamiento es de 3 meses. En consecuencia, hay una diferencia de 3 meses entre un periodo y el otro, lo cual puede haber implicado una sobrestimación de la respuesta a la TRC respecto a la obtenida con el TMRG. Aunque la miocardiopatía inducida por BRI es un trastorno infrecuente, el pequeño tamaño de la muestra no permite extraer conclusiones definitivas acerca de los efectos del tratamiento médico y la TRC en este grupo de pacientes. Serán necesarios nuevos estudios prospectivos, aleatorizados y con un mayor tamaño muestral para confirmar las hipótesis generadas.
CONCLUSIONESEl TMRG —que incluye bloqueadores beta, ARM, IECA/ARA-II/INRA ± inhibidores de SGLT2— parece ser ineficaz para mejorar la FEVI y la clase funcional de los pacientes con IC de novo y MCPI-BRI. La TRC puede dar mejores resultados que el TMRG para mejorar y recuperar la FEVI de los pacientes con MCPI-BRI, por lo que se podría considerar el implante temprano de TRC como estrategia razonable para este subgrupo de pacientes.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores del estudio han participado en el diseño, la obtención o el análisis y la interpretación de los datos, la redacción del texto o la corrección final del texto presentado.
CONFLICTOS DE INTERESESEsta investigación no contó con ninguna subvención específica de organismos del sector público, privado o sin ánimo de lucro. Los autores declaran no tener ningún conflicto de intereses.
- –
La miocardiopatía inducida por bloqueo de rama izquierda es un trastorno infrecuente caracterizado por una hiperrespuesta a la terapia de resincronización cardiaca. Sin embargo, la evidencia relativa al efecto del tratamiento médico en este grupo de pacientes es escasa, a pesar de que constituye el primer paso del tratamiento para todos los pacientes con insuficiencia cardiaca y FEVI <40%.
- –
Este es uno de los primeros estudios en que se ha analizado y presentado la hipótesis de que el nuevo tratamiento médico recomendado por la guía mediante los nuevos grupos farmacológicos para la IC no sería eficaz para mejorar la FEVI o la clase funcional de los pacientes con MCPI-BRI, ya que no son capaces de corregir la asincronía intraventricular generada por el BRI.