Bosentán ha demostrado eficacia en el tratamiento de la hipertensión pulmonar a corto plazo. Sus efectos después de 2-3 años son poco conocidos. Nuestro objetivo es analizar la eficacia y la seguridad a largo plazo (5 años) del bosentán en los pacientes tratados en nuestra unidad.
MétodosSe analizaron en forma retrospectiva y secuencial diversos parámetros clínicos, funcionales y analíticos en una serie unicéntrica de pacientes tratados con bosentán en monoterapia desde 2002 hasta 2009. El éxito terapéutico se definió como supervivencia sin eventos clínicos o deterioro que requiriese adición de otros vasodilatadores pulmonares.
ResultadosLa serie incluye a 20 pacientes (el 70% mujeres; media de edad, 46±14 años; el 65% con cardiopatías congénitas), con una mediana de seguimiento de 64 meses. A corto plazo, se observó una mejoría significativa de parámetros hemodinámicos, clínicos y funcionales, que en los dos últimos se mantuvo a los 5 años. La supervivencia total a 5 años fue del 95% (84-100%). El éxito terapéutico se mantuvo a 1, 2, 3, 4 y 5 años en el 95% (84-100%), el 83% (65-100%), el 78% (58-98%), el 61% (38-84%) y el 41% (16-66%), respectivamente. El grupo con mejor evolución a largo plazo se caracterizó por cifras de NT-proBNP al año < 400 pg/ml (p=0,013).
ConclusionesEn esta serie, el éxito terapéutico obtenido con bosentán en monoterapia se mantuvo en el 78% a 3 años y en el 41% a 5 años. El grupo con éxito a largo plazo mostró valores más bajos de NT-proBNP al año del tratamiento. La supervivencia a 5 años fue del 95%.
Palabras clave
La hipertensión pulmonar está presente en múltiples situaciones clínicas y ha sido clasificada en cinco grupos1. Los pacientes de los grupos 1 —«hipertensión arterial pulmonar» (HAP)— y 3 —«hipertensión pulmonar tromboembólica crónica» (HTPTEC)— sin posibilidad de endarterectomía son subsidiarios de tratamiento con vasodilatadores pulmonares, que han conseguido mejorar la supervivencia y la calidad de vida de estos pacientes2, 3.
La endotelina 1 es un péptido secretado por el endotelio pulmonar que favorece la vasoconstricción y la mitosis celular y produce el aumento de las resistencias vasculares pulmonares (RVP). Sus concentraciones están aumentadas en los pacientes con HAP. El bosentán es un inhibidor no selectivo de los receptores A y B de la endotelina que, en estudios a corto plazo frente a placebo, produjo una mejoría de la capacidad funcional y la distancia recorrida en el test de 6 minutos de marcha (T6M)4, 5. Sus beneficios clínicos se han demostrado en grupos específicos como HAP idiopática6, enfermedades del tejido conectivo7, HTPTEC8 y cardiopatías congénitas (CC)9. Entre sus virtudes, que comparte con el sildenafilo, se encuentran la comodidad de su administración oral y el perfil favorable de efectos adversos. Por ello se utiliza como fármaco de primera línea en pacientes con HAP moderadamente sintomática, clásicamente clase funcional III, a los que posteriormente se incorporó la clase II10.
En la mayoría de los estudios con bosentán, la media de seguimiento ha sido inferior a 1 año4, 5, 7, 8, 9. Son escasas las publicaciones dirigidas a conocer si su efecto beneficioso es prolongado, y el seguimiento en ningún caso supera los 3 años11, 12, 13, 14, 15. La cuestión tiene gran relevancia, pues habitualmente el tratamiento de estos pacientes debe mantenerse durante largo tiempo, en general de por vida.
Existen antecedentes de desarrollo de tolerancia al beneficio clínico de los vasodilatadores pulmonares. Con beraprost, un análogo de la prostaciclina activo por vía oral, se demostró que el beneficio obtenido a los 6 meses no se mantenía en el seguimiento posterior a 1 año, lo que motivó el abandono de su utilización en nuestro medio16.
La posible pérdida de efecto del bosentán a largo plazo (> 3 años), ya sea por tolerancia al fármaco o progresión de la enfermedad de base, no se ha investigado.
Nuestro objetivo es analizar la eficacia y la seguridad a largo plazo (5 años) del tratamiento con bosentán en monoterapia en los pacientes remitidos a nuestra unidad, así como identificar factores asociados a buena respuesta persistente.
MétodosPoblaciónSe incluyó a todos los pacientes con diagnóstico de HAP o HPTEC (grupos 1 y 3 de la clasificación de Dana Point) grave, en clase funcional II-III de la Organización Mundial de la Salud, que iniciaron tratamiento con bosentán como monoterapia entre 2002 y 2009. El diagnóstico se realizó mediante cateterismo derecho, con objetivación de una presión arterial pulmonar (PAP) media basal > 45 mmHg en reposo. Se excluyó a los pacientes a los que se añadió bosentán ante el fracaso del tratamiento con otros vasodilatadores pulmonares (3 casos) o cuando se iniciaron simultáneamente bosentán y otro vasodilatador pulmonar (4 casos).
Protocolo de seguimientoSe registraron clase funcional, distancia recorrida en el T6M y parámetros ecocardiográficos y analíticos, incluida la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP). Los datos fueron recogidos en situación basal y cada 6 meses durante el tratamiento. Se realizó cateterismo derecho en situación basal y a los 3 meses del tratamiento, con registro de presión en aurícula derecha, PAP sistólica, diastólica y media, presión capilar pulmonar, gasto, índice cardiaco y RVP.
Todos los pacientes firmaron un consentimiento informado antes de iniciar el tratamiento con bosentán. La dosis administrada al inicio fue de 62,5 mg cada 12 h, y tras 4 semanas se incrementaba hasta 125 mg cada 12 h. Se realizó una analítica mensual con parámetros de función hepática para monitorizar la aparición de posibles efectos adversos del tratamiento.
Variables de desenlaceDefinimos el fracaso del tratamiento con bosentán como el deterioro clínico, habitualmente consistente en empeoramiento de la clase funcional, con necesidad de adición de otro vasodilatador pulmonar por insuficiente control de síntomas en monoterapia, ingresos por causas relacionadas con HAP, trasplante o fallecimiento por cualquier causa.
Análisis estadísticoLas variables numéricas se expresan como media±desviación estándar en el caso de variables con distribución normal o mediana (mínimo-máximo) en caso contrario. Con respecto a la variable clase funcional, si bien es una variable ordinal, se analizó también como variable continua, debido a que permite expresar situaciones intermedias entre las diferentes categorías y seguir mejor los cambios en el tiempo.
Para realizar comparaciones entre las medidas repetidas en el tiempo, en el caso de variables con distribución normal utilizamos ANOVA de medidas repetidas y en el resto, ANOVA no paramétrico con la prueba de Friedman. La supervivencia al final del seguimiento y la supervivencia libre de fracaso del tratamiento se representan mediante las curvas de Kaplan-Meier. A efectos de análisis de supervivencia y otros datos clínicos, para evitar el sesgo de selección que supondría incluir sólo a los pacientes con bosentán en monoterapia, se incluyeron los datos de todos los pacientes vivos, independientemente de que hubieran necesitado modificaciones en su tratamiento. De esta manera, el seguimiento de los pacientes finalizaba cuando ocurría la muerte, aunque en los pacientes se hubiera añadido terapia combinada. Por otro lado, en el análisis actuarial del fracaso de tratamiento, los pacientes terminaban el seguimiento al añadir otro fármaco.
Con el fin de identificar variables asociadas a buena respuesta a largo plazo en monoterapia con bosentán, se compararon las características basales y evolutivas de los pacientes con éxito terapéutico a lo largo del seguimiento con los que sufrieron muerte o deterioro clínico a pesar del tratamiento. También se compararon las características de los pacientes con CC con las de los que tenían HTPTEC.
En todos los casos, la significación estadística se estableció en p<0,05.
ResultadosCaracterísticas basales de los pacientesLas características basales de los pacientes (n=20) incluidos en el estudio se muestran en la Tabla 1.
Tabla 1. Características basales de los pacientes (n=20)
| Edad al inicio de bosentán (años) | 46,2±14 |
| Mujeres | 14 (70) |
| Etiología | |
| Shunt sistemicopulmonar | 13 (65) |
| Tromboembolia pulmonar crónica | 5 (25) |
| Esclerosis sistémica | 1 (5) |
| Virus de la inmunodeficiencia humana | 1 (5) |
| Tratamiento concomitante | |
| Oxígeno domiciliario | 12 (60) |
| Anticoagulación oral | 17 (85) |
| Diuréticos | 13 (65) |
| Antagonistas del calcio | 3 (15) |
| Espironolactona | 6 (30) |
| Digital | 6 (30) |
| IECA/ARA-II | 6 (30) |
| Sangrías | 2 (10) |
| Clase funcional | |
| I | 0 |
| II | 3 (15) |
| III | 17 (85) |
| IV | 0 |
| Distancia recorrida en 6min (m) | 314±66 |
| NT-proBNP (pg/ml) | 677,5 (26-4.734) |
| Parámetros ecocardiográficos | |
| Presión sistólica arteria pulmonar (mmHg) | 92±34 |
| Parámetros hemodinámicos | |
| Presión media aurícula derecha (mmHg) | 9±4 |
| Presión sistólica arteria pulmonar (mmHg) | 102±19 |
| Presión media arteria pulmonar (mmHg) | 70,5±17 |
| Presión capilar pulmonar (mmHg) | 12±4 |
| Gradiente transpulmonar (mmHg) | 56±14 |
| Gasto cardiaco (l/min) | 4,1±1 |
| Índice cardiaco (l/min/m2) | 2,5±1 |
| Resistencia vascular pulmonar (UW) | 15±5 |
ARA-II: antagonistas selectivos del receptor AT1 de la angiotensina II; IECA: inhibidores de le enzima de conversión de la angiotensina.
Los datos expresan n (%), media±desviación estándar o mediana (mínimo-máximo).
La enfermedad congénita con shunt sistemicopulmonar estaba presente en 13 casos (8 pacientes con comunicación interventricular, 3 con comunicación interauricular y 2 con persistencia de ductus arterioso permeable). Los pacientes con HAP comenzaron monoterapia con bosentán a una edad más joven que los del grupo de HTPTEC (41,7±9 frente a 62,8±13,3; p=0,001).
Los datos funcionales (314±66 m en el T6M) y los parámetros hemodinámicos basales (RVP 15±5 UW) reflejan, en general, una población con HAP avanzada y mal pronóstico.
En el ecocardiograma basal todos los pacientes mostraban algún grado de insuficiencia tricuspídea (el 80% en grados I y II).
Parámetros de eficacia del tratamientoDe los 20 pacientes incluidos, en 1 se interrumpió el tratamiento al mes del inicio por síncopes recidivantes. La mediana del seguimiento fue de 64 (13-96) meses.
Efecto a corto plazo (3-6 meses): parámetros clínicos y hemodinámicosLa evolución de los parámetros clínicos se muestra en la Tabla 2. En la evaluación inicial, el 90% de los pacientes se encontraban en clase funcional III. Este parámetro experimentó un cambio significativo tras iniciar el tratamiento con bosentán, ya que registramos la mejoría de un grado de clase funcional en el 74% de los pacientes (14 de ellos pasaron de clase funcional III a II en la evaluación de los 6 meses; 3 permanecían en clase funcional III y los 2 que estaban en clase funcional II la mantuvieron).
Tabla 2. Evolución de los distintos parámetros
| Basal | 6 meses | 1 año | 2 años | 3 años | 4 años | 5 años | p | |
| Clase funcional | 2,8±0,3 | 2,1±0,3 | 1,9±0,4 | 2±0,5 | 2±0,5 | 2,2±0,4 | 2,3±0,5 | < 0,001 |
| T6M (m) | 314±66 | 332±76 a | 363±76 | 361±73 | 360,7±72 | 351,2±94 | 351,6±124 | 0,003 |
| NT-proBNP (pg/ml) | 667 (26-4.734) | 1.050 (43-4.300) | 280 (25-4.590) | 957 (69-7.978) | 858 (98-9.433) | 267 (88-3.551) | 1.644 (87-5.612) | 0,37 |
| PAPS (mmHg) | 92±34 | 98±40 | 98±38 | 89±36 | 90±43 | 87,7±37 | 90±21 | 0,21 |
PAPS: presión arterial pulmonar sistólica estimada por ecografía; T6M: test de 6 minutos de marcha.
Los datos expresan media±desviación estándar o mediana (mínimo-máximo).
a Sin significación estadística respecto del valor basal.
Con respecto a los parámetros hemodinámicos (Tabla 3), objetivamos una reducción significativa del gradiente transpulmonar y de las RVP y un aumento del gasto cardiaco.
Tabla 3. Parámetros hemodinámicos en situación basal y tras 3 meses de tratamiento
| Parámetros hemodinámicos (n=19) | Basal | 3 meses | p |
| Presión aurícula derecha (mmHg) | 9±4 | 9±8 | 0,9 |
| Presión sistólica de la arteria pulmonar (mmHg) | 102±19 | 100±25 | 0,7 |
| Presión arteria pulmonar (mmHg) | 70,5±17 | 64±17 | 0,9 |
| Presión capilar pulmonar (mmHg) | 12±4 | 14±7 | 0,2 |
| Gradiente transpulmonar (mmHg) | 56±14 | 50±17 | 0,01 |
| Gasto cardiaco (l/min) | 4,1±1 | 4,7±1 | 0,04 |
| Índice cardiaco (l/min/m2) | 2,5±1 | 2,8±1 | 0,08 |
| Resistencia vascular pulmonar (UW) | 15±5 | 11±5 | 0,001 |
Los datos expresan media±desviación estándar.
Parámetros clínicos y funcionales:
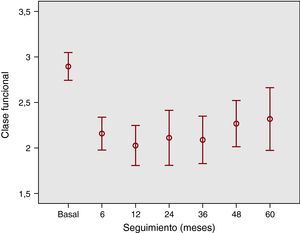
• La mejoría alcanzada a corto plazo se mantuvo de forma significativa a lo largo del seguimiento (Figura 1). Si expresamos la clase funcional numéricamente, la basal era 2,8±0,3, 1,9±0,4 al año; 2±0,5 a los 3 años y 2,3±0,5 a los 5 años (p<0,001 respecto del valor basal en todos los casos).
Figura 1. Evolución de la clase funcional. Se observa que la clase funcional basal de los pacientes (2,8±0,3) mejora en forma significativa a los 6 meses y se mantiene en el seguimiento a 1, 2, 3, 4 y 5 años.
• T6M: registramos una mejoría significativa en la distancia recorrida en el T6M a lo largo del seguimiento. El aumento en los metros recorridos se evidenció a partir del año y permaneció significativamente mayor (p=0,003) respecto del valor basal en los pacientes que continuaban el seguimiento a 2, 3, 4 y 5 años. El aumento medio de los metros recorridos respecto a la situación basal a 1, 2, 3, 4 y 5 años fue de 49, 48, 47, 38 y 38 m respectivamente. La capacidad de esfuerzo medida en el T6M fue significativamente mejor en el grupo de HAP que en el de HTPTEC a los 3 (378±66 frente a 278±31; p=0,02) y 5 años (417±66 frente a 220±111; p=0,01).
• NT-proBNP: en nuestra serie, las cifras de NT-proBNP mostraron una gran dispersión. Respecto a los valores de la evaluación inicial, no se observaron diferencias estadísticamente significativas en el seguimiento.
Parámetros ecocardiográficos: en todos los pacientes se registró en el estudio basal algún grado de insuficiencia tricuspídea, que permitía estimar la PAP sistólica. El valor medio de la estimación ecocardiográfica de la PAP sistólica en situación basal fue 92±34mmHg, similar al obtenido mediante cateterismo. No se registraron diferencias significativas en esta variable durante el seguimiento a pesar de la mejoría en la clínica de los pacientes. Tampoco varió de forma significativa el grado de insuficiencia tricuspídea durante la evolución.
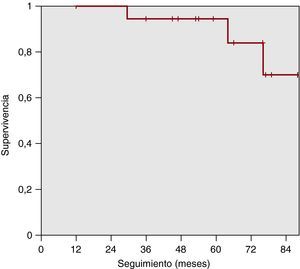
Supervivencia total y supervivencia libre de fracaso terapéutico de bosentánCon un seguimiento mediano de 64 meses, hubo 3 muertes a los 29, 64 y 75 meses respectivamente, 2 de ellas por progresión de la enfermedad y 1 por shock séptico, aunque el paciente se encontraba también en una situación terminal de su enfermedad (Figura 2). Estos pacientes habían presentado previamente un deterioro clínico que llevó a la adición de otro fármaco vasodilatador —a los 23, 41 y 53 meses respectivamente— para alcanzar nueva estabilidad. Destaca que la supervivencia actuarial de los pacientes fue del 95% (84-100%) a 5 años y del 70% (30-100%) a 7 años.
Figura 2. La supervivencia actuarial de los pacientes es del 95% (84-100%) a 5 años y del 70% (30-100%) a 7 años.
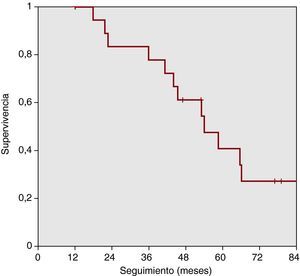
Con respecto a la supervivencia libre de eventos o deterioro que requiriera cambios en el tratamiento (fracaso de bosentán), la Figura 3 muestra la evolución. El éxito terapéutico del bosentán en monoterapia a 1, 2, 3, 4 y 5 años fue del 95% (84-100%), el 83% (65-100%), el 78% (58-98%), el 61% (38-84%) y el 41% (16-66%) respectivamente.
Figura 3. Supervivencia libre de fracaso de tratamiento. El éxito terapéutico del bosentán en monoterapia a 1, 2, 3, 4 y 5 años fue del 95% (84-100%), el 83% (65-100%), el 78% (58-98%), el 61% (38-84%) y el 41% (16-66%) respectivamente.
Como promedio, el fracaso del tratamiento apareció en un 12% de los pacientes por cada año de seguimiento. El vasodilatador pulmonar elegido para combinar con bosentán fue en la mayoría de los casos sildenafilo, habitualmente con nueva mejoría clínica, como se desprende del beneficio mantenido en los parámetros clínicos y funcionales de la serie.
Características asociadas a buena respuesta mantenida al bosentánLa Tabla 4 compara las características basales y las derivadas de la respuesta a bosentán entre el grupo de pacientes con éxito terapéutico y los que sufrieron muerte o deterioro clínico. No hubo diferencias estadísticamente significativas entre ambos grupos en las características basales. Tampoco hubo diferencias entre ambos grupos en los parámetros hemodinámicos del cateterismo realizado a los 3 meses ni en las modificaciones de los diferentes parámetros (aumento del gasto e índice cardiaco, disminución de las RVP y de la PAP media) entre el cateterismo basal y el realizado a los 3 meses.
Tabla 4. Comparación de diferentes características entre los grupos con éxito y con fracaso terapéutico
| Parámetro | Éxito (n=7) | Fracaso (n=12) | p |
| GC basal (l/min) | 4,4 (3,5-7,7) | 4,3 (3-7,3) | 0,7 |
| Índice cardiaco basal (l/min/m 2 ) | 2,4 (2,3-4,6) | 2,5 (1,9-4,2) | 0,4 |
| RVP basales (UW) | 11,4 (4-19) | 9 (6-21) | 0,6 |
| Aumento del índice cardiaco (l/min/m 2 ) | 0,76 (−0,3-1,9) | 0,1 (−0,9-0,5) | 0,3 |
| Aumento del GC (l/min) | 0,59 (−0,4-3,3) | 0,6 (−1,5-1,8) | 0,7 |
| Reducción de RVP basales (UW) | 5,6 (1,1-12,2) | 2,3 (−0,7-8,2) | 0,1 |
| Reducción de PAPm (mmHg) | 13 (−27-29) | 5,5 (−20-20) | 0,1 |
| Disminución de 1 CF basal a los 6 meses | 5 (71) | 9 (75) | 0,8 |
| Cambio en la CF basal a los 12 meses | 0,7±0,2 | 0,7±0,3 | 0,3 |
| Aumento T6M basal a los 12 meses (m) | 60,2±16 | 37,5±10,5 | 0,4 |
| T6M a los 12 meses (m) | 372±55,3 | 352±87 | 0,6 |
| T6M > 350 m a los 12 meses | 4 (57) | 6 (50) | 0,7 |
| Aumento de 50 m T6M basal a los 12 meses | 5 (71) | 5 (42) | 0,2 |
| NT-proBNP a los 6 meses (pg/ml) | 552 (122-1.370) | 1.530 (43-4.300) | 0,3 |
| NT-proBNP a los 12 meses (pg/ml) | 210 (25-338) | 1.431 (79-4.590) | 0,04 |
| NT-proBNP < 400 pg/ml a los 12 meses | 7 (100) | 4 (33) | 0,013 |
| Reducción de 200 pg/ml de NT-proBNP basal-12 meses | 5 (71) | 3 (25) | 0,06 |
| FA en la evolución | 1 (14) | 3 (25) | 0,5 |
CF: clase funcional; FA: fibrilación auricular; GC: gasto cardiaco; PAPm: presión arterial pulmonar media; RVP: resistencias vasculares pulmonares; T6M: test de 6 minutos de marcha.
Los datos expresan n (%), media±desviación estándar o mediana (mínimo-máximo).
La mediana de NT-proBNP al año del inicio de tratamiento con bosentán fue significativamente inferior en el grupo con éxito terapéutico: 210 (25-338) frente a 1.431 (79-4.590) pg/ml (p=0,04). Todos los pacientes con éxito terapéutico presentaban cifras de NT-proBNP<400 pg/ml al primer año, en contraste con sólo un 33% en el grupo con peor evolución (p=0,013).
De este modo, la presencia de un valor de NT-proBNP < 400 pg/ml al año del inicio del tratamiento con bosentán identificaba a los respondedores a largo plazo con sensibilidad del 100% y especificidad del 66%, valor predictivo negativo del 100% y valor predictivo positivo del 64%.
Seguridad y efectos adversos (n=20)Un paciente (5%) presentó intolerancia a bosentán por síncopes recidivantes, que requirió su interrupción al mes de iniciado. En 3 pacientes observamos un aumento transitorio de transaminasas en los primeros 4 meses del tratamiento, que no requirió suspensión del fármaco. Ningún paciente presentó anemia u otras alteraciones analíticas que requiriesen tratamiento. No se registraron otros eventos adversos significativos.
DiscusiónEl presente estudio muestra una mejoría significativa de los parámetros clínicos, funcionales y hemodinámicos a corto plazo tras el tratamiento con bosentán en una serie de pacientes con HAP de diversas etiologías. Tras un seguimiento mediano de 5 años, la mejoría clínica se mantuvo, así como la distancia recorrida en el T6M. Sin embargo, tras un primer año con buena respuesta al tratamiento, aproximadamente un 12% de los pacientes por cada año de seguimiento mostró deterioro clínico, que en la mayoría de los casos requirió la adición de otro vasodilatador pulmonar.
En el corto plazo, nuestra experiencia reproduce la de las publicaciones previas en cuanto al beneficio clínico, funcional y hemodinámico. Como es habitual en otros estudios4, 5, la mejoría clínica de los pacientes fue más acusada que la de los parámetros hemodinámicos a los 3 meses de tratamiento. Observamos mejorías significativas, aunque moderadas (variación del 10-15%), en cuanto a gradiente transpulmonar y gasto cardiaco, mientras que la cifra de RVP, que muestra el beneficio acumulado de ambos cambios, mostró una reducción del 27%.
En comparación con los pacientes de otros estudios, nuestra serie tenía parámetros basales de mayor gravedad de la HAP. Los pacientes incluidos en diferentes trabajos4, 5, 7, 8, 9 recorrían como promedio distancias > 350 m en situación basal, mientras que en nuestro grupo la distancia media era de 314 m. Por otro lado, las RVP en nuestro grupo eran de 15 UW, frente a 11 en el trabajo de Channick et al4.
Nuestro estudio se diferencia de las publicaciones previas sobre el efecto de bosentán en la HAP por su seguimiento prolongado, que es más del doble del comunicado por otros autores.
Los diversos estudios publicados con seguimiento a «medio plazo» (1-2,7 años), evidenciaron mejorías en la clase funcional, parámetros hemodinámicos y distancia recorrida en el T6M en los primeros meses de tratamiento, lo que confirma los estudios a corto plazo referidos anteriormente. En el seguimiento, a partir del año, los resultados han sido variables: entre los estudios «favorables» destaca el de Díaz-Caraballo et al15, que incluyó a 10 adultos con HAP asociada a CC, en los que tanto la clase funcional como el T6M seguían mostrando mejoría significativa a los 25 meses de seguimiento.
Otros tres trabajos mostraron resultados menos favorables: en el estudio de Provencher et al11, que incluyó a 103 pacientes con HAP idiopática con seguimiento a 2 años, un 39% de los pacientes experimentaron fracaso terapéutico al año y un 56% a los 2 años. En la mayoría de los pacientes se añadió epoprostenol intravenoso para rescate clínico. La peor evolución puede explicarse por la etiología de su HAP (es bien conocido que la HAP asociada a CC evoluciona mejor que la HAP idiopática) y el hecho de que los pacientes partieran de una clase funcional basal III-IV.
En el estudio de Van Loon et al14, que siguió a 20 adultos y 10 menores con CC durante una mediana de 2,7 años, bosentán mejoró significativamente la clase funcional y el T6M a los 4 meses, con persistencia de la mejoría hasta el año. El beneficio declinó posteriormente en la serie total, que mostró un 27% de fracaso terapéutico en el seguimiento, a expensas principalmente de la población pediátrica, que tenía una HAP más grave al inicio (persistencia del beneficio a 1 y 2 años del 78 y el 57% de los adultos y el 50 y el 20% de la población pediátrica respectivamente). El peor pronóstico de la HAP en población pediátrica parece confirmarse en el estudio de Apostolopoulou et al13, que incluyó a 19 pacientes con mayoría de HAP asociada a CC y media de edad de 22 años. Aunque no se definió el fracaso terapéutico de modo similar a otros trabajos, sus resultados muestran pérdida del beneficio clínico y funcional iniciales tras 24 meses de seguimiento.
La evolución más favorable de los pacientes de nuestra serie (el 100 y el 83% libres de fracaso terapéutico a 1 y 2 años) puede estar justificada por tratarse de una población adulta con mayoría de HAP asociada a CC, que parece tener evolución más favorable que la de los diferentes estudios y similar a la de la serie inglesa de HAP en CC recientemente publicada17. De este modo, la aparente discordancia con la experiencia de otros autores puede no ser tal. Es importante señalar que con seguimientos más prolongados nuestro grupo mostró cifras apreciables de fracaso terapéutico (el 22% a 3 años y el 59% a 5 años), que parecen indicar que la progresión de la HAP acabará por causar un lento deterioro clínico de los pacientes a pesar del tratamiento.
Debe tenerse en cuenta que el llamado fracaso terapéutico de estos estudios no conlleva un pronóstico tan desfavorable como su nombre podría indicar. En la mayoría de los casos, la adición de otro fármaco específico (sildenafilo o análogos de prostaciclina) «rescata» de su situación clínica a los pacientes, en los que se puede recuperar el beneficio del tratamiento al menos durante un tiempo, como muestran el estudio de Hoeper18 y nuestra propia experiencia.
En cuanto a la mortalidad, tampoco parece que haya diferencias importantes con los escasos trabajos que ofrecen cifras concretas: en la serie de McLaughlin12, la mortalidad de 139 pacientes con HAP idiopática en clase funcional III tratados con bosentán fue del 3% al año y el 9% a los 2 años, mientras que en el aludido estudio de Van Loon et al14, la mortalidad a los 2,7 años fue del 10%.
Frente a ello, la mortalidad del 5% a 5 años y el 30% a 7 años de nuestra serie, más favorable en términos absolutos, puede explicarse por las diferencias en la etiología y la edad de las poblaciones estudiadas. En cualquier caso, se trata de cifras muy alejadas de la mortalidad de series de pacientes anteriores a la utilización de vasodilatadores pulmonares específicos3.
La identificación de un parámetro asociado a respuesta favorable prolongada al tratamiento con bosentán es un aspecto atractivo de nuestro trabajo. La variable NT-proBNP mostró una gran dispersión de valores, por lo que no hubo diferencias significativas en el seguimiento del grupo total, a pesar de la mejoría clínica evidenciada. Sin embargo, al comparar esta variable entre los grupos con éxito y con fracaso terapéutico a 5 años, hemos encontrado que los valores de NT-proBNP a los 12 meses del inicio de bosentán eran significativamente inferiores en el grupo con éxito terapéutico. Asimismo, a los 12 meses del inicio de bosentán, todos estos pacientes tenían un NT-proBNP < 400 pg/ml, lo que nos permite confirmar que cifras bajas de NT-proBNP se asocian a buena respuesta a largo plazo, con sensibilidad y valor predictivo negativo del 100%, lo que permitiría dar un mensaje sencillo y de alguna utilidad para el manejo de estos pacientes. Ya había consenso generalizado en que las cifras elevadas de péptidos natriuréticos y, en particular, su aumento durante el seguimiento son predictores independientes de mortalidad en pacientes con HAP19. Este dato debe ser tomado con prudencia debido al pequeño tamaño de nuestra serie. De confirmarse en series de mayor tamaño, podría identificar a una población con mayor riesgo de muerte o deterioro clínico que, por lo tanto, se debería someter a vigilancia más estrecha, con bajo umbral para la adopción de otras medidas terapéuticas.
La tolerancia al bosentán fue buena, y sólo en 1 paciente (5%) fue necesario retirarlo, cifra que concuerda con la experiencia de Van Loon et al14. Tres pacientes presentaron elevación asintomática y transitoria de transaminasas entre 3-5 veces el límite superior de la normalidad, que se manejó con la disminución temporal de la dosis de bosentán, y no reapareció al volver a la dosis habitual.
Las limitaciones de nuestro estudio están principalmente vinculadas al pequeño tamaño de la muestra. No obstante, las series publicadas a mediano plazo en general tienen un tamaño similar (10-30 pacientes), justificable por tratarse de una enfermedad poco prevalente. Por otro lado, la etiología predominante de CC puede explicar la elevada supervivencia a pesar de parámetros basales desfavorables, similar a la de la serie inglesa recientemente publicada17. También señalamos como limitación el protocolo de estudio ecocardiográfico de estos pacientes, que ha cambiado de forma importante durante el periodo de estudio20. Debido a la falta de coherencia en la determinación de diversos parámetros ecocardiográficos relacionados con la función del ventrículo derecho en nuestros estudios iniciales, no hemos podido ofrecer la variedad de datos ecocardiográficos que reflejan otras series modernas de pacientes con HAP.
ConclusionesNuestra experiencia indica que bosentán en monoterapia es una opción útil para obtener mejoría clínica a corto plazo en los pacientes con HAP. Cabe esperar una duración de la mejoría de al menos 1 año en la gran mayoría de los casos, con una tasa de deterioro posterior en torno al 12% de los pacientes cada año, de modo que algo menos de la mitad se mantiene sin deterioro a los 5 años en monoterapia. En los demás pacientes, caracterizados por cifras de NT-proBNP elevadas al año de tratamiento, la adición de otros vasodilatadores pulmonares suele ser necesaria para obtener una nueva mejoría. La supervivencia a 5 años de esta serie de pacientes fue del 95%.
FinanciaciónLa Dra. Patricia Avellana ha obtenido financiación de una beca de Investigación de la Fundación Carolina-BBVA. Los Dres. Javier Segovia, Manuel Gómez-Bueno, Pablo García-Pavía y Luis Alonso-Pulpón pertenecen a la Red Temática de Investigación en Insuficiencia Cardiaca REDINSCOR, del Instituto de Salud Carlos III, Ministerio Español de Ciencia e Innovación.
Conflicto de interesesNinguno.
Recibido 23 Enero 2011
Aceptado 25 Abril 2011
Autor para correspondencia: Unidad de Insuficiencia Cardiaca, Trasplante e Hipertensión Pulmonar, Servicio de Cardiología, Hospital Universitario Puerta de Hierro de Majadahonda, Manuel de Falla 2, 28222 Majadahonda, Madrid, España. patriciaavellana@yahoo.com.ar