La morbilidad y la mortalidad después de un ingreso por insuficiencia cardiaca aguda siguen siendo extremadamente elevadas. En este contexto, se ha demostrado que las concentraciones plasmáticas del antígeno carbohidrato 125 muestran correlación con la gravedad de la sobrecarga hídrica y el riesgo de muerte y reingreso. Los datos preliminares indican un posible papel del antígeno carbohidrato 125 como guía para el tratamiento. El objetivo de este estudio es evaluar el efecto pronóstico de una estrategia de tratamiento guiada por el antígeno carbohidrato 125 comparada con el tratamiento estándar en pacientes dados de alta recientemente tras un ingreso por insuficiencia cardiaca aguda.
MétodosEnsayo clínico multicéntrico, aleatorizado y a ciego simple, de evaluación de la eficacia en pacientes recientemente dados de alta tras una insuficiencia cardiaca aguda (< 180 días), en clase funcional II-IV de la New York Heart Association y con antígeno carbohidrato 125 > 35 U/ml. Se utilizó un esquema de aleatorización para asignar a los participantes (en relación 1:1) a tratamiento guiado por el antígeno carbohidrato 125 (destinado a mantener valores normales) o tratamiento estándar. El tratamiento guiado se centra principalmente en la frecuencia de monitorización y ajuste de dosis de los tratamientos descongestivos y las estatinas. Hasta el 10 de diciembre de 2013, se había incluido en el estudio a 383 pacientes. El objetivo principal era la combinación de mortalidad por cualquier causa o rehospitalización por insuficiencia cardiaca aguda a 1 año. Se planificó el análisis según el criterio de intención de tratar.
ConclusionesEl descubrimiento de estrategias terapéuticas novedosas o mejores formas de optimizar los tratamientos establecidos ha pasado a ser una prioridad de la asistencia sanitaria en la insuficiencia cardiaca. Este estudio aporta nuevos conocimientos importantes acerca del potencial del antígeno carbohidrato 125 como instrumento útil para la monitorización y ajuste de la posología de los tratamientos en los casos en que la utilización óptima no está bien definida, como ocurre con los diuréticos y las estatinas.
Registro del ensayo: ClinicalTrials.gov número: NCT02008110.
Palabras clave
Después del alta tras un episodio de insuficiencia cardiaca aguda (ICA), incluso a pesar de una mejoría del estado clínico, las tasas de rehospitalización y de mortalidad siguen siendo excesivamente altas durante los primeros meses1–3. La sobrecarga de líquidos (SL) es una característica clave de la patogenia de la ICA4,5, pero su gravedad y su distribución difieren notablemente de un paciente a otro4–7. La cuestión se complica porque a muchos de estos pacientes se les da de alta con cierto grado de congestión residual4,5. Tradicionalmente, la SL se ha evaluado por signos y síntomas, a pesar de que la exactitud en su identificación es escasa5,8. De igual modo, otros instrumentos, como la radiografía de tórax, los péptidos natriuréticos, la ecocardiografía y las evaluaciones invasivas, han dado malos resultados en la cuantificación de la gravedad de la SL5,8,9. De hecho, la disponibilidad de un método exacto y basado en la clínica para cuantificar el estado de SL continúa siendo una necesidad insatisfecha en el tratamiento actual de los pacientes con ICA.
El marcador tumoral antígeno carbohidrato 125 (CA-125), una glucoproteína ampliamente utilizada en el seguimiento del cáncer de ovario, ha surgido como posible biomarcador de insuficiencia cardiaca (IC)10. Las concentraciones de CA-125 en plasma están correlacionadas con parámetros clínicos, hemodinámicos y ecocardiográficos relacionados con la gravedad de la enfermedad10,11. Tiene especial interés la correlación con los signos y síntomas de SL y la actividad inflamatoria10. De hecho, se ha demostrado que hay altas concentraciones de esta glucoproteína en la mayoría de los pacientes ingresados por ICA12 y que están relacionadas de manera independiente con mortalidad y rehospitalizaciones por ICA10,12. Además, determinadas características, como la amplia disponibilidad, el bajo coste y la estrecha correlación entre los cambios plasmáticos y la evolución clínica, han aumentado el interés de los investigadores por el potencial de esta glucoproteína para monitorizar y guiar el tratamiento en la IC10–14. En este sentido, cierta evidencia preliminar indica que los pacientes con una elevación de las concentraciones de CA-125 podrían beneficiarse de un tratamiento descongestivo más agresivo15. Además, como marcador de inflamación, permitiría identificar también un subgrupo de pacientes en los que obtiene un efecto al tratarlos con estatinas16.
En consecuencia, este estudio se diseñó para evaluar la hipótesis de que una estrategia de tratamiento guiada por las concentraciones de CA-125 en plasma puede mejorar los resultados clínicos a 1 año, comparada con una estrategia de asistencia habitual, en pacientes que habían tenido un episodio reciente de ICA.
MÉTODOSDiseño del estudioEste estudio se diseñó en forma de ensayo multicéntrico, aleatorizado y a ciego simple, de evaluación de la eficacia en pacientes dados de alta recientemente tras un episodio de ICA (< 180 días), en clase funcional II–IV de la New York Heart Association y con CA-125>35 U/ml. Se utilizó un esquema de aleatorización generado por ordenador para asignar a los participantes, en relación 1:1, a un tratamiento guiado por el CA-125 (destinado a mantener un valor de CA-125 ≤ 35 U/ml) o a un tratamiento estándar. Se ocultó a los pacientes la asignación al grupo de tratamiento, pero no a los investigadores. El estudio se está llevando a cabo en cinco centros en España. Con independencia de su inclusión escalonada, la duración mínima de participación de un paciente es de 12 meses desde la primera visita hasta la última. El estudio se lleva a cabo cumpliendo las normas de Buena Práctica Clínica, Declaración de Helsinki de 2002. Todos los pacientes firmaron el documento de consentimiento informado y el protocolo recibió la aprobación del comité de ética de investigación de los centros participantes y de la Agencia Española de Medicamentos y Productos Sanitarios.
Población en estudioSe seleccionó a los pacientes candidatos de una cohorte consecutiva de pacientes ingresados recientemente por una ICA. Los criterios de inclusión y exclusión se resumen en la tabla 1.
Criterios de inclusión y exclusión del estudio
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| • Edad ≥ 18 años • Al menos 1 episodio de ICA en los últimos 180 días • Estar en clase funcional de la NYHA ≥ II en el momento de la inclusión • Evidencia objetiva, durante el ingreso de cualificación o al menos 180 días antes de la inclusión, de una anomalía estructural o funcional del corazón en reposo, definida como: NT-proBNP>1.000 pg/ml o BNP>100 pg/ml o anomalías ecocardiográficas compatibles con diagnóstico de IC, como: disfunción sistólica del VI (FEVI < 50%); hipertrofia del VI (definida como grosor de la pared posterior del VI o del septo ≥ 12mm o índice de masa del VI (%)>104 g/m2 [mujeres] o 116 g/m2 [varones]); cociente E/e’ > 15 o valvulopatía cardiaca significativa (moderada a grave) • Un valor de CA-125 en plasma > 35 U/ml en una determinación reciente (≥30días antes de la inclusión y preferiblemente antes del alta hospitalaria) • El paciente debe ser capaz de comprender y firmar un documento de consentimiento informado | • CA-125 en plasma ≤ 35 U/ml • Esperanza de vida < 12 meses a causa de otras enfermedades diferentes de la insuficiencia cardiaca • Trasplante cardiaco, intervención de revascularización coronaria (ICP y/o CBAG) o sustitución de válvula cardiaca en los últimos 3 meses • Angina de pecho de clase > II (clasificación de CCS) • Embarazo en el momento de la inclusión • Valvulopatía cardiaca para la que se ha programado ya una intervención quirúrgica • Enfermedad pulmonar restrictiva y/u obstructiva crónica grave, con necesidad de oxigenoterapia continua • Creatinina sérica > 3 mg/dl o insuficiencia renal crónica en tratamiento de diálisis • Tratamiento de resincronización aplicado durante el ingreso de cualificación • Enfermedades médicas simultáneas significativas, incluidos el cáncer o los antecedentes de cáncer en un plazo de 5 años antes de la inclusión en el periodo de selección inicial, endometriosis, cirrosis, síndrome coronario agudo en los 6 meses previos, hipertensión no controlada, antecedentes de infección por VIH o una infección activa significativa • Participación en otro ensayo aleatorizado |
BNP: péptido natriurético cerebral; CA-125: antígeno carbohidrato 125; CBAG: cirugía de bypass arterial coronario; CCS: Canadian Cardiovascular Society; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC: insuficiencia cardiaca; ICA: insuficiencia cardiaca aguda; ICP: intervención coronaria percutánea; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association;VI: ventrículo izquierdo; VIH: virus de la inmunodeficiencia humana.
El cribado de los pacientes se realizó durante la hospitalización (antes del alta del ingreso por ICA) o ambulatoriamente en los primeros 180 días siguientes al alta hospitalaria. Tras revisar los criterios de inclusión y exclusión y firmar y fechar el documento de consentimiento informado, se realizaron una historia clínica y una exploración física detalladas. Tanto las exploraciones como los procedimientos basales se realizaron antes de la asignación del tratamiento.
Visitas de seguimientoSe evaluó a los pacientes al cabo de 1, 6 y 12 meses de la aleatorización (visitas 1, 2 y 3 respectivamente). En cada una de estas visitas, se realizaron anamnesis completa, exploración física y electrocardiograma de 12 derivaciones y se obtuvieron muestras de sangre para análisis de laboratorio. Los análisis incluyeron hemograma y bioquímica, péptidos natriuréticos cerebrales y concentraciones de CA-125 en suero, entre otros parámetros. Los procedimientos programados para cada visita se detallan en la tabla 2.
Diseño del seguimiento
| Visita | Examen de selección: visita 0 | Visita 1 (1 mes) | Visita 2 (6 meses) | Visita 3 (1 año) |
|---|---|---|---|---|
| Procedimientos del estudio | ||||
| Formulario de consentimiento informado | X | |||
| Peso y estatura | X | X | X | X |
| Revisión de criterios de inclusión/exclusión | X | |||
| Evaluación clínica | X | X | X | X |
| Registro de medicaciones concomitantes | X | X | X | X |
| Electrocardiograma | X | X | X | X |
| Registro de eventos adversos | X | X | X | |
| Muestras de sangre | ||||
| Hematología, bioquímica* | X | X | X | X |
| Biomarcadores (BNP/NT-proBNP y CA-125) | X | X | X | X |
| Exploraciones de imagen | ||||
| Radiografía de tórax | X | |||
| Determinación de FEVI | X | X | ||
| Intervención | ||||
| Asignación aleatoria | X | |||
| Tratamiento guiado por CA-125/clínica | X | X | X | X |
BNP: péptido natriurético cerebral; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; CA-125: antígeno carbohidrato 125; FEVI: fracción de eyección del ventrículo izquierdo.
En ambos grupos de tratamiento se permitieron visitas opcionales si el médico responsable de los pacientes lo consideraba clínicamente apropiado.
Tratamiento en estudioSe asignó aleatoriamente a los pacientes al grupo de tratamiento activo o al de tratamiento estándar.
Estrategia de tratamiento estándar:
- •
Los pacientes asignados aleatoriamente a este grupo reciben tratamiento según lo establecido en la guía europea vigente17,18.
- •
Para los pacientes con disfunción sistólica, la asistencia estándar incluye: a) inhibidores de la enzima de conversión de la angiotensina salvo contraindicación; en caso de intolerancia, se debe pasar a un antagonista del receptor de la angiotensina II; b) bloqueadores beta a la dosis máxima tolerada; c) se debe considerar el empleo de antialdosterónicos para pacientes con fracción de eyección del ventrículo izquierdo (FEVI) ≤ 35%; d) ivabradina para pacientes con FEVI ≤ 35%, ritmo sinusal y frecuencia cardiaca ≥ 70 lpm; e) tratamiento vasodilatador con hidralazina más dinitrato de isosorbida si los inhibidores de la enzima de conversión de la angiotensina o los antagonistas de los receptores de la angiotensina II están contraindicados o se toleran mal, y f) se recomienda un antagonista de los receptores de la angiotensina II para los pacientes con inhibidor de la enzima de conversión de la angiotensina y FEVI ≤ 40% que continúan con síntomas a pesar del tratamiento óptimo con un IECA y un bloqueador beta, salvo que ya estén tomando un antialdosterónico.
- •
Para los pacientes con IC y FEVI conservada, el tratamiento debe centrarse en: a) tratar los signos y síntomas de retención de líquidos con diuréticos de asa; b) fomentar el uso de inhibidores de la enzima de conversión de la angiotensina o antagonistas de los receptores de la angiotensina II, y c) indicar un bloqueador beta o un antagonista del calcio (verapamilo y/o diltiazem), en especial cuando la presión arterial es >130/80mmHg o el paciente está en fibrilación auricular.
- •
Para todos los pacientes asignados a este grupo, debe realizarse un ajuste de la dosis del diurético según los signos y síntomas de SL. Puede estar indicada la administración intravenosa ambulatoria de un diurético de asa en los casos de signos y síntomas atribuibles a la SL persistentes o que empeoran pese a la administración oral de dosis altas de un diurético de asa.
- •
Para todos los pacientes asignados a este grupo, se opta por no recomendar estatinas ni ácidos grasos poliinsaturados omega-3, pero se permite su empleo.
- •
Otros tratamientos (digoxina, nitratos, anticoagulantes, antiarrítmicos, terapia de resincronización cardiaca, revascularización cardiaca, cirugía valvular cardiaca, trasplante de corazón e inotrópicos) se indican según lo establecido en la guía vigente17,18.
- •
Se recomienda la administración de hierro intravenoso a los pacientes con ferropenia (ferritina sérica < 100μg/l, o 100-299μg/l cuando la saturación de transferrina es < 20%), hemoglobina en 95-135g/l y en clase funcional de la New York Heart AssociationIII–IV. La dosis de hierro está en consonancia con el cálculo del déficit total de hierro.
- •
Las visitas preprogramadas se planificaron para realizarlas 1, 6 y 12 meses después de la asignación aleatoria. Se programaron otras visitas adicionales según el estado clínico del paciente y el criterio del médico responsable de cada paciente.
- •
El CA-125 se determina en esos pacientes, aunque no se dispone de los valores durante el ensayo.
- •
Los péptidos natriuréticos se determinan también en estos pacientes y se dispone de los resultados durante el ensayo, aunque no se establecen recomendaciones terapéuticas específicas en función de los valores obtenidos.
Estrategia guiada por el CA-125:
- •
En este grupo, se recomienda a los médicos que optimicen todas las medidas de tratamiento con el objetivo de mantener un valor de CA-125 ≤ 35 U/ml, al tiempo que se pretende minimizar los potenciales efectos secundarios. En general, todos los pacientes deben recibir tratamiento según lo establecido en la guía en cuanto al uso de inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina II, bloqueadores beta, antialdosterónicos, ivabradina y otros tratamientos, como anticoagulantes, antiarrítmicos, digoxina, nitratos y fármacos vasoactivos, dispositivos e intervenciones quirúrgicas. De igual modo, los pacientes con IC y FEVI conservada deben recibir tratamiento según las recomendaciones estándares17,18.
- •
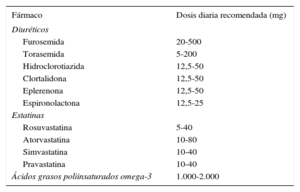
En general, en este grupo, la frecuencia de visitas para el seguimiento y el ajuste de los tratamientos descongestivos, las estatinas, el hierro intravenoso y los ácidos grasos poliinsaturados omega-3 deben estar en función de la evolución del CA-125. El algoritmo propuesto se muestra en la tabla 3. Las dosis de los fármacos recomendadas para el grupo de tratamiento activo se resumen en la tabla 4.
Tabla 3.Algoritmo de tratamiento (tratamiento guiado por CA-125)
Visita 0 • Considerar el uso de estatinas en todos los pacientes, especialmente en dosis bajas
• Considerar el uso de ácidos grasos poliinsaturados omega-3
• Mantener la dosis de diurético de asa si hay estabilidad clínica. Considerar un aumento de la dosis de diurético de asa si persisten los signos y síntomas de congestiónVisitas 1, 2, 3 y adicionales El CA-125 vuelve a valores normales (≤ 35 U/ml): • Considerar la reducción de la dosis del diurético de asa, especialmente para pacientes que reciben dosis de diuréticos elevadas (dosis equivalente de furosemida ≥ 120 mg/día) o presentan signos de agravamiento de la función renal
• Si no se han prescrito ya, recomendar la instauración o la continuación del tratamiento con estatina y ácidos grasos poliinsaturados omega-3 si se tolera bienEl CA-125 disminuye pero continúa siendo alto (> 35 U/ml): • Considerar el mantenimiento de la dosis del diurético de asa o un aumento de la dosis si la actualmente prescrita de equivalente de furosemida es < 80 mg/día
• Volver a evaluar la situación clínica y el CA-125 en una visita adicional (2-8 semanas)
• Considerar un aumento de la dosis de estatina
• Considerar la prescripción de ácidos grasos poliinsaturados omega-3 si no se han utilizado anteriormente
• Considerar un ajuste al alza de las dosis de bloqueadores beta y/o IECA y/o ARA-II hasta la dosis máxima recomendada
• Considerar la adición de antialdosterónicos si no se administraban ya
• Considerar la administración de hierro intravenoso si hay ferropeniaEl CA-125 aumenta durante el ensayo clínico: • Considerar un aumento de la dosis del diurético de asa y/o la adición de hidroclorotiazida 12,5-50 mg/día o clortalidona 12,5-50 mg/día y/o antagonistas de aldosterona 12,5-50 mg/día
• Considerar la programación de nuevas visitas opcionales (1-4 semanas)
• Considerar la administración ambulatoria de furosemida intravenosa y/o el uso de técnicas de ultrafiltración
• Maximizar el tratamiento con estatina si es posible
• Considerar la prescripción/aumento de ácidos grasos poliinsaturados omega-3
• Considerar la administración de hierro intravenoso si hay ferropeniaARA-II: antagonistas del receptor de la angiotensina II; CA-125: antígeno carbohidrato 125; IECA: inhibidores de la enzima de conversión de la angiotensina.
Tabla 4.Dosis recomendadas de diuréticos, estatinas y ácidos grasos poliinsaturados omega-3 para el grupo de tratamiento guiado por CA-125
Fármaco Dosis diaria recomendada (mg) Diuréticos Furosemida 20-500 Torasemida 5-200 Hidroclorotiazida 12,5-50 Clortalidona 12,5-50 Eplerenona 12,5-50 Espironolactona 12,5-25 Estatinas Rosuvastatina 5-40 Atorvastatina 10-80 Simvastatina 10-40 Pravastatina 10-40 Ácidos grasos poliinsaturados omega-3 1.000-2.000 CA–125: antígeno carbohidrato 125.
Todos los objetivos de valoración se verifican por un supervisor clínico independiente y se remiten luego a un comité de validación que no conoce las asignaciones de los tratamientos.
Objetivo principalEl objetivo principal es la combinación de muerte por cualquier causa y rehospitalización por ICA en el plazo de 1 año desde la asignación aleatoria (optando por la que se produzca antes y evaluando los episodios repetidos). El reingreso por ICA se definió como la hospitalización no planificada que requiera una estancia >24h y causada por un agravamiento sustancial de los signos y/o síntomas de IC que requiera nueva administración de tratamientos intravenosos para la IC, incluidos inotrópicos, diuréticos o vasodilatadores.
Objetivos secundarios- •
Objetivo combinado de muerte o reingreso por cualquier causa en el plazo de 1 año desde la asignación aleatoria.
- •
Días de vida fuera del hospital al cabo de 1 año.
- •
Número de hospitalizaciones por ICA al cabo de 1 año.
- •
Número de episodios de agravamiento de la IC que no requieran hospitalización al cabo de 1 año.
- •
Porcentaje de pacientes en los que se normalizan los valores de CA-125 (≤ 35 U/ml) y tiempo necesario para alcanzar el objetivo.
- •
Efectos en la concentración de péptido natriurético cerebral o fracción aminoterminal del propéptido natriurético cerebral (al cabo de 1, 6 y 12 meses).
En función de las estrategias de tratamiento aplicadas, la evaluación de la seguridad del paciente se centra específicamente en la vigilancia de función renal y hepática, miopatía y alteraciones electrolíticas.
Cálculo del tamaño muestralLa determinación del tamaño muestral para este estudio parte del supuesto de una prueba bilateral con un nivel de significación alfa de 0,05. La magnitud del efecto para el objetivo principal se basó en los resultados previos del registro de ICA del Hospital Clínico Universitario (Valencia, España). En ese estudio piloto, 1.702 pacientes ingresados de manera consecutiva en el hospital con un diagnóstico de ICA recibieron seguimiento respecto a los objetivos clínicos. Durante la hospitalización de cualificación, el 64,6% tenía CA-125>35 U/ml. En este registro, se ha asumido que los dos grupos de CA-125 han recibido un tratamiento médico estándar y, por lo tanto, las diferencias halladas en los resultados no incluirán el efecto de un tratamiento optimizado. La tasa del objetivo combinado de muerte por cualquier causa o reingreso por ICA hasta 1 año después del alta se estimó en el 42,8% del grupo con CA-125>35 U/ml y el 32,6% del grupo con CA-125 ≤ 35 U/ml, lo cual implica una diferencia absoluta de la tasa del 10,4%. En consecuencia, es previsible que la optimización del tratamiento en el grupo con CA-125>35 U/ml se traducirá en una reducción del 35% en el riesgo relativo de esta variable de valoración combinada. Así pues, usando una potencia estadística del 80% para detectar al menos esta diferencia a 1 año y con aleatorización en proporción 1:1, se estimó que serían necesarios 180 pacientes para cada grupo (n=360 pacientes). El tamaño muestral total se aumentó hasta 378 pacientes (n=189 en cada grupo) para tener en cuenta las posibles pérdidas del seguimiento, que se supuso que serían de alrededor del 5%.
Plan de análisis estadísticoTodas las comparaciones estadísticas se realizarán según el principio de intención de tratar. Las variables continuas se expresarán en forma de media ± 1 desviación estándar o mediana [intervalo intercuartílico], según sea apropiado. La comparación de las dos estrategias de tratamiento se llevará a cabo con una prueba de la t de Student para datos no apareados o con la prueba de la U de Mann-Whitney según sea la distribución de la variable. Las variables discretas se compararán con la prueba de la χ2 o la prueba exacta de Fisher según sea apropiado.
Se ha previsto dos enfoques metodológicos para el análisis del objetivo principal:
- •
Análisis mediante el tiempo hasta el primer evento: en el primer enfoque, que se basa en la manera tradicional de analizar los resultados de los ensayos clínicos, la diferencia entre los grupos de tratamiento se representará gráficamente con el método de Kaplan-Meier y se evaluará mediante log rank test. Los criterios principales para la censura de los pacientes para el análisis serán el final del ensayo (censura administrativa a 1 año) y el tiempo hasta el primer evento. Se estimarán las razones de riesgos univariables con una regresión de riesgos proporcionales de Cox; sin embargo, el análisis de regresión de Cox multivariable se utilizará únicamente en caso de que haya factores pronósticos importantes o características basales de los pacientes que muestren un desequilibrio significativo entre los dos grupos establecidos mediante la aleatorización. Todos los análisis tendrán en cuenta un posible efecto de agrupación dentro de los centros.
- •
Teniendo en cuenta las rehospitalizaciones por IC: para tener en cuenta toda la evolución clínica de los pacientes, se hará un análisis de regresión binomial negativa, en el que se comparará el recuento de eventos (incluida la muerte si se produce) de los dos grupos de tratamiento.
Con los objetivos secundarios, para la combinación de muerte y cualquier rehospitalización, se utilizará un enfoque similar. Para el objetivo de mortalidad, se compararán los grupos utilizando el enfoque de modelización conjunta (joint modeling), que introduce simultáneamente un ajuste respecto al efecto de la variación temporal longitudinal del CA-125 a la vez que tiene en cuenta la muerte como evento terminal. Para el objetivo de rehospitalización, se elaborará la curva de supervivencia como función de incidencia acumulativa, para tener en cuenta la mortalidad como evento en competencia. Sin embargo, para estos objetivos, se explorará también el uso del modelo de fragilidad conjunta para comparar los grupos en lo relativo a las rehospitalizaciones en todo el periodo de seguimiento, al tiempo que se introduce un ajuste respecto a la muerte como evento terminal. Para el objetivo de días de vida fuera del hospital, la duración del seguimiento que se empleará en el análisis de la supervivencia no incluirá el tiempo que el paciente ha permanecido en el hospital en cualquiera de los ingresos.
Se realizará un análisis de subgrupos de pacientes definidos según la edad (> 65,>70, > 75 años), el sexo, el uso de estatinas, la FEVI (> 50%, >40%), la etiología, el estado inflamatorio (recuento relativo de linfocitos y proteína C reactiva de alta sensibilidad), la insuficiencia renal, el valor basal de CA-125 (por encima de la mediana) y los péptidos natriuréticos en situación basal (por encima de la mediana).
Todos los análisis se han programado según el criterio de intención de tratar. Se considera estadísticamente significativo un valor de p bilateral < 0,05 en todos los análisis. Todos los análisis se llevarán a cabo con el programa informático Stata 13.1 o con el programa R.
Situación actualEl protocolo recibió la aprobación del comité ético o del consejo de revisión interno de cada centro participante. La inclusión de pacientes se inició en diciembre de 2011. El 17 de julio de 2013, el estudio había completado la inclusión de pacientes. En diciembre de 2013 se había completado el seguimiento de >50% de los pacientes.
DISCUSIÓNMorbilidad y mortalidad después de un episodio de insuficiencia cardiaca aguda: la importancia de la sobrecarga de líquidos y el estado inflamatorioEn cualquier sistema nacional de salud, las hospitalizaciones por ICA comportan una carga de asistencia sanitaria considerable1–3,19, que se asocia a unas tasas de morbilidad y mortalidad extremadamente elevadas después del alta1–3. Paradójicamente, la mayor parte de los estudios que han evaluado estrategias de tratamiento novedosas se han centrado en los pacientes con una IC estable y no en el contexto de la ICA17,18. En opinión de los investigadores de este estudio, los nuevos caminos de la investigación tienen que orientarse a ese periodo vulnerable para reducir la carga que supone esta enfermedad. A este respecto, las estrategias de tratamiento alternativas que aborden la optimización del tratamiento descongestivo y la modulación de la actividad inflamatoria parecen objetivos pertinentes, puesto que ambos mecanismos desempeñan un papel crítico durante este periodo en concreto5,20. Por ejemplo, la gravedad de la SL está relacionada con el mal pronóstico5,21–23 y, lejos de ser un epifenómeno, puede fomentar la progresión de la enfermedad a través de complejas interacciones neurohumorales (que favorecen la retención de sodio), renales (que reducen el filtrado glomerular), cardiacas y endoteliales24,25. En este sentido, la evaluación de la SL y su tratamiento resultan difíciles con frecuencia y son en gran parte subjetivos, debido sobre todo a que los instrumentos clínicos disponibles, como los signos y síntomas, la radiología e incluso los péptidos natriuréticos, tienen poca exactitud respecto a la identificación y la cuantificación del grado de SL. Esto es especialmente cierto en lo que respecta a ciertos subgrupos de pacientes en los que se dan situaciones que pueden llevar a confusión, como la obesidad, la edad avanzada y las enfermedades pulmonares, hepáticas o venosas periféricas5,8,9. De igual modo, la inflamación de bajo grado es frecuente en los pacientes con ICA, y este hecho abre el camino para el uso de nuevas modalidades de tratamiento, como las estatinas y los ácidos grasos poliinsaturados omega-326,27, a pesar de que con estos tratamientos no se haya podido demostrar un sustancial efecto clínico beneficioso en estudios previos28,29.
Así pues, este estudio se ha diseñado sobre la base de la información previa antes comentada e intentando evaluar si los valores de CA-125 permiten optimizar el tratamiento tras un episodio de ICA.
Tratamiento guiado por biomarcadores en la insuficiencia cardiacaEl tratamiento guiado por biomarcadores ha surgido recientemente como una estrategia atractiva para personalizar las opciones terapéuticas ya existentes para el tratamiento de la IC. En varios estudios se ha evaluado la utilidad clínica del tratamiento guiado por los valores de los péptidos natriuréticos en la IC pero, a pesar de la leve mejora observada en los datos combinados30,31, otros estudios relativamente amplios no han documentado una mejoría clínica significativa en la mortalidad y la morbilidad30–32. De hecho, la vigente guía estadounidense33 no recomienda su uso sistemático para mejorar los resultados (recomendación de clase IIb); otras guías de práctica clínica (como las de la Sociedad Europea de Cardiología) están esperando los resultados de nuevos ensayos clínicos. Esta falta de consenso se debe, al menos en parte, a varias incertidumbres existentes: a) determinar qué concentración plasmática se debe adoptar como objetivo óptimo, un umbral que no está bien establecido porque la mayoría de los estudios han utilizado criterios diferentes; b) factores de confusión frecuentes como la edad, el peso, la función renal y otras comorbilidades con demostrada influencia en la capacidad predictiva de los péptidos natriuréticos; c) escasez de estudios amplios que hayan evaluado la utilidad clínica del tratamiento guiado por factores natriuréticos en los pacientes dados de alta recientemente tras un episodio de ICA, y d) inconvenientes logísticos como el precio y la gran variabilidad también pueden tener un papel importante30–32. En opinión de los investigadores del presente estudio, en el futuro deberán realizarse ensayos clínicos más amplios que permitan resolver los anteriores puntos destacados.
CA-125: un posible biomarcador para monitorizar y guiar el tratamientoEl CA-125, también denominado MUC16, es una glucoproteína sintetizada por las células serosas epiteliales, con una estructura extremadamente compleja y un peso molecular elevado. Aunque el CA-125 se utiliza ampliamente para supervisar el tratamiento del cáncer de ovario, se han descrito también concentraciones plasmáticas elevadas en otras enfermedades malignas y no malignas (IC, síndrome nefrótico, cirrosis hepática, tuberculosis o enfermedad inflamatoria pelviana, entre otras)10. En el contexto de la IC, las concentraciones de CA-125 en plasma muestran correlación con parámetros clínicos (clase funcional de la New York Heart Association), hemodinámicos (presión arterial pulmonar enclavada, presión auricular derecha) y ecocardiográficos (tiempo de desaceleración de la onda E, disfunción sistólica ventricular derecha) que están relacionados con la gravedad de la enfermedad10,11. Se observan valores elevados en la mayoría de los pacientes ingresados por una ICA; por ejemplo, en una reciente cohorte de 1.111 pacientes no seleccionados que ingresaron por una ICA, el 65% presentó valores de CA-125 >35 U/ml12. En este contexto, el CA-125 se ha relacionado con los signos y síntomas de SL10,12, el estado inflamatorio34 y la mortalidad y los reingresos a los 6 meses12 de manera independiente de los péptidos natriuréticos y otros factores de riesgo tradicionales. Además, estudios recientes10,12–16 han resaltado el potencial del CA-125 en el control y la orientación del tratamiento de la IC aprovechando ciertas características, como la correlación estrecha con la gravedad de la enfermedad y los resultados clínicos, y también como un marcador que permite caracterizar de manera diferencial el efecto pronóstico atribuido al uso de las dosis de diuréticos de asa y estatinas. De hecho, el grupo de trabajo observó que en la primera visita ambulatoria después de un ingreso por ICA (media, 28 días después del alta), los pacientes en quienes se normalizó la concentración de CA-125 fueron los que tenían más bajo riesgo de muerte ajustado, mientras que el riesgo era intermedio para los que presentaron disminución pero no la normalización del CA-125 y era superior en los pacientes con un aumento del CA-12513. Estos resultados se reprodujeron también en la predicción de los reingresos por ICA en un periodo de 6 meses14. Más recientemente, Husser et al35 han descrito, al estudiar a 228 pacientes con estenosis aórtica sometidos a implante percutáneo de válvula aórtica, que la evolución longitudinal de los valores de CA-125 predecía el resultado clínico adverso después de la intervención. Además, se ha descrito que, en una cohorte de pacientes ingresados por ICA, el alta con tratamiento de diuréticos de asa a dosis altas se asoció con mayor riesgo de muerte, con la excepción de un subgrupo de pacientes caracterizados por altas concentraciones de nitrógeno de urea en sangre y CA-125, en los que el uso de diuréticos de asa a dosis altas se asoció con tasas de mortalidad ajustadas más bajas15. Por otro lado, el uso de estatinas se ha correlacionado con unas tasas de mortalidad inferiores en los pacientes con ICA, pero solo cuando el CA-125 estaba elevado16.
Otras características, como la amplia disponibilidad, el bajo coste (aproximadamente 2 euros por determinación), concentraciones que no se modifican sustancialmente con la edad y la disfunción renal y la larga semivida (> 1 semana), hacen de este biomarcador un instrumento clínico prometedor en la IC10.
CONCLUSIONESEn los pacientes con ICA, el CA-125 en plasma se correlaciona con la SL, el estado inflamatorio y el pronóstico. Esta glucoproteína ha surgido recientemente como posible nuevo instrumento clínico para la supervisión y ajuste de dosis del tratamiento. El objetivo de este ensayo es evaluar en condiciones controladas el papel del CA-125 en la optimización del tratamiento de los pacientes con un ingreso reciente por ICA.
FINANCIACIÓNEste trabajo cuenta con el apoyo de una subvención del Ministerio de Sanidad español (concesión de la ayuda para el fomento de la investigación clínica independiente, Orden SAS/2377/2010; EC10-108) y el Instituto de Salud Carlos III, Red de Investigación Cardiovascular, Programa 7 (RD12/0042/0010 y RD/12/0042/0068) FEDER.
CONFLICTO DE INTERESESNinguno.
Damos las gracias a los coordinadores del estudio, las enfermeras y el personal de los centros de investigación y, en especial, a todos los pacientes que participaron en este ensayo. Nuestro agradecimiento especial a Marta Peiró, Gemma Romero, Anna Mollar, Estefania Montalvo y el personal de INCLIVA (Fundación para la Investigación del Hospital Clínico de la Comunidad Valenciana) por el apoyo logístico e institucional.
Hospital Clínico Universitario, Valencia, España: Julio Núñez, Sergio García-Blas, Juan Sanchis, Vicent Bodí, Enrique Santas, Miryam Olivares, Clara Bonanad, Lourdes Bondanza y Francisco J. Chorro.
Hospital de la Plana, Castellón, España: Maria José Bosch, Pilar Merlos, Jorge Gallego y Patricia Palau.
Hospital de Manises, Manises, Valencia, España: Pau Llàcer, Andrea Mendizábal, Gema Miñana, Valle Pedrosa, Montserrat Salvador, Antonio Camps y Gonzalo Salvador.
Hospital de San Juan, San Juan de Alicante, Alicante, España: Vicente Bertomeu-González, Vicente Bertomeu-Martínez, Alberto Cordero, José Moreno, Juan Quiles y Adriana López Pineda.
Hospital General Universitario, Valencia, España: Lorenzo Fácila, Vicente Montagud, Rosa Fonfria, Maria Teresa Jareño, Joaquina Belchi, Eva Rumiz y Salvador Morell.