La ranolazina se emplea como tratamiento complementario de la angina en pacientes sintomáticos insuficientemente controlados con los tratamientos antianginosos de primera línea. La ranolazina inhibe los canales de sodio operados por voltaje, lo cual indica su posible intervención en el proceso de reperfusión al prevenir la sobrecarga de sodio y calcio que se produce durante la isquemia. En este estudio, se ha caracterizado el efecto de la ranolazina en la homeostasis del calcio en miocitos cardiacos adultos de ratas a las que se aplicó un protocolo de isquemia y reperfusión simuladas.
MétodosSe evaluaron los efectos de la ranolazina en los cambios de la concentración de calcio intracelular en diferentes momentos empleando electroestimulación de campo. El estudio del calcio intracelular se llevó a cabo mediante microfluorimetría utilizando el indicador fluorescente Fura-2 y por microscopia confocal utilizando el indicador Fluo-3.
ResultadosSe observó que los cardiomiocitos a los que se aplicaba la isquemia-reperfusión mostraban un aumento de la concentración de calcio diastólica y una disminución de la amplitud de los transitorios de calcio intracelular. La aplicación de la ranolazina durante la isquemia mejoró significativamente la regulación del calcio evitando la sobrecarga de calcio intracelular, reduciendo la concentración de calcio diastólica, aumentando la carga de calcio en el retículo sarcoplásmico y preservando la amplitud del transitorio de calcio intracelular, lo cual se reflejaba en una recuperación satisfactoria en el proceso de acoplamiento de excitación-contracción durante la reperfusión. Sin embargo, estos efectos de la ranolazina no se produjeron cuando el fármaco se aplicó solo durante la reperfusión o cuando se aplicó tanto en la isquemia como en la reperfusión.
ConclusionesLa ranolazina muestra unos efectos favorables en los cardiomiocitos expuestos a isquemia-reperfusión, pero solo cuando se aplica durante la isquemia. Este efecto se alcanza mejorando la regulación del calcio durante la isquemia.
Palabras clave
La cardiopatía isquémica es la primera causa de muerte en los países occidentales1. La expresión más devastadora de esta enfermedad es el infarto agudo de miocardio con elevación del segmento ST, que se debe a una oclusión arterial coronaria aguda que se sabe que es causa de muerte isquémica de células del miocardio. Después de un infarto agudo de miocardio con elevación del segmento ST, la reperfusión rápida del miocardio mediante un tratamiento trombolítico o una intervención coronaria percutánea primaria es la estrategia más eficaz para reducir el tamaño del infarto y mejorar, por lo tanto, los resultados clínicos2. La terapia de reperfusión tiene una repercusión sustancial en la mortalidad temprana tras un infarto agudo de miocardio con elevación del segmento ST. Sin embargo, en un porcentaje elevado (20-30%) de los pacientes del hospital se produce un remodelado adverso3. Una reperfusión temprana y efectiva limita el grado de necrosis del miocardio al reducir la incidencia del remodelado y la disfunción del ventrículo izquierdo pero, aun con el mejor tratamiento de reperfusión, paradójicamente una parte de los cardiomiocitos muere a causa del restablecimiento del flujo sanguíneo4. Este fenómeno se denomina lesión por isquemia-reperfusión (IR)5.
La privación de oxígeno y la sobrecarga de calcio durante la isquemia cardiaca y la producción de especies moleculares de oxígeno reactivas durante la reperfusión causan la muerte de los cardiomiocitos mediante necrosis y apoptosis6. Los principales cambios adversos que se producen en el miocardio isquémico consisten en un aumento de la concentración de Na+ intracelular a causa de un fallo de la bomba de Na+/K+ del sarcolema en ausencia de energía y acidificación del citosol por la glucolisis anaerobia. La célula intenta resolver este aumento de Na+ intracelular a través de un intercambiador de Na+/Ca2+ (NCX) que actúa a la inversa, expulsando Na+ e introduciendo Ca2+ en las células. Esto da lugar a una sobrecarga intracelular de Ca2+ y una mala regulación del Ca2+ por las células7.
La ranolazina es un derivado de piperazina con un mecanismo de acción novedoso que fue autorizada por primera vez por la Food and Drug Administration en 2006 para el tratamiento sintomático de pacientes con angina crónica. Dadas sus propiedades farmacológicas, es capaz de bloquear la corriente de Na+ tardía (INaL) en los cardiomiocitos y desviar la oxidación de los ácidos grasos hacia la oxidación de la glucosa, lo cual hace que el uso de oxígeno en el corazón sea más eficiente8,9. Sin embargo, el mecanismo de acción de la ranolazina no se conoce con precisión. Los efectos beneficiosos de la ranolazina derivan de su acción de reducción de la entrada de Na+ en las células del miocardio a través de los canales de Na+, que en situaciones patológicas falla durante su inactivación o vuelve a abrirse10. Se ha señalado que la ranolazina reduce la sobrecarga de calcio de las células miocárdicas durante la isquemia al bloquear la INaL9. A las concentraciones plasmáticas terapéuticas (≤ 10-21 mmol/l), la ranolazina inhibe de forma selectiva la INaL, reduce la acumulación intracelular de Na+ y la posterior sobrecarga de Ca2+ inducida por el Na+, así como las anomalías mecánicas, eléctricas y metabólicas en el miocardio isquémico o en insuficiencia11. Sin embargo, a esta concentración12, la ranolazina no modifica el máximo de la corriente de Na+ encargado del paso 0 del potencial de acción, la corriente de entrada de Ca2+, o la actividad del NCX y el intercambiador de Na+/H+.
Actualmente el uso de la ranolazina está autorizado como tratamiento adyuvante de la angina sintomática de pacientes insuficientemente controlados con los tratamientos antianginosos de primera línea12. El desarrollo de una sustancia capaz de inhibir o reducir los efectos nocivos de un aumento patológico de la concentración intracelular de Ca2+ en los cardiomiocitos durante los procesos de isquemia sería una contribución clínica y terapéutica de enorme importancia. En este estudio, se plantea la hipótesis de que la ranolazina pudiera tener una acción novedosa en las intervenciones de reperfusión al prevenir la sobrecarga de Na+ y Ca2+ que se produce en el corazón isquémico y facilitar una mejor regulacion del Ca2+ por las células en la reperfusión.
MÉTODOSLa manipulación de los animales se atuvo a las recomendaciones del Real Decreto 53/2013 en consonancia con la Directiva 2010/63/UE del Parlamento Europeo. El estudio fue aprobado por el Comité Ético de Investigación Humana local del Hospital Universitario Virgen del Rocío de Sevilla y por el Comité de Investigación Animal de la Universidad de Sevilla.
Aislamiento de miocitos ventricularesSe utilizaron ratas adultas Wistar macho, de un peso aproximado de 250-350g, que previamente fueron heparinizadas (4 UI/g por vía intraperitoneal) y anestesiadas mediante la administración intraperitoneal de tiopental sódico (1ml/250g). Se extrajo rápidamente el corazón y se montó en un sistema de perfusión Langendorff con flujo constante. Se aislaron cardiomiocitos ventriculares mediante perfusión de colagenasa de tipo II (251 UI/ml, Worthington Biochemical; Lakewood, New Jersey, Estados Unidos)13. Los cardiomiocitos se mantuvieron en solución de Tyrode (mM): 140 NaCl, 4 KCl, 1,1 MgCl2, 10 HEPES, 10 glucosa, 1,8 CaCl2 (pH 7,4), con un suplemento de 1,8mM CaCl2. Todos los experimentos se realizaron en células de forma alargada a temperatura ambiente (24–26°C).
Determinación del Ca2+ intracelular con microfluorimetríaSe registraron los transitorios de Ca2+ intracelular con el sistema de imagen Incyt hight speed Im2 (Intracellular Imaging Inc.; Imsol, Reino Unido) en cardiomiocitos recién aislados cargados con el marcador de Ca2+ fluorescente Fura-2AM. Durante los experimentos, se realizó una perfusión continua de las células con solución de Tyrode normal (mM) o solución de isquemia simulada (mM): 140 NaCl, 3,6 KCl, 1,2 MgCl2, 1,8 CaCl2, 20 HEPES, 20 lactato-Na y 2 NaCN (pH=6,22). Para provocar los transitorios de Ca2+ intracelular, se aplicó una estimulación de campo a los cardiomiocitos durante todo el experimento a 0,5Hz empleando dos electrodos de platino en paralelo, según un método descrito con anterioridad14.
Determinación del Ca2+ intracelular con microscopia confocalLos experimentos de microscopia confocal se realizaron en cardiomiocitos recién aislados y cargados con Fluo-3AM. Se obtuvieron imágenes con microscopia confocal (Leica TCS SP2 AOBS, objetivo W.I. 63×y N.A. 1,2) mediante el examen de la célula con un láser de argón cada 1,54ms. Con objeto de provocar los transitorios de Ca2+ intracelular, se aplicó a los cardiomiocitos una estimulación de campo a 0,5Hz, según un método descrito con anterioridad14. La carga de Ca2+ del retículo sarcoplásmico se estimó mediante la aplicación rápida de cafeína a cardiomiocitos cargados con Fluo-3, utilizando el Leica SP5, objetivo 40×W.I., N.A. 1,2, con un modo de escáner lineal a 700Hz y un láser de luz blanca de 500nm. En ambos casos, la emisión se detectó a más de 510nm, tal como se ha descrito con anterioridad14,15.
Protocolos de tratamientoGrupo 1: IR. Después de la estabilización con solución de control, se expusieron las células a una isquemia simulada mediante la perfusión de solución isquémica durante 6min, seguido de 10min de reperfusión con solución de control.
Grupo 2: se aplicó la ranolazina al inicio de la reperfusión (IR+Ran). Las células se expusieron durante 6min a isquemia simulada y 10min de reperfusión con la solución de control, que contenía 10μM de ranolazina.
Grupo 3: se aplicó la ranolazina en la isquemia y durante la reperfusión (I+Ran/R+Ran). Se expusieron las células a 6min de isquemia simulada en presencia de 10μM de ranolazina, seguidos de 10min de reperfusión con solución de control, que contenía 10μM de ranolazina.
Grupo 4: se aplicó la ranolazina solamente durante la isquemia (I+Ran/R). Se expusieron las células a 6min de isquemia simulada con 10μM de ranolazina, seguidos de 10min de reperfusión con solución de control.
Empleando de estos protocolos, un 50-60% de los cardiomiocitos a los que se aplicó el protocolo de IR mostraron una hipercontracción significativa en comparación con las células de control.
Análisis de los datosLos datos de los grupos se presentan en forma de media±error estándar de la media. Se utilizó la prueba de la t de Student para datos únicos o apareados para determinar la significación estadística de los datos. Se evaluó la significación de la comparación de múltiples grupos empleando un análisis de la varianza seguido de la prueba de Tukey. Los resultados con un valor de p<0,05 se consideraron significativos. Los fármacos se compraron a Sigma-Aldrich.
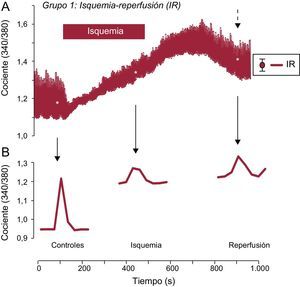
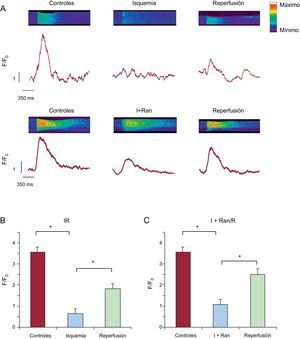
RESULTADOSCambios de Ca2+ intracelular durante la isquemia-reperfusiónSe examinaron los cambios de Ca2+ intracelular en los cardiomiocitos sometidos a IR y a los que se aplicó una estimulación de campo a 0,5Hz. La isquemia indujo una disminución significativa de la amplitud de los transitorios de Ca2+ intracelular, que se recuperó parcialmente después de la reperfusión (figura 1A). Este efecto se acompañó de un aumento de Ca2+ intracelular diastólico durante la isquemia y durante la fase inicial de la reperfusión, que no se restablecía al final de la reperfusión (figura 1B). Tal como se muestra, los valores basales de Ca2+ intracelular eran estables en la situación de control, pero continuaron aumentando durante la isquemia simulada, lo cual impedía la recuperación del aumento transitorio del Ca2+ en la reperfusión.
Efecto de la isquemia-reperfusión en los transitorios de Ca2+ intracelular. A: se muestra el trazado medio de los cambios en los transitorios de Ca2+ intracelular obtenidos en varios cardiomiocitos adultos aislados cargados con el indicador fluorescente Fura-2AM y sometidos a un protocolo de isquemia-reperfusión simuladas; las células se estimularon a una frecuencia de 0,5Hz. B: se muestra un solo aumento del transitorio de Ca2+ intracelular representativo, registrado en la solución de control, durante la isquemia y después de la reperfusión celular. IR: isquemia-reperfusión. La flecha discontinua indica el error estándar de la media, que se muestra a la derecha de la figura A.
* p < 0,05.
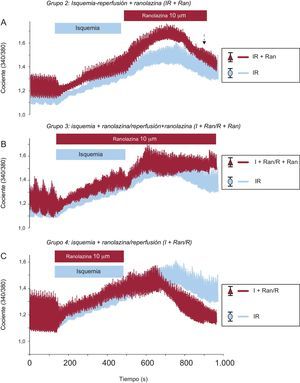
Con objeto de verificar el efecto de la ranolazina en la regulación del Ca2+ intracelular, primero se intentó determinar el momento apropiado para su aplicación. Para ello, se sometieron cardiomiocitos adultos aislados a un protocolo de IR en el que se aplicó el fármaco en tres etapas: a) en el momento de la reperfusión; b) durante la IR, y c) durante la isquemia solamente. En primer lugar, se aplicó la ranolazina (10 μM) al inicio de la reperfusión como tratamiento apropiado para la aplicación clínica durante la angioplastia primaria y, por lo tanto, las células cardiacas se sometieron a una isquemia simulada durante 6min y luego se expusieron a 10min de reperfusión con una solución de control que contenía 1,8mM de CaCl2 y 10μM de ranolazina (figura 2A). Empleando este protocolo, no se observó mejora alguna en el cambio de Ca2+ intracelular. Además, el aumento de Ca2+ intracelular diastólico causado por la isquemia aumentó en mayor medida con la aplicación del fármaco en el momento de la reperfusión.
Efecto de la ranolazina aplicada a diferentes grupos experimentales. Los registros muestran la evolución temporal de los cambios de los valores medios de los transitorios de Ca2+ intracelular registrados en los cardiomiocitos sometidos a isquemia-reperfusión (trazados en azul n=59) y en células tratadas con ranolazina aplicada en diferentes momentos (trazados en rojo). A: ranolazina (10μM) aplicada al inicio de la reperfusión (n=16). B: ranolazina (10μM) añadida durante la isquemia y la reperfusión (n=24). C: ranolazina (10μM) aplicada solo durante la isquemia (n=31). I+Ran/R: isquemia + ranolazina/reperfusión; I+Ran/R+Ran: isquemia + ranolazina/reperfusión + ranolazina; IR: isquemia-reperfusión; IR+Ran: isquemia-reperfusión + ranolazina. La flecha discontinua indica el error estándar de la media, que se muestra a la derecha. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
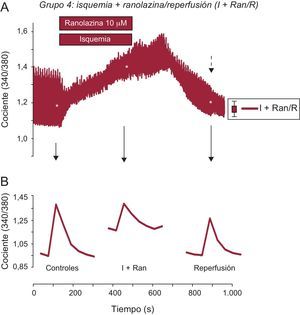
A continuación, con objeto de determinar si la ranolazina tenía un mayor efecto protector cuando se aplicaba durante la IR, se trataron los cardiomiocitos con una solución de isquemia simulada con un suplemento de 10μM de ranolazina durante 6min y se reperfundieron luego con solución de control, también con un suplemento de ranolazina durante 10min. Como resultado de este experimento, se observó un aumento progresivo y sostenido del Ca2+ intracelular diastólico, que no mejoró en ningún momento durante la reperfusión (figura 2B). Por último, se sometieron los cardiomiocitos adultos a 6min de isquemia simulada con un contenido de 10μM de ranolazina, seguidos de 10min de reperfusión en ausencia del fármaco. El aumento de Ca2+ intracelular diastólico generado durante la isquemia se redujo significativamente en la reperfusión con la solución de control (figura 2C). Después de la aplicación de la ranolazina durante la isquemia simulada solamente, el aumento transitorio de Ca2+ intracelular mejoró significativamente en las células cardiacas en comparación con los demás protocolos (figura 3). De hecho, la sobrecarga de Ca2+ generada por la isquemia se redujo significativamente durante la reperfusión en este grupo. Además, la amplitud del transitorio de Ca2+ intracelular se recuperó significativamente durante la reperfusión sin ranolazina (figura 3B).
La adición de ranolazina durante la isquemia restableció la amplitud de los transitorios de Ca2+ intracelular. A: los trazados muestran la media del registro de los transitrios de Ca2+ intracelular en los cardiomiocitos tratados con ranolazina aplicada durante la isquemia (trazo rojo). B: registro representativo de un solo aumento de los transitorios de Ca2+ intracelular que muestra una recuperación significativa en la reperfusión. I+Ran: isquemia + ranolazina; I+Ran/R: isquemia + ranolazina/reperfusión. La flecha discontinua indica el error estándar de la media, que se muestra a la derecha. *Significación estadística. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Un análisis detallado del Ca2+ intracelular diastólico mostró que aumentaba progresivamente, que era mayor en el grupo de IR, y que no recuperaba los valores iniciales en la reperfusión. Mientras tanto, la adición de ranolazina a la solución isquémica produjo un aumento del Ca2+ intracelular diastólico similar durante la isquemia, pero en este caso hubo una recuperación de los valores preisquémicos en la reperfusión sin ranolazina (figura 4A). El tratamiento de las células con ranolazina durante la isquemia restableció el aumento sistólico de Ca2+ intracelular a valores similares a los preisquémicos (figura 4B). El Ca2+ intracelular diastólico se redujo durante la reperfusión en el grupo de I+Ran/R (105,86±3,07%) y fue significativamente inferior a la del grupo de IR (116,65±1,83%) (figura 4C).
La ranolazina restableció los transitorios de Ca2+ intracelular diastólico en la reperfusión, después de la isquemia. A: representación gráfica de los cambios de Ca2+ intracelular diastólico durante el experimento en cardiomiocitos sometidos a isquemia-reperfusión y cardiomiocitos sometidos a I+Ran/R; la concentración de Ca2+ diastólica se recuperó significativamente en las células tratadas con ranolazina. B: el gráfico de barras resume la amplitud de Ca2+ intracelular telesistólica en la solución de control, en isquemia-reperfusión (n=59) y en I+Ran/R (n=30). C: el gráfico de barras resume la amplitud de Ca2+ intracelular telediastólica en la solución de control, en isquemia-reperfusión (n=59) y en I+Ran/R (n=30). I+Ran/R: isquemia + ranolazina/reperfusión; IR: isquemia-reperfusión; NS: no significativo. * p < 0,05.
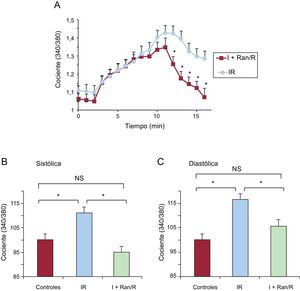
Con objeto de disponer de una mejor perspectiva respecto al proceso de contracción de los cardiomiocitos, se repitieron los experimentos con métodos de imagen confocales utilizando el modelo de escáner lineal14. Mediante el escáner del eje largo de los cardiomiocitos, puede realizarse un seguimiento del «rigor» de las células contracturadas durante la diástole. En primer lugar, se analizaron los transitorios de Ca2+ intracelular, que confirmaron los resultados de las determinaciones del Ca2+ realizadas con microfluorimetría (figura 5). Se observó una notable recuperación de los transitorios de Ca2+ intracelular después de someter a los cardiomiocitos al protocolo de IR empleando ranolazina (10μM) durante la isquemia y retirándola al inicio de la reperfusión (figura 5A). El gráfico de barras de la figura 5B indica una disminución significativa de las amplitudes de los transitorios de Ca2+ intracelular, que se recuperó en parte durante la reperfusión. Al mismo tiempo, en la figura 5C se muestra la recuperación significativa de la amplitud de los transitorios de Ca2+ intracelular que corresponden al protocolo de I+Ran/R. En la figura 5C se muestra también que la amplitud de los aumentos transitorios de Ca2+ intracelular durante la isquemia se mantuvo en presencia de ranolazina, pero no en su ausencia.
Efecto de la ranolazina en los transitorios de Ca2+ intracelular medido con microscopia confocal. A: imágenes del escáner lineal representativas (parte superior) que muestran los transitorios de Ca2+ intracelular en los cardiomiocitos de isquemia-reperfusión y de I+Ran/R estimulados a una frecuencia de 0,5Hz y la amplitud correspondiente de los transitorios (parte inferior). B y C: los gráficos de barras muestran los datos de resumen del cambio de amplitud de los transitorios de Ca2+ intracelular en un experimento como en A (n=4–6). I+Ran: isquemia + ranolazina; I+Ran/R: isquemia + ranolazina/reperfusión; IR: isquemia-reperfusión. * p < 0,05. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
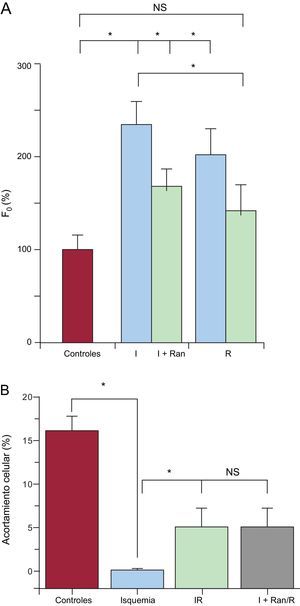
Además, el patrón de Ca2+ intracelular diastólico por microscopia confocal mostró un aumento significativo de Ca2+ intracelular diastólico durante la isquemia y una recuperación mínima con la reperfusión en las células sometidas a IR (figura 6A). Sin embargo, en comparación con el protocolo de I+Ran/R, el aumento de Ca2+ intracelular diastólico durante la isquemia y en la reperfusión fue inferior a los valores obtenidos en el grupo de IR. Por último, la ranolazina no mejoró la recuperación del acortamiento celular en las células sometidas al protocolo de I+Ran/R en comparación con las sometidas a IR (figura 6B).
Cambios en el Ca2+ intracelular diastólico en células tratadas con ranolazina. A: gráfico de barras que compara la amplitud de la concentración de Ca2+ diastólica registrada en la solución de control (rojo), la isquemia y la reperfusión en la isquemia-reperfusión (trazado en azul, n=6) y en la isquemia + ranolazina/reperfusión (trazado en verde, n=4) empleando microscopia confocal. B: acortamiento celular en los cardiomiocitos (n=10) de la solución de control (rojo), la isquemia (azul), la isquemia-reperfusión (verde) y la la isquemia + ranolazina/reperfusión (gris). I+Ran: isquemia + ranolazina; I+Ran/R: isquemia + ranolazina/reperfusión; IR: isquemia-reperfusión; NS: no significativo. * p < 0,05. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
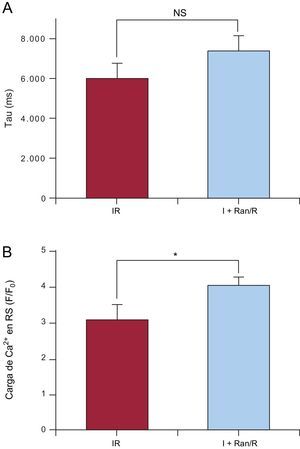
Dado que el NCX es muy importante para la homeostasis del Ca2+ en el miocardiocito adulto, se estudió su intervención en la regulación del Ca2+ durante el protocolo de I+Ran/R. Para ello, utilizó I+Ran/R y, 3min después de la reperfusión, se aplicaron 10mM de cafeína. En presencia de cafeína, se estudió la tau de la recuperación hasta llegar al valor basal del Ca2+, que se debió principalmente a la expulsión de Ca2+ a través del NCX. La ranolazina no modificó este parámetro, lo cual indica que el intercambiador NCX no interviene en el aumento de Ca2+ intracelular producido por la ranolazina durante la isquemia (figura 7A). Sin embargo, el análisis de la carga de Ca2+ en el retículo sarcoplásmico, estimado mediante los transitorios de Ca2+ intracelular provocados por la cafeína, indica que fue mayor en las células tratadas con ranolazina que en las no tratadas, lo cual indica que la ranolazina fomentó la carga del retículo sarcoplásmico en los cardiomiocitos (figura 7B).
Efecto de la ranolazina en el intercambiador de Na+/Ca2+ y la carga de Ca2+ del retículo sarcoplásmico. A: el gráfico de barras muestra el análisis de la reducción de la amplitud de los transitorios de Ca2+ intracelular (tau, en milisegundos) inducida por 10mM de cafeína, que eleva la función del intercambiador de Na+/Ca2+. B: valor máximo de los transitorios de Ca2+ provocados por la cafeína, que estiman la carga de Ca2+ del retículo sarcoplásmico. I+Ran/R: isquemia + ranolazina/reperfusión; IR: isquemia-reperfusión; NS: no significativo; RS: retículo sarcoplásmico. Los datos proceden de células sometidas al protocolo de isquemia-reperfusión y de células tratadas con ranolazina en la isquemia (isquemia + ranolazina/reperfusión). Datos de resumen procedentes de 37 células. * p < 0,05.
Desde comienzos de la década de los años cincuenta, se ha realizado una intensa investigación en el campo de la protección del miocardio, con el objetivo principal de caracterizar los mecanismos celulares y moleculares que intervienen en la protección miocárdica después de que el miocardio haya experimentado un proceso de IR15. En primer lugar, en un estudio previo14, se confirmó la viabilidad del modelo experimental de IR en cardiomiocitos aislados, en los que se pudo analizar los cambios estructurales in vivo y de Ca2+ intracelular que se producen en el proceso de IR14. A continuación, en este estudio se presentan nuevas evidencias que indican que la ranolazina, un fármaco ampliamente utilizado en los tratamientos antianginosos16, puede proporcionar a los cardiomiocitos protección contra la lesión por IR regulando el Ca2+ intracelular de manera independiente de su efecto en la INaL. Empleando dos enfoques diferentes para analizar los cambios de Ca2+ intracelular, se estudiaron los cambios de Ca2+ intracelular en cardiomiocitos sometidos a isquemia y/o reperfusión y el papel de la ranolazina, que es capaz de reducir la sobrecarga de Ca2+ generada en los procesos de IR. En este estudio, se confirma que la aplicación de ranolazina durante la isquemia miocárdica restablece de forma significativa la amplitud de los transitorios de Ca2+ intracelular en la reperfusión. Además, no solo se observó una mejora de la amplitud de los transitorios, sino también que el Ca2+ intracelular diastólico, que se mantenía elevado durante todo el periodo de isquemia, volvía a valores basales después del tratamiento con ranolazina durante la isquemia. Estos datos concuerdan con lo indicado por los estudios de Hwang et al17, en corazones de rata perfundidas en un sistema de Langendorff, a los que se aplicó ranolazina antes de la isquemia. Esos autores observaron que los transitorios de Ca2+ intracelular, abolidos por la interrupción de la función del ventrículo izquierdo después de cierto periodo de isquemia, se restablecían rápidamente durante la reperfusión posisquémica con ranolazina17. Sin embargo, en este estudio, el Ca2+ intracelular residual se mantuvo significativamente alto en comparación con el valor basal previo a la inducción de la isquemia17. Además, en este estudio, el análisis de los transitorios de Ca2+ intracelular provocados por cafeína indica que la ranolazina aumenta la eficiencia de la carga de Ca2+ del retículo sarcoplásmico, lo cual es esencial para conservar un acoplamiento eficiente de la excitación-contracción en los cardiomiocitos después de un periodo de isquemia. Además, el análisis de la constante de tiempo de reducción de los transitorios de Ca2+ intracelular (tau) puso de manifiesto que el tratamiento con ranolazina durante la isquemia no aumentaba la expulsión de Ca2+ a través del NCX. Así pues, el NCX no parece involucrado en el aumento del Ca2+ intracelular diastólico en la reperfusión, cuando se trata a las células con ranolazina durante la isquemia. En consecuencia, debe haber otros mecanismos alternativos que expliquen este efecto de la ranolazina en el Ca2+ intracelular, que será útil investigar.
La mayoría de los estudios previos han aplicado la ranolazina antes de la isquemia17,18. En este caso se aplicó el fármaco una vez iniciada la isquemia y/o en la reperfusión. El objetivo era reproducir lo que podría ocurrir en la situación clínica en que los fármacos deberán administrarse al inicio de la reperfusión. Se observaron efectos beneficiosos significativos en la regulación del Ca2+ intracelular solo cuando la ranolazina se aplicó durante la isquemia, lo cual podría limitar su uso en una aplicación clínica para pacientes con infarto agudo de miocardio con elevación del segmento ST. Sin embargo, se cree que sigue siendo importante comprender estos efectos en la homeostasis del Ca2+ de los cardiomiocitos en la IR.
En las últimas décadas, ha habido una verdadera explosión de información respecto a los cambios de la contractilidad tras el síndrome de IR, como en el caso de los procesos denominados de «miocardio aturdido» (aturdimiento) y de hibernación del corazón19,20. El Ca2+ desempeña un papel central en la regulación de la contracción y la frecuencia cardiaca y se ha asociado a la presencia de cardiopatía, de manera directa o indirecta, y a cambios de comportamiento del Ca2+ intracelular21–23. La sobrecarga de Ca2+ intracelular causa un aumento de la interacción diastólica de los miofilamentos de actina/miosina y el aumento de la presión diastólica ventricular izquierda (p. ej., «rigidez», incapacidad de relajación normal). Este trastorno diastólico se produce a causa de la prolongación de los potenciales de acción y el funcionamiento lento de las bombas bioquímicas, que son necesarias para la recaptación del calcio intracelular24,25. En consecuencia, el trabajo de contracción del miocardio, el consumo de oxígeno y la compresión del espacio vascular durante la diástole pueden ser anormalmente altos. La compresión del espacio vascular da lugar a una reducción del flujo sanguíneo miocárdico, que reduce el aporte de oxígeno, especialmente en la región subendocárdica del ventrículo izquierdo, al tiempo que aumenta la demanda de oxígeno para respaldar el trabajo contráctil. Este patrón de causa-efecto tiene las características de un sistema de «realimentación» positiva nocivo, en el que la isquemia genera aún más isquemia26,27. Con los experimentos realizados con la presente investigación, se demostró que el Ca2+ intracelular diastólico se recuperó de manera significativa en los cardiomiocitos de rata adultos sometidos a un protocolo de IR cuando se aplicó la ranolazina durante la isquemia. Estos datos son coherentes con los resultados de otros estudios18,28, en los que el efecto de la ranolazina se produjo con la inhibición de la INaL utilizando un modelo de corazón completo. La ranolazina redujo la sobrecarga de Ca2+ intracelular, restableciendo unos valores diastólicos posisquémicos próximos a los basales previos a la isquemia. Sossalla et al29 estudiaron el posible efecto de la ranolazina en la sobrecarga diastólica de Na+ y Ca2+ intracelulares y su capacidad de mejorar la función diastólica en las fibras de músculo de los ventrículos de corazones humanos procedentes de pacientes con insuficiencia cardiaca en fase terminal tratados con trasplante de corazón29. Además, para investigar el efecto beneficioso de la ranolazina en la presión diastólica, utilizaron la toxina II de Anemonia sulcata (40nM) para aumentar la concentración de Na+ intracelular en miocitos ventriculares del conejo. En presencia de ranolazina, la INaL, al igual que los valores diastólicos de Na+ y Ca2+ intracelulares, disminuyó en todas las frecuencias de marcapasos. Además, la ranolazina aceleró significativamente la disminución de los transitorios de Ca2+, que inicialmente había pasado a ser más lenta por la acción de la toxina II de A. sulcata30.
CONCLUSIONESEstos resultados ponen claramente de manifiesto que, cuando se administra durante la isquemia, la ranolazina protege a los cardiomiocitos de rata adultos aislados del daño causado por la IR, con lo que mejora el proceso de acoplamiento de excitación-contracción y reduce la sobrecarga de Ca2+ en la reperfusión, lo cual es de gran interés para preservar la contractilidad del corazón contra las lesiones por IR.
FINANCIACIÓNEste estudio fue financiado por el Ministerio de Ciencia e Innovación de España (BFU2013-45564-C2-2), el Instituto de Salud Carlos III (PI12/00941) y la RIC (Red de Investigación Cardiovascular) (RD12/0042/0041; RD12/0042/0030), el Gobierno de Andalucía (PI-0108-2012; P10-CVI-6095) y la ANR (Agence Nationale de la Recherche) francesa (ANR-13-BSV1- 0023-01).
CONFLICTO DE INTERESESNinguno.
Damos las gracias a Florence Lefevbre por su ayuda en el aislamiento de las células.