Palabras clave
INTRODUCCIÓN
Durante el tratamiento percutáneo de las lesiones en bifurcación, el stent del vaso principal es necesariamente deformado cuando se dilata el ramo colateral a través de la estructura metálica del stent. Se han publicado algunos estudios in vitro1-3 de los que se pueden deducir ciertas consideraciones teóricas. Sin embargo, no hay estudios de seguimiento in vivo sobre estos aspectos, y tampoco sobre el tipo de estrategia técnica que podría preservar la normal geometría del stent en el vaso principal. Tampoco se ha analizado el impacto que esta deformación del stent podría tener sobre el resultado a largo plazo del procedimiento. El propósito de este artículo es la investigación de los hallazgos ultrasónicos a los 6 meses de seguimiento en el stent del vaso principal en los pacientes con lesiones en bifurcación que fueron tratados en la era de los stents liberadores de fármacos, así como la influencia de los factores técnicos que intervienen en estos parámetros ultrasónicos.
PACIENTES Y MÉTODO
Pacientes
Nuestra serie está constituida por 55 pacientes con lesiones en bifurcación que fueron tratados mediante la implantación de stents de rapamicina entre junio de 2002 y junio de 2004 y en los que se realizó un estudio de ecografía intracoronaria en la revaluación a los 6 meses. Todos los pacientes cumplieron los siguientes criterios de inclusión: a) lesión localizada en una bifurcación mayor independientemente de la morfología y la angulación; b) vaso principal > 2,5 mm de diámetro; c) ramo colateral ≥ 2,25 mm de diámetro, y d) estenosis significativa con necesidad de tratamiento en ambos ramos. Los pacientes con lesiones difusas en el ramo colateral fueron excluidos del estudio. Se obtuvo el consentimiento informado en todos los pacientes.
Procedimiento
La técnica de implantación de stent de rapamicina en este tipo de lesiones ha sido descrita previamente4,5. Primero se dilató con balón el ramo colateral o ambos vasos. Posteriormente se implantó un stent de rapamicina en el vaso principal a una presión media de 14 ± 2 atmósferas. Seguidamente se introdujo una tercera guía en el ramo colateral y se dilató su origen a través de la estructura metálica del stent del vaso principal. La implantación o no del stent en el ramo colateral se realizó según un proceso de aleatorización entre junio de 2002 y abril de 2003, y de acuerdo con los criterios del operador en los pacientes tratados entre junio de 2003 y junio de 2004. La decisión de realizar inflados simultáneos de balones al final del procedimiento o dilatación con balón más allá de los límites del stent quedó a discreción de los operadores. Esta maniobra se realizó con el mismo balón utilizado para la suelta del stent en el vaso principal y un segundo balón de 15-20 mm de longitud del mismo diámetro que el tamaño de referencia del ramo colateral. La presión de inflado fue inferior a la utilizada para la suelta del stent (6-12 atmósferas). En cualquier caso, la relación balón/arteria para cada una de las partes distales de cada rama fue próxima a 1. En el laboratorio de hemodinámica, los pacientes recibieron un bolo de 1-2 mg/kg de heparina intravenosa no fraccionada, seguido de heparina de bajo peso molecular (Fragmin®) 10.000 U anti-Xa/día, ticlopidina 500 mg/día y aspirina 150 mg/día durante el primer mes. Después de este régimen inicial los pacientes continuaron con clopidogrel y aspirina durante 1 año. La protamina se administró al final del procedimiento y permitió la retirada inmediata de la vaina femoral. La versión 4.1.1 del CAAS II se utilizó para efectuar la angiografía cuantitativa. Se utilizó el catéter guía relleno de contraste como referencia. Los parámetros angiográficos cuantitativos se obtuvieron en condiciones basales inmediatamente posprocedimiento y durante el seguimiento.
Estudio de seguimiento
Los pacientes fueron seguidos estrechamente por contacto telefónico y se programó un segundo cateterismo a los 6 meses o antes, en presencia de síntomas. El estudio angiográfico cuantitativo se realizó en la misma proyección que durante el procedimiento y la reestenosis fue definida como una estenosis > 50% durante el seguimiento en el ramo principal o colateral. Todo el estudio ultrasónico se efectuó después de un bolo intracoronario de nitroglicerina (450 µg), con un catéter EndoSonics® de 3,5 Fr. Las mediciones ultrasónicas fueron obtenidas en el vaso principal en los bordes, en el diámetro mínimo de la luz, en el punto inmediatamente tras la salida del ramo colateral y en el de máxima expansión. Los segmentos de referencia proximal y distal se seleccionaron a 1 cm de los bordes del stent. En cada punto del estudio obtuvimos las siguientes mediciones: área de la elástica externa, área del stent y área de la luz.
Estudio estadístico
Los datos se expresan como media ± desviación estándar (DE). El test de Student-Fisher para datos no emparejados se utilizó en la comparación de medias procedentes de diferentes grupos de pacientes. El coeficiente de regresión lineal de Pearson (r) se utilizó en la correlación entre presiones de inflado y parámetros ultrasónicos. Los valores de p < 0,05 fueron considerados estadísticamente significativos.
RESULTADOS
Datos basales y de procedimiento
Los datos clínicos basales se resumen en la tabla 1. La mayoría de los pacientes fue ingresada por angina inestable, y 26 eran diabéticos. La lesión diana se localizó frecuentemente en la arteria descendente anterior-ramo diagonal. Los datos angiográficos y de procedimiento se resumen en la tabla 2. Los inhibidores de la glucoproteína IIb/IIIa se utilizaron a discreción de los operadores y se aplicaron en el 53% de los casos.
Curso hospitalario y resultados al mes de seguimiento
En todos los pacientes se obtuvo éxito angiográfico. Un paciente desarrolló un infarto sin onda Q de acuerdo con las determinaciones seriadas de la creatincinasa (CK). El pico posprocedimiento de CK alcanzó las 102 ± 127 U/l. En el vaso principal, el diámetro mínimo de la luz medido angiográficamente aumentó tras el procedimiento de 0,81 ± 0,5 a 2,71 ± 0,4 mm. En el ramo colateral, el diámetro mínimo de la luz aumentó de 0,87 ± 0,4 a 1,96 ± 0,4 mm.
Seguimiento clínico y angiográfico
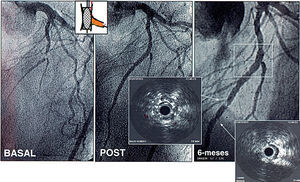
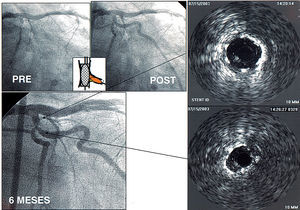
El tiempo de seguimiento medio fue de 11 ± 3 meses. El estudio angiográfico a los 6 meses mostró una reducción en el diámetro mínimo de la luz en el vaso principal de 2,71 ± 0,4 a 2,44 ± 0,5 mm, y en el ramo colateral de 1,96 ± 0,4 a 1,7 ± 0,4 mm. Dos pacientes desarrollaron reestenosis en el vaso principal y uno en el ramo colateral. El sitio de reestenosis fue el cuerpo del stent distal en el punto de la bifurcación en un paciente (fig. 1) e inmediatamente debajo del origen del ramo colateral en otro (fig. 2). El paciente con reestenosis en el ramo colateral había sido tratado con stents en ambos ramos e inflado simultáneo de balones al final del procedimiento. En los 2 casos de reestenosis, en el ramo principal se realizó redilatación de la lesión diana, y el paciente con reestenosis en el origen del ramo colateral fue seguido con tratamiento médico. En 2 pacientes adicionales se realizó una nueva revascularización fuera de la bifurcación. No registramos eventos cardíacos mayores adicionales durante el período de seguimiento en los 51 pacientes restantes.
Fig. 1. Lesión en la bifurcación localizada en la arteria descendente anterior-ramo diagonal, tratada con stents en el vaso principal y dilatación del ramo colateral. En el seguimiento se pueden observar 2 puntos de reestenosis focal intra-stent, pero alejada del punto de la bifurcación (cuadrado).
Fig. 2. Paciente con una lesión en bifurcación tratada mediante implantación de stent en el vaso principal y dilatación con balón del ramo colateral. A los 6 meses se observa una reestenosis focal en el punto inmediatamente tras la salida del ramo colateral. Además de cierto grado de inexpansión del stent se precisó una proliferación neointimal para producir una reestenosis focal en esa zona.
Estudio ultrasónico a los 6 meses
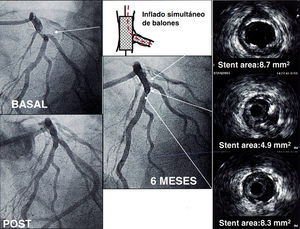
En la tabla 3 se resumen los hallazgos ultrasónicos a los 6 meses en los diferentes puntos estudiados en el vaso principal. Observamos una pequeña diferencia entre el área del stent y el área de la luz en los segmentos analizados, como consecuencia de una reducida proliferación neointimal conseguida con la liberación del fármaco. El área del stent a lo largo del segmento stentado no fue uniforme. Así, el área del stent y de la luz inmediatamente bajo el origen del ramo colateral fue significativamente más pequeña que en la máxima expansión (7,0 ± 2,1 y 6,7 ± 1,8 frente a 5,5 ± 1,4 frente a 5,1 ± 1,3 mm²; p < 0,05) (figs. 3 y 4). La influencia del inflado simultáneo de los balones en ambas ramas al final del procedimiento sobre esta deformación del stent a los 6 meses y los demás parámetros ultrasónicos se resume en la tabla 4. Como puede observarse, no hubo diferencias significativas entre las medidas de los segmentos de referencia o los bordes proximales y distales. Una pequeña diferencia, aunque significativa, apareció en el área del stent en la máxima expansión entre los pacientes que fueron tratados con inflado simultáneo de balón frente a aquellos en los que no se realizó esta maniobra (tabla 4). Esto fue debido a que el doble balón en el segmento proximal produjo cierta sobredimensión de esta parte del stent (fig. 5). Sin embargo, en términos de área del stent o área de la luz no hubo diferencias en el punto inmediatamente por debajo de la salida del ramo colateral (tabla 4 y fig. 6). Las mediciones ultrasónicas fueron similares entre los pacientes con o sin stent en el ramo colateral (tabla 5). La relación balón/arteria en el ramo principal no tuvo influencia sobre las áreas de la luz o del stent en el punto inmediatamente tras la salida del ramo colateral o en la máxima estenosis. Así, los pacientes con relación balón/arteria ≥ 1 (n = 31) frente a los que tenían dicha relación menor de 1 (n = 24) mostraron las siguientes áreas: a) stent en máxima estenosis, 5,0 ± 1,6 frente a 5,0 ± 1,1 mm² (p = NS); b) stent bajo la salida del ramo colateral, 5,6 ± 1,5 frente a 5,5 ± 1,2 mm² (p = NS); c) luz en máxima estenosis, 4,5 ± 1,5 frente a 4,6 ± 1,1 mm² (p = NS), y d) luz bajo la salida del ramo colateral, 5,1 ± 1,4 frente a 5,0 ± 1,2 mm² (p = NS).
Fig. 3. Bifurcación en la descendente anterior-ramo diagonal, tratada mediante stent en ambos vasos. Se realizó un inflado simultáneo de balones al final del procedimiento y, a pesar de ello, se observa una reducción del área del stent inmediatamente tras la salida del ramo colateral, que contrasta con los segmentos proximales o distales.
Fig. 4. Lesión localizada en una bifurcación en el tronco común de la coronaria izquierda que se trató con stents hacia la descendente anterior y dilatación con balón del origen de la arteria circunfleja. La ecografía intracoronaria en la descendente anterior inmediatamente bajo el origen de la arteria circunfleja muestra cierto grado de inexpansión del stent; sin embargo, el estudio angiográfico de seguimiento a los 6 meses demuestra un excelente resultado sobre todos los segmentos tratados en la bifurcación. Cx: circunfleja; DA: descendente anterior; TCI: tronco común de la arteria coronaria izquierda.
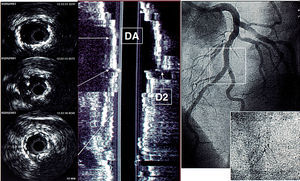
Fig. 5. Lesión en bifurcación en la arteria descendente anterior-ramo diagonal, tratado mediante stents en ambos vasos. El inflado simultáneo de balones produjo un aumento del área del stent en el segmento proximal, pero en el punto inmediatamente bajo el ramo diagonal se observa una reducción en el área del stent comparado con los segmentos proximales o distales. DA: descendente anterior; D2: segunda diagonal.
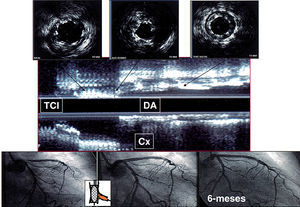
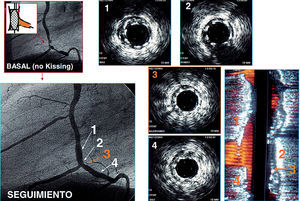
Fig. 6. Ejemplo de un paciente con lesión en la bifurcación localizada en la coronaria derecha. El stent del vaso principal mantiene una geometría homogénea tras la salida del ramo colateral, y no se observa ningún tipo de deformación a pesar de no haber utilizado un inflado simultáneo de balones al final del procedimiento. 1. Stent proximal. 2. En la salida del ramo colateral. 3. Inmediatamente tras la salida del ramo colateral. 4. Stent distal. A la derecha se observa una reconstrucción longitudinal de la bifurcación stentada.
No hubo correlación entre las presiones de inflado utilizadas en la implantación del stent y la presencia de infraexpansión de éste. Los coeficientes de correlación (r) entre la presión de inflado y los parámetros ultrasónicos fueron los siguientes: a) área del stent en máxima estenosis, r = 0,18 (p = NS); b) área del stent bajo la salida del ramo colateral, r = 0,12 (p = NS); c) área de la luz en el punto de máxima estenosis, r = 0,21 (p = NS), y d) área de la luz bajo la salida del ramo colateral, r = 0,13 (p = NS). El efecto de la dilatación con balón más allá de los límites del stent en el vaso principal sobre los parámetros ultrasónicos a los 6 meses se resume en la tabla 6. Las áreas de los bordes proximal y distal fueron casi idénticas en pacientes en los que se realizó esta dilatación fuera del stent frente a aquellos en los que no se realizó. Ninguno de los pacientes de esta serie desarrolló reestenosis en los bordes del stent.
DISCUSION
Los hallazgos ultrasónicos durante el seguimiento tras la implantación con éxito de stents liberadores de fármacos han sido recientemente comunicados en la bibliografía en lesiones complejas no bifurcadas6-10. Estos estudios han demostrado la eficacia de estos dispositivos en la inhibición de la proliferación neointimal en las lesiones de novo y en la reestenosis intra-stent. A diferencia de los stents convencionales11, no parece necesario realizar una expansión agresiva de la prótesis durante el implante cuando se usan stents liberadores de fármacos. Sin embargo, algunos autores han sugerido que la inexpansión del stent inmediatamente tras el procedimiento se asoció con una mayor tasa de reestenosis en ciertos grupos de lesiones coronarias12.
Deformación del stent del vaso principal en las lesiones en bifurcación
Los estudios in vitro han revelado que el stent se deforma cuando se dilata lateralmente su estructura metálica para alcanzar el ramo colateral1-3. Básandose en estos estudios, se ha propuesto la utilización del inflado simultáneo de balones para evitar este fenómeno. Sin embargo, todavía no hay información in vivo disponible. Nuestro estudio indica que cierto grado de deformación del stent inmediatamente debajo del origen del ramo colateral es un hallazgo frecuente después de la utilización de stents liberadores de fármacos en lesiones en bifurcación. Esta deformidad del stent no se previene por el uso del inflado simultáneo de balones al final del procedimiento (tabla 4) o por el tipo del tratamiento en el ramo colateral (tabla 5). La discordancia de nuestros hallazgos con los estudios experimentales puede ser explicada por la ausencia de desplazamiento de placa hacia el ramo colateral en los estudios in vitro, no precisándose en estos casos una dilatación agresiva de éste. También puede influir la posible manipulación que el investigador puede hacer con los inflados, insistiendo a más presión en uno u otro balón según convenga para conseguir una buena geometría del stent. In vivo se efectúan algunos inflados sin poder controlar la deformidad remanente del stent tras ellos.
Aunque esta deformación podría ser la causante de un aumento de la reestenosis, nuestro estudio no confirma esta teoría. Así, solamente un paciente desarrolló reestenosis en este punto (fig. 2). Como se puede observar en la figura 2, a pesar de la deformación del stent se necesita una proliferación neointimal exagerada para causar esta reestenosis focal. Nuestros hallazgos son consistentes con otro estudio clínico de stents de rapamicina en bifurcaciones13 en el que se comunicó una baja tasa de reestenosis en el stent del ramo principal en contraste con la del origen del ramo colateral.
Finalizar el procedimiento con un inflado simultáneo de balones ha sido sistemáticamente recomendado durante la era de los stents convencionales14; sin embargo, no hay estudios que demuestren una reducción significativa de la reestenosis o de los eventos cardíacos tardíos tras la realización de esta maniobra15. En la era actual de los stents liberadores de fármacos, la necesidad de terminar el procedimiento con un inflado simultáneo de balones persiste como tema de controversia. Los autores que utilizan la técnica de crush han recomendado el uso sistemático de esta maniobra porque los resultados tardíos de los pacientes con inflado simultáneo de balones fue mejor que los de aquellos en los que no se realizó16-18. Sin embargo, nosotros creemos que la recomendaciones en los pacientes tratados con crush no son aplicables a la estrategia de stent provisional para el ramo colateral. Tras la implantación del stent del vaso principal, las series que utilizan el crush crush y comunicados en la bibliografía en el grupo que no recibió dilatación en kissing probablemente no recibieron posdilatación del ramo colateral. Es posible que esto pueda influir en las tasas de reestenosis que describen los autores en el origen del ramo colateral16-18.
Finalmente, creemos que estos resultados no son extrapolables al tratamiento de bifurcaciones con stents no recubiertos o con otros tipos de stents liberadores de fármacos con mayor pérdida luminal que los stents de rapamicina. En estos casos, una menor área del stent posprocedimiento puede predisponer a una mayor tasa de reestenosis en caso de pequeño o moderado crecimiento neointimal en esta zona.
Dilatación más allá de los límites del stent y reestenosis de los bordes
La reestenosis en los segmentos adyacentes a los bordes proximales y distales del stent ha sido una preocupación adicional cuando se utilizaban stents radiactivos o liberadores de fármacos19,20. En el SIRIUS, la reestenosis de los bordes ocurrió en un 5,8% de los pacientes20. Evitar la dilatación con balón más allá de los límites del stent parece una estrategia razonable; sin embargo, la influencia de esta maniobra en los parámetros ultrasónicos en los bordes no ha sido estudiada. Nuestro estudio muestra un área luminal en los bordes proximales y distales del stent prácticamente idéntica en pacientes con dilatación o no más allá de los bordes del stent. Por otra parte, ninguno de nuestros pacientes revaluados con ecografía intracoronaria desarrolló reestenosis en los bordes. Así, los stents liberadores de rapamicina parecen tener un efecto protector sobre la reestenosis de los bordes en los pacientes con o sin dilatación con balón más allá de los límites del stent.
Limitaciones del estudio
El tamaño de los grupos puede resultar reducido y, por tanto, el estudio podría no tener la suficiente potencia estadística para poder detectar pequeñas diferencias significativas. La falta de aleatorización de la técnica (inflado simultáneo de balones al final del procedimiento o dilatación fuera de los bordes) podría introducir un sesgo en el estudio, ya que la decisión técnica fue dejada a criterio de los operadores. Por último, la ausencia de estudios ultrasónicos inmediatamente posprocedimiento también podría dificultar la interpretación de nuestros hallazgos.
CONCLUSIONES
Los estudios con ultrasonidos durante el seguimiento en pacientes con lesiones en bifurcación tratadas con stents de rapamicina en el ramo principal y stent provisional en el ramo colateral muestran cierto grado de inexpansión del stent inmediatamente tras la salida del ramo colateral. Esta deformidad no fue prevenida por el inflado simultáneo de balones al final del procedimiento y no tuvo impacto significativo sobre la incidencia de reestenosis. Los parámetros ultrasónicos en los bordes fueron similares en los pacientes con o sin dilatación más allá de los límites del stent.
Véase editorial en págs. 1261-5
Correspondencia: Dr. M. Pan.
AININCAR.
Apartado Postal 2031. 14080 Córdoba. España.
Correo electrónico: grupo_corpal@arrakis.es