Objetivo
El objetivo de nuestro estudio fue evaluar la función diastólica del ventrículo izquierdo por estudio ecocardiográfico en jóvenes (< 40 años) asintomáticos con diabetes mellitus tipo 1 sin síntomas cardiovasculares, y analizar los factores asociados a disfunción diastólica del ventrículo izquierdo (DDVI) en estos pacientes.
Pacientes y Métodos
Fueron estudiados 35 diabéticos tipo 1 (edad media de 27,8 ± 7,5 años) sin síntomas cardiovasculares y 54 controles sanos (edad media de 26,1 ± 4,1 años). Se realizó una anamnesis, exploración física, analítica general y estudio eco-Doppler.
Resultados
El DDVI estuvo presente en 13 (37,1%) de los pacientes diabéticos y en ninguno de los pacientes control. En el grupo de diabéticos encontramos un índice entre la velocidad de llenado precoz y llenado tardío (auricular) significativamente menor que en el grupo control (1,1 ± 0,3 frente a 1,5 ± 0,2; p < 0,01) y un tiempo de relajación isovolumétrico mayor que en el grupo control (104 ± 11 frente a 79 ± 11; p < 0,01). Los diabéticos con DDVI tenían una mayor edad, en su mayoría eran varones, tenían un peor control glucémico, más alteración del metabolismo lipídico y mayores concentraciones de microalbuminuria que aquellos sin DDVI.
Conclusión
La DDVI es frecuente en diabéticos jóvenes sin síntomas cardiovasculares. Estos estudios sugieren que la presencia en estos pacientes de una mayor edad, sexo masculino, pobre control glucémico, metabolismo lipídico alterado y microalbuminuria puede asociarse a una DDVI que, en ausencia de enfermedad cardiovascular, podría ser una alteración preclínica potencialmente relacionada con el subsiguiente desarrollo de miocardiopatía diabética.
Palabras clave
Diabetes mellitus
Ecocardiografía Doppler
Miocardiopatía
INTRODUCCIÓN
La función sistólica del ventrículo izquierdo se encuentra con frecuencia afectada en los pacientes con diabetes mellitus (DM), especialmente cuando es de larga evolución 1. Sin embargo, la función diastólica sólo ha despertado interés en los últimos años gracias a exploraciones no invasivas, como la ecocardiografía y la ventriculografía isotópica, que han permitido demostrar la presencia de una alteración funcional del miocardio en los diabéticos sin sintomatología cardiovascular 2,3. La mayor incidencia de episodios de insuficiencia cardíaca y muerte tras un infarto agudo de miocardio en los diabéticos 4, así como la alta prevalencia de esta enfermedad en los pacientes diagnosticados de miocardiopatía dilatada idiopática 5, han llevado a plantear, desde un aspecto epidemiológico, la existencia de una enfermedad miocárdica propia del diabético.
La afectación del miocardio del diabético no asociada a aterosclerosis coronaria ni a hipertensión arterial (HTA) se ha denominado durante años miocardiopatía diabética, pero en la actualidad se prefiere el término enfermedad muscular cardíaca del diabético (EMCD) por ajustarse mejor a las definiciones nosológicas 6. Su patogenia se considera multifactorial, y se han implicado alteraciones en la microcirculación del miocardio 7, cambios metabólicos 8 y neuropatía autonómica cardíaca 9, lo que conlleva el depósito de colágeno en su intersticio, la hipertrofia de los miocitos y el depósito de lípidos en el interior de éstos 10-12. La consecuencia de todos estos cambios estructurales es la alteración del funcionamiento miocárdico, que comienza con disfunción diastólica del ventrículo izquierdo (DDVI) y, en fases posteriores, disfunción sistólica de este ventrículo 13.
La presencia de DDVI en los diabéticos sin cardiopatía isquémica ni HTA puede considerarse un marcador precoz de EMCD 14. Para el diagnóstico de DDVI se empleó inicialmente el cateterismo cardíaco 15, pero en la actualidad se utilizan métodos no invasivos: ventriculografía isotópica 16 y ecocardiografía 17, los cuales conservan una buena correlación diagnóstica 18. De ellos, la ecocardiografía es el método más utilizado debido a su mayor difusión, alta rentabilidad y ausencia de complicaciones 19.
La búsqueda de factores de riesgo asociados a la presencia de EMCD que permitan intervenir precozmente y retrasar, cuando no impedir, su desarrollo ha originado una serie de estudios con resultados muy dispares 20-22. El objetivo de este trabajo persigue analizar por métodos ecocardiográficos la función diastólica del ventrículo izquierdo en un grupo de jóvenes con DM tipo 1 sin sintomatología cardíaca, así como establecer una posible relación entre la presencia de DDVI y los hallazgos exploratorios y analíticos en estos pacientes. PACIENTES Y MÉTODOS
Pacientes
Durante el período comprendido entre marzo de 1998 y enero de 1999 se han preseleccionado para el estudio 43 pacientes con DM tipo 1, de ambos sexos, con edades comprendidas entre 18 y 40 años, atendidos de forma consecutiva en las consultas del Servicio de Medicina Interna y Endocrinología del Complejo Hospitalario de Albacete, y del Servicio de Medicina Interna del Hospital Comarcal de Hellín (Albacete).
Se trata de un estudio de casos y controles formado por un grupo de personas sanas (grupo control) y un grupo de jóvenes con diabetes tipo 1 (grupo diabéticos), dividiéndose estos últimos, a su vez, en dos subgrupos según tuviesen DDVI (CONDDVI) o no la tuviesen (SINDDVI), con la finalidad de identificar un grupo de diabéticos con mayores riesgos de presentar una EMCD.
Fueron criterios de exclusión los siguientes: estar en tratamiento con cualquier medicamento que no fuese insulina, haber seguido tratamiento con fármacos potencialmente capaces de modificar la función diastólica y tener antecedentes de alcoholismo, hipotiroidismo, HTA, valvulopatía o cardiopatía isquémica. Además, fueron excluidos los que en el electrocardiograma (ECG) no estuviesen en ritmo sinusal, presentasen bloqueo de rama o tuviesen hipertrofia ventricular izquierda de cualquier etiología.
En el grupo de diabéticos se preseleccionaron 43 pacientes, de los que 35 (81,3%) cumplían los criterios de inclusión en el estudio y 8 (18,6%) fueron excluidos: 3 por HTA, 3 por estar en tratamiento con inhibidores de la enzima de conversión de la angiotensina, 1 por presentar en la ecocardiografía una estenosis mitral que desconocía y 1 paciente por hipotiroidismo. A todos se les realizó una historia clínica y una exploración física completa. La presencia de retinopatía se evaluó por el examen de fondo de ojo, efectuado por un oftalmólogo, y se clasificó en ausente, no proliferativa y proliferativa. El diagnóstico de neuropatía clínica se efectuó siguiendo las recomendaciones de la conferencia de San Antonio 23. Se consideró que el paciente era portador de una vasculopatía periférica cuando en la anamnesis se recogía la existencia de claudicación intermitente o en la exploración física los pulsos periféricos estaban ausentes o disminuidos.
La enfermedad coronaria fue excluida por la negatividad de la historia clínica, la normalidad del ECG y por la ausencia de movimientos asinérgicos en la pared ventricular en el registro ecocardiográfico.
El grupo control estuvo formado por 54 voluntarios sanos, donantes de sangre, con edades menores de 40 años, a quienes se realizó historia clínica, exploración física, hemograma, bioquímica elemental y ecocardiograma.
En todos los casos se obtuvo el consentimiento escrito de los pacientes incluidos en el estudio.
Métodos analíticos
Se realizó una extracción de sangre en ayunas para la determinación de glucemia, hemoglobina glucosilada (HbA1C) (por técnica de cromatografía líquida de alta resolución en una columna de intercambio iónico. Diamat, Biorad Laboratories), colesterol total, colesterol HDL, colesterol LDL (según fórmula de Friedewald), triglicéridos, urea y creatinina. En orina de 24 h se determinaron microalbuminuria y creatinina.
Estudio ecocardiográfico
Se efectuó un estudio ecocardiográfico en modo M y bidimensional y un ecocardiograma Doppler con un equipo VINGMET y transductor electrónico de 3,5 MHz. Simultáneamente se realizó ECG y fonocardiográfico.
El registro se llevó a cabo con el paciente en reposo en posición de decúbito lateral izquierdo a unos 30-45º y en espiración mantenida. La medida del flujo de llenado ventricular izquierdo se hizo por ventana apical, colocando el transductor en el borde libre de los velos de la válvula mitral. Las medidas morfológicas se obtuvieron desde el eje largo paraesternal, a partir de un registro ecocardiográfico en modo M, por debajo de la válvula mitral, siguiendo los criterios de la Sociedad Americana de Ecocardiografía 24. Se determinaron los siguientes parámetros morfológicos: a) diámetro ventricular izquierdo telediastólico (DD); b) diámetro ventricular izquierdo telesistólico (DS); c) grosor de la pared posterior del ventrículo izquierdo en diástole (PP); d) grosor del tabique interventricular en diásto-le (TIV); e) masa ventricular izquierda (MVI), que se calculó según la fórmula de Devereux y Reichek 25: 1,04 [(DD + TIV + PP) 3 - DD 3] -13,6, y f) índice de masa del ventrículo izquierdo (IMVI), que se obtuvo con el cociente MVI por el área de superficie corporal. Los parámetros de función sistólica medidos fueron los siguientes: a) fracción de acortamiento del ventrículo izquierdo (FA), según la fórmula 100 × (DD - DS)/DD, y b) fracción de eyección (FE), aceptándose que existía una buena función sistólica cuando la FE era igual o superior al 55%. Los parámetros de función diastólica medidos fueron: a) velocidad pico de la onda de llenado precoz del ventrículo izquierdo (E) en metros/segundo (m/s), tomando como referencia la velocidad del flujo máximo en diástole precoz; b) tiempo de aceleración de la onda E (TA), medido desde el comienzo de la onda E al punto de máxima velocidad; c) tiempo de desaceleración (TD), medido entre el pico de la onda E y la línea basal; d) tiempo de hemipresión (THE), medido como el tiempo en el que se reduce a la mitad el gradiente mitral; e) velocidad pico de la onda de contracción auricular izquierda (A) en m/s, tomando como referencia la máxima velocidad de flujo en telediástole (tras la onda P del ECG); f) índice E/A, como un índice de la relativa contribución de la aurícula al llenado ventricular izquierdo, y g) tiempo de relajación isovolumétrica (TRIV), medido desde el chasquido de cierre aórtico, detectado por Doppler, hasta el inicio de la onda E del flujo mitral.
La exploración fue realizada por un mismo evaluador en todos los casos y la variabilidad intraobservador se determinó con la realización en 10 pacientes de dos registros en el transcurso de una hora, siendo los coeficientes de variación intraobservador menores del 9% en todos los parámetros medidos; además, se promediaron las mediaciones obtenidas en 3 latidos consecutivos y se utilizó más de un índice para la definición de DDVI.
Se consideró que un paciente presentaba DDVI cuando estuvieron presentes las siguientes condiciones: índice E/A inferior a 1, TD superior a 130 ms y TRIV mayor de 100 ms.
Análisis estadístico
El análisis estadístico se realizó utilizando el programa EPI-INFO versión 6.0 y el programa SPSS versión 7.5 para Windows. Las variables continuas se expresaron como media ± desviación estándar y las variables cualitativas en valores absolutos y porcentaje. Para estudiar la asociación entre dos variables de carácter cualitativo se procedió al cálculo de la χ 2, mientras que para la asociación entre dos variables cuantitativas, en función de otra cualidad, se utilizó el análisis de la t de Student o la U de Mann-Whitney, en aquellos casos en los que no se pudo asumir la normalidad de la distribución de los datos. Como medida de asociación se empleó la odds ratio (OR) y su correspondiente intervalo de confianza (IC) del 95%. Se realizó un análisis de regresión logística múltiple para conocer las variables que influían con más fuerza en la presencia de DDVI en el total de personas estudiadas, controles y diabéticos, tomando como variable dependiente la existencia o no de DDVI, y como variables independientes aquellas que en el análisis univariante habían tenido una diferencia estadísticamente significativa (glucemia, HbA1c, colesterol total, colesterol HDL y colesterol LDL), incluyéndose en el análisis la existencia o no de diabetes.
Para conocer qué variables influían de forma independiente en la presencia de DDVI se realizó un análisis de regresión logística múltiple exclusivamente en los diabéticos, teniendo como variable dependiente la presencia o ausencia de DDVI y como variables independientes aquellas que en el análisis univariante habían tenido una diferencia estadísticamente significativa (edad, sexo, colesterol total, colesterol HDL, colesterol LDL, triglicéridos y microalbuminuria). Para la inclusión de las variables en el modelo se siguió el método paso a paso hacia delante. Se tomó el valor de p < 0,05 como indicador de significación estadística. RESULTADOS
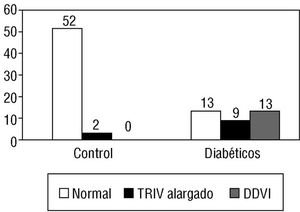
Se incluyeron en el estudio 35 diabéticos de los cuales 22 (62,9%) eran varones y 13 (37,1%) mujeres. La media de edad era de 27,8 ± 7,5 años, con unos extremos entre 18 y 40 años. El tiempo transcurrido desde el diagnóstico de DM fue de 11,1 ± 7,1 años, con un rango entre 3 y 34 años. En 15 (42,8%) pacientes había antecedentes familiares de DM. La glucemia basal tuvo una media de 198 ± 73 mg/dl y la HbA1c de 7,7 ± 1,3%. El grupo control estaba formado por 54 voluntarios sanos, 34 (63%) varones y 20 (37%) mujeres, con una media de edad de 26,1 ± 4,1 años (rango, 22-40 años). En la tabla 1 se comparan las características demográficas y metabólicas entre el grupo de control y el de diabéticos. No observamos predominio del sexo entre los grupos: 34 (63%) varones en el grupo control frente a 22 (62,9%) entre los diabéticos (OR = 1,0; IC del 95% = 0,38-2,65%), encontrando, por definición, diferencias en el metabolismo glucídico entre diabéticos y controles. En la tabla 2 se recogen los parámetros ecocardiográficos en estos grupos. Entre los diabéticos cumplieron criterios de DDVI 13 pacientes (37,1%) y, además, otros 9 (25,7%) tenían un alargamiento patológico del TRIV. Por el contrario, en el grupo control sólo 2 (3,7%) presentaban un alargamiento patológico del TRIV y ninguno DDVI (fig. 1). En el estudio de regresión logística múltiple observamos que las variables independientes asociadas a la presencia de DDVI fueron la glucemia (p < 0,05; R = -0,23; Exp [B] de 0,98 con IC del 95% = 0,97-0,99%), la HbA1C (p < 0,05; R = -0,29; Exp [B]: 0,96 con un IC del 95% = 0,89-0,99%) y el colesterol LDL (p < 0,05; R = -0,37; Exp [B]: 0,95 con un IC del 95% = 0,92-0,98%).
Fig. 1. Distribución de frecuencia de los hallazgos ecocardiográficos de la función diastólica del ventrículo izquierdo encontrados en el grupo de diabéticos y control. DDVI: disfunción diastólica del ventrículo izquierdo; TRIV: tiempo de relajación isovolumétrica.
En la tabla 3 se exponen las características generales de los dos subgrupos de diabéticos según presentasen o no DDVI. Encontramos una mayor proporción de varones (84,6%) en el subgrupo CONDDVI frente al 50% del subgrupo SINDDVI (p < 0,01; OR = 5,2; IC del 95% = 2,5-10,7%). Dentro del subgrupo CONDDVI, 2 (15,3%) pacientes manifestaron antecedentes familiares de enfermedad cardíaca, 6 (46,1%) de DM y 2 (15,3%) de HTA, y en el subgrupo SINDDVI, 5 (22,7%), 9 (40,9%) y 7 (31,8%), respectivamente. Los 2 pacientes que presentaron manifestaciones clínicas de neuropatía periférica pertenecían al subgrupo CONDDVI. En 3 (23%) pacientes del subgrupo CONDDVI se observó retinopatía proliferativa, frente a sólo 1 (4,5%) en el subgrupo SINDDVI; en 3 pacientes de cada subgrupo se encontró retinopatía proliferativa, lo que corresponde al 23% en el subgrupo CONDDVI y el 13,6% en el subgrupo SINDDVI, sin que existieran diferencias estadísticamente significativas. Cuando examinamos los datos de laboratorio entre los dos subgrupos de diabéticos observamos diferencias tanto en el metabolismo de la glucosa como en el lipídico, así como en la cantidad de microalbuminuria excretada en 24 h; estos hallazgos se reflejan en la tabla 4. Se realizó un análisis de regresión logística múltiple en estos pacientes para conocer las variables que se asociaban de forma independientes a la presencia de DDVI; se tomó como variable dependiente la existencia o no de DDVI, y como variables independientes todos aquellos parámetros que en el análisis univariante habían tenido una diferencia estadísticamente significativa: edad, sexo, colesterol total, colesterol LDL, colesterol HDL, triglicéridos y microalbuminuria en orina de 24 h. Sólo los triglicéridos mantuvieron la significación estadística (R = 0,27; Exp [B] de 1,21 con un IC del 95% = 1,01-1,50%), con p < 0,05.
DISCUSIÓN
La DM incide sobre el corazón produciendo dos tipos de complicaciones: la aterosclerosis coronaria 26 y la EMCD 10. La DDVI se considera una fase precoz de la EMCD 14, encontrándose en diabéticos sin sintomatología cardiovascular con una frecuencia que oscila entre el 18% de Uusitupa et al 27 y el 69% de Paillole et al 28; esta amplia diferencia posiblemente se deba a las desiguales selecciones de pacientes, técnicas de exploración y definiciones de DDVI. En nuestra serie, el porcentaje de diabéticos con DDVI fue del 37%, similar al obtenido por otros autores 14,16, y en ninguno de los controles encontramos DDVI; a pesar de ello, en el análisis multivariante, el hecho de ser diabético no constituyó un factor de riesgo per se para el desarrollo de DDVI, pero sí lo fue un mal control del metabolismo de la glucosa, tanto a corto como a medio plazo. Esta discordancia se podría atribuir en parte a que sea el grado de hiperglucemia el que desempeñe un papel en la patogenia de la alteración miocárdica, más que la diabetes en sí.
En nuestro estudio es destacable que la cuarta parte de los diabéticos tuvieran exclusivamente un alargamiento del TRIV, por sólo el 3,7% del grupo control. Es bien sabido que en este período de relajación del miocardio se produce un importante consumo energético, por lo que alteraciones en la utilización de glucosa por el miocito, como sucede en la diabetes, pueden alterar de forma precoz este parámetro. Si tenemos en cuenta que el TRIV es muy sensible en la detección de DDVI y que puede ser una fase inicial en la alteración el llenado ventricular 29, se podría suponer que estos pacientes desarrollarían en fase posteriores una DDVI, posibilidad que se confirmará o no con un seguimiento ecocardiográfico.
Al igual que otros autores 30-32, encontramos que los diabéticos CONDDVI tenían una edad superior a los del subgrupo SINDDVI. Aunque es conocido que la función diastólica sufre un deterioro fisiológico con la edad 33, en nuestro estudio parece poco probable que ésta sea la causa del deterioro en el llenado diastólico, dada la relativa juventud de los pacientes y los resultados claramente patológicos que presentaban.
Con respecto al sexo, hemos observado un mayor porcentaje de varones en el subgrupo CONDDVI, lo que coincide con los hallazgos de otras series 34,35; estos datos podrían hacer suponer que el sexo masculino es un factor predisponente para el desarrollo de DDVI. En este sentido, Airaksinen et al estudiaron la función diastólica en un grupo de mujeres diabéticas menores de 40 años, encontrando que también en el sexo femenino es altamente frecuente la DDVI 36.
En contraste con varios estudios 37-39, no encontramos asociación entre la presencia de DDVI y el tiempo de evolución de la DM, lo que es compartido por otros autores 20,40.
En la patogenia de la EMCD se han implicado diferentes factores responsables de las anomalías que aparecen en el miocardio, ocupando en el momento actual un papel relevante la microcirculación coronaria, tanto por alteraciones estructurales, principalmente el engrosamiento de la pared vascular 41, como por disfunción del endotelio vascular 42. En diversas series, el deterioro de la función miocárdica se ha asociado a complicaciones microvasculares, sobre todo retinianas y renales 43,44, apuntando una base etiológica común que afectase simultáneamente a la microcirculación de diferentes órganos. Así, Guglielmi et al realizaron un estudio en un grupo de jóvenes diabéticos y hallaron en los que presentaban DDVI y microalbuminuria de manera simultánea, unas cifras de presión arterial diastólica, que, aun dentro de la normalidad, eran más elevadas que en aquellos que no presentaban ambas alteraciones. Esta asociación podría hacer suponer la existencia de un vínculo común entre DDVI y microalbuminuria, que posiblemente estuviese relacionado con un aumento del tono vascular 45.
Los resultados obtenidos en el presente estudio apuntan en este sentido, al encontrar una mayor presencia de microalbuminuria en el subgrupo CONDDVI. La explicación patogénica de esta posible relación podría proceder de las observaciones de Shimomura y Spiro, quienes en diabéticos con DDVI y microalbuminuria encontraron una reducción del proteoglicano-heparan-sulfato tanto en la membrana basal glomerular como en la microvasculatura miocárdica 46.
La hiperglucemia mantenida es uno de los factores que clásicamente se han implicado en la patogenia de la EMCD, al conllevar una glucación no enzimática de las proteínas en el miocardio con entrecruzamien-to de las fibras de colágeno y aumento de éste en su intersticio 47. En nuestro estudio encontramos relación entre un mal control glucémico, tanto a corto como a medio plazo, y la presencia de DDVI, lo que coincide con las observaciones de Sanderson et al 13, aunque no con la de otros autores 48,49.
La observación en nuestro estudio de unas concentraciones de lípidos plasmáticos más elevadas en el subgrupo CONDDVI es compartida por Airaksinen et al 36. La implicación de los lípidos plasmáticos, y más concretamente de los triglicéridos, en la patogenia de la EMCD viene avalada por los resultados de dos estudios epidemiológicos: Framingahm y WHO, que encuentran en los triglicéridos un importante factor de riesgo cardiovascular 1,50. Apoyan esta implicación los hallazgos anatomopatológicos del miocardio de estos pacientes, que pone de manifiesto depósitos lipídicos en el miocito 12,51, consecuencia de una mala utilización de la glucosa en la célula miocárdica, que precisa de la obtención de energía a partir de la oxidación de los ácidos grasos. Como resultado, se produce un exceso de triglicéridos que, además de depositarse en el miocito, activa la proteincinasa C, que fosforiliza las proteínas de los canales del calcio del retículo sarcoplásmico y altera su homeostasis y, con ello, la función del miocardio 52.
Limitaciones del estudio
No podemos descartar en nuestro estudio la posibilidad de la existencia subclínica de una enfermedad aterosclerótica de las arterias coronarias, aunque la relativa juventud de los pacientes, la negatividad de la historia clínica, la normalidad del ECG y la ausencia de zonas de discinesia ventricular hacen poco probable esta posibilidad. La realización de otras exploraciones, como prueba de esfuerzo, ventriculografía isotópica y, más aún, el estudio hemodinámico, podría haber ayudado en este sentido.
En conclusión, el deterioro de la función diastólica del ventrículo izquierdo es una alteración frecuente entre los jóvenes con diabetes mellitus tipo 1 sin evidencia de enfermedad cardiovascular. De los resultados obtenidos en nuestro estudio podemos concluir que los diabéticos jóvenes varones de mayor edad, con concentraciones lipídicas más elevadas y presencia de microalbuminuria, pueden corresponder a un grupo de diabéticos con mayor probabilidad de presentar una DDVI, que en ausencia de otra enfermedad cardiovascular puede ser la fase silente o precoz de una EMCD. Creemos que sería interesante realizar un estudio ecocardiográfico a los diabéticos jóvenes con estos factores, con la finalidad de detectar la posible presencia de DDVI, que podría ser el marcador precoz de la existencia de una cardiopatía isquémica silente o de una EMCD. Por otro lado, se precisan estudios longitudinales para valorar el significado clínico de la DDVI en los diabéticos y evaluar el papel que desempeñan los diferentes factores implicados en su patogenia. Así mismo, sería pertinente la realización de ensayos clínicos encaminados a conocer si la corrección de los lípidos plasmáticos o de la microalbuminuria conlleva una mejoría en el llenado diastólico de estos enfermos.
La función sistólica del ventrículo izquierdo se encuentra con frecuencia afectada en los pacientes con diabetes mellitus (DM), especialmente cuando es de larga evolución 1. Sin embargo, la función diastólica sólo ha despertado interés en los últimos años gracias a exploraciones no invasivas, como la ecocardiografía y la ventriculografía isotópica, que han permitido demostrar la presencia de una alteración funcional del miocardio en los diabéticos sin sintomatología cardiovascular 2,3. La mayor incidencia de episodios de insuficiencia cardíaca y muerte tras un infarto agudo de miocardio en los diabéticos 4, así como la alta prevalencia de esta enfermedad en los pacientes diagnosticados de miocardiopatía dilatada idiopática 5, han llevado a plantear, desde un aspecto epidemiológico, la existencia de una enfermedad miocárdica propia del diabético.
La afectación del miocardio del diabético no asociada a aterosclerosis coronaria ni a hipertensión arterial (HTA) se ha denominado durante años miocardiopatía diabética, pero en la actualidad se prefiere el término enfermedad muscular cardíaca del diabético (EMCD) por ajustarse mejor a las definiciones nosológicas 6. Su patogenia se considera multifactorial, y se han implicado alteraciones en la microcirculación del miocardio 7, cambios metabólicos 8 y neuropatía autonómica cardíaca 9, lo que conlleva el depósito de colágeno en su intersticio, la hipertrofia de los miocitos y el depósito de lípidos en el interior de éstos 10-12. La consecuencia de todos estos cambios estructurales es la alteración del funcionamiento miocárdico, que comienza con disfunción diastólica del ventrículo izquierdo (DDVI) y, en fases posteriores, disfunción sistólica de este ventrículo 13.
La presencia de DDVI en los diabéticos sin cardiopatía isquémica ni HTA puede considerarse un marcador precoz de EMCD 14. Para el diagnóstico de DDVI se empleó inicialmente el cateterismo cardíaco 15, pero en la actualidad se utilizan métodos no invasivos: ventriculografía isotópica 16 y ecocardiografía 17, los cuales conservan una buena correlación diagnóstica 18. De ellos, la ecocardiografía es el método más utilizado debido a su mayor difusión, alta rentabilidad y ausencia de complicaciones 19.
La búsqueda de factores de riesgo asociados a la presencia de EMCD que permitan intervenir precozmente y retrasar, cuando no impedir, su desarrollo ha originado una serie de estudios con resultados muy dispares 20-22. El objetivo de este trabajo persigue analizar por métodos ecocardiográficos la función diastólica del ventrículo izquierdo en un grupo de jóvenes con DM tipo 1 sin sintomatología cardíaca, así como establecer una posible relación entre la presencia de DDVI y los hallazgos exploratorios y analíticos en estos pacientes. PACIENTES Y MÉTODOS
Pacientes
Durante el período comprendido entre marzo de 1998 y enero de 1999 se han preseleccionado para el estudio 43 pacientes con DM tipo 1, de ambos sexos, con edades comprendidas entre 18 y 40 años, atendidos de forma consecutiva en las consultas del Servicio de Medicina Interna y Endocrinología del Complejo Hospitalario de Albacete, y del Servicio de Medicina Interna del Hospital Comarcal de Hellín (Albacete).
Se trata de un estudio de casos y controles formado por un grupo de personas sanas (grupo control) y un grupo de jóvenes con diabetes tipo 1 (grupo diabéticos), dividiéndose estos últimos, a su vez, en dos subgrupos según tuviesen DDVI (CONDDVI) o no la tuviesen (SINDDVI), con la finalidad de identificar un grupo de diabéticos con mayores riesgos de presentar una EMCD.
Fueron criterios de exclusión los siguientes: estar en tratamiento con cualquier medicamento que no fuese insulina, haber seguido tratamiento con fármacos potencialmente capaces de modificar la función diastólica y tener antecedentes de alcoholismo, hipotiroidismo, HTA, valvulopatía o cardiopatía isquémica. Además, fueron excluidos los que en el electrocardiograma (ECG) no estuviesen en ritmo sinusal, presentasen bloqueo de rama o tuviesen hipertrofia ventricular izquierda de cualquier etiología.
En el grupo de diabéticos se preseleccionaron 43 pacientes, de los que 35 (81,3%) cumplían los criterios de inclusión en el estudio y 8 (18,6%) fueron excluidos: 3 por HTA, 3 por estar en tratamiento con inhibidores de la enzima de conversión de la angiotensina, 1 por presentar en la ecocardiografía una estenosis mitral que desconocía y 1 paciente por hipotiroidismo. A todos se les realizó una historia clínica y una exploración física completa. La presencia de retinopatía se evaluó por el examen de fondo de ojo, efectuado por un oftalmólogo, y se clasificó en ausente, no proliferativa y proliferativa. El diagnóstico de neuropatía clínica se efectuó siguiendo las recomendaciones de la conferencia de San Antonio 23. Se consideró que el paciente era portador de una vasculopatía periférica cuando en la anamnesis se recogía la existencia de claudicación intermitente o en la exploración física los pulsos periféricos estaban ausentes o disminuidos.
La enfermedad coronaria fue excluida por la negatividad de la historia clínica, la normalidad del ECG y por la ausencia de movimientos asinérgicos en la pared ventricular en el registro ecocardiográfico.
El grupo control estuvo formado por 54 voluntarios sanos, donantes de sangre, con edades menores de 40 años, a quienes se realizó historia clínica, exploración física, hemograma, bioquímica elemental y ecocardiograma.
En todos los casos se obtuvo el consentimiento escrito de los pacientes incluidos en el estudio.
Métodos analíticos
Se realizó una extracción de sangre en ayunas para la determinación de glucemia, hemoglobina glucosilada (HbA1C) (por técnica de cromatografía líquida de alta resolución en una columna de intercambio iónico. Diamat, Biorad Laboratories), colesterol total, colesterol HDL, colesterol LDL (según fórmula de Friedewald), triglicéridos, urea y creatinina. En orina de 24 h se determinaron microalbuminuria y creatinina.
Estudio ecocardiográfico
Se efectuó un estudio ecocardiográfico en modo M y bidimensional y un ecocardiograma Doppler con un equipo VINGMET y transductor electrónico de 3,5 MHz. Simultáneamente se realizó ECG y fonocardiográfico.
El registro se llevó a cabo con el paciente en reposo en posición de decúbito lateral izquierdo a unos 30-45º y en espiración mantenida. La medida del flujo de llenado ventricular izquierdo se hizo por ventana apical, colocando el transductor en el borde libre de los velos de la válvula mitral. Las medidas morfológicas se obtuvieron desde el eje largo paraesternal, a partir de un registro ecocardiográfico en modo M, por debajo de la válvula mitral, siguiendo los criterios de la Sociedad Americana de Ecocardiografía 24. Se determinaron los siguientes parámetros morfológicos: a) diámetro ventricular izquierdo telediastólico (DD); b) diámetro ventricular izquierdo telesistólico (DS); c) grosor de la pared posterior del ventrículo izquierdo en diástole (PP); d) grosor del tabique interventricular en diásto-le (TIV); e) masa ventricular izquierda (MVI), que se calculó según la fórmula de Devereux y Reichek 25: 1,04 [(DD + TIV + PP) 3 - DD 3] -13,6, y f) índice de masa del ventrículo izquierdo (IMVI), que se obtuvo con el cociente MVI por el área de superficie corporal. Los parámetros de función sistólica medidos fueron los siguientes: a) fracción de acortamiento del ventrículo izquierdo (FA), según la fórmula 100 × (DD - DS)/DD, y b) fracción de eyección (FE), aceptándose que existía una buena función sistólica cuando la FE era igual o superior al 55%. Los parámetros de función diastólica medidos fueron: a) velocidad pico de la onda de llenado precoz del ventrículo izquierdo (E) en metros/segundo (m/s), tomando como referencia la velocidad del flujo máximo en diástole precoz; b) tiempo de aceleración de la onda E (TA), medido desde el comienzo de la onda E al punto de máxima velocidad; c) tiempo de desaceleración (TD), medido entre el pico de la onda E y la línea basal; d) tiempo de hemipresión (THE), medido como el tiempo en el que se reduce a la mitad el gradiente mitral; e) velocidad pico de la onda de contracción auricular izquierda (A) en m/s, tomando como referencia la máxima velocidad de flujo en telediástole (tras la onda P del ECG); f) índice E/A, como un índice de la relativa contribución de la aurícula al llenado ventricular izquierdo, y g) tiempo de relajación isovolumétrica (TRIV), medido desde el chasquido de cierre aórtico, detectado por Doppler, hasta el inicio de la onda E del flujo mitral.
La exploración fue realizada por un mismo evaluador en todos los casos y la variabilidad intraobservador se determinó con la realización en 10 pacientes de dos registros en el transcurso de una hora, siendo los coeficientes de variación intraobservador menores del 9% en todos los parámetros medidos; además, se promediaron las mediaciones obtenidas en 3 latidos consecutivos y se utilizó más de un índice para la definición de DDVI.
Se consideró que un paciente presentaba DDVI cuando estuvieron presentes las siguientes condiciones: índice E/A inferior a 1, TD superior a 130 ms y TRIV mayor de 100 ms.
Análisis estadístico
El análisis estadístico se realizó utilizando el programa EPI-INFO versión 6.0 y el programa SPSS versión 7.5 para Windows. Las variables continuas se expresaron como media ± desviación estándar y las variables cualitativas en valores absolutos y porcentaje. Para estudiar la asociación entre dos variables de carácter cualitativo se procedió al cálculo de la χ 2, mientras que para la asociación entre dos variables cuantitativas, en función de otra cualidad, se utilizó el análisis de la t de Student o la U de Mann-Whitney, en aquellos casos en los que no se pudo asumir la normalidad de la distribución de los datos. Como medida de asociación se empleó la odds ratio (OR) y su correspondiente intervalo de confianza (IC) del 95%. Se realizó un análisis de regresión logística múltiple para conocer las variables que influían con más fuerza en la presencia de DDVI en el total de personas estudiadas, controles y diabéticos, tomando como variable dependiente la existencia o no de DDVI, y como variables independientes aquellas que en el análisis univariante habían tenido una diferencia estadísticamente significativa (glucemia, HbA1c, colesterol total, colesterol HDL y colesterol LDL), incluyéndose en el análisis la existencia o no de diabetes.
Para conocer qué variables influían de forma independiente en la presencia de DDVI se realizó un análisis de regresión logística múltiple exclusivamente en los diabéticos, teniendo como variable dependiente la presencia o ausencia de DDVI y como variables independientes aquellas que en el análisis univariante habían tenido una diferencia estadísticamente significativa (edad, sexo, colesterol total, colesterol HDL, colesterol LDL, triglicéridos y microalbuminuria). Para la inclusión de las variables en el modelo se siguió el método paso a paso hacia delante. Se tomó el valor de p < 0,05 como indicador de significación estadística. RESULTADOS
Se incluyeron en el estudio 35 diabéticos de los cuales 22 (62,9%) eran varones y 13 (37,1%) mujeres. La media de edad era de 27,8 ± 7,5 años, con unos extremos entre 18 y 40 años. El tiempo transcurrido desde el diagnóstico de DM fue de 11,1 ± 7,1 años, con un rango entre 3 y 34 años. En 15 (42,8%) pacientes había antecedentes familiares de DM. La glucemia basal tuvo una media de 198 ± 73 mg/dl y la HbA1c de 7,7 ± 1,3%. El grupo control estaba formado por 54 voluntarios sanos, 34 (63%) varones y 20 (37%) mujeres, con una media de edad de 26,1 ± 4,1 años (rango, 22-40 años). En la tabla 1 se comparan las características demográficas y metabólicas entre el grupo de control y el de diabéticos. No observamos predominio del sexo entre los grupos: 34 (63%) varones en el grupo control frente a 22 (62,9%) entre los diabéticos (OR = 1,0; IC del 95% = 0,38-2,65%), encontrando, por definición, diferencias en el metabolismo glucídico entre diabéticos y controles. En la tabla 2 se recogen los parámetros ecocardiográficos en estos grupos. Entre los diabéticos cumplieron criterios de DDVI 13 pacientes (37,1%) y, además, otros 9 (25,7%) tenían un alargamiento patológico del TRIV. Por el contrario, en el grupo control sólo 2 (3,7%) presentaban un alargamiento patológico del TRIV y ninguno DDVI (fig. 1). En el estudio de regresión logística múltiple observamos que las variables independientes asociadas a la presencia de DDVI fueron la glucemia (p < 0,05; R = -0,23; Exp [B] de 0,98 con IC del 95% = 0,97-0,99%), la HbA1C (p < 0,05; R = -0,29; Exp [B]: 0,96 con un IC del 95% = 0,89-0,99%) y el colesterol LDL (p < 0,05; R = -0,37; Exp [B]: 0,95 con un IC del 95% = 0,92-0,98%).
Fig. 1. Distribución de frecuencia de los hallazgos ecocardiográficos de la función diastólica del ventrículo izquierdo encontrados en el grupo de diabéticos y control. DDVI: disfunción diastólica del ventrículo izquierdo; TRIV: tiempo de relajación isovolumétrica.
En la tabla 3 se exponen las características generales de los dos subgrupos de diabéticos según presentasen o no DDVI. Encontramos una mayor proporción de varones (84,6%) en el subgrupo CONDDVI frente al 50% del subgrupo SINDDVI (p < 0,01; OR = 5,2; IC del 95% = 2,5-10,7%). Dentro del subgrupo CONDDVI, 2 (15,3%) pacientes manifestaron antecedentes familiares de enfermedad cardíaca, 6 (46,1%) de DM y 2 (15,3%) de HTA, y en el subgrupo SINDDVI, 5 (22,7%), 9 (40,9%) y 7 (31,8%), respectivamente. Los 2 pacientes que presentaron manifestaciones clínicas de neuropatía periférica pertenecían al subgrupo CONDDVI. En 3 (23%) pacientes del subgrupo CONDDVI se observó retinopatía proliferativa, frente a sólo 1 (4,5%) en el subgrupo SINDDVI; en 3 pacientes de cada subgrupo se encontró retinopatía proliferativa, lo que corresponde al 23% en el subgrupo CONDDVI y el 13,6% en el subgrupo SINDDVI, sin que existieran diferencias estadísticamente significativas. Cuando examinamos los datos de laboratorio entre los dos subgrupos de diabéticos observamos diferencias tanto en el metabolismo de la glucosa como en el lipídico, así como en la cantidad de microalbuminuria excretada en 24 h; estos hallazgos se reflejan en la tabla 4. Se realizó un análisis de regresión logística múltiple en estos pacientes para conocer las variables que se asociaban de forma independientes a la presencia de DDVI; se tomó como variable dependiente la existencia o no de DDVI, y como variables independientes todos aquellos parámetros que en el análisis univariante habían tenido una diferencia estadísticamente significativa: edad, sexo, colesterol total, colesterol LDL, colesterol HDL, triglicéridos y microalbuminuria en orina de 24 h. Sólo los triglicéridos mantuvieron la significación estadística (R = 0,27; Exp [B] de 1,21 con un IC del 95% = 1,01-1,50%), con p < 0,05.
DISCUSIÓN
La DM incide sobre el corazón produciendo dos tipos de complicaciones: la aterosclerosis coronaria 26 y la EMCD 10. La DDVI se considera una fase precoz de la EMCD 14, encontrándose en diabéticos sin sintomatología cardiovascular con una frecuencia que oscila entre el 18% de Uusitupa et al 27 y el 69% de Paillole et al 28; esta amplia diferencia posiblemente se deba a las desiguales selecciones de pacientes, técnicas de exploración y definiciones de DDVI. En nuestra serie, el porcentaje de diabéticos con DDVI fue del 37%, similar al obtenido por otros autores 14,16, y en ninguno de los controles encontramos DDVI; a pesar de ello, en el análisis multivariante, el hecho de ser diabético no constituyó un factor de riesgo per se para el desarrollo de DDVI, pero sí lo fue un mal control del metabolismo de la glucosa, tanto a corto como a medio plazo. Esta discordancia se podría atribuir en parte a que sea el grado de hiperglucemia el que desempeñe un papel en la patogenia de la alteración miocárdica, más que la diabetes en sí.
En nuestro estudio es destacable que la cuarta parte de los diabéticos tuvieran exclusivamente un alargamiento del TRIV, por sólo el 3,7% del grupo control. Es bien sabido que en este período de relajación del miocardio se produce un importante consumo energético, por lo que alteraciones en la utilización de glucosa por el miocito, como sucede en la diabetes, pueden alterar de forma precoz este parámetro. Si tenemos en cuenta que el TRIV es muy sensible en la detección de DDVI y que puede ser una fase inicial en la alteración el llenado ventricular 29, se podría suponer que estos pacientes desarrollarían en fase posteriores una DDVI, posibilidad que se confirmará o no con un seguimiento ecocardiográfico.
Al igual que otros autores 30-32, encontramos que los diabéticos CONDDVI tenían una edad superior a los del subgrupo SINDDVI. Aunque es conocido que la función diastólica sufre un deterioro fisiológico con la edad 33, en nuestro estudio parece poco probable que ésta sea la causa del deterioro en el llenado diastólico, dada la relativa juventud de los pacientes y los resultados claramente patológicos que presentaban.
Con respecto al sexo, hemos observado un mayor porcentaje de varones en el subgrupo CONDDVI, lo que coincide con los hallazgos de otras series 34,35; estos datos podrían hacer suponer que el sexo masculino es un factor predisponente para el desarrollo de DDVI. En este sentido, Airaksinen et al estudiaron la función diastólica en un grupo de mujeres diabéticas menores de 40 años, encontrando que también en el sexo femenino es altamente frecuente la DDVI 36.
En contraste con varios estudios 37-39, no encontramos asociación entre la presencia de DDVI y el tiempo de evolución de la DM, lo que es compartido por otros autores 20,40.
En la patogenia de la EMCD se han implicado diferentes factores responsables de las anomalías que aparecen en el miocardio, ocupando en el momento actual un papel relevante la microcirculación coronaria, tanto por alteraciones estructurales, principalmente el engrosamiento de la pared vascular 41, como por disfunción del endotelio vascular 42. En diversas series, el deterioro de la función miocárdica se ha asociado a complicaciones microvasculares, sobre todo retinianas y renales 43,44, apuntando una base etiológica común que afectase simultáneamente a la microcirculación de diferentes órganos. Así, Guglielmi et al realizaron un estudio en un grupo de jóvenes diabéticos y hallaron en los que presentaban DDVI y microalbuminuria de manera simultánea, unas cifras de presión arterial diastólica, que, aun dentro de la normalidad, eran más elevadas que en aquellos que no presentaban ambas alteraciones. Esta asociación podría hacer suponer la existencia de un vínculo común entre DDVI y microalbuminuria, que posiblemente estuviese relacionado con un aumento del tono vascular 45.
Los resultados obtenidos en el presente estudio apuntan en este sentido, al encontrar una mayor presencia de microalbuminuria en el subgrupo CONDDVI. La explicación patogénica de esta posible relación podría proceder de las observaciones de Shimomura y Spiro, quienes en diabéticos con DDVI y microalbuminuria encontraron una reducción del proteoglicano-heparan-sulfato tanto en la membrana basal glomerular como en la microvasculatura miocárdica 46.
La hiperglucemia mantenida es uno de los factores que clásicamente se han implicado en la patogenia de la EMCD, al conllevar una glucación no enzimática de las proteínas en el miocardio con entrecruzamien-to de las fibras de colágeno y aumento de éste en su intersticio 47. En nuestro estudio encontramos relación entre un mal control glucémico, tanto a corto como a medio plazo, y la presencia de DDVI, lo que coincide con las observaciones de Sanderson et al 13, aunque no con la de otros autores 48,49.
La observación en nuestro estudio de unas concentraciones de lípidos plasmáticos más elevadas en el subgrupo CONDDVI es compartida por Airaksinen et al 36. La implicación de los lípidos plasmáticos, y más concretamente de los triglicéridos, en la patogenia de la EMCD viene avalada por los resultados de dos estudios epidemiológicos: Framingahm y WHO, que encuentran en los triglicéridos un importante factor de riesgo cardiovascular 1,50. Apoyan esta implicación los hallazgos anatomopatológicos del miocardio de estos pacientes, que pone de manifiesto depósitos lipídicos en el miocito 12,51, consecuencia de una mala utilización de la glucosa en la célula miocárdica, que precisa de la obtención de energía a partir de la oxidación de los ácidos grasos. Como resultado, se produce un exceso de triglicéridos que, además de depositarse en el miocito, activa la proteincinasa C, que fosforiliza las proteínas de los canales del calcio del retículo sarcoplásmico y altera su homeostasis y, con ello, la función del miocardio 52.
Limitaciones del estudio
No podemos descartar en nuestro estudio la posibilidad de la existencia subclínica de una enfermedad aterosclerótica de las arterias coronarias, aunque la relativa juventud de los pacientes, la negatividad de la historia clínica, la normalidad del ECG y la ausencia de zonas de discinesia ventricular hacen poco probable esta posibilidad. La realización de otras exploraciones, como prueba de esfuerzo, ventriculografía isotópica y, más aún, el estudio hemodinámico, podría haber ayudado en este sentido.
En conclusión, el deterioro de la función diastólica del ventrículo izquierdo es una alteración frecuente entre los jóvenes con diabetes mellitus tipo 1 sin evidencia de enfermedad cardiovascular. De los resultados obtenidos en nuestro estudio podemos concluir que los diabéticos jóvenes varones de mayor edad, con concentraciones lipídicas más elevadas y presencia de microalbuminuria, pueden corresponder a un grupo de diabéticos con mayor probabilidad de presentar una DDVI, que en ausencia de otra enfermedad cardiovascular puede ser la fase silente o precoz de una EMCD. Creemos que sería interesante realizar un estudio ecocardiográfico a los diabéticos jóvenes con estos factores, con la finalidad de detectar la posible presencia de DDVI, que podría ser el marcador precoz de la existencia de una cardiopatía isquémica silente o de una EMCD. Por otro lado, se precisan estudios longitudinales para valorar el significado clínico de la DDVI en los diabéticos y evaluar el papel que desempeñan los diferentes factores implicados en su patogenia. Así mismo, sería pertinente la realización de ensayos clínicos encaminados a conocer si la corrección de los lípidos plasmáticos o de la microalbuminuria conlleva una mejoría en el llenado diastólico de estos enfermos.
Bibliografía
[1]
Role of diabetes in congestive heart failure. The Framingham study. Am J Cardiol 1974; 34: 29-34.
[2]
Relation of transmitral flow velocity patterns to left ventricular diastolic function: new insights from a combined hemodynamic and Doppler echocardiographic study. J Am Coll Cardiol 1998; 12: 426-440.
[3]
Comparison of pulsed Doppler echocardiography and radionucleotide angiography in the assessment of left ventricular filling. Am J Cardiol 1988; 61: 446-454.
[4]
The efect of diabetes mellitus on prognosis and seral left ventricular function after acute myocardial infarction: contribution of both coronary disease and left ventricular dysfunction to the adverse prognosis. The MILIS study group. J Am Coll Cardiol 1989; 14: 49-57.
[5]
The epidemiology of heart failure: the Framingham study. J Am Coll Cardiol 1993; 22: 6-13.
[6]
WHO Expert Committee on Cardiomyopathies. WHO Tech Rep Ser 1984; 697: 7-64.
[7]
Myocardial small vessel disease in patients with diabetes mellitus. Circulation 1973; 48 (Supl. 4): 6.
[8]
Myocardial cell dysfunction in diabetes mellitus. A review of clinical and experimental studies. Diabetes 1986; 35: 1158-1162.
[9]
Diabetic autonomic neuropathy: present insighits and future prospects. Diabetes Care 1986; 9: 648-665.
[10]
A new type of cardiomyopathy associated with diabetic glomerulosclerosis. Am J Cardiol 1972; 30: 595-602.
[11]
Miguno S, Takeda R. Quantitative approach to the histopathology of the biopsied right ventricular myocardium in patients with diabetes mellitus. Heard and Vessels 1985; 1: 43-47.
[12]
Bases anatomopatológicas de la disfunción ventricular latente en diabéticos insulinodependientes. Rev Esp Cardiol 1998; 51: 43-50.
[13]
Diabetic cardiomyopathy? An echocardiography study of young diabetics. Br Med J 1978; 1: 404-407.
[14]
Evolution of cardiac changes in young insulin-dependent (type I) dibetic patients one more piece of the puzzle of diabetic cardiomyopathy. Clin Cardiol 1993; 16: 784-790.
[15]
Myocardial dysfunction without coronary artery disease in diabetic renal failure. Am J Cardiol 1979; 43: 193-199.
[16]
Radionuclide assessment of left ventricular diastolic filling in diabetes mellitus with and without cardiac autonomic neuropathy. J Am Coll 1986; 7: 1303-1309.
[17]
Determination of left ventricular diastolic filling with pulsed Doppler echocardiography: comparison with cineangiography. Circulation 1985; 71: 543-550.
[18]
Noninvasive assessment of left ventricular diastolic function: analysis of Doppler echocardiography and radionuclide angiographic techniques. J Am Coll Cardiol 1986; 7: 518-526.
[19]
A practical guide to assessment of ventricular diastolic function using Doppler echocardiography. J Am Coll Cardiol 1996; 27: 1753-1760.
[20]
Diastolic abnormalities in young asyntomatic diabetic patients assessed by pulsed Doppler echocardiography. J Am Coll cardiol 1988; 42: 114-120.
[21]
Cardiovascular status in young patients with insulin-dependent diabetes mellitus. Circulation 1994; 90: 357-361.
[22]
Isolated and preclinical impairment of left ventricular filling insulin-dependent and non insulin-dependent diabetic patient. Clin Cardiol 1997; 20: 536-540.
[23]
Report and recomendations of the San Antonio Conference on Diabetes Neuropathy. Diabetes 1988; 37: 1000-1004.
[24]
Recomendation regarding quantitation in M-mode echocardiography: results of a survey of echocardiography mesaurements. Circulation 1987; 58: 1072-1083.
[25]
Echocardiographic determination of left ventricular mass in man. Anatomic validation of the method. Circulation 1977; 55: 613-618.
[26]
Cardiomyopathy syndrome due to coronary artery disease II. Increased prevalence in patients with diabetes mellitus. Br Heart J 1977; 39: 740-747.
[27]
Impairment of diastolic function in middle-aged type 1 (insulin-dependent) and type 2 (non-insulin-dependent) diabetic patients free of cardiovascular diasease. Diabetologia 1988; 31: 783-791.
[28]
Prevalence and significance of left ventricular filling abnormalities determined by Doppler echocardiograhy in young type 1 (inulindependent) diabetic patients. A J Cardiol 1989; 64: 1010-1016.
[29]
Assessment of diastolic function of the heart: Background and current applications of Doppler echocardiograhic. Part II: clinical studies. Mayo Clinic Proc 1989; 64: 181-204.
[30]
Left ventricular diastolic function in young long-term type I (insulin-dependent) diabetic men during exercise assessed by digitized echocariography. Eur Heart J 1988; 9: 395-402.
[31]
Alteraciones anatómicas y funcionales cardíacas en un grupo de jóvenes diabéticos tipo 1 con microangiopatía. Med Clin (Barc) 1992; 98: 405-408.
[32]
Left ventricular diastolic dysfunction in diabetic patients. Q J Med 1994; 87: 519-520.
[33]
Effect of aging on left ventricular diastolic filling in normal subjects. Am J Cardiol 1987; 59: 971-974.
[34]
Which left ventricular function is impaired earlier in the evolution of diabetic cardiomyopathy. Diabetes Care 1994; 17: 633-639.
[35]
Left ventricular function and wall thickness in long-term insulin-dependent diabetes mellitus: an echocardiographic study. J Intern Med 1991; 229: 527-531.
[36]
Impairment left ventricular filling in young femela diabetes. Acta Med Scand 1984; 216: 509-516.
[37]
Left ventricular performance in diabetes patients without clinical heart disease. Evaluation by systolic time intervals and echocardiography. Chest 1977; 17: 788-791.
[38]
Clinically unrecognized ventricular dysfunction in young patients. J Am Coll Cardiol 1984; 4: 234-238.
[39]
Exercise-induced left ventricular dysfunction in young men with asyntomatic diabetes mellitus (diabetic cardiomyopathy). Am J Cardiol 1984; 54: 633-637.
[40]
High prevalence of echocardiographic abnormalities in diabetic youths. Diabetes Care 1983; 6: 18-22.
[41]
Diabetic cardiomyopathy. Diabetes Care 1990; 1169-1179.
[42]
Urinary albumin excretion, cardiovascular disease, and endothelial dysfunction in non-insulin-dependent diabetes melitus. Lancet 1992; 340: 319-323.
[43]
Left ventricular diastolic impairment in type 1 diabetic patients with microalbuminuria. Nephron 1993; 63: 145-151.
[44]
Comparison of echocardiograpic variables between type1 diabetics and normal control. Am J Cardiol 1995; 75: 141-145.
[45]
Impaired left ventricular diastolic function and vasculation associated with microalbuminuria in IDDM patinets. Diabetes Care 1995; 18: 353-360.
[46]
Studies on macromolecular components of human glomerular basement membrane and alterations in diabetes: decreased levels of heparan sulfate proteoglycan and laminin. Diabetes 1987; 36: 374-381.
[47]
Advanced glycosylation end products in tissue and the biochemical basis of diabetic complications. N Engl J Med 1988; 318: 1315-1321.
[48]
Doppler echocardiographic evaluation of left ventricular diastolic function in adolescents with diabetes mellitus. Am J Cardiol 1990; 65: 899-902.
[49]
The relationship of cardiac diastolic dysfunction to concurrent hormonal and metabolic status in type 1 diabetes mellitus. J Clin Endocrinol Metab 1988; 66: 113-118.
[50]
The role of circulating glucose and triglyceride concentrations and their interactions with other «risk factors» as determinants of arterial disease in nine diabetic population samples from the WHO multinational study. Diabetes Care 1983; 6: 361-369.
[51]
Congestive heart faillure in the diabetic. Ann Rev Med 1983; 34: 161-168.
[52]
Role of elevated lipids in diabetic cardiomyopathy. Diabetes Res Clin Pract 1996; 31 (Supl): 67-71.