El propósito de nuestro trabajo es evaluar y cuantificar los cambios en la calidad de vida (CVRS) en pacientes con flutter auricular típico sometidos a ablación con catéter de radiofrecuencia, estandarizados y normalizados para la población española ajustada por edad y sexo.
MétodosHemos analizado a 95 pacientes consecutivos sometidos a ablación del istmo cavotricuspídeo que se han autoaplicado el cuestionario SF-36 antes del procedimiento y al cabo de 1 año de seguimiento. Hemos utilizado nuevas herramientas de medida de CVRS como son el tamaño de efecto y la media de respuesta estandarizada para cuantificar la magnitud del cambio y las diferencias mínimas clínicamente importantes para valorar si los cambios en la CVRS han sido percibidos clínicamente por el paciente.
ResultadosDe los 95 pacientes inicialmente incluidos, 88 completaron el estudio. Se observó una magnitud de cambio grande (tamaño del efecto ≥ 0,8) en las dimensiones función física, rol físico, salud general, vitalidad y componente sumario físico, y una magnitud de cambio moderada (tamaño del efecto ≥ 0,5), en las dimensiones rol emocional, actividad social, salud mental y componente sumario mental. En el análisis de las diferencias mínimas clínicamente importantes, se observó que en todas las dimensiones, excepto dolor corporal y actividad social, se supera el mínimo exigido para que la magnitud del cambio sea percibida clínicamente por el paciente.
ConclusionesSe observa una mejora en la CVRS de un grupo de pacientes con flutter auricular típico sometidos a ablación del istmo cavotricuspídeo después de 1 año del procedimiento.
Palabras clave
El flutter auricular (FlA) típico es una arritmia que se origina en la aurícula derecha por un mecanismo de reentrada alrededor de la válvula tricúspide, en la que el istmo cavotricuspídeo (ICT) forma parte del circuito de la arritmia. Causa el 75-90% de todas las taquicardias por macrorreentrada auriculares1.
La ablación del ICT es una opción de primera línea en el tratamiento del FlA típico recurrente, especialmente en casos de mala tolerancia clínica. También se indica en pacientes en los que el FlA se desarrolla tras el tratamiento farmacológico de la fibrilación auricular (FibA) con fármacos de clase I o III2, 3, 4.
Los estudios realizados han descrito una mejoría de los síntomas y mejor calidad de vida tras la ablación del ICT5, 6, 7, 8. En estos estudios se ha tomado como referencia la población americana y no se ha ajustado por edad y sexo sus valores poblacionales, factores que afectan de forma muy significativa a la calidad de vida.
Además, la medición del estado de salud ha tenido una evolución muy rápida en los últimos años, incorporando nuevas herramientas de medida de la calidad de vida. Las diferencias mínimas clínicamente importantes (MCID) y los cambios mínimos detectables son conceptos que intentan medir el cambio en la calidad de vida tras una intervención (responsiveness) y actualmente constituyen una importante área de investigación.
El objetivo de nuestro trabajo es evaluar los cambios en la calidad de vida en una cohorte de pacientes consecutivos y no seleccionados con FlA dependiente de ICT, enviados para ablación con catéter de radiofrecuencia, estandarizados y normalizados para la población española ajustada por edad y sexo. Además, hemos cuantificado la magnitud del efecto obtenido y hemos expresado el resultado según el concepto de las MCID que indican si el beneficio obtenido en la calidad de vida es suficiente para que el paciente lo perciba como un beneficio significativo en los síntomas.
MétodosPoblaciónSe ha analizado a 95 pacientes consecutivos remitidos al laboratorio de electrofisiología cardiaca desde enero de 2003 hasta marzo de 2005 que cumplían los siguientes requisitos: a) mayores de 18 años; b) 1 o más episodios de FlA documentado en electrocardiograma de 12 derivaciones en los 6 meses previos; c) historia de FlA aislado o predominante si presentaba también FibA concomitante o FlA después de recibir tratamiento antiarrítmico con fármacos tipo I o III para prevención de FibA, y d) confirmación de FlA dependiente del ICT en el estudio electrofisiológico o permeabilidad del ICT si se realiza el procedimiento de ablación en ritmo sinusal. En este caso se exigía que el electrocardiograma del episodio clínico fuera típico común.
Los criterios de exclusión fueron: a) FlA no dependiente de ICT; b) cirugía cardiaca o procedimiento intervencionista cardiaco (angioplastia coronaria o implante de marcapasos) en los 30 días previos; c) portador de desfibrilador implantable; d) expectativa de vida<1 año, y e) imposibilidad de cumplimentar el cuestionario de calidad de vida.
Se ha considerado que un paciente era portador de una enfermedad prevalente, tal como hipertensión arterial, diabetes mellitus, hiperlipemia, enfermedad pulmonar y artrosis, si el diagnóstico había sido establecido por un médico. Se ha definido obesidad si el índice de masa corporal era > 30.
DefinicionesFlutter común: morfología de las ondas de flutter en las derivaciones inferiores caracterizada por una pendiente descendente lenta, seguida de una pendiente descendente abrupta y un ascenso también abrupto para acabar con un componente positivo de baja amplitud que se continúa con el segmento descendente gradual de la siguiente onda de flutter. Las ondas de flutter son positivas en V1 y negativas en V6.
Flutter no común: morfología de las ondas de flutter positivas y anchas y con muescas en derivaciones inferiores con un componente negativo que precede al positivo, y ondas negativas y amplias en V1.
Procedimiento de ablaciónEl procedimiento se realizó con el paciente en ayunas durante un mínimo de 6 h. Se retiró la anticoagulación oral 2 días antes del estudio electrofisiológico y se inició tratamiento con heparinas de bajo peso molecular si la razón internacional normalizada era < 1,5. Se utilizó un catéter tetrapolar estándar (Usci-Bard Inc.) para cartografiar el área de His, un catéter decapolar (Usci-Bard Inc.) para cartografiar el seno coronario y un catéter duodecapolar Halo XP (Cordis-Webster Inc.) para cartografiar activacion de la cara anterolateral de la aurícula derecha. Se aplicó energía de radiofrecuencia durante un lapso de 60 s en cada punto. Se confirmó la dependencia del ICT por medio de encarrilamiento oculto cuando el ritmo al inicio del estudio electrofisiológico era FlA o cuando este se inducía en el laboratorio. Si el paciente estaba en ritmo sinusal, se comprobaba la permeabilidad bidireccional del ICT previa a la ablación. El objetivo del procedimiento fue alcanzar el bloqueo bidireccional en la conducción a través del ICT9, 10. Se definió bloqueo bidireccional a través de la secuencia de activación de los electrogramas en la aurícula derecha, His y seno coronario estimulando a una longitud de ciclo de 600 ms desde seno coronario y desde pared lateral baja de la aurícula derecha. Se comprobó la persistencia del bloqueo bidireccional al cabo de 20 min de haber terminado el procedimiento.
CuestionarioSe ha utilizado como instrumento de medida la calidad de vida relacionada con la salud (CVRS) el cuestionario SF-3611, que se autoaplicaron los pacientes antes del procedimiento de ablación y al cabo de 1 año de seguimiento. Este cuestionario consta de 8 escalas o dimensiones que se transforman en puntuaciones de 0 a 100, de tal forma que a mayor puntuación mejor es el estado de salud11. Existe un ítem adicional, llamado transición del estado de salud, que mide el cambio en el estado de salud en un periodo de 1 año, si bien no se incluye en el análisis con las ocho dimensiones (Tabla 1). Cada una de estas escalas fue estandarizada y normalizada para la población española ajustada por edad y sexo, de tal forma que los valores de referencia tienen una media de 50 y una desviación estándar (DE) de 10. Se definen como desviaciones ligeras las diferencias > 4 puntos, moderadas las > 6 puntos y grandes las > 8 puntos12, 13, 14.
Tabla 1. Escalas del cuestionario Short Form-36
| Escalas o dimensiones | N.o ítems | Resumen del contenido |
| Función física | 10 | Grado en que la salud limita las actividades físicas, tales como el autocuidado, caminar, subir escaleras, inclinarse, coger o llevar pesos y los esfuerzos moderados o intensos |
| Rol físico | 4 | Grado en que la salud física interfiere en el trabajo y en otras actividades diarias, como un rendimiento menor que el deseado, limitación en el tipo de actividades realizadas o dificultad en la realización de actividades |
| Dolor corporal | 2 | La intensidad del dolor y su efecto en el trabajo habitual, tanto fuera de casa como en el hogar |
| Salud general | 5 | Valoración personal de la salud que incluye la salud actual, las perspectivas de salud en el futuro y la resistencia a enfermar |
| Vitalidad | 4 | Sentimiento de energía y vitalidad, frente al sentimiento de cansancio y agotamiento |
| Función social | 2 | Grado en que los problemas de salud física o emocional interfieren en la vida social habitual |
| Rol emocional | 3 | Grado en que los problemas emocionales interfieren en el trabajo u otras actividades diarias, como reducción en el tiempo dedicado a esas actividades, rendimiento menor que el deseado y disminución del esmero en el trabajo |
| Salud mental | 5 | Salud mental general, que incluye depresión, ansiedad, control de la conducta y bienestar general |
| Transición del estado de salud | 1 | Evaluación de la salud general respecto a la de 1 año antes |
Mediante la combinación de las puntuaciones de cada dimensión, el cuestionario permite calcular dos puntuaciones sumario: el componente sumario físico (CSF) y el componente sumario mental (CSM)15.
Para cuantificar la respuesta obtenida, se han medido el tamaño de efecto (TE) y la media de respuesta estandarizada (SRM) para cada escala del cuestionario. El TE se calcula como la diferencia entre los valores medios de cada dimensión entre el seguimiento y el basal dividida por la DE del grupo basal. El SRM se calcula como la diferencia de los valores medios de cada dimensión entre el seguimiento y el basal dividida por la DE de la diferencia entre el seguimiento y el basal. Valores positivos reflejan mejoría en el número de veces que el resultado contiene la DE del grupo basal (TE) o la DE de la diferencia de los grupos (SRM) para cada dimensión16. No tiene unidades y se cuantifica de la siguiente forma: a) efecto grande (≥ 0,8); b) moderado (0,5-0,79); c) pequeño (0,2-0,49), y muy pequeño (0-0,19).
Otra forma de cuantificar el TE es compararlo con la mínima diferencia importante (MID)17, 18. Se define como la diferencia más pequeña medida en el estado de salud que significa una diferencia importante en los síntomas del paciente. Su estimación se basa en la determinación del error estándar de medida (SEM). Se define SEM como el error estándar en un resultado observado que oscurece el resultado verdadero y tiene la cualidad de que su valor es independiente de la muestra18. Esta propiedad lo hace un muy buen estimador de cambios individuales en un indicador de CVRS.
DEx: DE basal de cada dimensión.
rxx: coeficiente de correlación intraclase de las diferencias seguimiento-basal para cada dimensión.
DExx: DE de la diferencia entre los grupos seguimiento y basal.
Se estima que la MID es 1×SEM18. La MID puede utilizarse para estimar la MCID. Se define como la diferencia más pequeña en una puntuación de un ítem que el paciente percibe como beneficiosa y que, en ausencia de efectos secundarios significativos y coste excesivo, determinaría un cambio en el manejo del paciente. Habitualmente la MID y la MCID son similares y, en ausencia de criterio externo, se considera que la MCID es igual a la MID.
Se considera la existencia de efecto suelo o efecto techo si un 15% de los pacientes presentan valores mínimos o máximos posibles, respectivamente, para cada dimensión del cuestionario.
SeguimientoTodos los pacientes fueron programados para seguimiento clínico a los 3, 6 y 12 meses desde la ablación. Cualquier visita realizada tanto al cardiólogo como al servicio de urgencias se registró en la historia clínica electrónica. A los 6 meses del procedimiento, se colocó un Holter de arritmias de 7 días para valoración de eventos asintomáticos. Se mantuvo la anticoagulación oral durante 3 semanas desde el estudio electrofisiológico y posteriormente se realizó anticoagulación oral siguiendo las guías de actuación clínica de la Sociedad Europea de Cardiología19.
Análisis estadísticoPara comparar las escalas del SF-36, se utilizaron las pruebas de la t de Student y la no paramétrica de Mann-Whitney, según la distribución fuese paramétrica o no. Para verificar la normalidad de las distribuciones y la homogeneidad de las varianzas, se utilizaron las pruebas de Kolmogorov-Smirnov y la prueba de Levene, respectivamente. Para comparar los valores de las escalas basal y en el seguimiento tras la ablación, se utilizó la prueba de Wilcoxon para datos apareados. La supervivencia libre de arritmias (FibA/FlA) se expresa mediante curvas de Kaplan-Meier.
Consideraciones éticasEl estudio se ha realizado de acuerdo con los principios de la Declaración de Helsinki de 1975 y fue aprobado por el Comité Ético de Investigación Clínica de Galicia. Todos los pacientes fueron informados y se obtuvo consentimiento escrito.
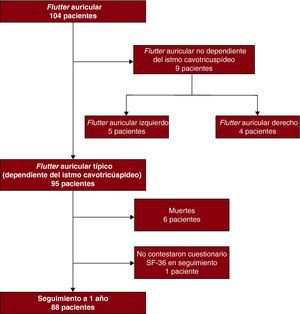
ResultadosCaracterísticas clínicas de los pacientesDe los 104 pacientes enviados consecutivamente al laboratorio de electrofisiología cardiaca por FlA, 95 presentaron un FlA típico (dependiente del ICT) y se los incluyó en el estudio (Figura 1). Las características basales de los pacientes se indican en la Tabla 2. Destaca la presencia de hipertensión arterial en casi el 50% de los pacientes y la ausencia de cardiopatía en el 21%. La cardiopatía más frecuente asociada ha sido la cardiopatía hipertensiva (39%) y un 20% presentó signos de insuficiencia cardiaca. Uno de cada 4 pacientes era obeso y el 40% tenía enfermedad respiratoria significativa. La prevalencia de artrosis significativa fue del 24%.
Figura 1. Diagrama de flujo de pacientes sometidos a estudio electrofisiológico por flutter auricular.
Tabla 2. Características clínicas de los pacientes
| Edad (años) | 64±11 |
| Sexo | |
| Varones | 77 (81,1) |
| Mujeres | 18 (18,9) |
| EPOC | 20 (21,1) |
| Hipertensión | 47 (49,5) |
| Tabaquismo | 45 (47,4) |
| Hiperlipemia | 41 (43,2) |
| Ingesta excesiva de alcohol | 12 (12,6) |
| Obesidad | 25 (26,3) |
| FEVI < 50% | 22 (23,1) |
| Cardiopatía hipertensiva | 37 (38,9) |
| Valvulopatía | 19 (20) |
| Tipo de valvulopatía | |
| Estenosis aórtica moderada | 4 (4,2) |
| Insuficiencia mitral | 12 (12,6) |
| Grado II | 9 (9,5) |
| Grado III | 3 (3,1) |
| Insuficiencia tricuspídea | 3 (3,2) |
| Grado III | 2 (2,1) |
| Grado IV | 1 (1,1) |
| Cardiopatía isquémica | 14 (14,7) |
| Infarto de miocardio previo | 10 (10,5) |
| Insuficiencia cardiaca | 18 (18,9) |
| Miocardiopatía dilatada | 21 (22,1) |
| Tras cirugía cardiaca | 12 (12,6) |
| Tipo de cirugía | |
| Bypass aortocoronario | 8 (8,3) |
| Pericardiectomía | 1 (1,1) |
| Valvular | 3 (3,2) |
| Sin cardiopatía | 20 (21,1) |
| Cor pulmonale | 5 (5,3) |
| Asma bronquial | 5 (5,3) |
| Portador de marcapasos definitivo | 7 (7,4) |
| Insuficiencia renal crónica | 8 (8,4) |
| Distrofia muscular de Steinert | 2 (2,1) |
| Diabetes mellitus | 19 (20) |
| Artrosis | 23 (24,2) |
| Arteriopatía periférica | 4 (4,2) |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección ventricular izquierda.
Los datos expresan n (%) o media±desviación estándar.
En la Tabla 3 se resumen las características relacionadas con la arritmia. El tipo más frecuente de FlA fue el paroxístico (56%). Casi un 40% de los pacientes se habían sometido a una cardioversión previa (eléctrica o farmacológica). El 43% tenía FibA concomitante. El 44% de los pacientes sometidos a ablación presentaban su primer episodio de FlA. Sólo un 58% estaba anticoagulado antes del procedimiento. Se objetivó FlA en relación con fármacos antiarrítmicos en el 15%, la mayoría por amiodarona. La incidencia de taquicardiomiopatía fue del 17%.
Tabla 3. Características relacionadas con la arritmia
| Forma de presentación del flutter | |
| Paroxístico | 53 (55,8) |
| Persistente | 42 (44,2) |
| Tipo de flutter | |
| Típico (antihorario) | 82 (86,3) |
| Típico inverso (horario) | 6 (6,3) |
| Ambos | 7 (7,4) |
| Ciclo ventricular (ms) | 653±223 |
| Paroxística | 641±260 |
| Persistente | 686±192 |
| Duración del flutter (meses) | 39,7±64,8 |
| N.ode episodios de flutter | 3,7±3,7 |
| Primer episodio de flutter | 42 (44,2) |
| Cardioversión eléctrica previa | 22 (23,2) |
| Flutter auricular | 15 (15,8) |
| Fibrilación auricular | 3 (3,2) |
| Ambas | 2 (2,1) |
| Sobrestimulación | 2 (2,1) |
| Cardioversión farmacológica previa | 15 (15,8) |
| Anticoagulación previa | 55 (57,9) |
| Anticoagulación posterior | 63 (66,3) |
| Fibrilación auricular previa | 41 (43,2) |
| Disfunción sinusal | 15 (15,8) |
| HV largo | 18 (18,9) |
| Flutter IC o amiodarona | 14 (14,7) |
| Amiodarona | 11 (11,6) |
| Flecainida | 3 (3,1) |
| Taquicardiomiopatía | 16 (16,8) |
| Trastorno de conducción | 43 (45,3) |
| Bloqueo AV 1.er grado | 12 (12,5) |
| Bloqueo AV 2.o grado | 2 (2,1) |
| Bloqueo bifascicular | 4 (4,2) |
| Bloqueo trifascicular | 1 (1,1) |
| Bloqueo rama derecha haz de His | 7 (7,4) |
| Bloqueo rama izquierda haz de His | 1 (1,1) |
| Hemibloqueo anterior izquierdo | 11 (11,6) |
| Marcapasos intraprocedimiento | 2 (2,1) |
| Inespecífico | 3 (3,2) |
| Antiarrítmico | 54 (56,8) |
| N.ode fármacos antiarrítmicos | |
| 0 | 41 (43,2) |
| 1 | 40 (42,1) |
| 2 | 11 (11,5) |
| 3 | 3 (3,2) |
Los datos expresan n (%) o media±desviación estándar.
El éxito agudo del procedimiento fue del 100%; se alcanzó bloqueo bidireccional en la conducción del ICT en todos los pacientes. No hubo ninguna muerte intrahospitalaria. Fallecieron 6 pacientes durante el seguimiento y las causas fueron: cáncer de pulmón, estenosis aórtica severa, insuficiencia respiratoria por enfermedad pulmonar obstructiva crónica severa, infección respiratoria y muerte súbita extrahospitalaria en 2 casos (1 de ellos por tromboembolia pulmonar). Un paciente no pudo realizar el test de calidad de vida del seguimiento por secuelas neurológicas de un accidente cerebrovascular. Por lo tanto, 88 pacientes completaron satisfactoriamente los cuestionarios de calidad de vida basal y al seguimiento.
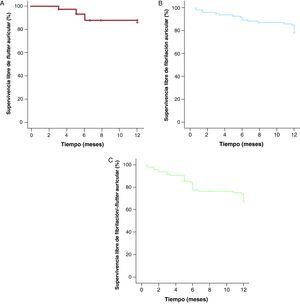
Se observaron 13 recurrencias de FlA típico (14,6%) al cabo de 12 meses de seguimiento. En 12 de ellas se realizó reablación del ICT y en 1 caso, cardioversión eléctrica; 24 pacientes (25%) presentaron episodios de FibA durante el seguimiento, frente a los 41 (43%) que tenían antecedentes de FibA previa al estudio electrofisiológico. De los 24 pacientes con FibA durante el seguimiento, 20 (83%) tenían antecedentes de FibA previa. Al cabo de 1 año de seguimiento, la supervivencia libre de recurrencia de FlA fue del 85% (Figura 2A) y la libre de ocurrencia de FibA fue del 80% (Figura 2B). La supervivencia libre de FlA o FibA al año fue del 67% (Figura 2C). Tres pacientes presentaron ambas arritmias. A los 12 meses de seguimiento, 81 pacientes (91%) estaban en ritmo sinusal, 7 (8%) en FibA y 1 (1%) en FlA.
Figura 2. Curva de supervivencia libre de arritmias durante 12 meses de seguimiento en pacientes sometidos a ablación de istmo cavotricuspídeo (método de Kaplan-Meier). A: flutter auricular típico. B: fibrilación auricular. C: flutter o fibrilación auricular.
Recibían tratamiento anticoagulante al cabo de 1 año de seguimiento 66 pacientes (66%) y 24 (27%), tratamiento antiagregante. Basalmente, 55 pacientes (58%) estaban anticoagulados.
Al año de seguimiento, 29 pacientes (31%) recibían fármacos antiarrítmicos, frente a los 54 pacientes (57%) que recibían tratamiento antiarrítmico antes de la ablación.
Calidad de vidaEn la Tabla 4 se indican los resultados basales y al cabo de 1 año de seguimiento del cuestionario de calidad de vida SF-36. En la calidad de vida basal, la dimensión rol físico fue la que presentó mayor descenso respecto a la media poblacional (11,7 puntos). Le siguieron las dimensiones rol emocional (9,7 puntos), vitalidad (8,3 puntos) y salud mental (8,1 puntos). La dimensión menos afectada fue dolor corporal. El CSF presentó un valor medio más alto que el CSM. El descenso del CSF fue de 5,7 puntos y el del CSM fue de 8,8 puntos.
Tabla 4. Calidad de vida basal y al cabo de 1 año, estandarizada y normalizada para la población española ajustada por edad y sexo
| Basal (n=95) | Seguimiento (n=88) | |
| Función física | 43,9±11,7 | 54,5±6,6 |
| Rol físico | 38,3±11,4 | 49,9±8,8 |
| Dolor corporal | 47,8±10,8 | 51,2±9,6 |
| Salud general | 42,9±9,4 | 49,5±10 |
| Vitalidad | 41,7±10,7 | 52,3±9,7 |
| Actividad social | 43,5±15 | 50,6±11 |
| Rol emocional | 40,3±15,7 | 49,5±12,1 |
| Salud mental | 41,9±11,3 | 50,1±8,9 |
| CSF | 44,3±10,1 | 52,2±8,2 |
| CSM | 41,2±14,5 | 49,4±11,4 |
CSF: componente sumario físico; CSM: componente sumario mental.
Los datos expresan en media±desviación estándar.
Al año de seguimiento, se observa que todas las escalas se encuentran muy próximas o superan el valor 50. La media del CSF fue más alta que la del CSM. Se detectó efecto techo en las dimensiones función física, rol físico, dolor corporal, actividad social y rol emocional.
En la comparación entre el seguimiento y el basal, se observaron diferencias grandes (> 8 puntos) en función física, rol físico, vitalidad, rol emocional, salud mental y CSM, y variaciones moderadas (> 6 puntos) en salud general, actividad social y CSF.
El TE y la media de respuesta estandarizada se describen en la Tabla 5. En las dimensiones función física, rol físico, salud general, vitalidad y CSF, se observó un efecto grande (≥ 0,8) en la magnitud del cambio tras el procedimiento. En las dimensiones rol emocional, actividad social, salud mental y CSM, se observó un efecto moderado (≥ 0,5), y en la dimensión dolor corporal el cambio observado fue pequeño.
Tabla 5. Diferencias en la calidad de vida estandarizadas y normalizadas para la población española. Tamaño de efecto, media de respuesta estandarizada y mínimas diferencias clínicamente importantes (n=88)
| Media | TE | SRM | MCID (TE) | MCID (SRM) | |
| Función física | 10,4±10,1 * | 0,88 | 1,03 | 0,62 | 0,69 |
| Rol físico | 11,8±12,1 * | 1 | 0,94 | 0,75 | 0,68 |
| Dolor corporal | 3,4±11,2 | 0,31 | 0,3 | 0,62 | 0,62 |
| Salud general | 6,9±8,6 * | 0,74 | 0,8 | 0,56 | 0,54 |
| Vitalidad | 10,7±10,6 * | 0,99 | 1,01 | 0,59 | 0,59 |
| Rol emocional | 9,9±13,1 * | 0,63 | 0,76 | 0,64 | 0,7 |
| Actividad social | 7,6±11,6 * | 0,5 | 0,66 | 0,58 | 0,66 |
| Salud mental | 8,5±11,1 * | 0,74 | 0,77 | 0,65 | 0,66 |
| CSF | 7,8±9,7 * | 0,78 | 0,8 | 0,62 | 0,58 |
| CSM | 8,9±12,7 * | 0,6 | 0,7 | 0,55 | 0,64 |
CSF: componente sumario físico; CSM: componente sumario mental; MCID: diferencias clínicas minimamente importantes; SRM: media de respuesta estandarizada; TE: tamaño del efecto.
Los datos cuantitativos se expresan en media±desviación estándar.
* p<0,001.
Si analizamos la MCID, observamos que en todas las dimensiones, excepto el dolor corporal y la actividad social, se supera el mínimo exigido para que la magnitud del cambio sea percibida clínicamente por el paciente. Los CSF y CSM superaron el dintel establecido para la MCID.
Los pacientes con FibA mejoraron significativamente su calidad de vida (Tabla 6). Tampoco se observaron diferencias significativas entre los pacientes que desarrollaron FibA durante el seguimiento y los que no (Tabla 7). No se detectaron diferencias significativas en la mejora de la calidad de vida entre los pacientes con un primer episodio de FlA y FlA recurrente.
Tabla 6. Diferencias en la calidad de vida entre el seguimiento y el momento basal en los pacientes con fibrilación auricular previa al procedimiento (A) y los pacientes que sufrieron fibrilación auricular durante el año de seguimiento (B)
| A. FibA previa (n=39) | B. FibA tras ablación (n=23) | |||
| Diferencias | p | Diferencias | p | |
| Función física | 23,1±22,7 | < 0,001 | 24,1±23,9 | < 0,001 |
| Rol físico | 38,2±41,6 | < 0,001 | 34,3±39,6 | 0,001 |
| Dolor corporal | 7,1±29,6 | 0,15 | 10,4±31,6 | 0,22 |
| Salud general | 9,2±20 | 0,004 | 10,2±19,4 | 0,02 |
| Vitalidad | 23,1±26,1 | < 0,001 | 20,4±26,5 | 0,003 |
| Actividad social | 17,4±25 | < 0,001 | 16±19,1 | 0,001 |
| Rol emocional | 35,9±41,4 | < 0,001 | 34,8±43,2 | 0,004 |
| Salud mental | 18,8±22,4 | < 0,001 | 13,2±21,8 | 0,007 |
FibA: fibrilación auricular.
Los datos expresan en media±desviación estándar.
Tabla 7. Diferencias en la calidad de vida entre el seguimiento y el momento basal, según ocurriera o no fibrilación auricular durante el seguimiento
| FibA (n=23) | Sin FibA (n=65) | p | |
| Función física | 24,1±23,9 | 24,5±20,1 | 0,94 |
| Rol físico | 34,3±39,6 | 48,8±47,3 | 0,19 |
| Dolor corporal | 10,4±31,6 | 9,6±32,2 | 0,91 |
| Salud general | 10,2±19,4 | 17,1±19,2 | 0,15 |
| Vitalidad | 20,4±26,5 | 26,6±23,1 | 0,32 |
| Actividad social | 16±19,1 | 16,7±27,1 | 0,88 |
| Rol emocional | 34,8±43,2 | 30,3±39,8 | 0,66 |
| Salud mental | 13,2±21,8 | 19,4±23,5 | 0,25 |
FibA: fibrilación auricular.
Los datos expresan en media±desviación estándar.
El coeficiente de consistencia interna alfa de Cronbach fue de 0,85 para las escalas basales y de 0,85 para las escalas durante el seguimiento, lo que indica valores adecuados para la comparación entre grupos.
DiscusiónEn este estudio, hemos encontrado una mejora clínicamente significativa en la calidad de vida de los pacientes con FlA típico tras someterse a ablación del ICT. Este resultado se ha obtenido a pesar de que en esta cohorte se ha incluido a pacientes con FibA concomitante (43%) y único episodio de FlA (44%). Se ha detectado una mejora estadísticamente significativa en todas las escalas del cuestionario SF-36 y en los CSF y CSM. Si se ajusta el resultado a valores poblacionales, no se han observado diferencias significativas en la dimensión dolor corporal. Este hecho no es sorprendente, ya que sólo 7 pacientes (7,4%) presentaron como síntoma predominante dolor torácico, por lo que no eran de esperar cambios importantes en esta dimensión.
En el análisis de la magnitud del cambio se presentan los datos del TE estandarizados y normalizados para la población española ajustada por edad y sexo, y se observa una magnitud de efecto grande en el CSF y moderado en el CSM, lo que indica una mejoría más intensa en el estado físico de salud que en el mental.
Pero consideramos de mayor importancia la expresión de la variación del cambio en la calidad de vida a través del concepto de la MCID, que permite ayudar a la toma de decisiones clínicas. La MCID es un parámetro de CVRS que permite saber si un tratamiento produce un beneficio percibido en el estado de salud del paciente suficiente para que, en ausencia de efectos colaterales graves o coste excesivo, lleve a un cambio en el manejo terapéutico de dicho paciente16, 17. Así, se observó en todas las dimensiones, salvo en dolor corporal y actividad social, una magnitud de cambio de calidad de vida que superó el dintel exigido por la MCID. Por lo tanto, el tratamiento mediante ablación del ICT supuso un cambio en el estado de salud percibido por el paciente de una magnitud suficiente para tenerlo en consideración en todos los pacientes con FlA típico.
La expresión de los resultados de CVRS de una arritmia cardiaca por medio del concepto de la MCID es novedosa en este ámbito y con implicación clínica directa, ya que no se evalúa si la ablación del ICT con catéter de radiofrecuencia produce un beneficio en la CVRS estadísticamente significativo, sino si ese beneficio, además de ser estadísticamente significativo, es suficiente para la toma de decisión a la hora de ofrecer esta opción terapéutica a todos los pacientes con FlA típico.
En estudios previos de CVRS en pacientes con FlA típico, Calkins et al5 mostraron un beneficio en 6 de las 8 dimensiones del cuestionario SF-36 en una cohorte de 150 pacientes con FlA típico sometidos a ablación del ICT y seguidos durante 6 meses. No se encontró mejoría en las dimensiones dolor corporal y salud general. En otra cohorte de 169 pacientes con FlA típico sometidos también a ablación con catéter y seguidos durante 6 meses, Feld et al6 comunicaron una mejoría en 7 de las 10 escalas del SF-36. Las escalas dolor corporal, salud general y rol emocional no mejoraron, si bien partían ya de cifras basales muy altas (73, 67 y 71 puntos de la escala transformada, respectivamente). El CSF ajustado para la población americana fue de 42 y el CSM de 50. En nuestra cohorte los valores basales de dolor corporal, salud general y rol emocional fueron más bajos (69, 44 y 59 puntos de la escala transformada respectivamente). El CSF estandarizado para la población española y ajustada por edad y sexo fue 44 y el CSM 41. Así, la cohorte de Feld et al6 estaba menos afectada por su arritmia fundamentalmente en las dimensiones mentales.
O’Callaghan et al7 publicaron, de una serie de 55 pacientes sometidos a ablación del ICT y seguidos durante 12 meses, no sólo una mejoría en la CVRS y una reducción en la frecuencia y la severidad de los síntomas, sino también una disminución de las hospitalizaciones y de las visitas al servicio de urgencias debido a la arritmia.
En otro trabajo, Lee et al8 mostraron una mejora en la CVRS general utilizando un cuestionario diferente del SF-36 en una serie de 100 pacientes seguidos durante 6 meses. Observaron que la presencia de FibA previa a la ablación era el único factor en el análisis multivariable que se asociaba de forma independiente a una menor mejora en la calidad de vida. En nuestra cohorte los pacientes con FibA durante el seguimiento mejoraron significativamente su calidad de vida. Si bien tuvieron valores más bajos al final del seguimiento que los pacientes que no sufrieron FibA.
Los estudios sobre la CVRS tras la ablación del FlA típico en los que se ha utilizado el cuestionario SF-36 presentan algunas diferencias con respecto a nuestro trabajo. En primer lugar, y como es lógico, hemos estandarizado y normalizado los resultados para la población española en lugar de la población americana. En segundo lugar, hemos ajustado por edad y sexo. La edad es un factor importante en la CVRS, de tal forma que a mayor edad, peor CVRS14. En el cuestionario SF-36 tiene especial influencia en las dimensiones físicas que son más bajas a medida que aumenta la edad. Respecto al sexo, los varones tienen mejor calidad de vida que las mujeres en el cuestionario SF-36 en general, con lo que son dos variables con las que es imprescindible ajustar para expresar los resultados15. Finalmente, hemos expresado los resultados con relación a la MCID, que es un parámetro que indica el beneficio clínico percibido por el paciente tras una intervención terapéutica.
LimitacionesUna de las limitaciones de nuestro estudio es la presencia de efecto techo en las dimensiones rol físico, dolor corporal, actividad social y rol emocional en el momento basal y en las dimensiones función física, rol físico, dolor corporal, actividad social y rol emocional en el seguimiento. Es decir, es posible que se haya subestimado las diferencias obtenidas en estas dimensiones y, por lo tanto, el beneficio podría ser todavía mayor. También, aunque no tan importante desde el punto de vista de los beneficios en la CVRS, debemos mencionar la presencia de efecto suelo en el momento basal en las dimensiones rol físico y rol emocional.
Otra limitación viene dada por el carácter prospectivo del estudio en un grupo de pacientes de edad avanzada y con comorbilidades, en el que se han producido algunas pérdidas en el seguimiento debidas a la muerte o la incapacidad de los pacientes para contestar un segundo cuestionario después de 1 año. Esta limitación se añade a otra derivada del bajo número de pacientes reclutados. El carácter observacional del estudio, sin asignación aleatoria de los pacientes al grupo de tratamiento o placebo, impide establecer una relación causal en nuestra observación. Es necesario confirmar estos resultados con estudios adecuadamente controlados.
Por último, hemos utilizado un cuestionario general de evaluación de calidad de vida y no lo hemos complementado con un cuestionario específico de evaluación de calidad de vida en arritmias cardiacas.
ConclusionesSe observa una mejora en la calidad de vida de un grupo de pacientes con FlA típico sometidos a ablación del ICT con catéter de radiofrecuencia después de 1 año del procedimiento.
FinanciaciónEste estudio ha sido financiado en parte con ayudas del Instituto de Salud Carlos III (redINSCOR [RD06/0003/0016 y RD06/0003/0008], redIAPP [RD06/0018/0006]). F. Gude tuvo una ayuda (BAE09/90052) del Instituto de Salud Carlos III (Ministerio de Ciencia y Tecnología).
Conflicto de interesesNinguno.
Recibido 23 Julio 2010
Aceptado 13 Diciembre 2010
Autor para correspondencia: Unidad de Arritmias, Servicio de Cardiología, Hospital Clínico de Santiago de Compostela, Travesía de la Choupana s/n, 15706 Santiago de Compostela, A Coruña, España. Javier.Garcia.Seara@sergas.es