La enfermedad por coronavirus de 2019 (COVID-19) es una enfermedad infecciosa causada por el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2)1. La mayor parte de los pacientes con COVID-19 grave presentan neumonía y síndrome de dificultad respiratoria aguda (SDRA)1. Los pacientes con antecedente de trastornos cardiovasculares parecen tener mayor riesgo de sufrir formas graves de la COVID-191.
La hipertensión arterial pulmonar (HAP) es una enfermedad muy infrecuente, con mal pronóstico a largo plazo y un riesgo de mortalidad especialmente elevado durante las hospitalizaciones por trastornos no cardiovasculares2.
Hasta el 10 de abril de 2020, a 10 de los 350 pacientes con HAP (el 100% mujeres; edad, 43,3 [36,0-47,2] años) seguidos en nuestro centro se les diagnosticó COVID-19.
Todos los pacientes tenían antecedente de HAP significativa (presión arterial pulmonar media, 51,5 [44-66] mmHg; resistencias vasculares pulmonares, 10,9 [8-18,4] UW). La mediana de tiempo transcurrido entre el diagnóstico de la HAP y la COVID-19 fue 3,9 [0,6–11,1] años.
Requirieron hospitalización 7 pacientes (70%) (estancia, 10 [4-16] días), aunque ninguno de ellos en la unidad de cuidados intensivos; 5 (50%) presentaron neumonía, con manifestaciones de SDRA en 2 casos; 5 (50%) necesitaron oxigenoterapia (3 de ellos ya recibían oxigenoterapia domiciliaria). Los resultados clínicos fueron favorables en todos los pacientes (tabla 1).
Características basales de los pacientes antes de la infección y cuadro clínico de la COVID-19
| Pac. | Sexo | Etiología | Años | HT | Tabaquismo | PAPm (mmHg) | RVP (UW) | IC (l/min/m2) | Puntuación de riesgo de la ESC | Tratamiento de la HAP | Cuadro clínico | T (°C) | Patrón de la RxT | PCR (mg/dl) | LDH (u/l) | RAL (ml) | DD (ng/ml) | DH (días) | O2 | Tratamiento de la COVID-19 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | M | VIH | 58 | N | N | 69 | 13,7 | 2,3 | Intermedia | iPDAREPCO2 | DR | 40 | NML | 1,9a | 265a | 1300 | 1324a | 16 | OFAb | LPV-RTVHCQ |
| 2 | M | EVOPF | 37 | N | N | 51 | 8,5 | 3,2 | Baja | iPDAREO2 | DR | 39 | NML | 2,1a | 293a | 1200 | 455 | 14 | GNb | LPV-RTV |
| 3 | M | RCA | 43 | N | N | 26 | 2,7 | 2,9 | Baja | AC | Pseudogripal | 38 | Normal | 0,17 | 168 | 400a | 314 | 4 | Ninguna | LPV-RTVHCQ |
| 4 | M | HAPI | 47 | S | S | 28 | 2,5 | 3,1 | Baja | iPDARE | Pseudogripal | 38,5 | Normal | 0,65 | ND | 1650 | ND | 0 | Ninguna | - |
| 5 | M | HAPI | 50 | N | N | 42 | 5,6 | 2,8 | Baja | iPDAREPCO2 | DR | 37,8 | NML | 0,72 | 208 | 1520 | 266 | 6 | GNb | HCQ |
| 6 | M | RCA | 35 | N | N | 29 | 1,9 | 3,3 | Baja | AC | Ninguno | 36 | Normal | ND | ND | ND | ND | 0 | Ninguna | - |
| 7 | M | CC | 76 | N | N | 44 | 5 | 3,24 | Intermedia | Ninguno | SDRA | 38 | NML | 6,5a | ND | 1050a | 1300a | 28 | OFA | LPV-RTVHCQ |
| 8 | M | ETC | 64 | N | N | 26 | 2,7 | 3,2 | Baja | ARE | SDRA | 38 | NML | 4,2a | 228a | 430a | 520a | 20 | OFA | LPV-RTVHCQA-IL6 |
| 9 | M | VIH | 53 | N | S | 52 | 8 | 2,7 | Intermedia | ARE | Seudogripal | 35,5 | Normal | 2,03a | 191 | 1500 | ND | 3 | Ninguna | LPV-RTVcHCQ |
| 10 | M | HAPF | 35 | N | N | 62 | 11,2 | 2,9 | Baja | iPDAREPC | SeudogripalDiarrea | 38,5 | Normal | 5,8a | 223a | 1300 | 396 | 0 | Ninguna | - |
AC: antagonistas del calcio; A-IL6: antagonista de la interleucina-6; ARE: antagonistas del receptor de la endotelina; CC: cardiopatía congénita; CF: clase funcional (Organización Mundial de la Salud); DD: dímero D; DH: duración de la hospitalización; DR: dificultad respiratoria; ESC: Sociedad Europea de Cardiología; ETC: enfermedad del tejido conjuntivo; EVOPF: enfermedad venooclusiva pulmonar familiar; GN: gafas nasales de oxigenoterapia; HAPF: hipertensión arterial pulmonar familiar; HAPI: hipertensión arterial pulmonar idiopática; HCQ: hidroxicloroquina; HT: hipertensión; IC: índice cardiaco; iPD: inhibidores de la fosfodiesterasa tipo 5; LDH: lactato deshidrogenasa; LPV-RTV: lopinavir-ritonavir; M: mujer; N: no; NML: neumonía multilobular; O2: oxigenoterapia domiciliaria; OFA: oxigenoterapia con flujo alto; Pac.: paciente; PAPm: presión arterial pulmonar media; PArD: presión auricular derecha; PC: análogos de la prostaciclina o agonistas del receptor de la prostaciclina; PCR: proteína C reactiva; RAL: recuento absoluto de linfocitos; RCA: pacientes con respuesta a los antagonistas del calcio; RVP: resistencia vascular pulmonar; RxT: radiografía de tórax; S: sí; SDRA: síndrome de dificultad respiratoria aguda; T: temperatura; VIH: virus de la inmunodeficiencia humana.
Se presentan las características clínicas y la evolución de 10 pacientes con HAP que sufrieron la COVID-19. El riesgo de mortalidad por procesos no cardiovasculares de los pacientes con HAP es especialmente elevado (el 9,4% en la neumonía y el 21,4% en la insuficiencia respiratoria)2. Sorprendentemente, la mitad de los pacientes solo tuvieron síntomas leves, y para quienes contrajeron neumonía la tendencia general fue una evolución favorable, sin que fuera necesaria la asistencia en cuidados intensivos ni se produjera ninguna muerte.
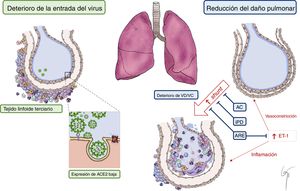
Nuestra hipótesis es que las características fisiopatológicas de la HAP y los beneficios atribuibles al tratamiento específico podrían producir un efecto protector a través de los siguientes mecanismos (figura 1):
- 1.
Reducción de la entrada del virus:
- –
Enzima de conversión de la angiotensina 2 (ECA2): en la sangre y los pulmones de los pacientes con HAP, la expresión de la ECA2 está disminuida 3. De hecho, se ha propuesto el empleo de ECA2 recombinante como tratamiento novedoso para la HAP, con objeto de revertir la vasoconstricción, la proliferación y la inflamación3. Se sabe que la ECA2 actúa como receptor para el SARS-CoV-2. Los estudios experimentales realizados con el SARS-CoV han mostrado que, en ratones knockout para la ECA2, solo pudo detectarse una cantidad muy baja del virus4. Por lo tanto, las concentraciones bajas de ECA2 en los pacientes con HAP podrían actuar como factor protector en una fase infecciosa inicial que impediría la entrada del SARS-CoV-2.
- –
El papel de la inflamación crónica en la HAP: la inflamación pulmonar crónica es un hallazgo frecuente en los pacientes con HAP3,5. Los tipos de células inmunitarias que infiltran los pulmones de los pacientes con HAP son linfocitos, macrófagos, neutrófilos, células dendríticas y mastocitos. Este ambiente de células inmunitarias propio de los pulmones de la HAP indica que hay una desviación hacia el sistema inmunitario adaptativo. Por consiguiente, existe lo que se denomina «tejido linfoide terciario» en la proximidad de los bronquiolos, lo que podría limitar la infección y la expansión del virus.
- 2.
Daño pulmonar atenuado: los cambios en la circulación pulmonar inherentes a la fisiopatología de la HAP o relacionados con el tratamiento vasodilatador específico empleado en este trastorno podrían reducir el daño causado a los pulmones y la consiguiente hipoxemia grave que se describe en los pacientes con COVID-19.
- –
Cambios en la perfusión pulmonar: se ha descrito una forma atípica de SDRA en los pacientes con COVID-19. Se ha observado una disociación inusual entre las propiedades mecánicas pulmonares (con una distensibilidad casi normal) y la hipoxemia grave6, que indica hiperperfusión anormal de áreas no ventiladas como consecuencia del deterioro de la regulación de la perfusión pulmonar y la vasoconstricción hipóxica6. La perfusión pulmonar anormal basal presente en los pacientes con HAP podría limitar este desequilibrio brusco de perfusión hacia las áreas no ventiladas. Además, el tratamiento vasodilatador crónico podría prevenir la respuesta de vasoconstricción hipóxica grave. A este respecto, se ha propuesto el empleo de inhibidores de fosfodiesterasa-5 e incluso de antagonistas del calcio como posible tratamiento para la COVID-19, dadas sus propiedades vasodilatadoras, y en la actualidad se está llevando a cabo un ensayo clínico con sildenafilo (NCT: 04304313)1. Así pues, el tratamiento vasodilatador pulmonar de nuestros pacientes podría haber atenuado la vasoconstricción hipóxica y haber favorecido un equilibrio adecuado entre ventilación y perfusión.
- –
Efecto protector de los antagonistas de receptores de endotelina (ARE) frente al SDRA: el SDRA se origina por una respuesta inflamatoria grave, que se produce a través de varios agentes y citocinas con efectos proinflamatorios (factor de necrosis tumoral, interleucinas o endotelina-1)5. Se ha observado que la endotelina-1 interviene tanto en el SDRA como en la HAP5. Estudios previos han señalado que los ARE podrían ser útiles en el tratamiento del SDRA, dados sus efectos beneficiosos en los estudios preclínicos experimentales realizados5. Siete pacientes (70%) de nuestra cohorte estaban en tratamiento con ARE cuando se les diagnosticó COVID-19, lo que apunta la posibilidad de un efecto beneficioso del bloqueo crónico de la endotelina-1.
Posibles explicaciones del curso benigno de la COVID-19 en los pacientes con HAP. Deterioro de la entrada del virus en las células pulmonares debido a la presencia de «tejido linfoide terciario» y la reducción de la expresión de ACE2. Reducción del daño pulmonar debido al deterioro de las propiedades «vasotónicas» y al tratamiento vasodilatador de la HAP, que reduce al mínimo el cortocircuito intrapulmonar. Reducción de la respuesta inflamatoria que se produce a través de la ET-1, debido al efecto de los ARE. AC: antagonista del calcio; ACE2: enzima de conversión de la angiotensina 2; ARE: antagonista del receptor de la endotelina; ET-1: endotelina-1; iPD: inhibidor de la fosfodiesterasa-5; VD/VC: vasodilatación/vasoconstricción. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El curso clínico de la COVID-19 en nuestra cohorte de pacientes con HAP fue inesperadamente favorable. Esta observación podría explicarse por las peculiaridades fisiopatológicas de la enfermedad o por un efecto protector del tratamiento específico empleado para la HAP. Los tratamientos para la HAP pueden tener también un efecto protector en la COVID-19, aunque solo podrá abordarse mediante ensayos controlados con placebo y aleatorizados.
FINANCIACIÓNJ. Nuche ha recibido una beca predoctoral (Jordi Soler Soler) a través del CIBERCV. P. Escribano Subías ha recibido una beca del Ministerio de Ciencia y Universidades de España para el estudio de las bases moleculares de la hipertensión arterial pulmonar (PI 18/01233). El CNIC cuenta con el apoyo del Instituto de Salud Carlos III (ISCIII), el Ministerio de Ciencia e Innovación de España y la Fundación Pro CNIC, y es un Centro de Excelencia Severo Ochoa (SEV-2015-0505).
Los autores desean expresar su agradecimiento a Carlos Galán-Arriola (CNIC) por el diseño y dibujo de la figura. También quieren dar las gracias a Javier Segovia-Cubero (Hospital Puerta de Hierro, Madrid), Francisco Pastor-Pérez (Hospital Virgen de la Arrixaca, Murcia) y Mercedes Alcalde (Hospital San Pedro, Logroño) por proporcionar las historias clínicas de los pacientes ingresados en sus centros.