La estimación mediante ecografía intracoronaria de la repercusión funcional de lesiones angiográficas intermedias se ha basado principalmente en la medición del área luminal mínima. Estas estimaciones no han tenido en cuenta la longitud de la lesión y no han sido estudiadas suficientemente en lesiones coronarias largas.
MétodosSe incluyen 61 lesiones con un 40-70% de estenosis angiográfica visual y necesidad de stent ≥ 20mm para su tratamiento, que se estudiaron con ecografía y reserva fraccional de flujo. Se realizó un análisis tridimensional offline del estudio de ecografía, ciego al valor de reserva fraccional. Se correlacionaron los parámetros angiográficos y ecográficos con la reserva fraccional obtenida.
ResultadosSe obtuvieron por angiografía valores medios de diámetro de referencia (2,87±0,57mm; longitud, 29,8±10,01mm) y grado de estenosis (50,3±8,7%). El valor medio de reserva fraccional de flujo fue 0,78±0,09. Se obtuvo una pobre correlación lineal (R) entre la reserva fraccional y los parámetros de ecografía que no incluían la longitud de la lesión: reserva fraccional-área luminal mínima (R=0,4; p=0,003); y mejor cuando se la tenía en cuenta: reserva fraccional−volumen de la placa (R=–0,65; p<0,0005); reserva fraccional−longitud/área luminal media (R=0,73; p<0,0005). La mejor correlación se obtuvo con el producto estenosis media por área×longitud de la lesión (R=−0,78; p<0,0005).
ConclusionesEn las lesiones coronarias largas, el área luminal mínima medida por ecografía no tiene buena correlación con su repercusión funcional. En estos casos, la estimación de la repercusión funcional debe tener en cuenta la longitud de la lesión o realizarse por medición directa de la reserva fraccional de flujo.
Palabras clave
El porcentaje de estenosis obtenido mediante angiografía y las características angiográficas de la lesión siguen siendo útiles y el método más empleado para decidir la revascularización de una lesión coronaria. Sus limitaciones son conocidas, especialmente en presencia de anatomías complejas y, sobre todo, cuando el grado de estenosis angiográfica se encuentra en valores intermedios1,2. Se ha demostrado la validez de la reserva fraccional de flujo (RFF) obtenida mediante una guía intracoronaria de presión para decidir la necesidad de revascularizar lesiones de significación angiográfica dudosa o intermedia3,4, lo que ha aumentado su utilización en los últimos años5. La utilidad de la ecografía intracoronaria (IVUS), clásicamente utilizada también para decidir la revascularización en los casos con dudas en la angiografía, ha sido cuestionada en estudios recientes que la han comparado con la RFF6–8.
Tanto en el caso de la angiografía coronaria (estenosis por diámetro > 70%) como en el IVUS9 (área luminal mínima [ALM]>4mm2 o diámetro luminal mínimo > 2mm2), los criterios más utilizados para diferir o indicar la revascularización se basan en mediciones tomadas en un punto concreto de la lesión que no tienen en cuenta la longitud de esta. Este hecho no concuerda con la clásica ecuación de la dinámica de fluidos, en la que la resistencia que encuentra un flujo al atravesar una estenosis depende también de su longitud, y no únicamente del diámetro o la importancia de la estenosis10,11. La decisión a partir de medidas focales de diámetros o áreas mínimas tampoco tiene en cuenta la existencia de lesiones en tándem o segmentos difusamente enfermos que pueden condicionar el flujo a través de ellos con independencia o añadiéndose al grado de estenosis máxima medida en un punto concreto.
En el presente estudio se comparan, en una serie de lesiones largas, los parámetros de IVUS obtenidos mediante retirada automática y su reconstrucción tridimensional con el valor de RFF obtenido en la misma lesión.
MÉTODOSDiseño y pacientes incluidosEstudio observacional y prospectivo de una cohorte de pacientes evaluados mediante coronariografía por sospecha de enfermedad coronaria entre el 1 de enero de 2009 y el 31 de mayo de 2010, en los que se estudió, mediante guía de presión e IVUS con el objeto de decidir su revascularización, una lesión coronaria de gravedad intermedia (entre el 40 y el 70% de estenosis por diámetro en la estimación visual) y con una longitud que obligara, en caso de decidir su tratamiento, a la utilización de una longitud de stent ≥ 20mm.
Se excluyeron aquellos casos en que la lesión se encontraba en un vaso que irrigaba una zona previamente infartada, las lesiones con signos evidentes de inestabilidad (presencia de trombo, ulceraciones o flujo thrombolysis in myocardial infarction < 3), los pacientes con contraindicaciones para la administración de adenosina y aquellos que no accedieron a firmar el consentimiento informado. Se excluyeron también los casos en que la lesión objeto de estudio presentaba otras lesiones proximales o distales a ella con una estenosis visual > 20%. No se incluyeron lesiones potencialmente causantes de un síndrome coronario agudo con elevación del segmento ST, por no ser práctica habitual del laboratorio el empleo de la guía de presión para valorar este tipo de lesiones.
ProcedimientoAl decidirse la realización del estudio invasivo, el catéter diagnóstico empleado para la coronariografía se sustituyó por un catéter guía de 6 Fr. Se repitieron con este catéter las proyecciones con que se obtuvo la mejor visualización de la lesión, con mayor estenosis visual y sin la superposición de ramas o pérdida de longitud por incurvación. Antes de la introducción de la guía intracoronaria, todos los pacientes incluidos recibieron, si no la habían recibido ya, heparina sódica intravenosa a 100UI/kg de peso. La valoración funcional se realizó con una guía intracoronaria de presión de 0,014 ″ (Pressure Wire, Radi Medical Systems; Uppsala, Suecia, o PrimeWire, Volcano Corp.; San Diego, California, Estados Unidos). Se calibró la guía externamente y después se avanzó hasta el extremo distal del catéter guía verificándose la igualdad entre las curvas de presión en el catéter y la guía de presión o igualándolas cuando se observaron diferencias o el sistema de medición de la RFF o si este lo requería. Tras suministrar una dosis de 200-300μg de nitroglicerina intracoronaria, se avanzó la guía hasta ubicar su sensor al menos 20mm distal a la lesión en estudio. La RFF se obtuvo administrando 300-1.200μg de adenosina intracoronaria, prestando especial atención a que no hubiera enclavamiento del catéter en el ostium coronario tras la inyección del bolo del fármaco. La RFF se determinó mediante el cociente, latido a latido, entre las medias de la presión aórtica (en el extremo del catéter guía) y la presión distal a la lesión (recogida por la guía de presión), en situación de hiperemia máxima. Se realizaron al menos tres determinaciones de la RFF y finalmente se utilizó el menor valor de RFF obtenido. Se intentó la administración de una dosis > 600μg de adenosina intracoronaria siempre que una dosis inferior no produjera un periodo de asistolia ≥ 6s.
Tras el estudio con guía de presión, se administró otra dosis de 200-300μg de nitroglicerina intracoronaria y, a través de la misma guía intracoronaria, se introdujo el catéter de IVUS (Atlantis Pro, Boston Scientific Co.; Boston, Massachussetts, Estados Unidos) hasta ubicarlo al menos 20mm distal a la lesión objetivo. Se realizó entonces una retirada automática a 0,5mm/s que finalizó en el catéter guía siempre que la longitud de retirada < 100mm lo permitiera. La decisión de revascularización se continuó según el criterio del operador, de acuerdo con los datos obtenidos en el estudio funcional y ecográfico.
Cuantificación coronaria digitalLa cuantificación de los registros angiográficos y ecográficos la realizaron offline dos hemodinamistas experimentados (RL y PC) que, aunque podían haber participado en la realización de los procedimientos, estaban ciegos al resultado de la valoración funcional en el momento de la medición. Para la cuantificación digital automática (QCA), se utilizó el catéter lleno de contraste como calibración. Los segmentos de referencia y el porcentaje de estenosis se midieron en telediástole, en la proyección con que se observaba mayor gravedad. La longitud de la lesión se determinó en la proyección con menos acortamiento. De acuerdo con un trabajo previo11, a partir de las siguientes mediciones directas: longitud (LQCA), diámetro de referencia proximal y distal (obtenidos en los 5mm adyacentes a los límites proximal y distal de la lesión, diámetro luminal mínimo (DLMQCA) y diámetro luminal medio de la lesión (DLMEDQCA), se calcularon los siguientes índices: diámetro de referencia (DREFQCA): media de los diámetros de referencia proximal y distal; porcentaje de estenosis por diámetro máxima (%EDMAXQCA): 100×(DREFQCA−DLMQCA)/DREFQCA; porcentaje de estenosis por diámetro media (%EDMEDQCA): 100×(DREFQCA−DLMEDQCA)/DREFQCA; %EDMAXQCA×LQCA; %EDMEDQCA×LQCA; LQCA/DLMQCA y LQCA/DLMEDQCA. Se empleó el software de medición QAngio XA versión 7.1.43.0 (Medis Medical Imaging Systems; Leiden, Países Bajos).
Cuantificación del estudio de ecografía intracoronariaLa cuantificación tridimensional de las imágenes de IVUS se realizó también de manera ciega al resultado de la valoración funcional. Tras el trazado automático de las áreas del vaso y de la luz arterial, se realizó una corrección en cada corte. Se consideraron las áreas de referencia proximal y distal como las áreas medias de los 5 mm adyacentes a los bordes proximal y distal de la lesión. Los puntos de inicio y final de la lesión quedaron a criterio del intervencionista que realizó la medición, apoyándose en referencias anatómicas angiográficas en los pocos casos en que se consideró necesario.
El propio software determinó automáticamente el ALM tras las correcciones de los bordes de la íntima y la lámina elástica externa. El software de medición calcula automáticamente el volumen de placa de la lesión (volumen del vaso – volumen de la luz) y el área luminal media. Se calculó, para cada lesión, el volumen teórico del tronco de cono correspondiente a las áreas de referencia proximal y distal y a la longitud de la lesión (VOLTCONOIVUS). A partir de las siguientes mediciones directas: longitud (LIVUS), áreas de referencia proximal y distal (ALMIVUS), área luminal media de la lesión (ALMEDIVUS), volúmenes del vaso en el segmento de la lesión (VOLVASIVUS) y volumen de la luz en el segmento de la lesión (VOLLUZIVUS), se calcularon los siguientes índices: área de referencia (AREFIVUS): media de las áreas de referencia proximal y distal; porcentaje de estenosis por área máxima (%AEMAXIVUS): 100×(AREFIVUS−ALMIVUS)/AREFIVUS; porcentaje de estenosis por área media (%AEMEDIVUS): 100×(AREFIVUS−ALMEDIVUS)/AREFIVUS; LIVUS/ALMIVUS; LIVUS/ALMEDIVUS; %AEMAXIVUS×LIVUS; %AEMEDIVUS×LIVUS; VOLLUZIVUS/VOLVASIVUS; VOLLUZIVUS/VOLTCONOIVUS. Se empleó el software de medición QCU-CMS versión 4.1 (Medis Medical Imaging Systems; Leiden, Países Bajos).
Análisis estadísticoTodas las variables cuantitativas se presentan como media±desviación estándar y las cualitativas, como valor absoluto (porcentaje). Se realizaron varios estudios de correlación lineal simple con determinación del coeficiente de correlación de Pearson entre el valor de RFF observado y los índices obtenidos mediante angiografía e IVUS. El valor predictivo de una RFF<0,80 para los distintos índices angiográficos y ecográficos se estimó mediante la correspondiente curva receiver operating characteristic (ROC). A partir de la curva ROC, se estimaron los mejores puntos de corte para cada parámetro, con sus correspondientes sensibilidad, especificidad y valores predictivos positivo y negativo. Se escogieron estos puntos de corte como aquellos cuya suma de sensibilidad y especificidad fuera mayor. Se empleó el paquete estadístico SPSS 15.0 para Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos) y el paquete SigmaPlot para Windows versión 11.0 (Systat Software Inc.; Chicago, Illinois, Estados Unidos).
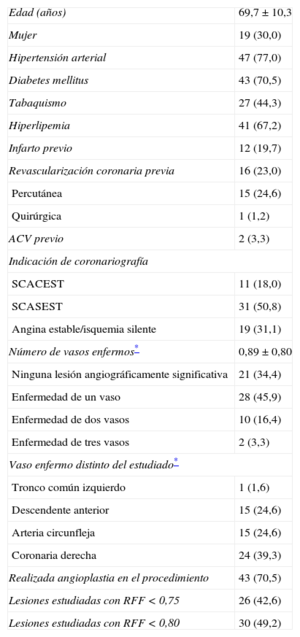
RESULTADOSEn el periodo de estudio se realizaron en nuestro laboratorio 282 estudios con guía intracoronaria de presión. De ellos, 191 no cumplían los criterios de inclusión, 18 presentaban varias lesiones en el mismo vaso donde se realizó el estudio con guía de presión y en 12 pacientes el operador decidió realizar únicamente estudio con guía de presión. Se incluyeron finalmente 61 lesiones estudiadas en 61 pacientes. Las características basales de los pacientes se muestran en la tabla 1. Hasta un 70% de los pacientes tenían diabetes mellitus. En la mayoría de los pacientes, la indicación de coronariografía era un síndrome coronario agudo. Un 69% de los pacientes tenían lesiones angiográficamente significativas en un vaso distinto del estudiado. El 43% de las lesiones estudiadas presentó una RFF<0,75 y un 49%, una RFF<0,80.
Características basales de los pacientes (n=61)
| Edad (años) | 69,7±10,3 |
| Mujer | 19 (30,0) |
| Hipertensión arterial | 47 (77,0) |
| Diabetes mellitus | 43 (70,5) |
| Tabaquismo | 27 (44,3) |
| Hiperlipemia | 41 (67,2) |
| Infarto previo | 12 (19,7) |
| Revascularización coronaria previa | 16 (23,0) |
| Percutánea | 15 (24,6) |
| Quirúrgica | 1 (1,2) |
| ACV previo | 2 (3,3) |
| Indicación de coronariografía | |
| SCACEST | 11 (18,0) |
| SCASEST | 31 (50,8) |
| Angina estable/isquemia silente | 19 (31,1) |
| Número de vasos enfermos* | 0,89±0,80 |
| Ninguna lesión angiográficamente significativa | 21 (34,4) |
| Enfermedad de un vaso | 28 (45,9) |
| Enfermedad de dos vasos | 10 (16,4) |
| Enfermedad de tres vasos | 2 (3,3) |
| Vaso enfermo distinto del estudiado* | |
| Tronco común izquierdo | 1 (1,6) |
| Descendente anterior | 15 (24,6) |
| Arteria circunfleja | 15 (24,6) |
| Coronaria derecha | 24 (39,3) |
| Realizada angioplastia en el procedimiento | 43 (70,5) |
| Lesiones estudiadas con RFF < 0,75 | 26 (42,6) |
| Lesiones estudiadas con RFF < 0,80 | 30 (49,2) |
ACV: accidente cerebrovascular; RFF: reserva fraccional de flujo; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST.
Las cifras expresan n (%) o media±desviación estándar.
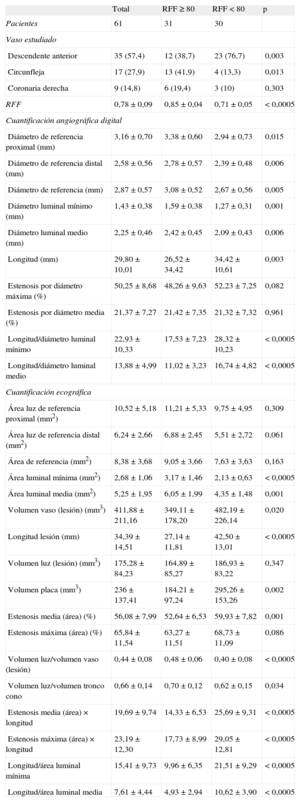
Las características angiográficas y ecográficas de las lesiones, en general y según mostraran o no una RFF<0,80, se presentan en la tabla 2. Angiográficamente, el diámetro medio de referencia fue 2,87±0,70mm, con una longitud media de 29,80±10,01mm y un grado medio de estenosis del 50,25±8,68%. Las lesiones con RFF<0,80 tenían diámetros de referencia significativamente menores, diámetros luminales mínimos menores y mayor longitud, pero no se observaron grados de estenosis máxima y media significativamente mayores.
Características angiográficas de las lesiones según punto de corte de la reserva fraccional de flujo en 0,80
| Total | RFF ≥ 80 | RFF < 80 | p | |
| Pacientes | 61 | 31 | 30 | |
| Vaso estudiado | ||||
| Descendente anterior | 35 (57,4) | 12 (38,7) | 23 (76,7) | 0,003 |
| Circunfleja | 17 (27,9) | 13 (41,9) | 4 (13,3) | 0,013 |
| Coronaria derecha | 9 (14,8) | 6 (19,4) | 3 (10) | 0,303 |
| RFF | 0,78±0,09 | 0,85±0,04 | 0,71±0,05 | < 0,0005 |
| Cuantificación angiográfica digital | ||||
| Diámetro de referencia proximal (mm) | 3,16±0,70 | 3,38±0,60 | 2,94±0,73 | 0,015 |
| Diámetro de referencia distal (mm) | 2,58±0,56 | 2,78±0,57 | 2,39±0,48 | 0,006 |
| Diámetro de referencia (mm) | 2,87±0,57 | 3,08±0,52 | 2,67±0,56 | 0,005 |
| Diámetro luminal mínimo (mm) | 1,43±0,38 | 1,59±0,38 | 1,27±0,31 | 0,001 |
| Diámetro luminal medio (mm) | 2,25±0,46 | 2,42±0,45 | 2,09±0,43 | 0,006 |
| Longitud (mm) | 29,80±10,01 | 26,52±34,42 | 34,42±10,61 | 0,003 |
| Estenosis por diámetro máxima (%) | 50,25±8,68 | 48,26±9,63 | 52,23±7,25 | 0,082 |
| Estenosis por diámetro media (%) | 21,37±7,27 | 21,42±7,35 | 21,32±7,32 | 0,961 |
| Longitud/diámetro luminal mínimo | 22,93±10,33 | 17,53±7,23 | 28,32±10,23 | < 0,0005 |
| Longitud/diámetro luminal medio | 13,88±4,99 | 11,02±3,23 | 16,74±4,82 | < 0,0005 |
| Cuantificación ecográfica | ||||
| Área luz de referencia proximal (mm2) | 10,52±5,18 | 11,21±5,33 | 9,75±4,95 | 0,309 |
| Área luz de referencia distal (mm2) | 6,24±2,66 | 6,88±2,45 | 5,51±2,72 | 0,061 |
| Área de referencia (mm2) | 8,38±3,68 | 9,05±3,66 | 7,63±3,63 | 0,163 |
| Área luminal mínima (mm2) | 2,68±1,06 | 3,17±1,46 | 2,13±0,63 | < 0,0005 |
| Área luminal media (mm2) | 5,25±1,95 | 6,05±1,99 | 4,35±1,48 | 0,001 |
| Volumen vaso (lesión) (mm3) | 411,88±211,16 | 349,11±178,20 | 482,19±226,14 | 0,020 |
| Longitud lesión (mm) | 34,39±14,51 | 27,14±11,81 | 42,50±13,01 | < 0,0005 |
| Volumen luz (lesión) (mm3) | 175,28±84,23 | 164,89±85,27 | 186,93±83,22 | 0,347 |
| Volumen placa (mm3) | 236±137,41 | 184,21±97,24 | 295,26±153,26 | 0,002 |
| Estenosis media (área) (%) | 56,08±7,99 | 52,64±6,53 | 59,93±7,82 | 0,001 |
| Estenosis máxima (área) (%) | 65,84±11,54 | 63,27±11,51 | 68,73±11,09 | 0,086 |
| Volumen luz/volumen vaso (lesión) | 0,44±0,08 | 0,48±0,06 | 0,40±0,08 | < 0,0005 |
| Volumen luz/volumen tronco cono | 0,66±0,14 | 0,70±0,12 | 0,62±0,15 | 0,034 |
| Estenosis media (área)×longitud | 19,69±9,74 | 14,33±6,53 | 25,69±9,31 | < 0,0005 |
| Estenosis máxima (área)×longitud | 23,19±12,30 | 17,73±8,99 | 29,05±12,81 | < 0,0005 |
| Longitud/área luminal mínima | 15,41±9,73 | 9,96±6,35 | 21,51±9,29 | < 0,0005 |
| Longitud/área luminal media | 7,61±4,44 | 4,93±2,94 | 10,62±3,90 | < 0,0005 |
RFF: reserva fraccional de flujo.
Las cifras expresan n (%) o media±desviación estándar.
Ecográficamente, la media del ALM de las lesiones fue 2,68±1,06mm2, con una longitud media de 34,39±14,51mm. Las lesiones con RFF<0,80 presentaron una ALM significativamente menor, mayores longitud, volumen de placa y demás parámetros asociados a mayor grado de estenosis y mayor longitud.
La longitud medida por IVUS fue una media de 4,16±12,8mm mayor que la obtenida mediante QCA (p=0,025).
En los modelos de regresión lineal realizados, el grado de correlación lineal observado con el valor de RFF obtenido fue pobre en todos los parámetros angiográficos analizados (tabla 3), aunque mejor en aquellos que incluían la longitud de la lesión estudiada. Igualmente, los parámetros que incluían la longitud mostraron los mejores valores predictivos con el punto de corte de RFF<0,80, según las curvas ROC realizadas para cada uno de ellos (tabla 3). El mejor valor de corte para el porcentaje de estenosis medido por angiografía fue el 45,6% de estenosis (sensibilidad, 86,2%; especificidad, 48,3%), y para la longitud de la lesión, 26,5mm (sensibilidad, 86,2%; especificidad, 58,6%).
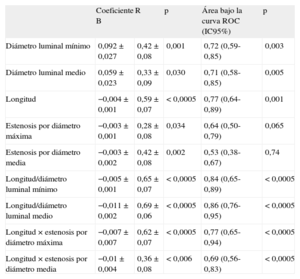
Análisis de correlación lineal entre los distintos parámetros angiográficos y el valor de reserva fraccional de flujo obtenido. Áreas bajo la curva receiver operating characteristic para el punto de corte reserva fraccional de flujo < 0,80
| Coeficiente B | R | p | Área bajo la curva ROC (IC95%) | p | |
| Diámetro luminal mínimo | 0,092±0,027 | 0,42±0,08 | 0,001 | 0,72 (0,59-0,85) | 0,003 |
| Diámetro luminal medio | 0,059±0,023 | 0,33±0,09 | 0,030 | 0,71 (0,58-0,85) | 0,005 |
| Longitud | −0,004±0,001 | 0,59±0,07 | < 0,0005 | 0,77 (0,64-0,89) | 0,001 |
| Estenosis por diámetro máxima | −0,003±0,001 | 0,28±0,08 | 0,034 | 0,64 (0,50-0,79) | 0,065 |
| Estenosis por diámetro media | −0,003±0,002 | 0,42±0,08 | 0,002 | 0,53 (0,38-0,67) | 0,74 |
| Longitud/diámetro luminal mínimo | −0,005±0,001 | 0,65±0,07 | < 0,0005 | 0,84 (0,65-0,89) | < 0,0005 |
| Longitud/diámetro luminal medio | −0,011±0,002 | 0,69±0,06 | < 0,0005 | 0,86 (0,76-0,95) | < 0,0005 |
| Longitud×estenosis por diámetro máxima | −0,007±0,007 | 0,62±0,07 | < 0,0005 | 0,77 (0,65-0,94) | < 0,0005 |
| Longitud×estenosis por diámetro media | −0,01±0,004 | 0,36±0,08 | < 0,006 | 0,69 (0,56-0,83) | < 0,0005 |
IC95%: intervalo de confianza del 95%; ROC: receiver operating characteristic.
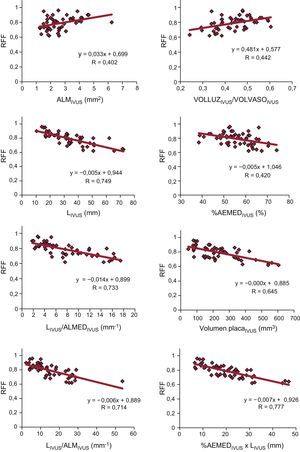
En los modelos de regresión lineal realizados con los parámetros de IVUS analizados y el valor de RFF obtenido (tabla 4 y fig. 1), se observaron también pobres correlaciones lineales, si bien mejores que las observadas en los parámetros angiográficos. Los mejores grados de correlación lineal y los mejores valores predictivos con el punto de corte de RFF<0,80 según las curvas ROC realizadas se observaron, igual que ocurría en los parámetros angiográficos, en los parámetros que incluían la longitud de la lesión: LIVUS, LIVUS/ALMIVUS, LIVUS/ALMEDIVUS, %AEMAXIVUS×LIVUS, %AEMEDIVUS×LIVUS. Ninguno de los parámetros volumétricos analizados mostró una buena correlación lineal con los valores de RFF obtenidos.
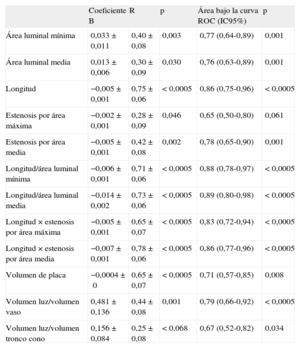
Análisis de correlación lineal entre los distintos parámetros ecográficos y el valor de reserva fraccional de flujo obtenido. Áreas bajo la curva receiver operating characteristic para el punto de corte reserva fraccional de flujo < 0,80
| Coeficiente B | R | p | Área bajo la curva ROC (IC95%) | p | |
| Área luminal mínima | 0,033±0,011 | 0,40±0,08 | 0,003 | 0,77 (0,64-0,89) | 0,001 |
| Área luminal media | 0,013±0,006 | 0,30±0,09 | 0,030 | 0,76 (0,63-0,89) | 0,001 |
| Longitud | −0,005±0,001 | 0,75±0,06 | < 0,0005 | 0,86 (0,75-0,96) | < 0,0005 |
| Estenosis por área máxima | −0,002±0,001 | 0,28±0,09 | 0,046 | 0,65 (0,50-0,80) | 0,061 |
| Estenosis por área media | −0,005±0,001 | 0,42±0,08 | 0,002 | 0,78 (0,65-0,90) | 0,001 |
| Longitud/área luminal mínima | −0,006±0,001 | 0,71±0,06 | < 0,0005 | 0,88 (0,78-0,97) | < 0,0005 |
| Longitud/área luminal media | −0,014±0,002 | 0,73±0,06 | < 0,0005 | 0,89 (0,80-0,98) | < 0,0005 |
| Longitud×estenosis por área máxima | −0,005±0,001 | 0,65±0,07 | < 0,0005 | 0,83 (0,72-0,94) | < 0,0005 |
| Longitud×estenosis por área media | −0,007±0,001 | 0,78±0,06 | < 0,0005 | 0,86 (0,77-0,96) | < 0,0005 |
| Volumen de placa | −0,0004±0 | 0,65±0,07 | < 0,0005 | 0,71 (0,57-0,85) | 0,008 |
| Volumen luz/volumen vaso | 0,481±0,136 | 0,44±0,08 | 0,001 | 0,79 (0,66-0,92) | < 0,0005 |
| Volumen luz/volumen tronco cono | 0,156±0,084 | 0,25±0,08 | < 0,068 | 0,67 (0,52-0,82) | 0,034 |
IC95%: intervalo de confianza del 95%; ROC: receiver operating characteristic.
Gráficos de correlación lineal entre los distintos parámetros de ecografía intracoronaria y el valor de reserva fraccional de flujo. %AEMED: porcentaje por área de estenosis media de la lesión; ALM: área luminal mínima; ALMED: área luminal media; IVUS: ecografía intracoronaria; L: longitud de la lesión; RFF: reserva fraccional de flujo; VOLLUZ: volumen de la luz para la longitud de la lesión; VOLVASO: volumen del vaso para la longitud de la lesión.
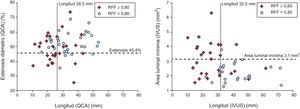
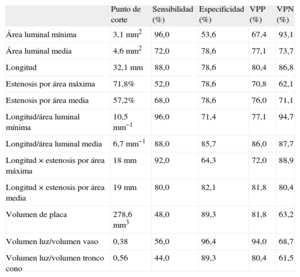
Los mejores puntos de corte para cada parámetro ecográfico analizado se muestran en la tabla 5. La figura 2 muestra el poder clasificatorio de los puntos de corte angiográficos (%EDMAXQCA y LQCA) y ecográficos (ALMIVUS y LIVUS), que fue mejor para los parámetros ecográficos escogidos. El empleo conjunto de los dos puntos de corte angiográficos (grado de estenosis máxima y longitud) para predecir una RFF<0,80 mostró: sensibilidad, 72,4%; especificidad, 79,3%; valor predictivo positivo, 77,8%, y valor predictivo negativo, 74,2%. El empleo conjunto de los dos puntos de corte ecográficos (ALMIVUS<3,1mm2 y LIVUS > 32,5mm) mostró: sensibilidad, 84,0%; especificidad, 85,7%; valor predictivo positivo, 84,0%, y valor predictivo negativo, 85,7%.
Mejores puntos de corte para la obtención de una reserva fraccional de flujo < 0,80 para los distintos parámetros de ecografía intracoronaria generados a partir de las curvas receiver operating characteristic realizadas
| Punto de corte | Sensibilidad (%) | Especificidad (%) | VPP (%) | VPN (%) | |
| Área luminal mínima | 3,1mm2 | 96,0 | 53,6 | 67,4 | 93,1 |
| Área luminal media | 4,6mm2 | 72,0 | 78,6 | 77,1 | 73,7 |
| Longitud | 32,1mm | 88,0 | 78,6 | 80,4 | 86,8 |
| Estenosis por área máxima | 71,8% | 52,0 | 78,6 | 70,8 | 62,1 |
| Estenosis por área media | 57,2% | 68,0 | 78,6 | 76,0 | 71,1 |
| Longitud/área luminal mínima | 10,5mm−1 | 96,0 | 71,4 | 77,1 | 94,7 |
| Longitud/área luminal media | 6,7mm−1 | 88,0 | 85,7 | 86,0 | 87,7 |
| Longitud×estenosis por área máxima | 18mm | 92,0 | 64,3 | 72,0 | 88,9 |
| Longitud×estenosis por área media | 19mm | 80,0 | 82,1 | 81,8 | 80,4 |
| Volumen de placa | 278,6mm3 | 48,0 | 89,3 | 81,8 | 63,2 |
| Volumen luz/volumen vaso | 0,38 | 56,0 | 96,4 | 94,0 | 68,7 |
| Volumen luz/volumen tronco cono | 0,56 | 44,0 | 89,3 | 80,4 | 61,5 |
VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Gráficos de dispersión entre los parámetros angiográficos (panel izquierdo) y ecográficos (panel derecho) más usados, con los puntos de corte para cada parámetro. Cruces: lesiones con reserva fraccional de flujo ≥ 0,80. Círculos: lesiones con reserva fraccional de flujo < 0,80. IVUS: ecografía intracoronaria; QCA: cuantificación digital automática; RFF: reserva fraccional de flujo.
El presente estudio demuestra las limitaciones de la IVUS para determinar la repercusión funcional de lesiones coronarias largas angiográficamente moderadas y la importancia de considerar la longitud como uno de los parámetros de mayor importancia a la hora de estimar la repercusión funcional de este tipo de lesiones. El hecho de haber observado casi un 50% de lesiones con una RFF<0,80 contrasta con la cifra próxima al 30% de lesiones funcionalmente significativas observada en la mayoría de las series publicadas12,13 pese a haber incluido lesiones con grados de estenosis similares. Este dato por sí solo subraya la importancia de la longitud de la lesión en la repercusión funcional.
Recientemente hemos publicado un trabajo que demuestra la limitación de la angiografía y la importancia de la longitud de la lesión coronaria en su repercusión funcional en un subgrupo de lesiones seleccionadas de manera idéntica que en el presente estudio: las angiográficamente moderadas con una longitud que obliga, en caso de realizar tratamiento percutáneo, al implante de stents de longitud > 20mm14. Una de las limitaciones de este trabajo se debe a las propias limitaciones de la angiografía para valorar correctamente el grado de estenosis y la extensión de la enfermedad coronaria. La IVUS permite determinar de manera más precisa los diámetros y las áreas mínimas de la lesión, las referencias para determinar el grado de estenosis y la longitud de la lesión coronaria15–17. El presente trabajo demuestra que el valor predictivo de parámetros ecográficos que incluyan la longitud de la lesión pueden correlacionarse mejor que la angiografía con su repercusión funcional medida con guía intracoronaria de presión, pero también presenta numerosos errores clasificatorios, especialmente falsos positivos.
La IVUS se propuso como un método fiable para estimar la repercusión funcional de una lesión coronaria. El parámetro ecográfico más utilizado fue el ALM con distintos puntos de corte según el tipo de lesión estudiada y el trabajo publicado9,18–20. Múltiples trabajos más recientes han señalado las limitaciones de la IVUS para determinar la repercusión funcional de lesiones con estenosis angiográficamente intermedias, si bien la mayoría de ellos se ha centrado en parámetros ecográficos focales (principalmente el ALM) sin tener en cuenta la longitud de la lesión. Estos estudios han incluido lesiones con una longitud media < 15mm7,8,21,22, y puede ser razonable que, en lesiones de escasa longitud, este parámetro no tenga tanta importancia como en lesiones más largas y sea menor aún o inexistente la correlación lineal con el valor de RFF.
Se han formulado diferentes explicaciones para justificar la deficiente correlación entre el ALMIVUS y el valor de RFF observado. La longitud de la lesión es una de las razones que pueden determinar un valor de RFF distinto con idéntica ALM. El efecto de la longitud, poco relevante en lesiones < 15mm, puede ser más notable cuando se valoran estenosis coronarias de gran longitud, como las que se ha incluido en este trabajo. Otros factores que se integran en la determinación funcional directa mediante la RFF23,24 (tamaño del territorio miocárdico, enfermedad microvascular o tamaño del vaso) y no en la valoración puramente anatómica realizada mediante IVUS pueden ser los determinantes de que la correlación IVUS-RFF sea deficiente pese a tomar en consideración la longitud de la lesión. La existencia de daño microvascular, por ejemplo, puede causar que el flujo coronario máximo alcanzable en determinado territorio miocárdico esté limitado por la incapacidad de este para la vasodilatación, de forma que la contribución de la estenosis (a pesar de un ALM reducida) sea mínima en la posible limitación del flujo sanguíneo máximo que llega a esa zona miocárdica.
Lee et al25, en un reciente estudio, establecieron, para arterias < 3mm, una longitud de 20mm, junto con un valor de ALM, como valor de corte para estimar una RFF<0,80. El valor predictivo de la longitud en este estudio fue inferior a la observada en el nuestro, si bien los autores incluyeron lesiones con una longitud media de 17,9mm, mientras que las de nuestro estudio superan los 34mm. En el mismo trabajo, una combinación de parámetros focales (ALM) con otros en los que interviene la longitud de la lesión (carga de placa y la longitud misma) fue lo que, como en nuestro trabajo, presentó el mayor valor predictivo.
Nuestro trabajo ha encontrado que la combinación de los parámetros ecográficos de un ALM < 3,1mm2 junto con una longitud > 32,5mm se asoció a sensibilidad, especificidad y valores predictivos > 80%. No es objetivo de este trabajo analizar si este punto de corte, compuesto de dos medidas conjuntas, es igual de válido para los tres vasos coronarios y todos sus segmentos. Creemos que las medidas de validez diagnóstica relativamente altas encontradas para este punto de corte compuesto redundan aún más en la importancia de tener en cuenta la longitud de la lesión si se decide no utilizar una medida funcional para indicar la revascularización de este tipo de lesiones.
Nuestro estudio ha fracasado a la hora de encontrar algún parámetro volumétrico con buena correlación con el valor de RFF obtenido. El volumen de placa fue el mejor de ellos, lejos de aquellos en que intervenía la longitud. Las relaciones volumétricas volumen de la luz/volumen del vaso y volumen de la luz/volumen tronco de cono teórico mostraron baja correlación con el valor de RFF. La presencia de distintos grados de remodelado arterial puede hacer que las relaciones entre volúmenes no se relacionen con mayor grado de deterioro del flujo coronario, y se puede considerar esta mala correlación incluso como una expresión del significado adaptativo del remodelado arterial coronario como respuesta al crecimiento de la placa de ateroma15,26.
LimitacionesAl tratarse de un estudio unicéntrico que ha incluido únicamente lesiones largas, en ausencia de otras lesiones visibles proximales y distales a la estudiada, el número de lesiones incluidas es pequeño. Aun así, creemos que es suficiente para demostrar la importancia de considerar la longitud de la lesión cuando se quiera realizar una estimación de la repercusión funcional de una lesión a partir de datos ecográficos y las limitaciones de la IVUS para realizar este tipo de estimaciones. El reducido número de lesiones incluidas no permite analizar determinados factores anatómicos que podrían influir de manera diferencial en la repercusión funcional de las lesiones (localización proximal, media o distal, territorio en riesgo, etc.). La valoración de estos factores anatómicos requeriría de un estudio de mayor tamaño, probablemente con la participación de varios centros. Aunque la medición de la longitud de las lesiones la realizaron hemodinamistas experimentados en IVUS y de acuerdo con la técnica habitual para realizar este tipo de análisis, el carácter en ocasiones difuso de la enfermedad coronaria hace que pueda haber cierto grado de variabilidad o imprecisión en la determinación del inicio y el fin de la lesión. Creemos que desconocer el resultado de la RFF al realizar el análisis de la IVUS puede compensar la influencia en los resultados de la posible imprecisión en la medida.
CONCLUSIONESEn lesiones angiográficamente moderadas con longitudes > 20mm, la longitud medida por IVUS es un parámetro que se debe tener en cuenta a la hora de estimar su repercusión funcional. Dicha estimación debe realizarse combinando parámetros focales de estenosis máxima y longitud, si bien su correlación con los valores de RFF obtenidos mediante guía intracoronaria de presión es baja. La selección conjunta de un ALM < 3,1mm2 y una longitud > 32,5mm se asocia con el punto de corte de RFF < 0,80 con las mejores sensibilidad y especificidad. En los casos en que el principal objeto del estudio de una lesión angiográficamente dudosa sea conocer su posible repercusión funcional, parece aconsejable realizar una medición directa mediante determinación de la RFF, y no una estimación basada en datos anatómicos.
CONFLICTO DE INTERESESNinguno.