El tratamiento percutáneo de lesiones estenóticas en el árbol arterial pulmonar se ha mostrado válido y eficaz tanto en la edad adulta como en la edad pediátrica1,2. La producción de una fistula aortopulmonar iatrogénica tras angioplastia pulmonar es una complicación excepcional descrita por diversos autores, que han utilizado distintos dispositivos para el cierre percutáneo de dichas lesiones3–6. El motivo de la siguiente carta es discutir esta infrecuente lesión y considerar las opciones del tratamiento percutáneo.
A un paciente diagnosticado de transposición de grandes arterias, se le intervino con 13 días de vida para intercambio arterial y maniobra de Lecompte. En el quirófano se diagnosticó un patrón coronario consistente en arteria coronaria izquierda con trayecto intramural, de la que surgían descendente anterior y coronaria derecha, y una arteria circunfleja filiforme independiente. Para su corrección, se colocó tubo de PTFE de 3,5 mm entre aorta ascendente y coronaria izquierda. El postoperatorio fue satisfactorio, y se le dio el alta hospitalaria a los 14 días de la intervención.
En controles posteriores el paciente sufría estenosis pulmonar supravalvular con gradiente ecocardiográfico de 62 mmHg, por lo que se le practicó cateterismo cardiaco al año de edad; se registraron gradiente en la estenosis de 52 mmHg, presiones en el ventrículo derecho el 66% de las sistémicas y estenosis en origen de rama pulmonar derecha (gradiente, 18 mmHg). Se procedió a angioplastia percutánea del tronco pulmonar y del origen de la rama derecha con catéter-balón de 15 × 30 mm y 10 × 20 mm respectivamente a través de introductor de 8 Fr; se comprobó la desaparición del gradiente de la rama, la disminución del gradiente del tronco hasta 16 mmHg y la aparición de leve rotura de la íntima en el origen de la rama derecha. Sin embargo, en la resonancia magnética realizada se comprobó integridad de la pared del tronco y la rama pulmonar.
Durante los 4 años siguientes permaneció asintomático, hasta que fueron apareciendo signos de insuficiencia cardiaca congestiva; por ecocardiografía se observaba un progresivo aumento de tamaño de las cavidades cardiacas izquierdas, así como un flujo continuo en el origen de la rama pulmonar derecha junto con flujo retrógrado en la aorta descendente. Ante la sospecha de comunicación aortopulmonar secundaria a angioplastia, a los 5,5 años de edad y con 22 kg de peso, se le realizó cateterismo cardiaco y ecocardiografía transesofágica; se observó una fístula de 8 mm entre la aorta ascendente y el origen de la rama pulmonar derecha. Las presiones medias aórtica y pulmonar eran 65 y 28 mmHg respectivamente, con relación QP/QS de 2,3, gradiente suprapulmonar de 15mmHg y de 8mmHg en el origen de la rama derecha. Se procedió al cierre percutáneo de la fístula interauricular con dispositivo Amplatzer® Septal Occluder de 9 mm de cintura, por el que se optó debido al tamaño lesional. Se sondó el defecto por vía aórtica con un catéter de agujero distal de 4 Fr y guía hidrófila de 0,014”. Ya en la luz pulmonar, se creó un asa arteriovenosa mediante la captura de la guía con catéter-lazo de 10 mm, permitiendo la salida de la guía por vía venosa femoral. Una vez estabilizada la guía, permitió avanzar el catéter de agujero distal para la colocación de una guía de mayor soporte (0,035”), sobre la que se desplazó la vaina (Amplatzer® Delivery System de 7 Fr) por la que se asciende el dispositivo, y se colocó por vía pulmonar. El procedimiento transcurrió con éxito, sin incidencias y sin precisar reposicionamiento (figura 1 y figura 2). Tras el cierre, se observó un cortocircuito residual a través del dispositivo (QP/QS = 1,5), sin aumento del gradiente pulmonar ni de la aorta ascendente. Por control ecográfico se observó el cortocircuito durante 1 mes, así como signos de hemolisis ligera que desaparecieron a los 6 días del procedimiento sin tratamiento alguno. El paciente quedó asintomático el 5.o día tras el implante, con seguimiento tras el cierre de 28 meses, sin nuevas complicaciones asociadas.
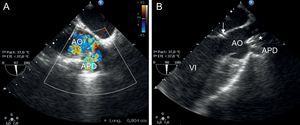
Ecocardiografía transesofágica. A: medición de la ventana aortopulmonar. B: comprobación de la correcta colocación del dispositivo (asterisco) sin alteración del funcionamiento de la válvula aórtica ni la salida del conducto coronario (flecha). AO: aorta; APD: arteria pulmonar derecha; VI: ventrículo izquierdo.
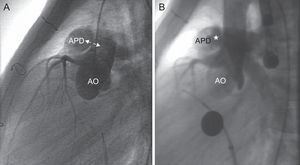
Cateterismo cardiaco. Aortografía en proyección lateral. A: visualización de la ventana (flechas) entre la pared posterior del tronco-rama pulmonar derecha y la pared anterior de la aorta. B: comprobación de la correcta colocación del dispositivo (asterisco) sin afectar a la perfusión coronaria, con shunt residual por el interior del dispositivo. AO: aorta; APD: arteria pulmonar derecha.
El tratamiento percutáneo de lesiones estenóticas del árbol arterial pulmonar ha sido aceptado como una opción eficaz y válida1,2. Existen casos aislados en los que se describe la producción de una comunicación iatrogénica entre la aorta y la arteria pulmonar y ramas, sobre todo en casos sometidos a intervención de switch arterial, como ocurre en el caso presentado3–6. En su etiopatogenia se ha descrito la amplia adherencia que se establece entre la aorta y la arteria pulmonar al realizar la maniobra de Lecompte en el switch arterial5.
La producción progresiva de síntomas de insuficiencia cardiaca debida a la ventana iatrogénica se debe al progresivo aumento del tamaño de la lesión, como explican Vida et al4 y ocurre en nuestro caso.
En cuanto al cierre percutáneo, hemos de ser cuidadosos en la selección del dispositivo para no afectar al funcionamiento normal de la válvula pulmonar, asegurar una perfusión adecuada coronaria y obstruir lo mínimo la luz de ambas arterias. En el cierre se han utilizado stents recubiertos3,4, que estén indicados en los casos cercanos a la bifurcación pulmonar, pues otro dispositivo generaría protrusión a la luz de las arterias pulmonares. También se han usado dispositivos Amplatzer® Duct Occluder II y Amplatzer® Septal Occluder6, sobre todo para lesiones de pequeño tamaño. El motivo de nuestra elección es el mejor perfil que se adaptara a la luz vascular sin ocluir la luz de ambos vasos y la salida del conducto que irriga las coronarias.