Palabras clave
INTRODUCCIÓN
La miocardiopatía hipertrófica (MCH) es la forma más frecuente de las miocardiopatías hereditarias. Se caracteriza a escala molecular por mutaciones en los genes que codifican las proteínas del sarcómero, e histológicamente se traduce en una disposición anómala de las fibras miocárdicas, hipertrofia ventricular, alteraciones de los vasos miocárdicos y fibrosis1. Con respecto a sus manifestaciones clínicas, además de por complicaciones intercurrentes como el ictus2, la severidad de la enfermedad viene dada por dos aspectos: por un lado, el deterioro hemodinámico y la limitación de la capacidad de esfuerzo por disfunción diastólica y, en ocasiones, alteración de la función sistólica con insuficiencia cardiaca clínica. El otro condicionante de la severidad es el riesgo de muerte súbita y arritmias ventriculares3-5. En cualquier caso, nuestro conocimiento respecto a los predictores tanto del deterioro hemodinámico como de la muerte súbita es limitado. El grado de deterioro funcional se predice débilmente por la magnitud de la hipertrofia, la obstrucción ventricular u otros marcadores clásicos de severidad de la enfermedad6. Las concentraciones de NT-proBNP muestran una mejor correlación, en sentido inverso, con la clase funcional7 y el consumo máximo de oxígeno durante el ejercicio8.
Recientemente se ha introducido la cardiorresonancia magnética (CRM) para el estudio de la MCH9-14. Además de un detallado estudio morfofuncional, la administración intravenosa de gadolinio permite estudiar la presencia de áreas de realce tardío (RTG). Tras 10-20 min de su administración, el gadolinio permanece en la matriz extracelular y se acumula en áreas de fibrosis15 y, posiblemente en menor grado, en áreas con importante desestructuración13,16. Esto nos permite estudiar la fibrosis in vivo. La participación de la fibrosis miocárdica en la limitación funcional no ha sido establecida por el momento.
Nuestro objetivo es comprobar si el RTG en la CRM se asocia, de forma independiente, con la limitación en la capacidad funcional que presentan los pacientes afectos de MCH. Para ello se incluyen los marcadores más relevantes relacionados con la capacidad funcional, como parámetros clínicos y ecocardiográficos, así como concentraciones basales de NT-proBNP.
MÉTODOS
Pacientes
Se incluyó a 98 pacientes consecutivos diagnosticados de miocardiopatía hipertrófica en las consultas monográficas del Hospital Universitario Virgen de la Arrixaca (Murcia, España) (44 pacientes) y el Hospital General Universitario de Alicante (Alicante, España) (54 pacientes). Se excluyó a los pacientes que tenían contraindicación o imposibilidad para la realización de ergometría o la CRM.
Los criterios de inclusión requerían el diagnóstico de miocardiopatía hipertrófica según las guías vigentes4: grosor parietal del ventrículo izquierdo 3 15 mm en ausencia de otra causa que pudiera condicionar hipertrofia ventricular; en el caso de familiares de primer grado de afectados, se siguieron los actuales criterios propuestos17.
A todos los pacientes se les realizó una evaluación clínica complementada por CRM con contraste, ergometría convencional y Holter de 24 h para valorar posible taquicardia ventricular no sostenida (TVNS). En un subgrupo de 71 pacientes, se obtuvieron además las concentraciones basales de NT-proBNP.
Evaluación clínica
Se realizó una valoración clínica completa en cada caso. Se hizo especial énfasis en la disnea (clase NYHA), la angina, el síncope y la fibrilación auricular u otras alteraciones del ritmo. De todos los pacientes, se realizó un estudio de estratificación del riesgo de muerte súbita, valorando los siguientes factores: a) antecedentes familiares de muerte súbita; b) síncope recurrente de origen no explicado o muerte súbita reanimada; c) respuesta presora anormal en la ergometría, y d) TVNS en el Holter y un grosor máximo del ventrículo izquierdo 3 30 mm en el ecocardiograma o un gradiente en TSVI > 30 mmHg en reposo.
Ecocardiografía Doppler
El estudio ecocardiográfico se realizó con un equipo Sonos 5500 (Phillips, Eindhoven, Países Bajos). Los estudios se realizaron en reposo, y las imágenes fueron almacenadas en soporte informático para posteriores revisiones. Se realizaron mediciones del grosor parietal en el eje corto a nivel de la válvula mitral y de músculos papilares. Se buscó el mayor grosor de la pared del ventrículo izquierdo. La fracción de eyección se calculó con el método de Simpson con promediado en los planos de dos y cuatro cámaras. La función diastólica se determinó mediante Doppler pulsado del flujo de entrada en la válvula mitral, así como mediante los picos de velocidad diastólica del anillo mitral y flujo de venas pulmonares. Se determinó la presencia de gradiente en TSVI mediante Doppler color y Doppler continuo, considerando significativo un valor > 30 mmHg.
Ergometría
Se utilizó un ergómetro con tapiz rodante (Marquette Electronics Inc., Milwaukee, Estados Unidos). Se realizó ergometría limitada por síntomas a todos los pacientes (88 mediante el protocolo de Bruce y en los 10 restantes, por dificultad para la deambulación, con el protocolo modificado de Bruce). Se determinó presión arterial no invasiva en reposo y cada minuto durante el ejercicio y los 5 min siguientes. Se consideró respuesta presora anormal cuando la presión arterial no llegaba a superar en 20 mmHg la presión en reposo o cuando la presión arterial descendía durante el esfuerzo más de 20 mmHg respecto al pico alcanzado18. Se estimó indirectamente el consumo de oxígeno en equivalentes metabólicos (MET) según las fórmulas habituales integradas en el software del equipo.
Cardiorresonancia magnética
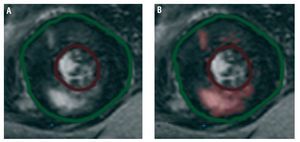
Se realizó CRM con el escáner General Electric 1,5 T Signa LX Release 9.1, con bobina de Torsopa de seis elementos y software de cardiología. Se administró gadolinio en dosis de 0,2 mm/kg en bolo, y tras 10 min se tomaron secuencias ecográficas de gradiente, con inversión-recuperación en cortes múltiples para valorar la presencia de fibrosis miocárdica. Las imágenes obtenidas fueron procesadas con el programa Mass Suite 6.1 de Medis (Leiden, Países Bajos). Se describió la presencia o ausencia de fibrosis. Se realizó asimismo la cuantificación digital del porcentaje de miocardio que presentaba captación tardía de gadolinio; para tal fin, las áreas con captación positiva quedaron definidas por una intensidad de la señal 2 desviaciones estándar por encima del valor promedio de la señal en una muestra de tejido miocárdico sano distante (fig. 1).
Fig. 1. Proceso de cuantificación del tejido afectado por realce tardío con gadolinio. A: antes del procesado. B: las áreas que presentan una intensidad de señal 2 desviaciones estándar por encima de los valores de señal en una muestra de tejido miocárdico sano son seleccionadas automáticamente (indicado en rosa).
Determinación de NT-proBNP
Se extrajeron muestras de sangre de los pacientes tras 12 h de ayuno, en reposo, de la vena antecubital. Se realizó centrifugación a 3.500 g durante 15 min para obtener los sueros. Las muestras se almacenaron a -40 °C para posteriores análisis. Se realizó determinación de concentraciones de NT-proBNP usando un kit diagnóstico de Roche en un analizador Elecsys 2010 (Roche Diagnostics, Mannheim, Alemania). Los límites de detección fueron 0,6 pmol/l y 4.130 pmol/l respectivamente. Para convertir pmol/l a pg/ml, se multiplicó los valores en pmol/l por 8.457.
Análisis estadístico
Se estudió si las variables analizadas seguían una distribución normal mediante el test de Kolmogorov-Smirnov. Las variables de distribución normal se expresan como media ± desviación estándar. Las variables de distribución no normal se expresan como mediana y rango intercuartílico. Las variables cualitativas se expresan como porcentajes.
Se estudió la relación de las distintas variables con la capacidad de esfuerzo (MET). Para variables dicotómicas, se utilizó el test de la t de Student. Para variables continuas, se utilizó el análisis de correlación (coeficiente de Pearson para variables de distribución normal, coeficiente de Spearman para variables de distribución no normal). Para el análisis de las concentraciones de NT-proBNP, que no muestran una distribución normal, se realizó una transformación logarítmica. Finalmente, para el estudio de los posibles factores de confusión y de la importancia de las variables independientes sobre las demás, se incluyeron las variables más significativas (p < 0,150 en el análisis univariable) en un análisis multivariable mediante un modelo de regresión lineal. Se consideró significativo un valor de p < 0,05. Se realizó el análisis con el paquete estadístico SPSS (versión 11, SPSS Inc.).
RESULTADOS
Se incluyó en el estudio a 98 pacientes (edad, 46,3 ± 15,4 años; el 71,4% varones). Las características basales se muestran en la tabla 1. El 61% de los pacientes presentaban disnea (clase funcional NYHA II o superior). El valor promedio de la capacidad de esfuerzo alcanzada en la ergometría fue de 8,8 ± 3,7 MET. El 52% de los pacientes presentaron dos o más factores de riesgo de muerte súbita. El 68,4% de pacientes mostraron RTG en la CRM.
Al estudiar la relación de las distintas variables clínicas con los MET alcanzados en la ergometría (tabla 2), observamos una peor capacidad funcional en mujeres, pacientes con disnea o con antecedentes de síncope, hipertensión o fibrilación auricular. Con respecto a las exploraciones complementarias, se observó peor capacidad funcional en pacientes con obstrucción ventricular (> 30 mmHg), respuesta tensional anormal en la ergometría o RTG en la CRM. No se observó relación entre la capacidad de esfuerzo y un grosor parietal máximo 3 30 mm (aunque sólo 5 pacientes presentaron grosores por encima de ese valor), ni con la TVNS o los antecedentes familiares de muerte súbita.
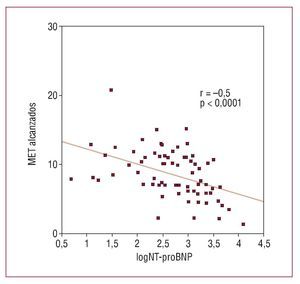
Se analizaron las correlaciones entre las variables cuantitativas y los MET alcanzados (tabla 3), y se observó una correlación inversa significativa entre capacidad de esfuerzo y edad, NT-proBNP plasmático, grado de obstrucción a la salida del ventrículo izquierdo, grosor máximo de la pared del ventrículo izquierdo, diámetro anteroposterior de la aurícula izquierda y porcentaje de miocardio afecto mediante RTG. El diámetro telediastólico del ventrículo izquierdo se relacionó de forma directa con la capacidad funcional. No encontramos correlación estadísticamente significativa entre la fracción de eyección del ventrículo izquierdo y los equivalentes metabólicos alcanzados. El logaritmo de NT-proBNP resultó ser la variable que mejor se correlacionó con la capacidad funcional (r = -0,5; p < 0,0001) (tabla 3, fig. 2).
Fig. 2. Correlación entre capacidad de esfuerzo (MET alcanzados en la ergometría) y el logaritmo de las concentraciones plasmáticas de NT-proBNP. Tras conversión logarítmica, los valores de logNT-proBNP presentan una distribución normal. Se indica nivel de significación y valor de r mediante análisis de correlación de Pearson.
Variables relacionadas con el realce tardío con gadolinio
Los pacientes que mostraron RTG en la CRM presentaron con mayor frecuencia disnea severa (NYHA III-IV), así como TVNS en el Holter y concentraciones más elevadas de NT-proBNP. En la ecocardiografía, los pacientes con RTG presentaban mayores grosores parietales, más obstrucción ventricular y reducción de los diámetros telediastólico y telesistólico del ventrículo izquierdo. No obstante, en nuestra muestra no se observó relación entre el RTG y la fracción de eyección del ventrículo izquierdo (datos no mostrados).
Realce tardío con gadolinio y capacidad funcional
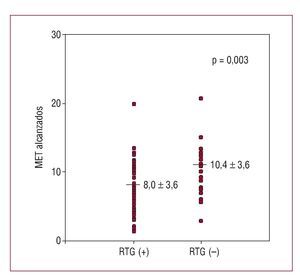
El RTG en la CRM se relacionó con una peor capacidad de ejercicio (8,04 ± 3,56 frente a 10,41 ± 3,57 MET; p = 0,003). Sin embargo, hemos de destacar que hay gran dispersión y solapamiento de los valores de equivalentes metabólicos alcanzados en ambos grupos (fig. 3). Respecto la cuantificación del RTG, se observó una correlación inversa significativa entre porcentaje de miocardio con RTG y los MET alcanzados, aunque dicha correlación es ciertamente débil (r = -0,21; p = 0,044).
Fig. 3. Diferencias en capacidad funcional (MET) entre pacientes con captación tardía de gadolinio en la resonancia magnética (RTG+) y sin captación tardía de gadolinio (se indica nivel de significación para el test de la t de Student).
Análisis multivariado
En el subgrupo de pacientes del que se disponía de concentraciones de NT-proBNP (71 pacientes), se realizó un análisis multivariable en el que se incluyó las variables independientes edad, sexo, antecedentes de fibrilación auricular (paroxística, persistente o permanente), fibrosis, concentraciones plasmáticas de NT-proBNP, grosor máximo (mm) y un gradiente en TSVI significativo (> 30 mmHg). Las características basales de este subgrupo de pacientes resultaron similares a las del conjunto de la población estudiada. De las variables incluidas, sólo la edad, los antecedentes de fibrilación auricular, la fibrosis en la CRM con gadolinio y el logaritmo de las concentraciones de NT-proBNP se asociaron de forma independiente con los MET alcanzados en la ergometría (tabla 4) (r2 del modelo = 0,47; r2 corregida = 0,44).
DISCUSIÓN
Nuestra población presenta una afección grave, tanto en capacidad funcional como en factores de riesgo de muerte súbita (el 52% presenta dos o más factores de riesgo de muerte súbita) o por fibrosis en la CRM (el 68,4% de los pacientes presentan áreas de RTG). Tal grado de afección es comparable a los de otros estudios (en los que se observa fibrosis en un 48-81% de los pacientes mediante CRM)9-11,14 y es característico de las poblaciones atendidas en los centros de referencia para MCH4.
Este estudio refuerza la tesis de que la fibrosis miocárdica —determinada in vivo mediante RTG en CRM— participa en la limitación funcional de los pacientes con MCH de forma independiente de otros factores, como podrían ser el grosor parietal ventricular, el gradiente en TSVI o la fibrilación auricular. No obstante, la asociación estadística es débil e incluso, tras considerar el conjunto de las variables más significativas (fibrilación auricular, edad, concentraciones de NT-proBNP y fibrosis), sólo se consigue explicar el 47% de la variabilidad en los MET alcanzados. Tal dificultad para explicar la limitación funcional en esta enfermedad coincide con lo publicado por otros grupos7,8,19 y refleja la complejidad y la heterogeneidad de los procesos implicados, que incluyen disfunción diastólica, disfunción sistólica, obstrucción al TSVI, insuficiencia mitral e isquemia, aparte de múltiples factores extracardiacos que condicionan la capacidad funcional. Coincidiendo con otros autores, el logNT-proBNP es el factor que mejor predice la capacidad de esfuerzo (r = -0,5)8. Sin embargo, el hecho de que no alcancen consideración como predictores independientes de capacidad funcional parámetros tales como la obstrucción del TSVI, la fracción de eyección del ventrículo izquierdo o el grosor parietal, con significación en otros estudios6,19-24, indica que los resultados deben ser valorados con cautela. Una característica peculiar de nuestra muestra es la escasa representación de pacientes con fracción de eyección deprimida (sólo 6 [6,2%] pacientes presentaban una fracción de eyección < 50%), lo que no nos permite aclarar el papel de la disfunción sistólica en la capacidad de esfuerzo y su relación con la fibrosis.
La relación de la fibrosis con algunos marcadores de la severidad de la enfermedad ya ha sido descrita previamente1,10,14,25. La CRM con RTG aporta la posibilidad de estudiar en vivo esta relación. El tejido fibroso se corresponde con un miocardio más patológico, con problemas de distensibilidad, mayor grosor, peor contractilidad y tendencia a la dilatación progresiva, todo lo cual conduce al deterioro hemodinámico del paciente9,11,12,26. Previamente, Dumont et al10 encontraron relación entre la captación de RTG y la respuesta isquémica en la prueba de esfuerzo, además de relacionarse con disfunción sistólica y con una menor capacidad de aumentar el gradiente en TSVI durante el esfuerzo. Esos hallazgos pueden ayudar a explicar la peor capacidad funcional en pacientes que presentan RTG.
Cabe destacar en nuestro estudio que la cuantificación del RTG no resulta superior a la mera distinción entre presencia o ausencia de RTG para predecir capacidad funcional. Tal fenómeno indica que el RTG evidencia en realidad distintos tipos de anomalía histológica y de distinta significación pronóstica (aumento difuso de la matriz intersticial, desestructuración arquitectónica, fibrosis plexiforme a nivel de las uniones interventriculares, fibrosis perivascular o áreas de cicatrización16). En la actualidad, no hay consenso sobre el método adecuado para cuantificar el RTG: aparte de la cuantificación basada en un umbral de señal que utilizamos9, otros grupos han realizado cuantificación mediante planimetría11,14, dispersión de la intensidad de la señal en el miocardio26 o contabilización del número de segmentos que presentan RTG10. Además, a diferencia de lo que sucede en afecciones como el infarto de miocardio, las zonas con RTG en pacientes con MCH —sobre todo en los que tienen afección miocárdica difusa— suelen encontrarse mal delimitadas y presentan distintos grados de afección, y coexisten en distinta proporción miocitos con una abundante matriz intersticial. Todo ello indica que todavía queda por esclarecer si alguno de los parámetros cuantitativos utilizados es el idóneo para determinar la severidad de la enfermedad. Moon et al11 incluso señalan que una valoración cualitativa, que indique el patrón de distribución de la fibrosis, podría aportar información pronóstica adicional.
Aunque no entra en el objetivo principal de nuestro análisis, se observa en nuestra población una asociación estadística entre el RTG en la CRM y los predictores de muerte súbita utilizados en la práctica clínica, lo que confirma los hallazgos de otros grupos4,10-12,14 y refuerza el probable papel de la fibrosis miocárdica en el origen de las arritmias ventriculares y la muerte súbita en estos pacientes (datos no mostrados).
Limitaciones
Nuestro estudio es de carácter observacional, realizado sobre una población no seleccionada de pacientes remitidos a las consultas especializadas participantes y, por lo tanto, está sujeto a posibles sesgos e interacciones entre las distintas variables estudiadas. Por otro lado, las características de la población son las habituales en las consultas especializadas de MCH, con un perfil de severidad de la enfermedad superior al de la población general de pacientes con MCH.
Observamos una contribución significativa, aunque modesta, de la fibrosis para explicar el deterioro funcional en el paciente. En cualquier caso, la complejidad de la afección cardiaca y los variados mecanismos implicados en ella dificultan el estudio del efecto de uno solo de estos mecanismos. No podemos excluir que con un mayor tamaño poblacional quizá se hubiera aclarado la participación de otras variables en el origen de la disnea.
Nuestro estudio tiene un diseño puramente transversal. Un seguimiento a largo plazo de nuestros pacientes probablemente podrá aportar información adicional, como el valor de la fibrosis para predecir progresión a disfunción sistólica, arritmias ventriculares o aparición de fibrilación auricular.
Por último, la determinación del consumo de oxígeno durante el esfuerzo hubiera permitido cuantificar de forma más fehaciente y reproducible la capacidad funcional de los pacientes19,27.
CONCLUSIONES
El RTG y su cuantificación (porcentaje de tejido realzado) en pacientes con MCH se asocia con una peor capacidad de esfuerzo, estimada mediante ergometría sobre cinta sin fin. La asociación es débil estadísticamente, pero independiente de otros predictores asociados con el deterioro funcional de estos pacientes.
ABREVIATURAS
CRM: cardiorresonancia magnética.
MCH: miocardiopatía hipertrófica.
RTG: realce tardío con gadolinio.
TSVI: tracto de salida del ventrículo izquierdo. TVNS: taquicardia ventricular no sostenida.
Full English text available from: www.revespcardiol.org
Correspondencia:
Dr. F. Marín.
Servicio de Cardiología. Hospital Universitario Virgen de la Arrixaca.
Ctra. Madrid-Cartagena, s/n. 30120 El Palmar. Murcia. España.
Correo electrónico: fcomarino@hotmail.com
Recibido el 19 de enero de 2008.
Aceptado para su publicación el 16 de abril de 2008.