La reestenosis coronaria tras implantar un armazón vascular bioabsorbible (AVB) es infrecuente. Hay poca información disponible sobre las principales características de este tipo de lesiones. El objetivo de este estudio es caracterizar las reestenosis del AVB mediante tomografía de coherencia óptica (OCT).
MétodosSe estudió a 330 pacientes que recibieron 398 AVB para tratar 380 lesiones. Se evaluó a estos pacientes clínica y angiográficamente y, tras detectarse la reestenosis, mediante OCT.
ResultadosTras un seguimiento de 19 ± 10 meses, se detectaron 18 casos de reestenosis en 17 pacientes (5,4%). La mayoría eran tardías o muy tardías (9 ± 4 meses). El patrón angiográfico más frecuente fue la reestenosis focal en 12 (67%) y principalmente localizada en el borde proximal en 9 (75%), afectando o no la plataforma. El patrón predominantemente homogéneo fue infrecuente en 3 (25%) y solo se visualizó en 3 de las 6 reestenosis situadas en el margen. La reestenosis focal localizada dentro del armazón presentó en la OCT un patrón heterogéneo o en capas. Finalmente se observó reestenosis difusa en 6 casos (33%), en los que se identificó un patrón rico en lípidos o un patrón en capas. Además, se identificaron microvasos y microcalcificaciones en algunos de ellos, lo que sugiere un proceso de neoateroesclerosis.
ConclusionesLa tasa de reestenosis tras una media de seguimiento de 19 meses fue del 5,4%. La presentación angiográfica más frecuente fue focal, situada en el borde proximal. La reestenosis difusa ocurrió tardía o muy tardíamente y la mayoría de estos pacientes presentaban signos de neoateroesclerosis.
Palabras clave
Implantar un armazón vascular bioabsorbible (AVB) es eficaz para tratar la enfermedad coronaria1–5. Los AVB pueden aportar también otros posibles efectos favorables cuando se absorben. Sin embargo, la reestenosis continúa siendo una limitación. Hay poca información sobre las características de la reestenosis tras el implante de esta plataforma bioabsorbible5–7. El proceso de reestenosis se ha interpretado como una respuesta exagerada durante el proceso de cicatrización tras el daño sufrido por la pared coronaria durante el proceso de revascularización8. Se han analizado las respuestas adversas a la angioplastia con balón, la aterectomía excisional, los stents metálicos sin recubrimiento (SMSR) y los stents farmacoactivos (SFA)9–11. La tasa de reestenosis ha disminuido drásticamente a causa de las mejoras que se han producido en la tecnología de los stents. Se han descrito patrones específicos de reestenosis tras el empleo de diferentes técnicas de revascularización12. Estos patrones pueden diferir según su forma de presentación clínica, la evolución temporal, la localización anatómica, la longitud angiográfica, el aspecto del tejido y la forma intraluminal. Recientemente se ha descrito la neoateroesclerosis como otro mecanismo diferente que da lugar a una reestenosis tardía13,14.
El objetivo de este estudio es analizar la reestenosis coronaria en una cohorte de pacientes tratados con AVB. Se describen la forma de presentación clínica, el aspecto angiográfico y las características del tejido de neoíntima intracoronario evaluadas mediante tomografía de coherencia óptica (OCT).
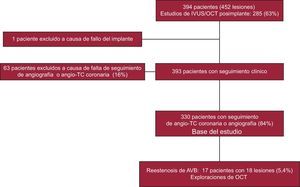
MÉTODOSPacientesEntre enero de 2012 y enero de 2015, se trató con un AVB a un total de 394 pacientes con enfermedad coronaria. En estos pacientes, se trataron con AVB 452 lesiones. El diagrama de flujo del estudio se muestra en la figura 1. Los pacientes no fueron consecutivos. Los criterios de exclusión fueron un diámetro del vaso de referencia > 4 mm, la calcificación extensa, la tortuosidad excesiva, la contraindicación de un tratamiento antiagregante plaquetario doble durante al menos 1 año, la edad > 75 años, la insuficiencia renal (aclaramiento de creatinina ≤ 30 ml/min) y el shock cardiogénico. Todos los pacientes firmaron un documento de consentimiento informado para la intervención. Tras una revascularización realizada con éxito, se dio el alta a los pacientes y se les dio seguimiento estricto mediante visitas médicas o llamadas telefónicas. Se programó una angiografía por tomografía computarizada (angio-TC) al menos 6 meses después de la intervención, con objeto de evaluar el segmento tratado con el armazón. Se llevó a cabo un nuevo cateterismo cardiaco en 17 pacientes que presentaron una recidiva clínica, signos de isquemia o sospecha de reestenosis según lo indicado por la angio-TC coronaria; estos pacientes constituyen el grupo de estudio. En función del tiempo transcurrido hasta su aparición, la reestenosis, en caso de que la hubiera, se consideró temprana (≤ 6 meses), tardía (6-12 meses) o muy tardía (> 12 meses)6.
Exploraciones angiográficasSe llevaron a cabo angiografías coronarias en diferentes proyecciones con objeto de delimitar adecuadamente las lesiones. Estas lesiones se definieron según la clasificación de AHA/CCA15. El empleo de predilatación se dejó al criterio del operador16. El diámetro del AVB se eligió en función del diámetro de referencia proximal. Se realizó una posdilatación si el balón del AVB no se había expandido por completo o si las imágenes intracoronarias indicaban que era recomendable, en caso de infraexpansión (diámetro luminal mínimo del AVB < 70%, en comparación con el área de referencia dentro de los 5 mm proximales y distales al armazón) o si había evidencia de mala aposición (> 200 μm de falta de aposición y ≥ 1 mm de longitud). El balón elegido fue un balón no distensible que no era más de 0,5 mm mayor que el diámetro del armazón. Dos operadores expertos llevaron a cabo un análisis de angiografía coronaria cuantitativa empleando un sistema de angiografía coronaria cuantitativo informatizado offline (CASS system, Pie Medical Imaging; Maastricht, Países Bajos). En el seguimiento, se realizó un nuevo cateterismo cardiaco a todos los pacientes que presentaban una reestenosis. Se utilizó la misma metodología y se aplicaron las mismas proyecciones radiográficas que en el examen angiográfico previo, con objeto de evaluar las características angiográficas de la reestenosis. La reestenosis binaria se definió como una reducción ≥ 50% del diámetro dentro del segmento en que se había implantado el armazón y en los 5 mm proximales y distales al implante. Estas lesiones se caracterizaron según la clasificación de Mehran17. Mediante este cateterismo cardiaco, el examen de OCT permitió realizar un análisis de las características de las lesiones de reestenosis. Finalmente, se aplicó un tratamiento percutáneo de la reestenosis a todos los pacientes.
Se llevaron a cabo exploraciones de angio-TC de seguimiento con un escáner de 64 cortes (LightSpeed VCT, GE Healthcare; Little Chalfont, Buckinghamshire, Reino Unido). Los parámetros de la exploración fueron los siguientes: adquisición de cortes 64 × 0,625 mm, tiempo de rotación del túnel (gantry) 350 ms, voltaje del tubo (100-120 kV) y corriente del tubo (650-800 mA). La exploración de angio-TC coronaria se analizó en una estación de trabajo dedicada (Advantage Windows 4.5). Se evaluó visualmente el AVB. Para la visualización del segmento tratado con el armazón, se realizaron reconstrucciones multiplanares curvas y una proyección de intensidad máxima, seleccionando el mejor ángulo de perspectiva para un mejor análisis del vaso. Se llevaron a cabo también reconstrucciones de proyecciones transversales del vaso en incrementos longitudinales de 1 mm, incluyendo los 5 mm proximales y distales al dispositivo, empleando indicadores de platino como marcadores de los puntos de referencia.
Método y análisis de la tomografía de coherencia ópticaSe realizó un análisis de OCT en todas las lesiones de reestenosis. En 10 de ellas (55%), se realizó un análisis de OCT después del implante del AVB. Se utilizó la OCT dominio de Fourier para el estudio (St. Jude Medical; St. Paul, Minnesota, Estados Unidos). Las imágenes de OCT se generaron a 100 fotogramas/s a medida que se retiraba el catéter a una velocidad de 20 mm/s. Se realizó mediante inyección continua con un medio de contraste no oclusivo a través de un catéter guía (12 ml) a una velocidad de 4 ml/s y 600 psi durante 3 s. Se adquirieron imágenes continuas, que se digitalizaron y registraron para un análisis posterior. Para la detección de la luz y el borde del armazón, se empleó la metodología descrita por Serruys et al.3 Para analizar la reestenosis, se eligieron al menos 3 fotogramas consecutivos de los segmentos tratados con armazones que tenían ≥ 50% de área tisular reestenosada (área del armazón, área luminal, área transversal). En función de las características del crecimiento de la neoíntima, la reestenosis se clasificó en 4 patrones ya descritos con anterioridad13,18: a) homogénea: una banda homogénea con señal uniforme, sin variación focal ni atenuación; b) heterogénea: propiedades ópticas con cambios focales y diversos patrones de atenuación de la señal; c) en capas: capas con diferentes propiedades ópticas, con una señal de alta intensidad a nivel adluminal y una señal de baja intensidad a nivel abluminal, y d) neoateroesclerótica: lesiones con una neoíntima cargada de lípidos, una neoíntima con calcificación o la presencia de un fibroateroma de cápsula fina. En las lesiones neoateroescleróticas se ha descrito también la presencia de macrófagos y formación de microvasos13. Se analizó también la presencia de una interrupción aguda o tardía debidas al proceso de absorción19,20. Se midió, además, la carga de tejido reestenótico en la zona de área luminal mínima (media del área de tejido reestenótico/media del área del stent × 100).
Análisis estadísticoSe utilizaron análisis descriptivos. Las variables discretas se presentan en forma de número y porcentaje, mientras que las variables continuas se expresan en forma de media ± desviación estándar. Para las comparaciones de medias se utilizó la prueba de la t de Wilcoxon. Todos los análisis se realizaron empleando el programa SPSS 16.0.0. (IBM Corp.; Armonk, New York, Estados Unidos).
RESULTADOSPacientesLa forma de presentación clínica inicial consistió en infarto agudo de miocardio con elevación del segmento ST en 96 pacientes (29%), infarto agudo de miocardio sin elevación del segmento ST en 30 pacientes (9%), angina inestable en 155 (47%) y angina estable en 49 (15%). La media de edad en el momento de implantar el AVB era 55 ± 8 años, y un 94% de los pacientes eran varones. La intervención se realizó con éxito en 323 pacientes (98%); 5 pacientes sufrieron un infarto de miocardio periprocedimiento (1,3%) y 2 fallecieron en el hospital (0,5%). Tras un periodo de seguimiento de 19 ± 10 meses, se detectaron 18 casos de reestenosis en 17 pacientes (5,4%), que se confirmaron angiográficamente. Estos pacientes constituyen la base de nuestro análisis. Los datos clínicos de los pacientes con reestenosis se presentan en la tabla 1. El tiempo transcurrido hasta la aparición de la reestenosis fue 9 ± 4 meses. Las reestenosis fueron tempranas en 3 pacientes (18%), tardías en 8 (47%) y muy tardías en 6 (35%). La forma de presentación clínica de las reestenosis fue benigna, y ninguno de los 3 pacientes con angina inestable presentó una elevación de biomarcadores. Además, en el momento de aparición de las reestenosis, 7 pacientes estaban asintomáticos. Seis pacientes con angio-TC coronaria normal 6 meses después del tratamiento presentaron recurrencia clínica en un seguimiento posterior, como consecuencia de una reestenosis tardía o muy tardía. Los pacientes tratados por una reestenosis de un AVB no sufrieron eventos adversos cardiovasculares mayores durante el seguimiento. El seguimiento clínico más largo de estos pacientes fue de 14 meses (media, 9 ± 5 meses).
Datos clínicos de los pacientes con reestenosis
| n (%) | |
|---|---|
| Variables clínicas (n = 17) | |
| Edad (años) | 55 ± 8 |
| Sexo masculino | 16 (94) |
| Diabetes mellitus | 6 (35) |
| Hipertensión | 15 (88) |
| Hipercolesterolemia | 14 (82) |
| Tabaquismo actual | 10 (59) |
| Forma de presentación clínica en la intervención basal | |
| Angina estable | 1 (6) |
| Angina inestable y síndrome coronario agudo | 16 (94) |
| Forma de presentación clínica en el seguimiento, n (%) | |
| Asintomático | 7 (41) |
| Angina estable | 7 (41) |
| Angina inestable | 3 (18) |
| Tiempo hasta aparición de la reestenosis | |
| Temprana | 3 (18) |
| Tardía | 8 (47) |
| Muy tardía | 6 (35) |
La media de longitud de los segmentos tratados con un armazón fue de 23 ± 9 mm. La estenosis angiográfica se redujo del 79 ± 23% al 9 ± 8%. El diámetro luminal mínimo aumentó de 0,7 ± 0,6 a 2,9 ± 0,5 mm después del tratamiento. En la tabla 2 se presentan los datos angiográficos y de la intervención. La mayoría de las lesiones reestenóticas eran lesiones complejas en la situación basal. Según el examen angiográfico, 4 lesiones de reestenosis (22%) reprodujeron la lesión basal respecto a su localización y su forma. La longitud de la reestenosis angiográfica fue de 10 ± 7 mm. Según la clasificación de Mehran, el tipo más frecuente fue la reestenosis focal en 12 casos (67%), y se situó en el borde del armazón (Ib) en 9 (75%) de ellos. De estos casos, en 6 el borde afectado estaba aislado y en 3 se combinaba con una reestenosis proximal dentro del armazón. Por lo que respecta a las 7 lesiones de reestenosis detectadas mediante angio-TC en pacientes asintomáticos, 6 fueron focales (4 Ib y 2 Ic), y 1 difusa, tras una oclusión total crónica tratada con AVB.
Resultados angiográficos y de la intervención en 17 pacientes con 18 lesiones
| Datos angiográficos y de la intervención | |
| FEVI (%) | 58 ± 10 |
| Arteria coronaria tratada, n (%) | |
| Arteria coronaria principal izquierda | 2 (11) |
| Arteria descendente anterior izquierda | 12 (67) |
| Arteria coronaria derecha | 1 (5) |
| Arteria coronaria circunfleja izquierda | 3 (17) |
| Tipo de lesión basal | |
| A | 3 (17) |
| B1 | 3 (17) |
| B2 | 5 (28) |
| C | 7 (38) |
| Patrón angiográfico de la reestenosis | |
| IC | 3 (16) |
| IB | 9 (50) |
| II | 3 (16) |
| III | 1 (6) |
| IV | 2 (12) |
| Intervención basal | |
| Referencia del vaso principal (mm) | 2,8 ± 0,4 |
| Diámetro luminal mínimo en la lesión nativa (mm) | 0,7 ± 0,6 |
| Diámetro luminal mínimo posbasal (mm) | 2,9 ± 0,5 |
| Longitud de lesión basal (mm) | 15,9 ± 10 |
| Estenosis basal (%) | 79 ± 23 |
| Estenosis posbasal (%) | 9 ± 8 |
| Longitud total del armazón (mm) | 23 ± 9 |
| Diámetro del AVB (mm) | 3 ± 0,4 |
| Implante directo de AVB (%) | 9 (50) |
| Predilatación de vaso principal electiva (%) | 8 (44) |
| OCT en la intervención basal (%) | 10 (55) |
| Área mínima de AVB (mm2) | 5,2 ± 1,1 |
| Infraexpansión | 3 (30) |
| Mala aposición | 1 (10) |
| Intervención por reestenosis | |
| Diámetro luminal mínimo de la reestenosis (mm) | 0,8 ± 0,5 |
| Longitud de la reestenosis (mm) | 11 ± 9 |
| Porcentaje de reestenosis (%) | 75 ± 11 |
| OCT en la intervención por reestenosis (%) | 18 (100) |
AVB: armazón vascular bioabsorbible; FEVI: fracción de eyección del ventrículo izquierdo; OCT: tomografía de coherencia óptica.
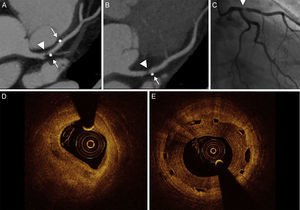
Los casos de reestenosis detectados mediante angio-TC identificaron de manera uniforme el estrechamiento de la luz. El crecimiento luminal mostró siempre un aspecto blando y no calcificado (figura 2).
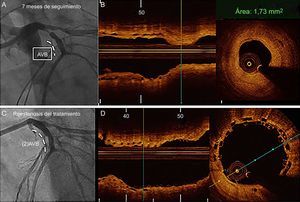
Imágenes de angiografía coronaria por tomografía computarizada y de tomografía de coherencia óptica de una reestenosis en la parte proximal de la arteria descendente anterior izquierda después de implantar un armazón vascular bioabsorbible. A y B: reestenosis en el borde proximal; la angiografía coronaria por tomografía computarizada muestra una placa no calcificada focal (punta de flecha) que causa una estenosis grave; la proyección de intensidad máxima muestra un segmento tratado con un armazón, que es permeable, y la lesión proximal al marcador metálico (flecha). C: la exploración angiográfica confirmó la estenosis focal grave (punta de flecha). D: reestenosis fuera del armazón. E: la exploración por tomografía de coherencia óptica mostró un tejido heterogéneo dentro del armazón.
Los principales resultados se resumen en la tabla 3. Fue necesaria una predilatación antes de la exploración en 3 de las lesiones, y ello modificó la lesión de reestenosis original en el estudio por OCT. La longitud de la reestenosis en la OCT fue de 11 ± 9 mm. La luz tenía una forma regular en la mayoría de los casos, sin que hubiera material intraluminal. El análisis de la OCT reveló interrupción de la íntima solo en 2 lesiones en las que se aplicó predilatación.
Resultados de la tomografía de coherencia óptica en 18 reestenosis en el seguimiento
| Cualitativos | |
| Fibroateroma de cubierta fina (n) | 2 |
| Ruptura de neoíntima (n) | 2 |
| Microvaso (n) | 8 |
| Neoateroesclerosis (n) | 8 |
| Reestenosis fuera del armazón (n) | 6 |
| Cuantitativos | |
| Media del área transversal de neoíntima (mm2) | 4,59 ± 1,30 |
| Media del área transversal de la luz (mm2) | 1,36 ± 0,55 |
| Media del área transversal del armazón (mm2) | 6,19 ± 0,97 |
| Media de grosor de la neoíntima (μm) | 773 ± 107 |
| Porcentaje de estenosis del área transversal de neoíntima | 79 ± 8 |
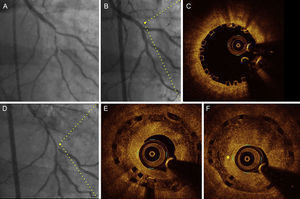
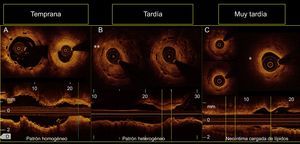
En 10 de las 18 lesiones de reestenosis, se dispuso de exploraciones de OCT inmediatamente después del implante del AVB. En esas lesiones, el área del armazón no difería de la determinada en el momento de la reestenosis (área del armazón en el examen basal, 7 ± 1 mm2; área del armazón en la reestenosis, 7,1 ± 1,2 mm2; p = 0,735). Se observaron struts solapados de forma tardía en el interior del tejido de 5 de las 18 reestenosis, lo cual indica una alteración tardía de la plataforma. En 3 de ellos, tras el implante del AVB se realizó examen por OCT, que mostró una aposición óptima y una ausencia de alteración aguda del armazón (figura 3). Tres de las lesiones de reestenosis mostraron unas características predominantemente homogéneas, 4 eran heterogéneas, 5 tenían una estructura en capas y 6 mostraron características de carga de lípidos (figura 4). En 8 lesiones de reestenosis (44%) se observaron signos que indicaban un proceso de neoateroesclerosis. El patrón más frecuente fue el de una neoíntima en capas, con o sin carga de lípidos, en especial en la reestenosis difusa. Además, la reestenosis difusa mostró imágenes que apuntaban a una neovascularización del nuevo tejido formado, y la mayoría presentaba infiltración de macrófagos (tabla 4). Además, el tiempo transcurrido hasta su aparición fue en todos los casos el de una presentación tardía o muy tardía (figura 4). En cambio, la mayoría de las lesiones de reestenosis que se produjeron en los primeros 6 meses se situaban justo en el borde proximal (a menos de 5 mm), y tenían un patrón predominantemente homogéneo (figura 5). En 5 de los 6 pacientes con un borde del AVB afectado y sin reestenosis dentro del armazón, se revisó el examen de OCT de la situación basal. Se detectaron placas vulnerables en 4 de ellos, con un área luminal mínima > 4,5 mm2. Además, se detectaron disecciones proximales leves en 3 lesiones. En 2 lesiones, la placa no estaba cubierta en su totalidad por el AVB no visible angiográficamente, y con un área luminal mínima de 5,8 mm2 y 5,1 mm2 respectivamente. Por lo que respecta al tratamiento de la reestenosis, en todas las lesiones se implantó un nuevo dispositivo. Se utilizó un nuevo AVB para tratar 4 reestenosis proximales en el segmento que no afectaban al armazón (figura 5). Las 14 lesiones de reestenosis restantes se trataron con un SFA. En las 6 lesiones de reestenosis difusa, se llevó a cabo una predilatación antes de implantar el stent.
Imágenes de angiografía (basal, después de implantarse el armazón vascular bioabsorbible y a los 14 meses de seguimiento) y tomografía de coherencia óptica (inmediatamente después del implante y en el seguimiento) en un paciente con reestenosis difusa. A: angiografía basal. B: resultado final después del implante del armazón vascular bioabsorbible (2,5 × 28 mm) con una técnica de implante de stent provisional en la bifurcación. C: la tomografía de coherencia óptica en el segmento proximal mostró una aposición óptima y ausencia de fracturas del armazón vascular bioabsorbible. D: exploración angiográfica en el seguimiento. E: la tomografía de coherencia óptica en el segmento proximal (mismo punto que en C) mostró un solapamiento tardío de los struts y un patrón de tejido de neoíntima en capas. F: fotograma consecutivo a E, con presencia de neovascularización (asterisco).
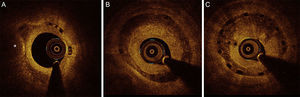
Patrones de reestenosis observados según el tiempo transcurrido hasta su aparición. A: reestenosis en el margen. B: reestenosis focal con patrón heterogéneo de neovascularización en el interior del armazón (doble asterisco). C: reestenosis difusa que revela un proceso de neoateroesclerosis, con una neoíntima con carga de lípidos (asterisco) en los segmentos medios y una estructura heterogénea de la cobertura tisular en los segmentos distales del armazón, según se visualiza en las proyecciones de eje corto y longitudinal.
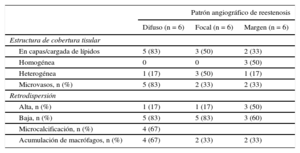
Relación entre los resultados de la angiografía y la tomografía de coherencia óptica
| Patrón angiográfico de reestenosis | |||
|---|---|---|---|
| Difuso (n = 6) | Focal (n = 6) | Margen (n = 6) | |
| Estructura de cobertura tisular | |||
| En capas/cargada de lípidos | 5 (83) | 3 (50) | 2 (33) |
| Homogénea | 0 | 0 | 3 (50) |
| Heterogénea | 1 (17) | 3 (50) | 1 (17) |
| Microvasos, n (%) | 5 (83) | 2 (33) | 2 (33) |
| Retrodispersión | |||
| Alta, n (%) | 1 (17) | 1 (17) | 3 (50) |
| Baja, n (%) | 5 (83) | 5 (83) | 3 (60) |
| Microcalcificación, n (%) | 4 (67) | ||
| Acumulación de macrófagos, n (%) | 4 (67) | 2 (33) | 2 (33) |
Imágenes de angiografía (A y C) y de tomografía de coherencia óptica de una reestenosis tardía (7 meses) en el margen proximal (B). En la situación inicial, la revascularización de la arteria descendente anterior izquierda se llevó a cabo con un AVB de 3,5 × 18 mm. B: reestenosis en el seguimiento con un tejido homogéneo fuera del armazón. C: resultado final del tratamiento de la reestenosis. D: solapamiento mínimo de los 2 AVB implantados. AVB: armazón vascular bioabsorbible.
Se cree que los mecanismos que subyacen a la reestenosis coronaria tras un tratamiento percutáneo son una combinación de hiperplasia de la íntima y remodelado dinámico temprano o tardío del segmento tratado21. También puede desempeñar un papel la infraexpansión del stent. Los estudios de OCT sobre la reestenosis temprana tras el implante de un SMSR han puesto de manifiesto que la proliferación de neoíntima debida a las células de músculo liso puede ser la causa principal de la reestenosis, y que ello se visualiza como una región homogénea de señal alta que recubre los struts del stent19,20. Gonzalo et al.12 propusieron la presencia de materiales de neoíntima con propiedades ópticas diferentes y sugirieron que la reestenosis podría estar formada por diferentes tejidos patológicos. Estas cuestiones se han analizado también con los SFA. Sin embargo, hay poca información sobre las lesiones de reestenosis tras el implante de un AVB. Según nuestro conocimiento, esta es la serie más amplia de reestenosis de AVB que se haya presentado.
Este estudio de observación indica que la reestenosis después del implante de un AVB es infrecuente y parece tener diferentes mecanismos. En este estudio no se observó un hundimiento de la plataforma como mecanismo de reestenosis. Nakatani et al.6 han presentado resultados similares. En 6 lesiones de reestenosis en el interior del armazón analizadas mediante OCT, estos autores observaron que las reestenosis tardías o muy tardías se atribuían a un crecimiento de tejido tan solo dentro del armazón, sin una compresión extrínseca de este por tejido externo. Esta observación parece tener importancia, ya que en las reestenosis tardías se ha perdido ya la sustentación de la plataforma. Sin embargo, puede producirse un deterioro tardío del armazón (figura 3), probablemente inducido por su propia debilidad durante el proceso de reabsorción. Al cabo de 6 meses, la plataforma pierde la fuerza radial y empieza a perder masa lentamente. Este análisis de la reestenosis después del implante de un AVB se realizó en un periodo en que el armazón aún no ha desaparecido por completo. No se ha explorado aún la posibilidad de que después de la reabsorción completa se produzca una reestenosis de un segmento coronario tratado.
El borde proximal fue la localización más frecuente de la reestenosis. Contrariamente a lo que ocurre con la reestenosis del SMSR, en que el patrón óptico de la proliferación neointimal es predominantemente homogéneo, en la reestenosis del AVB es poco frecuente y se observa solo cuando su localización es aislada en el margen (figura 5). Estas características podrían ser consecuencia de una respuesta proliferativa reactiva rápida o de un cubrimiento incompleto de la placa inicial. La reestenosis tardía fue en su mayor parte difusa y se produjo en el interior del armazón. El patrón predominante fue el de un aspecto en capas, con o sin depósitos ricos en lípidos, particularmente en reestenosis difusas (figura 6). En nuestro estudio, la mayoría de las reestenosis muy tardías mostraron signos que indicaban neoateroesclerosis. Las exploraciones de OCT identifican microvasos, acumulación de macrófagos y otros procesos histológicos que intervienen en la neoateroesclerosis13,20,21. Estos mecanismos en los stents metálicos se asociaron a incapacidad para mantener una neoíntima plenamente funcional en el interior del segmento tratado con el stent, lo cual crea las condiciones adecuadas para el inicio de una nueva ateromatosis22. En los SMSR, este fenómeno se ha descrito habitualmente con una aparición más de 5 años después del implante22. Según nuestros resultados, el tiempo que requiere este proceso con los AVB (13 ± 4 meses) parece similar al de la formación de la neoateroesclerosis descrito en los SFA. Se han estudiado los factores que predicen este grado de proliferación de neoíntima compleja y parecen asociados al grosor de la hiperplasia de neoíntima, los antecedentes de tabaquismo, la enfermedad renal crónica y el uso de SFA en comparación con el de SMSR23,24.
Signos de la tomografía de coherencia óptica que indican neoateroesclerosis. A: reestenosis del armazón vascular bioabsorbible a los 15 meses de seguimiento, en el que se observa una neoíntima con carga de lípidos y con microcalcificación (asterisco). B y C: imágenes de la reestenosis del mismo vaso obtenidas en un paciente 14 meses después del tratamiento; neoíntima en capas (B) y presencia de neovascularización en el tejido de neoíntima de nuevo crecimiento (C).
Por último, la forma de presentación clínica de la reestenosis fue predominantemente benigna, lo cual se corresponde con el patrón angiográfico focal predominante y con los resultados de la OCT, que no mostraron rotura de la neoíntima ni presencia de material intraluminal.
LimitacionesLa muestra de lesiones de reestenosis es pequeña, si bien este estudio constituye la serie más amplia publicada de reestenosis de AVB. Además, la OCT puede tener limitaciones intrínsecas en el análisis cualitativo del tejido reestenótico. Sin embargo, su alta resolución aporta una información detallada sobre las características del tejido. La tasa de reestenosis podría ser superior, debido a que no se dispuso de exámenes angiográficos o de angio-TC coronaria durante el seguimiento de un 16% de los pacientes. No obstante, se obtuvo un seguimiento clínico de todos ellos. Los resultados presentados son descriptivos y no se han comparado con los de los SMSR o los SFA. El estudio no analizó la reestenosis durante el periodo en que el dispositivo ha desaparecido ya por completo y, posiblemente, puedan aparecer patrones diferentes si la reestenosis se produce tras dicha desaparición.
CONCLUSIONESDespués de una media de seguimiento de 19 meses, se produjeron reestenosis en el 5,4% de las lesiones tratadas, y la forma de presentación clínica fue benigna. La mayoría de las lesiones de reestenosis fueron focales y se situaron en el borde proximal. En cambio, la reestenosis difusa se produjo casi siempre tardía o muy tardíamente y mostró signos de neoateroesclerosis. Estas observaciones se deberán confirmar en futuros estudios.
CONFLICTO DE INTERESESJavier Suárez de Lezo, Soledad Ojeda, Manuel Pan y José Suárez de Lezo han recibido pagos de pequeña cantidad por conferencias de Abbott.
- –
La reestenosis coronaria después del implante de un AVB es muy poco frecuente y se dispone de poca información sobre las características principales de este tipo de lesión.
- –
El estudio ABSORB II y el registro GHOST mostraron unos resultados clínicos comparables a 1 año y a 6 meses, respectivamente, tras el implante de un AVB en comparación con la de un stent liberador de everolimus de segunda generación.
- –
En un ensayo previo se ha establecido que el cubrimiento incompleto de la placa y la infraexpansión del armazón son causas predominantes de fallos de los AVB.
- –
Una descripción detallada de la caracterización mediante OCT de las lesiones de reestenosis coronaria tras el implante de AVB.