Full English text available from: www.revespcardiol.org/en
Los dispositivos vasculares bioabsorbibles (DVB) han supuesto una auténtica revolución conceptual en la cardiología intervencionista1–6. Su plataforma especial les permite conseguir unos excelentes resultados inmediatos y garantizar un perfecto andamiaje de la pared del vaso. Además, al incorporar un fármaco con potentes propiedades antiproliferativas, evitan la aparición de reestenosis2–6. Estas 2 propiedades también las tienen los stents farmacoactivos metálicos (STF). Sin embargo, el gran atractivo de los DVB consiste, precisamente, en que una vez realizada su función (soporte vascular y efecto antiproliferativo) tanto su plataforma como el polímero empleado para administrar el fármaco desaparecen completamente de la pared coronaria2–6. Por el contrario, con los STF siempre queda una estructura metálica en la pared vascular, y en los que no incorporan un polímero bioabsorbible, además queda el polímero permanente recubriendo el stent7,8. Diferentes estudios han confirmado de manera fehaciente la desaparición completa de los DVB de la pared vascular con el paso del tiempo. Generalmente el proceso se completa en ∼3 años2,3. De esta forma la arteria se libera del corsé que implica la presencia de una malla metálica en su interior y recupera sus funciones fisiológicas7,8. Así, es capaz de responder de nuevo a los estímulos generados por el flujo coronario (shear stress), lo que a su vez puede favorecer fenómenos crónicos de remodelado vascular adaptativo y ganancia tardía de la luz vascular. También se consigue una recuperación de la dinámica vascular fisiológica, con restauración de la respuesta de vasodilatación o vasoconstricción aguda ante diferentes estímulos o fármacos2,3. Algunos datos indican que incluso se podría producir una regresión de la placa de ateroma subyacente en la región tratada2,3. Además, implantar DVB sobre placas vulnerables o complicadas podría ayudar a conseguir su estabilización posterior.
Por otro lado, con la reabsorción se liberan las ramas laterales enjauladas por el dispositivo. De modo similar, la eventual desaparición de los elementos estructurales del DVB que no han quedado bien adosados (mala aposición) sobre la pared del vaso (por una inadecuada implantación o por una anatomía desfavorable) o que protruyen excesivamente (lesiones ostiales) podría evitar la aparición de complicaciones tardías2–6. Finalmente, la estructura no metálica del DVB (con identificadores de platino en sus extremos) permite una adecuada valoración de la anatomía coronaria mediante técnicas no invasivas (tomografía computarizada coronaria) al evitar los artefactos generados por los stents metálicos2–6.
Hay evidencia de que la presencia permanente de elementos extraños en la pared del vaso podría favorecer la aparición de eventos adversos durante el seguimiento. El más temido de todos ellos es la trombosis muy tardía del stent, pero también se ha descrito la aparición de reestenosis tardía a veces debida al desarrollo de neoateroesclerosis7,8. Los DVB fueron diseñados en un intento de soslayar todas estas limitaciones de los STF.
Múltiples trabajos han demostrado excelentes resultados clínicos tras el implante de DVB2–5. Estudios tanto observacionales como aleatorizados en pacientes seleccionados han confirmado unos resultados comparables a los obtenidos con los STF de última generación2–5. Si los resultados obtenidos durante el primer año son similares a los obtenidos con los STF de nueva generación, es atractivo especular que la evolución a muy largo plazo podría favorecer a los pacientes tratados con DVB. Hay que recordar, sin embargo, que los actuales DVB incorporan elementos de soporte relativamente gruesos (156 μm) para garantizar la necesaria fuerza radial y, por lo tanto, son inferiores a las nuevas generaciones de STF en cuanto a flexibilidad y navegabilidad. Esto explica que su utilización haya sido limitada y prudente en pacientes con lesiones complejas o calcificadas. De modo similar, la deformación que se puede conseguir en los DVB actuales está limitada por su composición plástica. Por lo tanto, se debe elegir muy cuidadosamente sus diámetros, ya que una excesiva expansión (o dilatación de sus celdas en caso de ramas laterales) puede causar su desestructuración tras fractura de los elementos de soporte2–6. Estos problemas son muy raros con los STF, que admiten una mayor deformación manteniendo su integridad estructural dentro de los límites requeridos en la práctica clínica. Todo ello explica que los buenos resultados iniciales de los DVB (comparables a los obtenidos con los nuevos STF) sean aplicables a lesiones relativamente favorables2–5.
Sin embargo, como siempre ha ocurrido en la historia de la cardiología intervencionista, toda revolución, lógicamente acompañada de una fase de entusiasmo inicial, en algún momento queda empañada por datos que suscitan preocupación y reflexión dentro de la comunidad científica9. Baste recordar un provocador editorial, publicado no hace tanto tiempo en esta misma Revista, en la que se auguraba que habíamos alcanzado el sueño de todo cardiólogo intervencionista: ¡una tasa de reestenosis del 0%!10. La realidad, sin embargo, pronto nos hizo volver a un escenario de mayor prudencia y humildad1,7. Habitualmente, la siguiente fase evolutiva conlleva la incorporación de nuevos avances tecnológicos y una mejor utilización de los nuevos dispositivos. De este modo se logra superar las limitaciones iniciales y consolidar la revolución tecnológica, con lo que se facilita su adopción generalizada7. Recientemente, el entusiasmo generado por la aparición de los DVB y sus buenos resultados iniciales ha quedado empañado por la aparición de algunas sombras9,11,12. Diferentes metanálisis de todos los estudios disponibles han detectado una clara señal de mayor riesgo de trombosis en los pacientes tratados con DVB11,12. De modo parecido, estos estudios indican que los resultados angiográficos tardíos son ligeramente inferiores a los obtenidos con los STF de última generación12. En este escenario, los resultados a los 3 años de seguimiento del estudio ABSORB II recientemente publicados no solo no han logrado confirmar la recuperación de la dinámica vascular en el segmento tratado con DVB, sino que apuntan a peores resultados angiográficos tardíos y una mayor tasa de eventos clínicos adversos (necesidad de revascularización y trombosis del dispositivo) en comparación con los nuevos STF6. Entramos, por lo tanto, en una nueva fase de preocupación y de reflexión sobre la utilidad de los DVB en la práctica clínica.
TÉCNICAS DIAGNÓSTICAS UTILIZADAS CON LOS DISPOSITIVOS VASCULARES BIOABSORBIBLESLas técnicas de diagnóstico intracoronario pueden ayudar a optimizar la implantación de los DVB y permiten estudiar su evolución temporal. La tomografía de coherencia óptica (OCT) tiene una resolución de 15 μm, es decir, 10 veces superior a la proporcionada por la ecografía intracoronaria. Proporciona imágenes tomográficas de altísima calidad de la pared coronaria y de los resultados obtenidos tras el implante de dispositivos intravasculares13. Debido a esta resolución sin precedentes, permite analizar con gran precisión la luz residual, el grado de expansión del DVB, el correcto contacto de sus elementos estructurales con la pared coronaria, la existencia de prolapso de material en su interior (ateroma o trombo) y la presencia de disecciones en sus bordes. La sensibilidad de la OCT para el diagnóstico de todos estos fenómenos es muy superior a la de la ecografía intracoronaria, aunque todavía no se conoce bien el significado clínico de las alteraciones más leves13. Durante el seguimiento, la OCT permite visualizar el grado de recubrimiento de los elementos estructurales del dispositivo, la respuesta proliferativa producida en su interior y, eventualmente, confirmar su degradación y posterior desaparición de la pared del vaso3. No obstante, quizá una de las aportaciones más interesantes de esta técnica sea su capacidad para detectar las características del tejido que se genera dentro del DVB y, en concreto, detectar la presencia de neoateroesclerosis o rotura de placa8,13–18. La ecografía intravascular también permite detectar los problemas mecánicos derivados de un implante de DVB subóptimo y, además, debido a su mayor penetración tisular, proporciona una visión espacial más completa tanto de la placa de ateroma subyacente como de la expansión del dispositivo con respecto al área total del vaso (lámina elástica externa). La histología virtual, también basada en ultrasonidos, permite detectar el cambio de composición del DVB a medida que se reabsorbe3. Finalmente, debido a sus características no metálicas, los DVB también pueden ser estudiados de forma no invasiva. En este contexto, la tomografía computarizada coronaria puede tener un valor especial en el seguimiento de pacientes seleccionados tratados con estos dispositivos (vasos proximales con tamaño adecuado), tanto desde el punto de vista clínico como con fines de investigación2,3.
PROBLEMAS CLÍNICOS ASOCIADOS A LOS DISPOSITIVOS VASCULARES BIOABSORBIBLESTodavía hay muy poca información sobre los mecanismos fisiopatológicos implicados en las complicaciones específicas de los DVB. Únicamente se han reportado casos aislados y pequeñas series retrospectivas de pacientes que han sufrido trombosis o reestenosis de DVB15–18. De hecho, algunos estudios indican que en algunos pacientes estas entidades están íntimamente relacionadas. Además, actualmente se dispone de información que demuestra que muchos de los mecanismos fisiopatológicos implicados en las trombosis o la reestenosis de los stents metálicos convencionales o de los STF también podrían afectar a los DVB8,19. Sin embargo, hay algunas características específicas de los DVB, como el grosor de sus elementos estructurales, sus características plásticas y el mismo proceso de reabsorción, que también parecen explicar algunos fallos tardíos de estos dispositivos.
En la tabla se resumen los mecanismos que han sido implicados en la reestenosis de los DVB15–18 (figura). Son diversos y, en realidad, varios de ellos pueden concurrir en un mismo paciente. Tanto la infraexpansión del dispositivo como su fractura por una sobredilatación inadecuada pueden asociarse al fracaso precoz o tardío del dispositivo. Un vaso de referencia pequeño es un clásico factor de riesgo de reestenosis, independientemente del tipo de intervención coronaria realizada, pero el mayor grosor de los DVB actuales puede explicar su menor eficacia en vasos pequeños. Algunas reestenosis de DVB se han descrito en lesiones largas que han precisado solapar varios dispositivos. Incluso en DVB perfectamente expandidos, una proliferación neointimal exuberante puede causar reestenosis. Todavía no se sabe si esto puede atribuirse a una resistencia al fármaco empleado. A su vez, la neoateroescleosis parece ser un problema particularmente relevante en todos los dispositivos que liberan fármacos antiproliferativos20. A diferencia de la hiperplasia neointimal causada por una proliferación relativamente homogénea de células musculares lisas (sustrato clásico de la reestenosis en el stent), la neoateroesclerosis implica la formación de auténticas placas de fibroateroma dentro del stent. Aunque en general estas placas tienen un alto contenido lipídico, algunas incluso evolucionan hacia placas calcificadas. La neoateroesclerosis no solo es más frecuente, sino que también ocurre antes tras el implante de STF20, y recientemente se ha descrito como causa de reestenosis de DVB. Su presentación más característica es un fibroateroma de capsula fina. Se ha señalado que la neoateroesclerosis complicada (rotura de fibroateroma de capsula fina con trombosis asociada) podría constituir el nexo de unión entre la reestenosis y la trombosis del stent, entidades que hasta hace poco se consideraban completamente independientes8. Este fenómeno también se ha detectado al analizar las causas de los fracasos tardíos de los DVB15–17. El problema de no cubrir bien con el dispositivo todo el segmento tratado («geographical miss»), ya descrito con los STF, también afecta a los DVB. De hecho, la estrategia de realizar una predilatación más agresiva con posdilatación sistemática de los DVB puede explicar la aparición de pequeñas disecciones que, casi sistemáticamente, se detectan con OCT en sus bordes.
Mecanismos implicados en la reestenosis de los dispositivos vasculares bioabsorbibles
| 1. | Proliferación neointimal excesiva | |
| 2. | Neoateroesclerosis | Estable (evolución progresiva) Complicada (rotura de la cápsula con trombosis asociada) |
| 3. | Infraexpansión del dispositivo con estructura íntegra | |
| 4. | Vaso de referencia demasiado pequeño (< 2 mm) (strut overcrowding) | |
| 5. | Alteración estructural del dispositivo | Aguda: • Por daño durante el implante o por una sobrexpansión inadecuada («fractura» del DVB) • Por insuficiente fuerza radial relativa: colapso agudo (acute recoil) |
| Tardía: por reabsorción programada • Dentro de la pared (por pérdida de soporte estructural) – Manteniendo su configuración y disposición – Con desplazamiento, desestructuración o colapso tardío (late recoil). Pérdida de alineamiento o circularidad • Con elementos desestructurados dentro de la luz (fuera de la pared) (mala aposición) – Manteniendo su configuración – Alterando su configuración espacial. Pérdida de alineamiento o circularidad | ||
| 6. | Reabsorción del dispositivo «retrasada». Persistencia muy tardía (> 3-4 años) de los elementos estructurales propios del DBV | |
| 7. | Resistencia al fármaco antiproliferativo | |
| 8. | Segmento adyacente no cubierto por el dispositivo | • Progresión de la enfermedad (placas de diferente composición) en los bordes (5 mm adyacentes al DVB) inicialmente no tratados • Progresión en placa ateroesclerótica adyacente tratada pero no cubierta con el dispositivo (geographical miss) • Falta de superposición (gap) entre 2 dispositivos |
| 9. | Superposición excesiva de dispositivos adyacentes (lesiones largas) |
DVB: dispositivo vascular bioabsorbible.
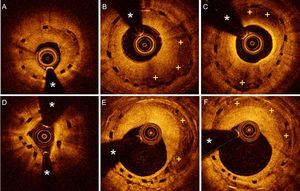
Imágenes de tomografía de coherencia óptica (OCT) de pacientes con reestenosis de dispositivos vasculares bioabsorbibles (DVB). A: infraexpansión importante de un DBV que muestra un crecimiento neointimal de aspecto brillante y relativamente homogéneo. B: proliferación neointimal grave, pero que muestra claras áreas de atenuación (+) en un BVS correctamente expandido. C: proliferación de material de aspecto muy heterogéneo, con una íntima muy brillante cerca de la luz y amplias zonas de atenuación que oscurecen parcialmente los elementos estructurales de un BVS con morfología elíptica. D: desestructuración, con falta de continuidad y circularidad, de los elementos estructurales de un DVB con moderado crecimiento neointimal asociado. E y F: reestenosis de un BVS causada por un tejido heterogéneo, con zonas de atenuación (+) de bordes muy bien definidos (E), que se había implantado para el tratamiento de la reestenosis de un stent metálico. Los elementos estructurales del BVS se visualizan como «cajas negras» sin sombra, mientras que los struts del stent metálico se identifican como áreas localizadas muy brillantes con sombra posterior. *: artefacto de la guía.
Sin embargo, hay 2 problemas inherentes al uso del DVB que pueden tener implicaciones en la aparición de reestenosis en estos dispositivos. En primer lugar, su menor fuerza radial y su posible desestructuración con un implante agresivo pueden explicar algunas recurrencias precoces2–6. Por otro lado, también se ha indicado que la pérdida progresiva de capacidad de soporte derivada de su reabsorción programada podría favorecer, en algunos pacientes, la aparición de reestenosis tardía por un retroceso elástico progresivo de la pared del vaso2–6. Además, aunque en condiciones normales la reabsorción paulatina del DVB no implica un cambio en su configuración, recientemente se ha postulado que este fenómeno puede asociarse a una alteración espacial importante, con pérdida de alineamiento de sus elementos estructurales y con aparición de struts superpuestos16–18. Cuando este fenómeno ocurre dentro de la pared del vaso, sus implicaciones clínicas parecen ser limitadas. Sin embargo, la desestructuración de elementos del DVB fuera de la pared del vaso (dentro de la luz) se ha asociado tanto con problemas de reestenosis como de trombosis muy tardía18. Inesperadamente, en algunos pacientes con fracaso muy tardío del DVB se ha logrado detectar la persistencia de material propio del DVB cuando, por el tiempo transcurrido desde el implante, debía haber desaparecido por completo18. Sin duda, son necesarios nuevos estudios para conocer mejor los fenómenos asociados a la reabsorción del DVB y sus implicaciones clínicas, especialmente cuando estos dispositivos se han implantado en sustratos anatómicos desfavorables.
ESTUDIO ACTUALEn el estudio de Chavarría el al.21 publicado en Revista Española de Cardiología, se analizan detalladamente las características clínicas, angiográficas y de OCT de 17 pacientes con reestenosis de un BVS. El estudio es de gran interés, tanto por la escasa información actualmente disponible sobre esta rara complicación como por lo meticuloso de los análisis realizados. Esta serie se origina de una población total de 330 pacientes tratados con DVB (398 DVB para tratar 380 lesiones) a los que se siguió clínicamente de forma muy rigurosa durante 19 ± 10 meses. El uso sistemático de la tomografía computarizada coronaria durante el seguimiento y el análisis con OCT de todos los pacientes en que se desarrolló reestenosis confieren un atractivo muy especial al trabajo. Se detectaron 18 DVB con reestenosis en 17 pacientes, lo que representa una incidencia del 5,4%. En la tomografía computarizada se apreció un tejido de baja densidad, no calcificado, como causa de la nueva lesión. El tiempo medio a la aparición de reestenosis fue de 9 ± 4 meses. La morfología más frecuente fue un patrón focal (12 pacientes [67%]) que habitualmente afectaba al borde proximal del DVB (9 pacientes [75%]). De los pacientes con afección del borde, en 3 también había lesión dentro del DVB, mientras que en los restantes 6 casos la lesión se situaba inmediatamente por fuera del dispositivo. Cuando estas reestenosis focales afectaban al interior de la plataforma, el tejido mostraba un aspecto heterogéneo o en capas. Sin embargo, en 6 casos (33%), la morfología de la reestenosis era difusa. En estos casos, la OCT reveló un patrón lipídico o en capas asociado a microcalcificaciones y microvasos, todo ello muy indicativo de neoateroesclerosis. En total, casi la mitad de las lesiones mostraban datos compatibles con neoateroesclerosis. Es interesante que, en 10 de los pacientes, también se disponía de imágenes de OCT obtenidas inmediatamente tras el implante del dispositivo que se pudo comparar con las obtenidas en el momento de la reestenosis. En un tercio de estos pacientes, la OCT tras la intervención demostró una infraexpansión significativa del DVB que podría haber favorecido la posterior aparición de reestenosis. Además, los estudios seriados revelaron que en ningún caso la pérdida luminal tardía era consecuencia de un colapso o retroceso elástico de la estructura del DVB. Por otro lado, es muy relevante que, en los pacientes que sufrieron reestenosis focales del borde del DVB, la OCT inmediatamente tras la intervención mostrara importantes placas lipídicas situadas a dicho nivel. También es notable que en 5 de las 18 reestenosis de DVB se visualizaran elementos del dispositivo completamente superpuestos entre sí, lo que indica un deterioro tardío con grave desestructuración de la plataforma. De hecho, en 3 casos con desestructuración del DVB en el seguimiento, la OCT inmediatamente tras el implante mostraba struts correctamente expandidos y sin superposiciones. Finalmente, los autores destacan que las reestenosis tempranas (< 6 meses) tendían a ser más focales, afectando a los bordes de BVS y mostrando un tejido de aspecto homogéneo. Por el contrario, en las reestenosis tardías predominaba un patrón angiográfico más difuso y presentaban un tejido de características más heterogéneas, frecuentemente con claros datos de neoateroesclerosis21.
En todos los casos la reintervención consistió en implantar un STF, excepto en 4 pacientes con reestenosis del borde proximal inmediatamente por fuera del dispositivo, en los que se implantó otro BVS.
En este estudio las reestenosis se documentaron en un momento en que todavía existía la estructura del DVB. Por lo tanto, serán necesarios nuevos estudios para caracterizar los patrones de reestenosis muy tardías, una vez que la estructura del BVS ha desaparecido por competo.
CONCLUSIONESEn este momento en el que asistimos a una controversia sobre las indicaciones de los DVB en la práctica diaria2–12,22 y sobre su utilidad en situaciones clínicas y anatómicas relativamente adversas, estudios como el de Chavarría et al.21 tienen un enorme interés. Debemos seguir investigando para conocer mejor los mecanismos implicados en los fallos tardíos y muy tardíos de estos dispositivos (reestenosis y trombosis). En este sentido, el estudio prospectivo RIBS VII, que pretende evaluar el tratamiento de la reestenosis de DVB en nuestro país, podría aportar datos especialmente relevantes. También es necesario identificar los escenarios clínicos y anatómicos en que estos dispositivos permitan ofrecer unos mejores resultados que logren traducirse en un claro beneficio clínico para los pacientes. Señalar que un implante de los DVB más cuidadoso podría mejorar su seguridad y eficacia parece muy razonable. También lo es que se intente optimizar los resultados utilizando sistemáticamente técnicas de imagen intracoronaria13. No obstante, debemos reconocer con humildad que ya éramos plenamente conscientes de todas estas consideraciones técnicas y metodológicas cuando comenzamos a utilizar estos dispositivos hace ya algunos años. Finalmente, los datos actualmente disponibles señalan la necesidad de replantearse la duración y el tipo de tratamiento antiagregante más adecuado tras el implante de DVB6–11,15–18. En cualquier caso, las nuevas generaciones de DVB (con importantes mejoras en la plataforma clásica de ácido poliláctico o con plataformas corrosibles de magnesio) muy pronto estarán disponibles para uso clínico generalizado, y se espera que permitan superar muchas de las limitaciones de los actuales dispositivos. Sin embargo, una valoración rigurosa y crítica de los resultados obtenidos con los nuevos dispositivos siempre debe seguir siendo el lema que rija el desarrollo de la cardiología intervencionista. El tratamiento de nuestros pacientes no puede ni debe basarse en simples expectativas, por muy atractivas que sean22.
CONFLICTO DE INTERESESNinguno.