En este artículo se revisan los biomarcadores no troponínicos con posibles sensibilidad y selectividad, que aportan una perspectiva diagnóstica en el síndrome coronario agudo, y su posible uso en los algoritmos de estratificación del riesgo. Dichos biomarcadores pueden ser útiles como análisis complementarios o alternativos a los de troponina cardiaca (I o T) en el diagnóstico precoz del síndrome coronario agudo, así como para monitorizar su progresión y evaluar el pronóstico. La información presentada en este artículo se basa en un análisis crítico de una selección de la literatura biomédica disponible a través de los motores de búsqueda Scopus y MEDLINE-PubMed de la National Library of Medicine de Estados Unidos. La mayor parte de los artículos citados en este trabajo de revisión y perspectiva, excepto unas pocas publicaciones históricas de referencia, se publicó entre enero de 2000 y diciembre de 2013.
Palabras clave
En esta revisión bibliográfica se presenta una selección crítica de las publicaciones identificadas en la búsqueda completa de la literatura biomédica de la National Library of Medicine de Estados Unidos (MEDLINE-PubMed) o, alternativamente, la obtenida con el motor de búsqueda Scopus. Para este artículo, se han seleccionado los artículos originales de investigación clínica o no clínica, así como una muestra representativa de revisiones históricas y recientes, en los que se identificaban los marcadores bioquímicos no troponínicos establecidos y presuntos (biomarcadores aka) del síndrome coronario agudo (SCA). En la presente revisión se identifican los biomarcadores en muestras de sangre que se emplean actualmente como complementarios o alternativos a la troponina cardiaca de alta sensibilidad (hs-cTn), así como los nuevos biomarcadores cuyo uso se ha propuesto para la estratificación del SCA. Parece claro que la manera más efectiva de realizar la estratificación consiste en combinar la historia clínica del paciente con una evaluación electrocardiográfica y análisis de sangre seriados para la determinación de los biomarcadores relevantes; habitualmente se emplean los resultados de los análisis de hs-cTn, mioglobina y la fracción MB de la creatincinasa (CK-MB). En esta revisión se incluyen los biomarcadores no troponínicos tanto de fase temprana como de fase tardía, con los que se pretende identificar (con diversos grados de sensibilidad y especificidad para una detección fiable de procesos biológicos subyacentes) la lesión isquémica de las células miocárdicas, las células endoteliales, la formación y erupción de placas, la agregación plaquetaria y otros factores asociados a la formación del trombo, así como la inflamación miocárdica o coronaria.
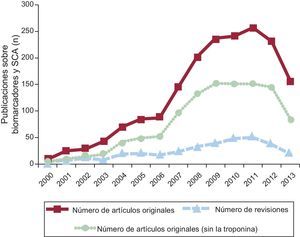
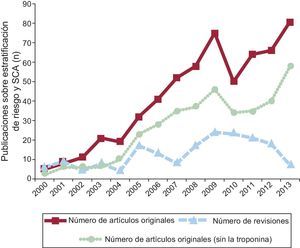
Como referencia de partida, se determinó la frecuencia de artículos originales y revisiones que presentaban información sobre biomarcadores y SCA (figura 1) o sobre estratificación del riesgo y SCA (figura 2), incluidos los artículos originales publicados respecto a biomarcadores no troponínicos entre enero de 2000 y diciembre de 2013 empleando el motor de búsqueda de la National Library of Medicine de Estados Unidos, PubMed1. Aunque el número de publicaciones de investigación original en las que se presentaban resultados de biomarcadores para el SCA parece haber alcanzado su máximo en 2011, las publicaciones relativas a la estratificación del riesgo de SCA parecen haber aumentado de manera constante durante todo el periodo de 14 años, excepto por una pequeña disminución entre 2009 y 2012. De forma análoga, el número de artículos de investigación original que abordan la estratificación del riesgo de SCA con biomarcadores no troponínicos se estabilizó en 2009 en alrededor de 40 artículos anuales, y la previsión es un ligero aumento del número de artículos originales en 2013. Las tendencias de las publicaciones que se muestran en las figuras 1 y 2 fueron similares cuando realizamos una búsqueda bibliográfica para el mismo intervalo de tiempo y con los mismos términos de búsqueda utilizando el motor Scopus2. Con objeto de asegurar que se había identificado las guías y las opiniones y prácticas de consenso respecto a los biomarcadores del SCA, se realizó también una búsqueda en la base de datos de The Cochrane Library3.
Resultados de la búsqueda en PubMed, 2000 a 2013 (hasta el 31 de octubre; estimado para 12 meses), para la combinación de términos de búsqueda «biomarker» y «acute coronary syndrome». Número total de artículos originales publicados (línea continua, cuadrados), total de artículos sin la troponina como uno de los marcadores (línea punteada, círculos) y total de artículos de revisión (línea a trazos, triángulos). SCA: síndrome coronario agudo.
Resultados de la búsqueda en PubMed, 2000 a 2013 (hasta el 31 de octubre; estimado para 12 meses), para los términos de búsqueda «risk stratification» y «acute coronary syndrome». Número total de artículos originales publicados (línea continua, cuadrados), total de artículos sin la troponina como uno de los marcadores (línea punteada, círculos) y total de artículos de revisión (línea a trazos, triángulos). SCA: síndrome coronario agudo.
El término SCA se emplea para describir multitud de situaciones en las que el aporte de sangre arterial coronaria al corazón sufre una interrupción u obstrucción repentina, habitualmente como proceso terminal de la evolución de una enfermedad vascular progresiva que afecta a una o varias de las ramas principales de la circulación arterial coronaria. El SCA engloba los dos tipos de isquemia/infarto de miocardio establecidos mediante la electrocardiografía (infarto de miocardio con elevación del segmento ST e infarto de miocardio sin elevación del segmento ST), la angina de pecho inestable y la enfermedad coronaria asociada a diversos trastornos metabólicos (p. ej., diabetes mellitus).
El Grupo de Trabajo de 2011 de la European Society of Cardiology define el SCA como «una manifestación de aterosclerosis [progresiva] con peligro para la vida del paciente […] que generalmente se desencadena por una trombosis aguda inducida por la rotura o erosión de una placa aterosclerótica coronaria, con o sin vasoconstricción simultánea, que causa una reducción súbita y crítica del flujo sanguíneo [coronario/miocárdico]». Las guías de la Sociedad Europea de Cardiología, la American College of Cardiology Foundation y la American Heart Association sobre los biomarcadores del SCA sitúan la hs-cTn seriada en el primer lugar de los indicadores y asignan a los análisis de CK masa, isoenzima CK-MB y mioglobina el papel de biomarcadores secundarios4,5. Parece claro que los biomarcadores de aparición temprana que pueden identificar los procesos patológicos celulares y tisulares que subyacen en el carácter progresivo del SCA son los que ahora están recibiendo más atención, mientras se perfeccionan cada vez más los instrumentos y las técnicas de detección diagnóstica y pronóstica.
Siempre que el aporte de flujo sanguíneo coronario se sitúa por debajo del umbral necesario para satisfacer la demanda metabólica del miocardio, se produce una situación de isquemia miocárdica relativa que se asocia a un paso de metabolismo aerobio a anaerobio6. Cuando la reducción del flujo coronario es lo bastante significativa y persistente, se produce una lesión del tejido miocárdico. Como consecuencia de las fuerzas físicas que se producen durante el ciclo cardiaco, la región endocárdica de la pared ventricular es más sensible a la isquemia durante estas reducciones agudas o progresivas de la presión de perfusión coronaria distal a los puntos de estenosis u oclusión.
En las células, la lesión de isquemia miocárdica regional conduce a una alteración de la membrana celular en el músculo cardiaco y una fuga del contenido celular que se puede detectar y puede ser útil como biomarcador del SCA. Durante el SCA se producen varias alteraciones del tejido que afectan a las placas ateroscleróticas preexistentes, las células endoteliales, las células de músculo liso vascular y los elementos formes de la sangre, como plaquetas, neutrófilos y leucocitos.
La CK posiblemente fue uno de los primeros marcadores bioquímicos (enzima intracelular) identificados que se liberaban a la sangre tras una oclusión arterial coronaria transitoria y sostenida7–9. La isoenzima miocárdica CK-MB tal vez sea uno de los biomarcadores «de referencia» más tempranos en la evaluación del SCA. Además de la CK-MB, los análisis de mioglobina y troponinas cardiacas (cTnI y cTnT) liberadas por las células de músculo cardiaco dañadas se utilizan de manera combinada para diagnosticar o confirmar el SCA. Actualmente, los análisis de hs-cTn se consideran el biomarcador de referencia global más relevante, sensible y específico para la valoración del SCA en la fase inicial y en la fase avanzada, así como en la de la lesión de isquemia miocárdica en pacientes que acuden al servicio de urgencias tras la aparición de los síntomas10. Parece claro que con la introducción de los análisis de hs-cTn, la capacidad de detección temprana del SCA ha llevado a la hs-cTn (I o T) al lugar de biomarcador preferido, por delante de otros candidatos previos, como la mioglobina y la copeptina11.
Los métodos actuales para confirmar el SCA incluyen los análisis de biomarcadores en sangre para determinar enzimas y proteínas cardiacas, habitualmente la troponina cardiaca I y T (hs-cTnI, hs-cTnT), CK-MB, mioglobina, proteína C reactiva (PCR), fibrinógeno, homocisteína, lipoproteínas, triglicéridos, péptido natriurético cerebral (BNP) o la fracción aminoterminal de su propéptido (NT-proBNP), etc. En cambio, los biomarcadores de la insuficiencia cardiaca congestiva, además de análisis de las troponinas cardiacas de alta sensibilidad, incluyen a menudo el BNP o NT-proBNP y la galectina-3.
Estos análisis de biomarcadores séricos del SCA, que se emplean habitualmente en combinación con un examen del electrocardiograma para determinar que hay isquemia miocárdica, pueden ser útiles para estimar la extensión de miocardio dañado por déficit de flujo coronario. Cada biomarcador tiene un perfil temporal propio en las muestras de sangre seriadas12. Algunos biomarcadores, como la mioglobina, pueden estar elevados en la fase inicial y volver al valor basal 4-6 h después del inicio del episodio, mientras que otros, como la troponina, aumentan de manera más lenta en la sangre y pueden persistir durante días tras el inicio del déficit de perfusión coronaria que desencadena el SCA. Se sigue identificando otros biomarcadores asociados al SCA (como la proteína traza-beta, la cistatina C, la glucógeno fosforilasa isoenzima BB, la proadrenomedulina de región media y el péptido natriurético auricular de región media) que presentan grados diversos de sensibilidad y especificidad para los procesos celulares y tisulares subyacentes. Los pacientes que presentan la gama de síntomas y los antecedentes compatibles con un SCA, en especial los que muestran una angina inestable o un infarto de miocardio sin elevación del segmento ST, tienen mayor probabilidad de diagnóstico correcto de un SCA si se usan biomarcadores independientes y complementarios en el diagnóstico y el pronóstico13. Los pacientes que presentan angina inestable o infarto de miocardio sin elevación del segmento ST pueden mostrar también patrones de biomarcadores cardiacos específicos de cada sexo. En los varones fue más probable la elevación de CK-MB y troponinas, mientras que en las mujeres fue más común la elevación de PCR y BNP14. Este estudio indica que hubo más pacientes, sobre todo mujeres, a los que se diagnosticó correctamente un SCA cuando se tuvo en cuenta múltiples biomarcadores.
Las recomendaciones actuales para el diagnóstico del SCA han sido establecidas por un grupo de trabajo conjunto de la Sociedad Europea de Cardiología/American College of Cardiology Foundation/American Heart Association/World Health Foundation, junto con la National Academy of Clinical Biochemistry. Estas organizaciones han recomendado utilizar el aumento de 3 desviaciones estándar (∼20%) en los valores de hs-cTn como requisito para confirmar el infarto de miocardio en el SCA.
Los valores de los biomarcadores y sus perfiles de evolución temporal pueden ser útiles también para evaluar el riesgo futuro de enfermedad coronaria, morbilidad y mortalidad. La prueba de esfuerzo convencional es ciertamente útil para el pronóstico del SCA. Aparte de los biomarcadores hemáticos, otros métodos empleados para confirmar la localización y la extensión de la lesión miocárdica en los SCA son la angiografía coronaria para visualizar obstrucciones de las arterias coronarias, la gammagrafía de perfusión cardiaca para identificar déficit de flujo coronario en reposo y durante las pruebas de provocación farmacológicas15, la ecocardiografía para determinar la función general del ventrículo izquierdo y evaluar las regiones miocárdicas con disfunción sistólica, la resonancia magnética y la tomografía de emisión de positrones. Aparte de estos métodos, se recomienda estudiar la reserva de flujo funcional para evaluar el rango dinámico de flujo coronario y la viabilidad miocárdica16,17.
Además de esta serie de métodos más convencionales y generalmente aceptados como biomarcadores de SCA antes descritos, hay un conjunto de nuevos candidatos derivados de estudios clínicos y de laboratorio como consecuencia de los recientes avances en biotecnología y biología celular. Entre estos nuevos marcadores, se encuentran los biomarcadores del daño celular —como los micro-ARN (miARN), el ADN sin células circulante, las macropartículas circulantes, las microvesículas (MV), los exosomas— y los biomarcadores selectivos del endotelio, las placas de aterosclerosis, el músculo liso celular y las células miocárdicas dañadas. Los miARN18 cardioenriquecidos circulantes y el ADN sin células circulante19 son indicadores de eventos isquémicos miocárdicos. Las micropartículas circulantes y las MV pueden ser útiles también como marcadores del SCA20. Entre los nuevos biomarcadores de disfunción o rotura endotelial, se encuentran la proteína precursora 770 de amiloide beta soluble21 y el factor derivado del epitelio pigmentario sérico22. La proteína de activación fibroblástica α es una glucoproteína de membrana que las placas ateroscleróticas expresan y liberan23. Se ha propuesto también el uso de la PCR de alta sensibilidad, la paraoxonasa-1, la fosfolipasa secretora A2 y diversas mieloperoxidasas (MPO) y metaloproteinasas como biomarcadores útiles del SCA24. Asimismo, se ha propuesto el uso de la catepsina-K, una potente colagenasa circulante, como biomarcador sensible del SCA25.
Sin duda alguna, el desarrollo de los métodos de análisis de hs-cTnI o hs-cTnT ha mejorado el porcentaje y la exactitud de diagnósticos de SCA, pero sigue habiendo un subgrupo de pacientes que tienen un SCA y muestran valores de troponina normales26. Este grupo de pacientes tiene un riesgo significativo de infarto de miocardio en un periodo de seguimiento de 1 año27, lo cual pone de manifiesto la necesidad de biomarcadores no troponínicos sensibles y específicos del SCA. Además, los análisis de hs-cTn comportan un riesgo significativo de resultados falsos positivos28. Un reciente estudio de Yayan29 ha identificado, además del biomarcador de PCR ya establecido, 46 nuevos biomarcadores de inflamación que están asociados a la enfermedad coronaria. Dedicando el tiempo y la atención adicionales necesarios, se podrá determinar cuáles de estos nuevos biomarcadores, si los hay, son lo bastante sensibles y específicos para poder usarlos en el diagnóstico y la estratificación del riesgo de SCA.
ESPECIFICIDAD Y SENSIBILIDAD DE LOS BIOMARCADORESHabitualmente se considera los términos «sensibilidad» y «especificidad» en el contexto de la técnica de análisis aplicada para detectar un biomarcador. Aunque los métodos y las técnicas para detectar biomarcadores específicos se están perfeccionando continuamente para aumentar los umbrales de detección inferiores («sensibilidad de medición») y determinar un biomarcador concreto de interés diferenciándolo de otros posibles parámetros analíticos de una muestra («selectividad de medición»), algunos métodos como la espectrometría de masas y la espectroscopia de resonancia magnética nuclear son capaces de detectar múltiples entidades moleculares que, consideradas como conjunto, pueden aportar ventajas al usarlas como conjuntos de biomarcadores sensibles y específicos en vez de usar un único biomarcador30.
Ciertamente, los biomarcadores deben tener «especificidad para el proceso», la entidad patológica o el estadio de la enfermedad que se está intentando determinar, y deben mostrar sensibilidad no solo en el método de análisis (p. ej., anticuerpos dirigidos contra un epítopo específico y estable presente en la troponina I), sino también, y tal vez de modo más importante, «sensibilidad en proporción a la magnitud del proceso» para el que el biomarcador ha mostrado especificidad. Así, si un biomarcador —p. ej., BNP— procede predominantemente de las aurículas cardiacas y esta liberación de BNP al torrente circulatorio está relacionada con la magnitud de la distensión auricular causada por la expansión del volumen sanguíneo asociada a las diversas fases progresivas de la insuficiencia cardiaca, el BNP mostraría tanto especificidad como sensibilidad con valor clínico. De manera análoga, si se determinara un marcador de la aterosclerosis y esta fuera sistémica, la relación del marcador con la aterosclerosis arterial coronaria podría no ser específica ni sensible para el lugar diana de la enfermedad, por lo que podría tener un valor limitado en la evaluación de este componente de los síndromes arteriales coronarios. Otro ejemplo: si una región del ventrículo izquierdo ha sufrido un daño debido a reducción u oclusión del flujo sanguíneo coronario, un biomarcador de dicho daño sería útil, como lo sería también un biomarcador que fuera específico para el daño isquémico y la magnitud de la isquemia miocárdica.
La inflamación es el cuarto caso en que la inflamación arterial coronaria sería de interés, y el biomarcador buscado deberá ser no solo un indicador sensible de un tipo concreto de proceso inflamatorio, sino también un indicador específico de solamente el proceso inflamatorio en la circulación coronaria. Tal vez la mejor forma de mejorar la especificidad de un biomarcador, aunque no siempre sea aplicable de forma práctica, fuera la obtención de muestras o la detección en la localización específica de la enfermedad de interés. Esto podría alcanzarse con la marcación y el uso de técnicas de imagen para visualizar un determinado biomarcador en el lugar donde se genera o se libera, y con un modo más dirigido de obtener muestras de sangre procedentes de las arterias que irrigan y las venas que drenan el tejido u órgano de interés, con lo que mejoraría la especificidad tisular (es decir, de localización). Cuando el SCA es la enfermedad de interés, la obtención simultánea de muestras de sangre de una arteria sistémica y del seno coronario permitiría identificar biomarcadores de episodios específicamente cardiacos31.
La dilución de la señal del biomarcador es una importante dificultad para poder utilizar muestras de sangre periférica en la detección de biomarcadores que sean específicos y sensibles para los SCA, y como nosotros32 y otros autores30 hemos propuesto, un único biomarcador puede no ser ni lo bastante específico ni lo suficientemente sensible para la determinación del pronóstico, la extensión o la progresión de un SCA, como lo sería un conjunto de biomarcadores que, considerados conjuntamente, pueden aumentar tanto la sensibilidad como la especificidad de la evaluación del síndrome y tal vez de eventos concretos en el desarrollo de ese síndrome. Este enfoque combinado se adopta cuando se emplean conjuntamente los datos de hs-cTn, mioglobina y CK-MB para mejorar la fiabilidad de la evaluación diagnóstica del SCA y la determinación del riesgo33–39.
BIOMARCADORES CELULARES MIOCÁRDICOS DEL SÍNDROME CORONARIO AGUDOLos biomarcadores que los miocitos cardiacos liberan de manera pasiva tras una lesión isquémica son los indicadores de SCA más comúnmente utilizados. La mioglobina, la CK-MB y las troponinas cardiacas son los biomarcadores convencionales actuales de este tipo. Además, si la masa del ventrículo izquierdo que se ve afectada por la insuficiencia coronaria es lo bastante grande para aumentar la tensión en la pared (dilatando la zona durante la diástole y produciendo un abombamiento paradójico durante la sístole), los miocitos distendidos pueden liberar y liberan BNP y NT-proBNP28. Otros factores que el miocardio dañado o en proceso de muerte celular libera son PCR, BNP, albúmina modificada por isquemia y proteína transportadora de ácidos grasos de tipo cardiaco35,40–42.
Con el paso del tiempo, se ha ido abandonando diversos biomarcadores de SCA anteriormente utilizados (aspartato aminotransaminasa, lactato deshidrogenasa total e isoenzimas de la lactato deshidrogenasa) debido a la baja especificidad para la lesión cardiaca y por su distribución tisular ubicua. En los estudios iniciales se identificaron otras moléculas citoplasmáticas liberadas por las células miocárdicas con una lesión transitoria o definitiva. Entre esos biomarcadores se encontraba la CK y la posterior identificación de sus isoformas miocárdicas y cerebrales7–9. Actualmente, el análisis de la hs-cTn, gracias a su mayor especificidad tisular y la mejor sensibilidad respecto a valores bajos de cTn en las muestras de sangre, es el patrón de referencia con el que se comparan otros presuntos biomarcadores del SCA para su evaluación. Se emplea el percentil 99 (3 desviaciones estándar por encima del valor medio normal) como límite para la toma de decisiones en la confirmación de la lesión miocárdica mediante hs-cTnI, hs-cTnT, CK-MB masa y mioglobina.
Además de la liberación de enzimas o productos proteicos del citoplasma al torrente circulatorio, las células dañadas pueden liberar también ácidos nucleicos que pueden detectarse de manera específica como biomarcadores. Varios estudios recientes han mostrado un aumento de las concentraciones séricas de ADN sin células circulante tras la isquemia cardiaca, presumiblemente como consecuencia de la apoptosis y necrosis de los miocitos43–45. Se ha descrito un aumento de las concentraciones séricas de ADN sin células circulante en pacientes con SCA y una elevación adicional tras el infarto de miocardio con elevación del segmento ST19,46. Sin embargo, la utilidad del ADN sin células circulante como biomarcador puede ser limitada por su semivida relativamente breve, < 30 min47. Pero por otro lado, aunque una semivida breve puede limitar su utilidad para determinar el grado de daño isquémico agudo, su rápida eliminación de la circulación puede ser un aspecto favorable para diferenciar los eventos isquémicos discretos de los sostenidos si la monitorización y la obtención de muestras de sangre se realizan en un intervalo de tiempo próximo a los eventos coronarios.
BIOMARCADORES DE LA INFLAMACIÓN EN EL SÍNDROME CORONARIO AGUDOEn el apartado anterior se ha descrito la secreción (activa o pasiva) de biomarcadores por el miocardio dañado, tras el inicio del episodio isquémico. A diferencia de estos biomarcadores, que indican una isquemia previa o en curso, los biomarcadores que se comentan en los dos apartados siguientes (marcadores de la inflamación o de aterosclerosis coronarias) tienen mayor valor predictivo, ya que a menudo están presentes antes de la lesión isquémica o la necrosis/apoptosis miocárdica. Además, la inflamación coronaria es un estímulo primario para el desarrollo y la progresión de la aterosclerosis y, por tanto, el aumento de la inflamación también suele ser indicador de aterosclerosis coronaria.
Entre los mediadores y marcadores de la inflamación coronaria y miocárdica, se encuentran diversas proteínas de fase aguda, citocinas, interleucinas (IL), moléculas de adhesión celular y PCR. La inflamación y otras lesiones del endotelio vascular se consideran el evento clave que, al cabo del tiempo, conduce al establecimiento de la placa de ateroma, que puede ser el foco de una posterior agregación plaquetaria y trombosis y/o de la rotura de la cápsula fibrosa protectora de la placa, y la PCR, la IL-6 y el amiloide A en suero se emplean como principales biomarcadores para ello en el paradigma del SCA. La liberación de PCR, detectada mediante análisis de alta sensibilidad (PCR de alta sensibilidad), puede producir también efectos derivados, como la expresión de moléculas de adhesión, entre otros procesos que ya de por sí pueden ser biomarcadores asociados al SCA. Hace una década, aparecieron diversos presuntos biomarcadores para la estratificación del riesgo de SCA. Entre ellos se encontraban los marcadores de la activación plaquetaria, enzimas como las metaloproteinasas que rompen la integridad de la cubierta fibrosa del ateroma, y las MPO liberadas por los leucocitos activados dentro de la circulación coronaria. El marcador de la inflamación coronaria más utilizado es la PCR48–52. Sin embargo, otros biomarcadores inflamatorios, como la pentraxina 3, el amiloide A en suero, el fibrinógeno y la MPO, han mostrado un valor predictivo del SCA y los posteriores eventos cardiacos igual o superior. La pentraxina 3, una proteína de fase aguda en la respuesta al SCA que es un marcador de la inflamación vascular más específico que la PCR, es liberada por múltiples tipos de células, como fibroblastos y células dendríticas y endoteliales, en respuesta a las señales inflamatorias primarias53,54. El amiloide A sérico y el fibrinógeno también son proteínas de fase aguda de respuesta al SCA cuyas concentraciones en suero aumentan en respuesta a la inflamación aguda55. El recuento de neutrófilos y la activación de estos son también marcadores de inflamación, y las concentraciones de la MPO lisosómica derivada de los neutrófilos pueden ser un biomarcador sensible de la inflamación y el riesgo cardiovascular.
La MPO, identificada por primera vez como biomarcador predictivo del SCA en ausencia de necrosis miocárdica en 2003, puede ser un marcador de la inflamación coronaria y el riesgo cardiaco mucho antes de que aparezcan los biomarcadores de la isquemia miocárdica y el infarto (mioglobina, troponina, CK-MB o PCR) en pacientes evaluados precozmente tras el inicio de los síntomas56,57. Estudios recientes han confirmado la utilidad de la MPO como biomarcador de la inflamación coronaria y han mostrado que su capacidad predictiva a largo plazo aumenta cuando se la combina con un método de análisis de PCR de alta sensibilidad48,58.
Se han investigado otros biomarcadores como posibles indicadores de la inflamación coronaria y el SCA, pero no se ha determinado aún de manera concluyente su utilidad clínica como biomarcadores sensibles y específicos. Como ejemplos de estos posibles biomarcadores, cabe citar el ligando soluble de CD40, el factor de necrosis tumoral alfa, la IL-10 y la IL-18. Tanto el ligando soluble de CD40 como el factor de necrosis tumoral alfa son conocidos iniciadores de la señalización proinflamatoria y están elevados en los pacientes con SCA. Sin embargo, ninguno de ellos parece ser un predictor específico de SCA o eventos cardiacos adversos posteriores59,60. Aunque la IL-18 es una citocina proinflamatoria que se cree que inicia la inestabilidad de la placa y se eleva en relación con otros factores de riesgo establecidos, no predice de manera independiente el riesgo de SCA ni el de infarto de miocardio61.
BIOMARCADORES DE ATEROSCLEROSIS CORONARIALa alteración progresiva precedente y el proceso que conduce al SCA es la aterosclerosis arterial coronaria. Por ello, los biomarcadores selectivos pueden permitir la detección de los procesos de cambio rápido relacionados con la placa aterosclerótica, incluida la rotura de su capa fibrosa protectora.
BIOMARCADORES ORIGINADOS EN EL ENDOTELIO CORONARIO DAÑADOLa integridad del endotelio coronario es necesaria para la homeostasis capilar y para el funcionamiento fisiológico adecuado del músculo liso vascular subyacente de los segmentos arteriales coronarios que conducen a los capilares62. El endotelio es la interfase con la sangre y constituye la primera barrera y el transductor de los efectos vasomotores de los cambios de fuerzas tangenciales microfluídicas y de ciertas sustancias vasoactivas que actúan a través del óxido nítrico. La lesión o la inflamación del endotelio coronario altera estas funciones de barrera y puede conducir a la presencia de biomarcadores y MV en la circulación coronaria, que pueden detectarse en muestras de suero sistémico63–66.
BIOMARCADORES DE LA ACTIVACIÓN PLAQUETARIA COMO PRECURSORA DE LA TROMBOSIS ARTERIAL CORONARIALa agregación plaquetaria puede producirse tras la activación del receptor de fibrinógeno, la glucoproteína IIb/IIIa y la molécula de adhesión celular endotelial PECAM-1. Una vez activados, los biomarcadores pueden desprenderse de las plaquetas en forma de proteínas libres, miARN o MV.
MICRO-ARN DE ORIGEN CARDIACO COMO BIOMARCADORES DEL SÍNDROME CORONARIO AGUDOLos miARN constituyen una clase emergente de biomarcadores que probablemente sean liberados de manera activa por las células cardiacas en respuesta al daño isquémico. Se sabe desde hace tiempo que los cambios en la expresión de miARN en el interior de los miocitos varían en respuesta a la isquemia, y se está acumulando evidencia de que el perfil de expresión de los miARN circulantes de origen cardiaco es representativo del entorno y las condiciones en que se encuentra el miocardio. Los miARN circulantes presentan ciertas ventajas como biomarcadores, por cuanto tienen una favorable evolución temporal de la expresión (inicio rápido y larga duración), son estables en la circulación y tras el aislamiento y son detectables de manera muy específica a concentraciones muy bajas25. Los estudios llevados a cabo hasta ahora han investigado los miARN circulantes como biomarcadores del SCA y del daño miocárdico por isquemia-reperfusión, y han sido objeto de una revisión reciente por parte de Deddens et al67. Otro atractivo que tienen los miARN como biomarcadores del SCA es su expresión específica tisular. Por ejemplo, el miR-208 se expresa de una forma específica de los miocardiocitos a partir de un intrón del gen MHC alfa. Diversos estudios han aprovechado esta ventaja para investigar la secreción de miR-208 como marcador específico de la lesión isquémica de los miocardiocitos. Aunque no todos los estudios relativos al miR-208 como biomarcador específico para el SCA han dado resultados positivos, múltiples trabajos muestran un aumento rápido del miR-208 circulante tras el infarto de miocardio68–72. El miR-499 es otro miARN específico del músculo cardiaco que ha resultado prometedor como marcador temprano del infarto de miocardio68,73.
Tal vez el miARN circulante más prometedor sea miR-1, un biomarcador específico muscular que numerosos estudios han observado elevado tras la isquemia cardiaca tanto en el infarto de miocardio con elevación del segmento ST como en el infarto de miocardio sin elevación del segmento ST72. Además de los miARN específicos del músculo, como miR-1, miR-208 y miR-499, los miARN procedentes de otros tipos de tejidos, como el músculo liso vascular, el endotelio y los leucocitos, también son posibles biomarcadores de componentes del SCA. La investigación de los miARN como biomarcadores aún es reciente, y la mayoría de las publicaciones al respecto han aparecido tan solo en los últimos 3 o 4 años. Se sigue identificando nuevos miARN, y su uso como biomarcadores parece tener un potencial considerable.
MICROVESÍCULAS DE ORIGEN CARDIACO COMO BIOMARCADORES DEL SÍNDROME CORONARIO AGUDOAlgunos de los biomarcadores comentados no se secretan simplemente de manera pasiva como resultado de la lesión celular, sino que son objeto de liberación activa como una respuesta celular dinámica y específica a la isquemia. Numerosos estudios han descrito la liberación de MV extracelulares de los miocardiocitos, las células endoteliales y los neutrófilos. Estas MV desempeñan un papel activo en el desarrollo o la progresión del SCA65,66,74. El contenido y los productos liberados por estas MV parecen depender de la enfermedad, lo cual indica que pueden tener, además, un papel específico en la señalización de tejidos/células diana a distancia64,66,75,76. Se sabe que las MV secretadas contienen componentes proteicos definidos, y al menos tres de ellos (receptor de inmunoglobulina poligénico, cistatina C y factor C5a del complemento) pueden ser también útiles biomarcadores del SCA77.
Además de las proteínas que las forman, otros estudios han determinado directamente las MV y los tipos celulares de las que proceden, y han evaluado las MV procedentes de células endoteliales y procedentes de monocitos como factores independientes predictivos del daño miocárdico en los pacientes con infarto de miocardio sin elevación del segmento ST20. Las MV circulantes pueden constituir un tipo de biomarcadores diferenciables, con unas características únicas, por cuanto se puede usarlos unos en combinación con otros según el tejido de origen o el contenido. Como ejemplo de ello, cabe citar los estudios en que se han examinado múltiples poblaciones de MV diferenciadas o las proporciones de esas poblaciones como biomarcadores independientes20.
Recientemente se ha descubierto exosomas que contienen moléculas que aportan información de células específicas e intervienen en la señalización de la comunicación intercelular y el aporte de sustancias encapsuladas de una célula a otra; ello sugiere que la búsqueda de biomarcadores del SCA continuará avanzando. En un futuro próximo, el análisis del contenido de los exosomas de origen cardiaco y la interpretación de su perfil de contenido podrían abrir un nuevo camino para perfeccionar el establecimiento temprano de diagnóstico, pronóstico y estratificación del riesgo de SCA.
NUEVOS BIOMARCADORES GÉNICOS Y PROTEICOS PARA EL DIAGNÓSTICO Y LA ESTRATIFICACIÓN DEL RIESGO DE SÍNDROME CORONARIO AGUDOEn un reciente trabajo de Silbiger et al78, el análisis de expresión genómica con el empleo de los perfiles de miARN expresados en microchips génicos detectó 549 genes con una expresión diferente en la sangre periférica de los pacientes con SCA en las primeras 48 h. De entre estos centenares de genes expresados durante la fase temprana del SCA, 13 fueron considerados técnica y biológicamente validados mediante reacción en cadena de la polimerasa en tiempo real, y todos ellos se expresaban en los pacientes con SCA de manera diferente que en los pacientes de control en las dos fases del estudio. Los autores señalan que los cambios de los genes ALOX15, CA1 y KCNE1 pueden reflejar una «respuesta de sistema protector» tras la oclusión coronaria, y que los genes BCL2A y COX7B pueden indicar la regulación de la apoptosis en las células endoteliales y los miocitos cardiacos. Los autores señalan también que seis genes (AREG, IL18R1, IRS2, MYL4, BCL2L1 y MMP9) pueden indicar el remodelado del tejido endotelial y cardiaco tras la isquemia, y que otras combinaciones de estos 13 genes pueden indicar la progresión o rotura de la placa de aterosclerosis e intervenir en el inicio de la cascada inflamatoria.
De manera análoga, el estudio piloto IBIS-1, llevado a cabo por Wykrzykowska et al79, aplicó una tecnología de microchips génicos para correlacionar las exploraciones de imagen coronarias (ecografía intracoronaria y tomografía computarizada multicorte) con la expresión de biomarcadores circulantes en pacientes de todo el espectro de síndromes coronarios. Se detectaron elevaciones de PCR de alta sensibilidad IL-6, actividad de fosfolipasa A2 asociada a lipoproteína y NT-proBNP, pero no del factor de necrosis tumoral alfa o el ligando soluble de CD40. Los marcadores antiapoptóticos (p. ej., inhibidor del activador del plasminógeno tipo 1) aumentaron a lo largo del tiempo. Los marcadores proinflamatorios y los marcadores del tráfico de linfocitos (p. ej., C-6 Kine, CTAK) aumentaron inicialmente y luego fueron disminuyendo, al igual que ocurrió con los marcadores de la coagulación (como dímero D) y de la tensión tangencial y el remodelado endotelial (como folistatina).
Estos resultados de perfil de expresión génica y transcripcional indican que en futuros estudios se identificará y se perfeccionará un subgrupo esencial de productos génicos como biomarcadores para el uso durante todo el periodo de evolución del SCA con objeto de mejorar la evaluación y la estratificación del riesgo de los pacientes. Parece claro que los trabajos futuros se orientarán a mejorar la sensibilidad y la especificidad de estos biomarcadores génicos para aumentar su valor pronóstico en el SCA y a identificar qué biomarcadores génicos aportan nueva luz sobre procesos de tejidos específicos que subyacen en el SCA.
ESTRATEGIAS DE METABOLÓMICA DE MATRIZ PARA EL DIAGNÓSTICO Y LA ESTRATIFICACIÓN DEL RIESGO DE SÍNDROME CORONARIO AGUDOReconociendo que un solo biomarcador puede tener sensibilidad y especificidad insuficientes para la estratificación del riesgo de los pacientes con SCA, Bodi et al30,80 han descrito recientemente una mejora en el abordaje de la evaluación del riesgo de SCA con el empleo de múltiples marcadores bioquímicos. Parece razonable predecir que, aplicando las metodologías de análisis actuales como la espectroscopia de resonancia magnética de alto rendimiento y la espectrometría de masas, se puede analizar las muestras de sangre de los pacientes para identificar cambios relacionados con el SCA utilizando algoritmos computacionales que estratifiquen el riesgo de SCA de los pacientes32. Existen métodos de evaluación del riesgo, como las calculadoras de lípidos y enfermedad cardiovascular en toda Europa, y los hay avalados por profesionales de la cardiología y la aterosclerosis británicos82–84 y españoles85,86. Aunque la elaboración de algoritmos y calculadoras que integren los valores de los biomarcadores para facilitar la estratificación del riesgo es algo loable, pueden producirse resultados poco fiables cuando se emplean procesos biométricos ya superados para realizar el cálculo que indica la necesidad de uso de fármacos hipolipemiantes (estatinas). Concretamente, el uso de las nuevas guías y calculadoras del riesgo recientemente avaladas y publicadas en conjunto con la American Heart Association y el American College of Cardiology81 parece comportar una notable sobrestimación del riesgo y una posible prescripción excesiva de esta clase de fármacos a pacientes individuales que pueden no tener realmente un aumento del riesgo de aterosclerosis, que es uno de los componentes del SCA.
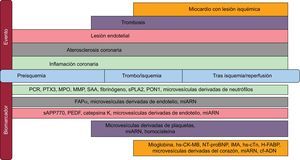
EL FUTURO DE LOS BIOMARCADORES DE SÍNDROME CORONARIO AGUDO COMO AYUDA PARA EL ESTABLECIMIENTO TEMPRANO DEL DIAGNÓSTICO, EL PRONÓSTICO Y LA ESTRATIFICACIÓN DEL RIESGOBiomarcadores sensibles y específicos para células/procesos y con correlación temporalLas prioridades en el uso de biomarcadores en la evaluación y la estratificación del riesgo de SCA requerirán nuevos estudios para caracterizar no solo la correlación temporal de cada biomarcador o conjunto de biomarcadores con cada fase de la progresión del SCA (figura 3), sino también una evaluación y verificación objetivas de la sensibilidad y la especificidad de cada biomarcador para un componente patológico subyacente que participe en el SCA. La elección de biomarcadores con una sensibilidad apropiada para identificar cambios específicos del tejido y el tipo de célula subyacentes de modo que sea paralela a la evolución temporal de los procesos patológicos respecto al momento de inicio de los síntomas de SCA será el método más útil de establecer con exactitud el diagnóstico y la estratificación del riesgo de esos pacientes. En nuestra opinión, la rápida expansión del volumen de información aportado por la investigación en modelos animales no clínicos del SCA y por los estudios clínicos de pacientes con SCA, tras los grandes esfuerzos realizados, proporcionarán pronto la posibilidad de elegir los biomarcadores más específicos y sensibles para cada una de las características subyacentes que se manifiestan en forma de SCA.
Biomarcadores del síndrome coronario agudo asociados a eventos miocárdicos subyacentes. cf-ADN: ADN sin células circulante; FAPα: proteína de activación fibroblástica alfa; H-FABP: proteína transportadora de ácidos grasos de tipo cardiaco; hs-CK-MB: fracción MB de la creatincinasa de alta sensibilidad; hs-cTn: troponina cardiaca de alta sensibilidad; IMA: albúmina modificada por isquemia; miARN: micro-ARN; MMP: metaloproteinasas; MPO: mieloperoxidasas; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; PEDF: factor derivado del epitelio pigmentario en suero; PCR: proteína C reactiva; PON1: paraoxonasa-1; PTX3: pentraxina 3; SAA: amiloide A en suero; sAPP770: proteína precursora amiloide beta 770 en suero; sPLA2: fosfolipasa secretora A2.
Se debe continuar trabajando no solo en explorar y aplicar nuevas tecnologías analíticas para identificar presuntos biomarcadores del SCA, sino también para establecer la relación entre los biomarcadores más específicos y sensibles, de entre los múltiples existentes, no simplemente como correlaciones con el SCA en la fase inicial o avanzada, sino también para cada uno de los procesos biológicos subyacentes, incluido el estado de las placas de aterosclerosis coronaria, la evidencia de agregación plaquetaria y formación de trombos, la salud de las células de músculo liso y endoteliales, la integridad de los miocitos cardiacos y tal vez incluso el estado de la inervación simpática del miocardio87.
La rapidez y la fiabilidad (sensibilidad y especificidad) de las determinaciones de biomarcadores que indiquen el diagnóstico y el pronóstico del paciente, la estratificación del riesgo y la toma de decisiones terapéuticas son cada vez más un punto de comunicación entre las pruebas realizadas en el lugar de asistencia y el desarrollo de nuevas tecnologías y dispositivos, a diferencia de lo que ocurre con los métodos de laboratorio centralizados convencionales y los centros clínicos. Los biomarcadores del SCA más recomendados (es decir, CK-MB, mioglobina, BNP y/o NT-proBNP, y posiblemente datos específicos de hs-cTnI y hs-cTnT) pueden estar elevados en otros trastornos que no sean SCA (p. ej., hipertensión, traumatismo de músculo esquelético, insuficiencia renal, aldosteronismo primario y enfermedad tiroidea). En consecuencia, continúa la búsqueda de biomarcadores concretos o conjuntos de biomarcadores que sean sensibles y específicos para cada una de las enfermedades y los procesos subyacentes que incluye el inicio y la progresión del SCA, así como de los biomarcadores que puedan resultar de mayor utilidad y eficacia en la estratificación del riesgo de SCA y la toma de decisiones terapéuticas óptimas.
Tendencia al uso de análisis de múltiples biomarcadores en el lugar de asistenciaCon los biomarcadores actualmente identificados, existe ciertamente una posibilidad de redundancia en la información aportada respecto a cualquiera de los procesos biológicos subyacentes. En un futuro próximo, es probable que los sistemas de análisis de respuesta rápida con microchips en el lugar de asistencia integren la combinación de proteínas séricas y biomarcadores séricos, enzimas bioquímicas y marcadores de la membrana celular para permitir un diagnóstico orientado a la toma de decisiones generales y en detalle del SCA y orientar una mejora de la estratificación del riesgo de los pacientes con SCA88. El planteamiento actual de los biomarcadores del SCA convencionales y los de nueva aparición (aparte de las consideraciones sobre métodos de laboratorio y especificidad y sensibilidad para la enfermedad) incluye la cuestión del tiempo necesario para obtener los resultados y la relación coste/beneficio de reducirlo con métodos fiables y reproducibles que puedan aplicarse en el lugar de asistencia del paciente. Las pruebas realizadas en el lugar de asistencia por médicos de atención primaria utilizando un dispositivo «tres en uno», capaz de indicar rápidamente la presencia de biomarcadores de SCA, insuficiencia cardiaca y tromboembolias (cTnT, NT-proBNP o dímero D, un indicador de la degradación de la fibrina y la activación de la coagulación) han mejorado el diagnóstico diferencial de un posible SCA en visitas extrahospitalarias89.
La valoración de los nuevos biomarcadores continua teniendo en cuenta si la adición de uno o varios de ellos (enfoques de múltiples marcadores) puede mejorar la estratificación del riesgo y su ventaja pronóstica respecto a las estrategias de estratificación actuales y más convencionales12,90. Hasta el momento, se ha demostrado un aumento del valor pronóstico en el SCA al combinar el NT-proBNP y el factor de diferenciación del crecimiento 15 con la puntuación GRACE más un valor de hs-cTnT corregido, en una evaluación basada en la variable de valoración de la mortalidad por todas las causas o el infarto de miocardio no mortal a los 6 meses91. Comparativamente, el valor predictivo a 1 año de diversos marcadores inflamatorios y no inflamatorios evaluados en pacientes con SCA en el estudio SIESTA mostró que solo el NT-proBNP y el fibrinógeno eran biomarcadores pronósticos sensibles y específicos del riesgo cardiovascular (mortalidad por todas las causas en un seguimiento de 1 año)92. En ese estudio, pocos o ninguno de los 10 biomarcadores examinados (entre otros, cistatina, PCR y selectina E) aportaron información adicional a la proporcionada por los marcadores del riesgo clínico convencionales; sin embargo, más de tres cuartas partes de los pacientes de este estudio estaban en tratamiento con una estatina (inhibidor de la 3-hidroxi-3-metilglutaril-coenzima A correductasa), y se sabe que estos fármacos tienen acciones antiinflamatorias, lo cual puede ser un factor de confusión en el estudio. Estos enfoques, al igual que los que utilizan análisis en el lugar de asistencia y microchips de análisis ligados a algoritmos predictivos de diagnóstico, pronóstico y estratificación del riesgo, podrán reducir los diagnósticos falsamente positivos de SCA y las hospitalizaciones no justificadas y aportarán un ahorro en la asistencia sanitaria y una mejora del uso informado de los tratamientos en beneficio de la salud de los pacientes.
CONFLICTO DE INTERESESNinguno.
Los autores desean agradecer a la Sra. Kristin Luther la ayuda en la elaboración de la figura 3.
Sección patrocinada por AstraZeneca