Las pruebas de imagen resultan esenciales en la valoración clínica de los pacientes que han sufrido un infarto de miocardio. Permiten no solo evaluar el daño isquémico inicial, sino además detectar subgrupos de pacientes con mayor riesgo de eventos en la evolución. La ecocardiografía sigue siendo el test inicial de elección, capaz de facilitar a pie de cama predictores potentes como los volúmenes ventriculares, la función ventricular general y segmentaria o la presencia de regurgitación valvular. Nuevas técnicas de estudio de la mecánica ventricular, fundamentalmente de la deformación miocárdica, están mostrando aspectos relevantes de la adaptación ventricular tras el infarto. La principal técnica alternativa a la ecocardiografía es la cardiorresonancia magnética, cuya principal ventaja es, aparte de su exactitud en la determinación de los volúmenes y la función ventriculares, la capacidad de caracterizar el miocardio y demostrar procesos que el daño isquémico conlleva, como necrosis/fibrosis, edema, obstrucción microvascular o hemorragia intramiocárdica. Esto no solo permite detectar y cuantificar el tamaño del infarto, sino que pone de manifiesto ciertas características del tejido infartado con valor pronóstico adicional.
Palabras clave
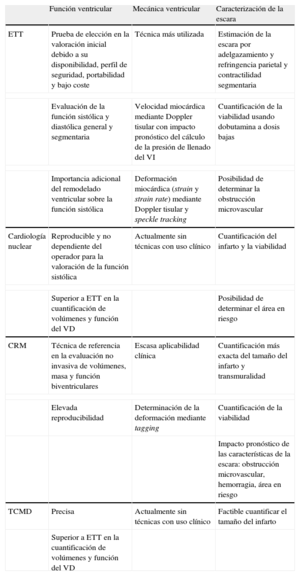
La incidencia de síndrome coronario agudo en España se mantiene alta, con aproximadamente 116.000 nuevos eventos en 2013, y se prevé un incremento en las próximas décadas1. Las técnicas de imagen no solo tienen un papel protagonista en el diagnóstico precoz del infarto de miocardio, sino también en la estratificación pronóstica, pues permite identificar subgrupos de pacientes que tienen mayor riesgo de complicaciones durante la evolución. A este respecto, la determinación de la función sistólica y los volúmenes ventriculares es la piedra angular de la predicción de eventos tras un infarto miocárdico. Para valorarlos, la ecocardiografía transtorácica (ETT) continúa siendo la prueba de elección, dadas su rapidez y su disponibilidad. Sin embargo, se ha incrementado la utilización de la cardiorresonancia magnética (CRM) por sus excelentes reproducibilidad y precisión. Se puede utilizar como alternativa otras modalidades, como las técnicas nucleares o la tomografía computarizada multidetectores (TCMD). Otro importante factor pronóstico es el tamaño del infarto, que se puede cuantificar con ETT, técnicas nucleares, TCMD o, con mayor precisión, CRM. Además, elementos relacionados con la caracterización miocárdica, como determinar la presencia de edema, hemorragia intramiocárdica u obstrucción microvascular mediante CRM, han emergido en los últimos años y se ha demostrado su relevancia pronóstica.
El objetivo de la presente revisión es realizar una actualización de la evidencia en el uso de técnicas de imagen, particularmente CRM, para la evaluación de la función ventricular y la cicatriz tras el infarto (tabla). El tratamiento detallado de otro aspecto de gran relevancia en la estratificación del riesgo tras un infarto miocárdico, la detección de isquemia residual, queda fuera de los objetivos de este artículo.
Papel de las técnicas de imagen en la valoración tras infarto de miocardio
| Función ventricular | Mecánica ventricular | Caracterización de la escara | |
| ETT | Prueba de elección en la valoración inicial debido a su disponibilidad, perfil de seguridad, portabilidad y bajo coste | Técnica más utilizada | Estimación de la escara por adelgazamiento y refringencia parietal y contractilidad segmentaria |
| Evaluación de la función sistólica y diastólica general y segmentaria | Velocidad miocárdica mediante Doppler tisular con impacto pronóstico del cálculo de la presión de llenado del VI | Cuantificación de la viabilidad usando dobutamina a dosis bajas | |
| Importancia adicional del remodelado ventricular sobre la función sistólica | Deformación miocárdica (strain y strain rate) mediante Doppler tisular y speckle tracking | Posibilidad de determinar la obstrucción microvascular | |
| Cardiología nuclear | Reproducible y no dependiente del operador para la valoración de la función sistólica | Actualmente sin técnicas con uso clínico | Cuantificación del infarto y la viabilidad |
| Superior a ETT en la cuantificación de volúmenes y función del VD | Posibilidad de determinar el área en riesgo | ||
| CRM | Técnica de referencia en la evaluación no invasiva de volúmenes, masa y función biventriculares | Escasa aplicabilidad clínica | Cuantificación más exacta del tamaño del infarto y transmuralidad |
| Elevada reproducibilidad | Determinación de la deformación mediante tagging | Cuantificación de la viabilidad | |
| Impacto pronóstico de las características de la escara: obstrucción microvascular, hemorragia, área en riesgo | |||
| TCMD | Precisa | Actualmente sin técnicas con uso clínico | Factible cuantificar el tamaño del infarto |
| Superior a ETT en la cuantificación de volúmenes y función del VD | |||
CRM: cardiorresonancia magnética; ETT: ecocardiografía transtorácica; TCMD: tomografía computarizada multidetectores; VD: ventrículo derecho; VI: ventrículo izquierdo.
La fracción de eyección del ventrículo izquierdo (FEVI), como potente predictor de eventos cardiovasculares, es el parámetro más extensamente utilizado en la práctica clínica para la evaluación de la alteración de la función cardiaca tras un infarto de miocardio2. No obstante, es importante tener en cuenta que la función sistólica, tanto general como segmentaria, puede ser engañosa en fase aguda debido a la presencia de aturdimiento miocárdico en segmentos no infartados o hipercontractilidad compensadora en zonas distantes. La ETT es la herramienta de elección para la valoración inicial de los volúmenes y la función sistólica tras el infarto de miocardio3. El método biplanar modificado de Simpson es el recomendado actualmente, en especial para esos pacientes con alteraciones segmentarias de la contractilidad4. La evaluación de la contractilidad regional no solo es útil para el diagnóstico inicial del síndrome coronario agudo, sino que tiene implicaciones pronósticas. El wall motion score index, que refleja la extensión de la disfunción contráctil a través de un cociente de la motilidad de los 17 segmentos del ventrículo izquierdo (VI), se ha demostrado predictor de mortalidad e ingreso por insuficiencia cardiaca tras un infarto de miocardio, independientemente de la FEVI5.
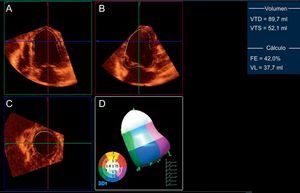
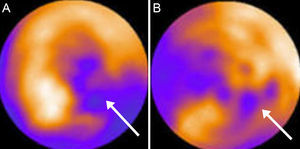
Pese a que la ETT está ampliamente disponible, se estima en un 10% los estudios con limitaciones en la calidad de la imagen que dificultan su interpretación6. La utilización de agentes de contraste ecocardiográfico permite mejorar la visualización del borde endocárdico y, con ello, la precisión de la evaluación de la función sistólica general y segmentaria7,8. Aunque en el pasado se los consideró contraindicados en el síndrome coronario agudo, las recomendaciones actuales consideran su utilización en este contexto con monitorización adecuada9. Otra técnica ecocardiográfica que está mostrando desarrollo y utilidad clínica crecientes en la práctica diaria es la ecocardiografía tridimensional, particularmente en tiempo real. Pese a continuar requiriendo una buena ventana acústica para obtener estudios de calidad, permite reformatear el set de datos tridimensional en cualquier plano de imagen y evita las presunciones geométricas (figura 1). La ecocardiografía tridimensional ha mostrado excelente correlación y concordancia con la CRM en la valoración de la FEVI, con mejores reproducibilidades interobservador e intraobservador que la ETT convencional10. Estos hallazgos se han confirmado en pacientes tras el infarto11, incluido el seguimiento seriado de la función del VI12. No obstante, está en controversia que esta técnica sea también superior a la ETT convencional para la evaluación de alteraciones segmentarias (figura 1), aunque la administración de contraste puede mejorar el rendimiento diagnóstico13.
Ecocardiografía transtorácica tridimensional del ventrículo izquierdo en un modelo experimental de infarto, reformateado en cuatro cámaras (A), dos cámaras (B) y eje corto (C), y análisis de la contractilidad regional (D) que demuestra hipocinesia apical (en blanco en el modelo tridimensional). Los volúmenes del ventrículo izquierdo y la fracción de eyección del ventrículo izquierdo se muestran en la columna de la derecha. VTD: volumen telediastólico; FE: fracción de eyección; VTS: volumen telesistólico; VL: volumen latido. Cortesía de los Dres. C. Santos-Gallego y J. Badimón.
Como alternativa no invasiva a la ETT, la técnica más utilizada es la CRM, actualmente considerada la prueba no invasiva de referencia para la medición de la fracción de eyección biventricular14. Su alta reproducibilidad es de especial interés en el contexto de la investigación, puesto que permite reducir los tamaños muestrales15. Asimismo, la CRM es una técnica precisa en la evaluación de las alteraciones segmentarias de la contractilidad16. Entre otras ventajas se incluyen la ausencia de radiación ionizante o necesidad de agentes de contraste, aunque está menos disponible y su coste es mayor que el de la ETT. La FEVI (y los volúmenes) se puede obtener a partir de estudios sincronizados de tomografía computarizada por emisión monofotónica (SPECT), que posee un valor pronóstico bien caracterizado17. Esta técnica tiene las ventajas de no depender del operador ni de presunciones geométricas, pero utiliza radiación ionizante, motivo por el cual actualmente se utiliza con poca frecuencia para cuantificar la función del VI como única indicación. Por motivos similares, también la TCMD se usa muy poco solo para la medición de los volúmenes y la función del VI, pese a proporcionar mediciones precisas18.
Función diastólica ventricular izquierdaConjuntamente con la función sistólica, el estudio no invasivo de la función diastólica mediante ETT Doppler del patrón de flujo transmitral es un elemento importante de la evaluación del paciente infartado que permite estimar la presión de llenado del VI. El impacto en la mortalidad y la incidencia de insuficiencia cardiaca de un patrón de llenado restrictivo se puso de manifiesto tempranamente19 y se corroboró después20. Un metanálisis reciente ha confirmado que la presencia de un patrón restrictivo (definido como un cociente E/A elevado con un tiempo de deceleración de E < 140 ms) es capaz de identificar un riesgo de mortalidad mayor del doble tras ajustar por edad, sexo y FEVI21. El desarrollo del Doppler tisular ha permitido medir concomitantemente las velocidades de desplazamiento miocárdico y, cuantificando la velocidad protodiastólica del anillo mitral (e’), estimar de manera no invasiva las presiones de llenado del VI. A este respecto, Hillis et al22 demostraron que un valor de E/e’ > 15 en la evaluación inicial tras el infarto quintuplica el riesgo de muerte en el seguimiento. Este hallazgo se corroboró después demostrando que el E/e’ es capaz de identificar un subgrupo de pacientes con mayor mortalidad incluso en presencia de cifras elevadas de péptido natriurético tipo B23. Estos datos indican que la rigidez miocárdica y las alteraciones de la relajación presentan un papel adicional a la función sistólica.
La limitación fundamental del Doppler deriva de su dependencia de las condiciones hemodinámicas, y resulta de interés la utilización de un parámetro con más estabilidad y reproducibilidad. Por este motivo, se evaluó la relevancia pronóstica del tamaño de la aurícula izquierda; se ha demostrado que un volumen indexado > 32 ml/m2 es un potente predictor de mortalidad tras infarto tanto a medio24 como a largo plazo25, y su efecto es independiente de que haya insuficiencia mitral o fibrilación auricular.
Dilatación y remodelado del ventrículo izquierdoYa en estudios experimentales clásicos26 se definió la importancia del proceso de remodelado ventricular, entendido como la alteración de la arquitectura ventricular (reflejada en el incremento de volumen y la modificación de la morfología de la cámaras cardiacas) que aparece tras el daño isquémico. El efecto beneficioso inicial de la dilatación del VI para mantener el volumen latido se ve contrarrestado a largo plazo por un efecto deletéreo, probablemente mediado por estimulación neuroendocrina desencadenada por el incremento de estrés parietal. Un metanálisis realizado por Kramer et al27, en el que se analizaron estudios de intervención terapéutica en pacientes con disfunción sistólica e insuficiencia cardiaca de origen isquémico y no isquémico, mostró una correlación entre los cambios en el remodelado ventricular o la FEVI (medidos con diferentes técnicas) y el efecto en la mortalidad. Esto apuntaría a que el beneficio de estos tratamientos podría estar mediado, al menos en parte, por su efecto en estos parámetros ventriculares. Múltiples ensayos clínicos28,29 han demostrado que el estudio del remodelado ventricular, representado por los volúmenes telediastólico y telesistólico del VI, aporta información adicional a la FEVI en la predicción de eventos mayores tras un infarto de miocardio. La esfericidad del VI, otro índice de remodelado, también se ha demostrado predictor de mortalidad incluso ajustando por la FEVI y el volumen telesistólico del VI30. La técnica de referencia para cuantificar los volúmenes ventriculares es nuevamente la CRM14. Aunque la ETT tridimensional ha mejorado la concordancia con la CRM respecto a la ETT convencional, continúa subestimando los volúmenes ventriculares10.
Además de la dilatación ventricular, la presencia de hipertrofia tiene relevancia pronóstica. En un subestudio ecocardiográfico del ensayo VALIANT31, se demostró que el patrón de remodelado, definido a partir de la masa del VI indexada y el grosor parietal relativo, se correlaciona con la incidencia de eventos cardiovasculares mayores tras un infarto de miocardio. Así, el remodelado concéntrico, la hipertrofia excéntrica y la hipertrofia concéntrica se asociaron de manera independiente con un incremento gradual de muerte cardiovascular, reinfarto, insuficiencia cardiaca, ictus y muerte súbita en el seguimiento, en comparación con la ausencia de remodelado del VI.
Función del ventrículo derechoEl infarto de ventrículo derecho (VD) se asocia con un incremento del riesgo de complicaciones y muerte durante el ingreso32. Hasta un 50% de los infartos de miocardio cursan con afección del VD en estudios de autopsia33; sin embargo, su detección clínica es menor y la ETT presenta importantes limitaciones en la evaluación de la función sistólica del VD34. A este respecto, la ecocardiografía tridimensional35 se ha demostrado superior a la ETT convencional en la evaluación del infarto de VD, y optimiza la identificación de pacientes con disfunción sistólica derecha. Un estudio mediante CRM36 confirmó que la afección del VD es marcador pronóstico independiente de la FEVI demostrando que la fracción de eyección del VD < 40% se asocia a un incremento absoluto del 27% en el riesgo de eventos cardiovasculares mayores a los 4 años de seguimiento.
Evaluación de la mecánica ventricularLos últimos años han sido testigos de un importante avance de las técnicas no invasivas de estudio de la mecánica cardiaca, cuyas aplicaciones clínicas están en evolución. Como máximos exponentes, se encuentran las técnicas ecocardiográficas de Doppler tisular y, particularmente, speckle tracking. Estas modalidades permiten determinar de manera cuantitativa velocidad, porcentaje de deformación (strain) y tasa de deformación (strain rate) miocárdica regional y general en dirección radial, longitudinal y circunferencial37. Se han demostrado, tanto en modelos animales38,39 como en estudios clínicos40,41, que las reducciones de estos parámetros son capaces de identificar alteraciones de la contractilidad segmentaria. Debido a la mayor dependencia del engrosamiento miocárdico de las fibras miocárdicas subendocárdicas, se ha propuesto como marcador de infarto no transmural un patrón de pérdida de función segmentaria radial con relativa preservación de la deformación longitudinal y, particularmente, circunferencial42,43. Por otro lado, la cuantificación de la deformación miocárdica general con estas técnicas también ha mostrado valor clínico: en un estudio de 659 pacientes tras infarto, la preservación del strain y el strain rate longitudinales generales fue un predictor de supervivencia superior a la FEVI y el wall motion score index44.
La deformación miocárdica se puede estudiar también con CRM. El tagging miocárdico es la técnica utilizada más extensamente, y muchos lo consideran la modalidad de referencia40. Aplica al miocardio unas líneas o cuadrícula (tags) de saturación magnética que se mantienen durante el ciclo cardiaco, de modo que se pone de manifiesto la deformación del VI. Esta se puede cuantificar después mediante posprocesado con software específico. Se demostró en un modelo animal45 que las diferencias en la contractilidad entre las regiones del infarto adyacentes y las distales persisten durante el proceso de remodelado ventricular, lo que se corroboró posteriormente en un estudio clínico46. En otras secuencias de CRM, la señal de intensidad miocárdica es proporcional a la velocidad (contraste de fase), desplazamiento (displacement encoding with stimulated echoes) o deformación (strain encoded imaging) miocárdicas, lo que permite un posprocesamiento más sencillo y se demuestra útil en pacientes con infarto de miocardio47–49. Estudios preliminares también han demostrado la posibilidad de analizar la deformación miocárdica con TCMD50 o SPECT51.
Las técnicas ecocardiográficas de estudio de la deformación miocárdica se han empleado también para evaluar la torsión del VI52,53, que se ha correlacionado con el gradiente de presión intraventricular54. En pacientes con infarto de miocardio se ha evidenciado una reducción del twist subendocárdico, directamente relacionado con la extensión del infarto55. También se han descrito con CRM menor rotación apical y retraso y prolongación del untwisting diastólico tras un infarto anterolateral, que llegan a perderse completamente en presencia de aneurismas ventriculares56.
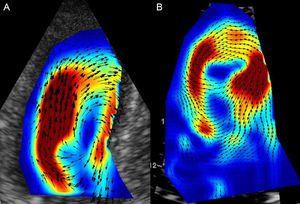
Finalmente, la evaluación de la dinámica de fluidos intraventricular durante el ciclo cardiaco o la caracterización de vórtex mediante ETT con contraste (figura 2) han despertado gran interés en los últimos tiempos. Nucifora et al57 han descrito en pacientes con infarto de miocardio índices de vórtex alterados, que presentaban correlación, aunque débil, con la función diastólica. Sin embargo, estos parámetros se encuentran aún lejos de su traslación a la práctica clínica.
Vórtices de flujo durante la contracción isovolumétrica en un sujeto normal (A) y un paciente con infarto de miocardio (B); se demuestra pérdida de la coherencia del flujo tras un infarto, lo que empeora el acoplamiento entre las fases de llenado y eyección. Cortesía de los Dres. M. Amaki y P. Sengupta.
La evaluación del tamaño del infarto se ha realizado clásicamente empleando herramientas clínicas básicas como el electrocardiograma, los marcadores enzimáticos de lesión miocárdica o las alteraciones en la contractilidad general o segmentaria. Una caracterización adicional del tamaño de la escara y la viabilidad miocárdica se puede llevar a cabo con técnicas ampliamente validadas como la ETT con dobutamina, la SPECT y la tomografía por emisión de positrones. Sin embargo, en los últimos años la CRM ha surgido como una prueba multipropósito que permite no solo evaluar la contractilidad, sino también una mejor caracterización tisular, con una calidad superior a la de la ETT y sin emplear radiación ionizante. Asimismo, estudios preliminares han demostrado la posibilidad de caracterizar el infarto con TCMD. El presente apartado se centra en el papel de las técnicas de imagen en los diferentes aspectos relacionados con la caracterización de la cicatriz del infarto, con un énfasis especial en la CRM.
Detección y cuantificación del infartoSi la reducción significativa del flujo coronario que acontece durante un síndrome coronario agudo se prolonga durante el tiempo suficiente, se produce una paulatina necrosis de los cardiomiocitos que progresa del subendocardio al subepicardio y posteriormente es reemplazada por fibrosis miocárdica. Inicialmente, la presencia de edema intersticial en el territorio necrótico puede incluso duplicar el tamaño aparente del infarto. Por otro lado, la paulatina sustitución del tejido necrótico por fibrosis puede reducir el volumen en un 25%58. Se produce también una hipertrofia compensadora de los segmentos distales que puede modificar el tamaño del infarto relativo a la masa total del VI59. Alrededor de la semana 6, el tamaño del infarto se considera relativamente estable60, lo cual debe tenerse en cuenta a la hora de interpretar los resultados de las técnicas de imagen.
Estos cambios histológicos pueden ponerse de manifiesto como ausencia de detección de radioisótopos en la zona infartada mediante técnicas nucleares, extensamente validadas en la cuantificación del tamaño del infarto, particularmente la SPECT61. Más recientemente, se ha visualizado con CRM el infarto mediante el fenómeno conocido como realce tardío de gadolinio (RTG) o acumulación del contraste en las zonas de infarto5–30 minutos después de administrarlo. Este proceso se debe a la acumulación de los quelatos de gadolinio, agentes extracelulares estrictos, en el espacio intracelular durante la fase aguda (debido a la pérdida de integridad de las membranas de los cardiomiocitos) y en el espacio intersticial durante la fase crónica (debido a su expansión por el proceso de fibrosis)62. El mismo proceso tiene lugar con contrastes yodados y estudios preliminares han demostrado la posibilidad de estudiar el infarto con TCMD63.
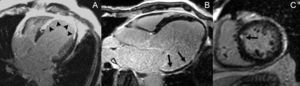
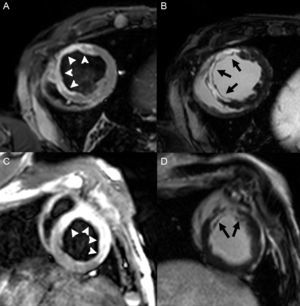
La capacidad de esta técnica para determinar el tamaño del infarto ha sido extensamente validada en modelos animales64. Debido a su excelente resolución espacial, el RTG permite determinar el grado de transmuralidad del infarto (figura 3). Se ha demostrado su mayor sensibilidad en la detección del infarto subendocárdico que las pruebas de medicina nuclear65,66, y es capaz de detectar infartos de hasta 1 g67 (figura 3). Por estas razones, se ha convertido en el test clínico de referencia para la evaluación de la escara. La prevalencia de infartos subclínicos con RTG es más común de lo considerado previamente, y se asocia con peor pronóstico68,69. Asimismo, el RTG permite detectar complicaciones específicas como el infarto del VD (también asociado a peor pronóstico)70, la afección de músculos papilares71 o el trombo ventricular72 (figura 4).
La cuantificación del tamaño del infarto con RTG se puede realizar mediante diferentes técnicas. El método visual consiste en aplicar una escala de 5 puntos a los 17 segmentos del VI (0, ausencia de realce; 1, 1-25% del grosor del segmento; 2, 26-50%; 3, 51-75%, y 4, 76-100%), y posteriormente se puede obtener un cociente al indexar la puntuación total por el número de segmentos o estimar el porcentaje total de escara en el VI73. Existen diferentes métodos cuantitativos de segmentación del infarto semiautomáticos, basados en la aplicación de un umbral de intensidad en relación con el miocardio distal viable. El mejor método parece ser el denominado full width half maximum74, aunque aún hay controversia. Por último, también se puede obtener la masa absoluta o relativa del infarto delimitándolo manualmente, lo cual se considera un método preciso si lo analizan observadores expertos, y con similar valor pronóstico75. Múltiples estudios han confirmado la relevancia pronóstica del tamaño de la escara mediante CRM, el cual es un predictor de eventos cardiovasculares mayores y mortalidad mejor que la función sistólica y los volúmenes ventriculares si se determina en fase aguda76 y, en particular, tardíamente tras el evento isquémico77. El grado de transmuralidad de la escara también se ha identificado como marcador pronóstico en algunos estudios78.
Una de las potenciales aplicaciones de caracterizar la escara mediante RTG es la predicción de arritmias ventriculares malignas. La relevancia de la extensión del infarto en la aparición de arritmias ventriculares se ha estudiado retrospectivamente en pacientes con enfermedad coronaria; el tamaño del área de RTG se identificó como un predictor independiente de descargas de desfibrilador apropiadas79 y mortalidad80. Posteriormente, un estudio prospectivo en pacientes con indicación primaria de implante de desfibrilador por criterios MADIT (Multicenter Automatic Defibrillator Implantation Trial) confirmó que el índice de transmuralidad relativa del infarto es un predictor independiente (odds ratio = 22,1) de descargas de desfibrilador apropiadas o muerte súbita81. También se puede determinar la heterogeneidad de la cicatriz examinando las variaciones de intensidad de señal en la escara. Áreas de heterogeneidad se corresponden con la presencia de canales de conducción que constituyen el sustrato de arritmias ventriculares tras un infarto82. Igualmente se ha definido la zona periinfartada o gris, que contiene tejido tanto necrótico como viable, y se ha demostrado su asociación con mortalidad cardiovascular83, inducibilidad de arritmias ventriculares84 y terapias de desfibrilador apropiadas, en prevención tanto secundaria como primaria85. No obstante, no todos los estudios han mostrado un valor independiente de este parámetro con respecto al tamaño total del infarto86.
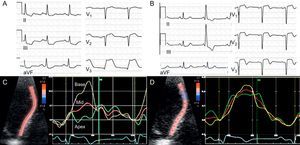
Viabilidad miocárdicaLa ecocardiografía de estrés con dobutamina a dosis bajas y la SPECT son técnicas extensamente validadas y de uso generalizado en la práctica diaria87. La tomografía por emisión de positrones, que detecta viabilidad principalmente mediante la discordancia (mismatch) entre perfusión y metabolismo miocárdicos (figura 5), es una técnica muy sensible para predecir la recuperación funcional, aunque está menos disponible en el ámbito clínico87. La integridad de la microcirculación demostrada mediante ETT con contraste también se ha asociado con viabilidad residual88. De manera similar, la preservación de parámetros de deformación miocárdica regional o general está en relación inversa con la transmuralidad y la extensión del infarto89,90, y se la ha propuesto como marcador de viabilidad miocárdica (figura 6). La mejora del strain y el strain rate regionales con dosis bajas de dobutamina también predice viabilidad91 y ha mostrado una capacidad diagnóstica mejor que la valoración visual92. Utilizando la CRM, la presencia de viabilidad puede detectarse por el incremento de contractilidad con dobutamina o, más frecuentemente, por el nivel de transmuralidad de la escara mediante RTG. El grado de transmuralidad está en relación inversa con la probabilidad de que se recupere la contractilidad tras la revascularización en el caso de miocardio hibernado93 o espontáneamente en el caso del miocardio aturdido94. De hecho, un estudio reciente ha cuestionado el concepto clásico de que el miocardio adelgazado es necesariamente inviable demostrando mejora del grosor y la contractilidad con la revascularización si la transmuralidad del RTG es < 50%95. En términos generales, el RTG presenta mayores sensibilidad (95%) y valor predictivo negativo (90%) para predecir la recuperación funcional segmentaria, mientras que el estrés con bajas dosis de dobutamina muestra mayores especificidad (91%) y valor predictivo positivo (93%)96.
Strain radial medido con speckle tracking antes y después de la reperfusión de un paciente con infarto agudo. Durante la oclusión coronaria demostrada por elevación del segmento ST (A) hay una disminución progresiva del strain sistólico radial de base a ápex (C). En el seguimiento, pese a la presencia de ondas Q en el electrocardiograma (B), hay recuperación de la función segmentaria (D), lo que indica viabilidad. Imágenes cortesía de los Dres. M. Amaki y P. Sengupta.
Un subestudio del ensayo aleatorizado y prospectivo STICH97 recientemente ha puesto en duda la significación clínica de la viabilidad miocárdica a la hora de decidir la necesidad de revascularizar a pacientes con disfunción sistólica de etiología isquémica. No identificó la presencia de viabilidad como predictor independiente de mortalidad a 5 años ni evidenció interacción en el pronóstico con la estrategia revascularizadora. Entre las limitaciones de ese estudio se debe recordar que en este subanálisis se incluyó a menos de la mitad de los pacientes inicialmente reclutados y que la indicación de estudio de viabilidad se realizó a criterio de su facultativo. Por otra parte, el estudio se realizó mediante SPECT y/o ETT con dobutamina. En un estudio prospectivo de 144 pacientes98, la presencia de viabilidad determinada por CRM en ausencia de revascularización completa se asoció con un incremento de casi 5 veces en la mortalidad, mientras que en ausencia de viabilidad significativa el tratamiento revascularizador no mejoró el pronóstico. No obstante, es discutible que el uso de CRM (o tomografía por emisión de positrones) hubiera modificado los resultados del STICH99.
Área en riesgo y evaluación del miocardio salvadoLas técnicas estándar no invasivas para la evaluación del área miocárdica en riesgo durante una oclusión coronaria requieren la inyección de radioisótopos100 o contraste ecocardiográfico88 antes de la reperfusión. En otro orden, la CRM se ha utilizado para detectar la presencia de edema miocárdico en las fases aguda y subaguda del infarto con secuencias específicas potenciadas en el tiempo de relajación T2. Estas secuencias permiten así diferenciar el infarto agudo del crónico101 e identificar subgrupos de pacientes con mayor riesgo durante un síndrome coronario agudo102. Las zonas edematosas evaluadas días después del evento isquémico se corresponden con el área en riesgo, como se ha validado con microesferas radiactivas en modelos animales103 y con scores angiográficos104 o SPECT105 —que muchos consideran la técnica de referencia— en humanos. El área de miocardio en riesgo definido por secuencias potenciadas en T2 es siempre mayor que el tamaño del infarto calculado mediante RTG, y de la diferencia entre ambos se obtiene el índice de miocardio salvado (figura 7). Este parámetro se ha identificado como factor independiente predictor de mortalidad y eventos cardiovasculares mayores a los 6106 y los 18107 meses del infarto. Asimismo, la determinación del tamaño del infarto, el área en riesgo y el miocardio salvado es sumamente útil en la evaluación de nuevas terapias cardioprotectoras108.
Cálculo del miocardio salvado mediante demostración del edema (A y C, cabezas de flecha) y realce tardío de gadolinio (B y D, flechas) en un modelo experimental de infarto. La fila superior muestra un animal cuyas áreas en riesgo (edema) e infartada (realce tardío de gadolinio) son similares, lo que indica escaso miocardio salvado. La fila inferior muestra otro animal cuya área en riesgo es mucho mayor que el infarto, lo que indica extenso miocardio salvado. Cortesía de los Dres. C. Santos-Gallego y J. Badimón.
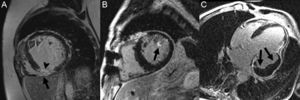
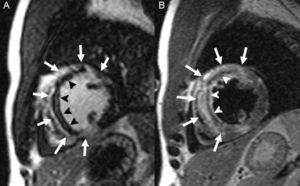
Otros aspectos relacionados con la caracterización de la escara tienen impacto pronóstico adicional al del tamaño del infarto. En relación con la reperfusión o el daño isquémico grave, puede producirse daño de la microcirculación miocárdica. Este fenómeno, denominado obstrucción microvascular o no-reflow, clásicamente se ha evaluado de manera no invasiva mediante ETT con contraste, que demuestra alteraciones en la perfusión miocárdica88. Más recientemente se ha utilizado la CRM, en la que la obstrucción microvascular se observa como un persistente defecto de perfusión en secuencias de primer paso o como una zona sin realce en el centro de la escara en las secuencias de RTG109 (figura 8A). La presencia de obstrucción microvascular es un potente predictor independiente de ausencia de recuperación de la contractilidad, remodelado adverso y eventos cardiovasculares110,111.
Asimismo, el daño isquémico microvascular puede causar, particularmente tras la reperfusión, extravasación sanguínea y hemorragia en el infarto. Esto se puede detectar mediante CRM como un área hipointensa en secuencias potenciadas en T2112 o, de manera más específica, con secuencias potenciadas en T2*113, debido a la presencia de productos de degradación de la hemoglobina (figura 8B). La hemorragia en el infarto se ha asociado también con mayor tamaño del infarto, remodelado ventricular adverso y ausencia de mejora de la contractilidad112,114.
CONFLICTO DE INTERESESNinguno.
Sección patrocinada por AstraZeneca