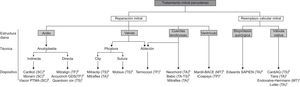
Las técnicas percutáneas para el tratamiento de la insuficiencia mitral han generado gran interés en los últimos años. La anuloplastia mitral percutánea se puede realizar por vía indirecta a través de dispositivos implantados en el seno coronario o por vía directa a través de un acceso retrógrado. Sin embargo, los resultados de la anuloplastia percutánea son todavía escasos, dispares y asociados a una alta tasa de complicaciones con algunos dispositivos. La técnica más utilizada de reparación percutánea mitral consiste en la plicatura de los velos mitrales mediante la implantación de uno o varios clips percutáneos (MitraClip) imitando la técnica quirúrgica de Alfieri. Este dispositivo, que actualmente acumula la mayor experiencia clínica, se asocia a una mejoría de la insuficiencia mitral en un alto porcentaje de pacientes bien seleccionados. Sin embargo, su eficacia se ha demostrado inferior a la de la reparación quirúrgica en el que hasta el momento es el único estudio aleatorizado (EVEREST), y se está a la espera de los resultados de nuevos estudios aleatorizados que clarifiquen qué tipo de pacientes pueden obtener mayor beneficio con esta técnica. Otros dispositivos de remodelado de ventrículo izquierdo, implantación de cuerdas tendinosas o ablación de valvas se encuentran en fase de desarrollo preclínico o primeras experiencias en humanos. Finalmente, el desarrollo de prótesis biológicas para reemplazo mitral percutáneo está en una fase incipiente, hay múltiples experiencias prometedoras en fase preclínica y las primeras experiencias en humanos proliferarán muy probablemente en un futuro próximo. Los estudios aleatorizados, sin embargo, deberán establecer el verdadero papel de esta técnica en el tratamiento de la valvulopatía mitral.
Palabras clave
La insuficiencia mitral (IM) es la enfermedad valvular más frecuente en Estados Unidos, y la segunda valvulopatía que requiere cirugía en Europa1. Su prevalencia aumenta con la edad y afecta típicamente a pacientes de 65 o más años, con lo que se espera que su prevalencia aumente en los próximos años debido al progresivo envejecimiento de la población2. El aparato valvular mitral es una estructura anatómicamente compleja3, con varios componentes (velos mitrales, músculos papilares, cuerdas tendinosas y anillo) que, junto con el ventrículo izquierdo (VI) y la aurícula izquierda, influyen en la hemodinámica valvular. La alteración de cualquiera de estos elementos puede favorecer el desarrollo de una IM. Los mecanismos de la IM se pueden clasificar en dos grandes grupos en función de la enfermedad subyacente: orgánica o primaria cuando el origen de la IM está en una alteración intrínseca de la válvula mitral (VM), y funcional o secundaria, cuando la VM es estructuralmente normal y el origen de la IM es una disfunción del VI1. La cirugía es el tratamiento de elección en la IM crónica grave y sintomática o asintomática con disfunción ventricular, fibrilación auricular de reciente comienzo o hipertensión pulmonar4,5. De hecho, hasta un 33% de los pacientes (el 62% si se trata de una IM moderada-grave) han sufrido algún evento cardiaco a los 5 años a pesar del tratamiento médico6, y muy pocos pacientes con IM grave sobreviven a largo plazo sin intervención7. A pesar de la ausencia de estudios aleatorizados, la cirugía de reparación mitral, cuando es factible, es preferible a la cirugía de reemplazo valvular mitral, ya que se ha asociado a menores mortalidad y morbilidad a corto y largo plazo, mejor preservación de la función ventricular y la posibilidad de evitar el tratamiento anticoagulante5. Sin embargo, hasta en un 49% de los pacientes con IM grave se contraindica un tratamiento quirúrgico debido a la edad, disfunción ventricular u otras comorbilidades8, y de los pacientes a los que se indica la cirugía, se realiza cirugía de reparación mitral sólo a un 34-53%9. Además, el beneficio de la cirugía en la IM funcional o isquémica, cuya prevalencia está en aumento, sigue en controversia5. En los últimos años se ha generado gran interés en el tratamiento percutáneo de la IM y se han desarrollado diversos dispositivos para la reparación percutánea de la VM y el reemplazo mitral (fig. 1). En este artículo se exponen las principales características de los dispositivos y procedimientos y los principales resultados clínicos asociados con los diferentes dispositivos destinados al tratamiento percutáneo de la valvulopatía mitral. Para ello se ha realizado una revisión de la literatura médica utilizando PubMed, EMBASE, Cochrane Library y fuentes de información por internet10–12, desde octubre de 2003 a diciembre de 2012, con los siguientes términos: «transcatheter/percutaneous mitral valve repair, transcatheter/percutaneous mitral valve replacement, transcatheter/percutaneous mitral annuloplasty, transcatheter/percutaneous and mitral regurgitation».
Clasificación de las terapias percutáneas para el tratamiento de la insuficiencia mitral. MT: minitoracotomía; SC: seno coronario; TA: transapical; TF: transfermoral; TP: transpericárdico; TS: transeptal. aDispositivos con aprobación de la Unión Europea para uso clínico. bDispositivos con primeras experiencias en humanos. cDispositivos en fase preclínica.
El tratamiento percutáneo de reparación de la VM se basa en los mismos principios que la cirugía mitral (resección parcial de los velos, plicatura de velos, anuloplastia, modificación papilar o reemplazo cordal y remodelado del VI), y existe una técnica percutánea equivalente a las técnicas quirúrgicas.
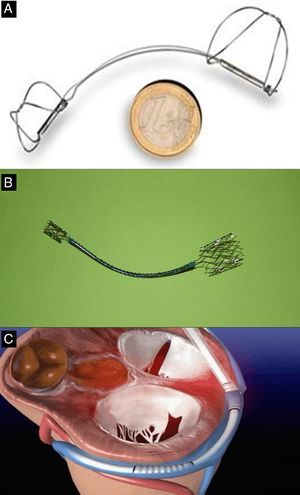
AnuloplastiaAnuloplastia indirecta a través del seno coronarioEsta técnica trata de imitar el efecto del anillo de anuloplastia quirúrgico implantando un dispositivo dentro del seno coronario (SC) que genera una tensión de acortamiento que se transmite por proximidad al anillo mitral. Los tres dispositivos que se han usado en humanos son el sistema Carillon (Cardiac Dimension; Kirkland, Washington, Estados Unidos), Monarc, antiguamente Viking (Edwards Lifesciences; Irvine, California, Estados Unidos) y Viacor PTMA (Viacor; Wilmington, Massachusetts, Estados Unidos) (fig. 2). En la tabla 1 se resumen los principales resultados obtenidos con estos dispositivos.
Dispositivos de anuloplastia percutánea indirecta. A: Carillon. B: Monarc. C: Viacor. Cortesía de los Dres. David Reuter (Seattle Children's Hospital, Seattle, Estados Unidos) (A), Jan Harnek (Skane University Hospital, Suecia) (B) y Stefan Sack (Academic General Hospital, Múnich, Alemania) (C).
Resultados con los dispositivos de anuloplastia indirecta
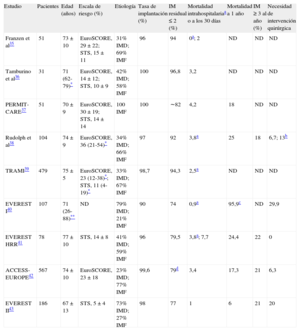
| Estudio | Dispositivo | Pacientes | Edad (años) | Escala de riesgo | Etiología | Tasa de implantación (%) | Reducción aguda de IM ≥ 1 (%) | Reducción del volumen regurgitante a los 6-12 meses (ml) | Reducción de la vena contracta a los 6-12 meses (mm) | Mortalidad a los 30 días | Mortalidad a 1 año |
| AMADEUS13 | Carillon | 48 | 64 (25-81)* | ND | 100% IMF | 62,5a | ND | 10,8b | 0,18 | 2,2 | ND |
| TITAN14 | Carillon | 53 | 62 ± 13 | ND | 100% IMF | 68 | ND | 14,3b | 0,23 | 1,9 | 22,6 |
| Webb et al15 | Viking | 5 | 67 ± 10 | ND | 100% IMF | 80 | 75b | ND | ND | 0 | 20 |
| EVOLUTION I16 | Monarc | 72 | 70 ± 10 | ND | 100% IMF | 82 | 93b | 8,8b | ND | 2,7 | 11,1 |
| Sack et al17 | Viacor PTMA | 27 | 70 ± 9 | ND | 100% IMF | 70,4 | 68b | ND | ND | 0a | ND |
IM: insuficiencia mitral; IMF: insuficiencia mitral funcional; ND: no disponible.
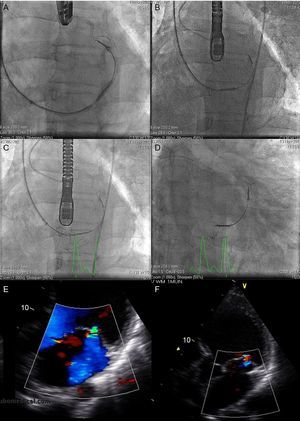
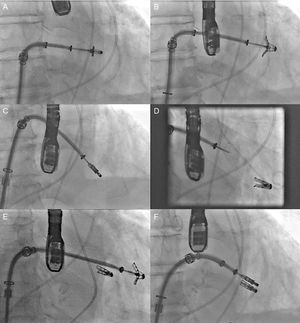
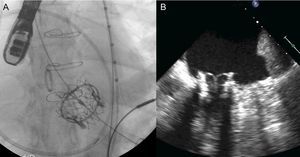
El sistema Carillon (fig. 2A) es un sistema autoexpandible de anclajes distal y proximal conectados con un cable de nitinol. Estos se posicionan y se liberan en la vena cardiaca magna y el SC proximal, respectivamente, mediante la punción de la vena yugular y un catéter (9 Fr) especialmente diseñado para su posicionamiento. Una vez implantado el anclaje distal, se aplica tracción manual en el sistema de liberación del dispositivo para regular el grado de contracción del anillo (fig. 3). En el estudio AMADEUS se evaluó la factibilidad, la seguridad y la eficacia de este dispositivo en pacientes con IM funcional secundaria a miocardiopatía dilatada13. De los 48 pacientes incluidos en el estudio, 18 (37,5%) no recibieron el dispositivo por dificultades de acceso (n=5), imposibilidad de liberar el dispositivo en una posición adecuada (n=3), ausencia de reducción de la IM (n=4) o deterioro coronario (n=6). En los pacientes con implantación exitosa del dispositivo, se observó mejoría en las dimensiones ventriculares y la capacidad funcional a los 6 meses. La tasa de complicaciones periprocedimiento fue del 13% (mortalidad, 2,2%; infarto de miocardio, 6,5%; perforación/disección del SC, 6,5%). Recientemente se han publicado los resultados del estudio TITAN, en el que se implantó el dispositivo Carillon a 53 pacientes; tuvo que ser retirado una vez implantado a 17 (32%) de ellos por obstrucción coronaria (n=8) o ausencia de reducción de la IM (n=9)14. Se observó una reducción significativa del volumen regurgitante y las dimensiones del VI en los pacientes con implantación definitiva del dispositivo y mejoría clínica persistente a los 2 años de seguimiento. Durante el seguimiento se observaron fracturas del dispositivo en el 25% de los pacientes. Datos preliminares del estudio TITAN II18, actualmente en curso, destacan una tasa de implantación del dispositivo exitosa más alta (∼80%) y una reducción de la incidencia de fracturas del dispositivo en comparación con el estudio previo (TITAN). Hasta el momento, el Carrillon es el único dispositivo de anuloplastia percutánea que ha recibido la aprobación de la Unión Europea, y el registro PRIME, que representa la experiencia inicial poscomercialización de este dispositivo, está actualmente en curso.
Secuencia fluoroscópica de implantación del dispositivo Carillon y resultado ecocardiográfico. A: implantación del anclaje distal. B: aplicación de tensión al sistema con cambio en el tamaño del anillo y la configuración del catéter. C: implantación del anclaje proximal para asegurar la tensión del sistema. D: dispositivo liberado. E: insuficiencia mitral antes del procedimiento. F: insuficiencia mitral tras el procedimiento. Cortesía del Dr. David Reuter (Seattle Children's Hospital, Seattle, Estados Unidos).
El dispositivo Monarc se implanta de modo similar en el SC mediante un catéter guía que permite su posicionamiento. Consta de tres secciones (fig. 2B): anclajes autoexpandibles proximal y distal y un puente entre ambos a modo de muelle, con una parte de material reabsorbible, que se acorta a medida que este material desaparece en unos 1-2 meses. El anclaje distal se posiciona en la vena interventricular anterior y el proximal, en el ostium del SC, y abarca mayor longitud de la circunferencia del anillo mitral que otros sistemas de anuloplastia percutánea. El efecto agudo del dispositivo se valora durante el procedimiento, y se puede retirarlo si el resultado no es óptimo. Sin embargo, una vez liberado el dispositivo, el resultado se debe evaluar tras la reabsorción del material del muelle, un proceso que tiene lugar en un lapso de varias semanas. No existe ningún método para predecir la respuesta subaguda del dispositivo. Experiencias iniciales con la primera versión del dispositivo (Viking) demostraron una reducción significativa (1-2 grados) de la IM, pero con un porcentaje alto (60%) de fracturas en la zona del puente15. En una versión más reciente del dispositivo llamada Monarc, se ha reforzado la zona del puente para evitar fracturas. El dispositivo Monarc se utilizó en pacientes con miocardiopatía dilatada (isquémica o idiopática) e IM ≥ 2 en el estudio EVOLUTION I16. La tasa de implantación del dispositivo exitosa fue del 82% (a 13 de 79 pacientes, no se les pudo implantar, principalmente por dificultades debidas a variaciones anatómicas del SC), y se observó una mejoría de al menos 1 grado de IM al año de seguimiento en el 50% de los pacientes. Un 30% (15 de 50) de los pacientes con seguimiento angiográfico tuvieron como complicación una compresión coronaria (arteria circunfleja o rama diagonal de la descendente anterior en todos los casos), que se complicó con infarto clínico en 2 pacientes (4%). No se observaron fracturas en la zona del puente, pero un 8% de los pacientes sufrieron fractura en la zona del anclaje proximal al puente, asintomática en todos los casos. Tras suspenderse el estudio EVOLUTION II por la baja tasa de inclusión de pacientes, este dispositivo ha dejado de producirse.
El dispositivo Viacor PTMA emplea un mecanismo diferente, sin necesidad de englobar y contraer todo el anillo mitral. Mediante un sistema de liberación (7 Fr) de tres luces posicionado en el SC, se colocan simultáneamente hasta tres varillas de nitinol de longitud y rigidez variables en las zonas central y posterior del anillo mitral, con lo que se logra una disminución de la dimensión septolateral (fig. 2C). Durante el procedimiento, se puede ir añadiendo varillas hasta obtener el grado de compresión y reducción de la IM deseado. Una ventaja potencial de este dispositivo es que se puede sustituir las varillas por otras más rígidas o recuperarlas en un segundo procedimiento si hubiera alguna complicación (p. ej., obstrucción coronaria) o falta de eficacia. La implantación en humanos ha sido factible, pero con una tasa de éxito < 50% (33-45%)17,19.
Existen varias limitaciones comunes a los tres dispositivos. El estrés mecánico del SC probablemente sea mayor que el que se había estimado, y se han comunicado numerosos casos de fracturas de los dispositivos por fatiga del metal. Se necesitan estudios con mayor número de pacientes y seguimientos más largos para determinar si las fuerzas de torsión que se generan en el SC continúan siendo un problema para la integridad de estos dispositivos a largo plazo. Una segunda limitación es la compresión extrínseca de una arteria coronaria. El SC cruza alguna rama diagonal en el 16% de los pacientes o la arteria circunfleja y/o sus ramas marginales en un 60-80%20–22. Con el dispositivo Carillon, esta compresión se puede evaluar durante el procedimiento y ajustar en consecuencia las fuerzas de tensión, o incluso retirar el dispositivo. Sin embargo, con el sistema Monarc, no se puede evaluar las fuerzas de compresión hasta pasadas algunas semanas tras el acortamiento completo del dispositivo. Aunque el sistema Viacor PTMA no engloba toda la circunferencia mitral, también se han descrito casos de compresión coronaria23. Por último, hay gran variabilidad interindividual en la distancia del SC con el anillo mitral, que es incluso mayor en pacientes con IM grave por dilatación del anillo20, lo que disminuye la eficacia de estos dispositivos. A pesar de estas limitaciones, la anuloplastia indirecta a través del SC continúa siendo un abordaje de interés para el tratamiento percutáneo de la IM, especialmente si se considera la simplicidad de la técnica por su fácil acceso a la estructura mitral.
Con el objetivo de solucionar algunas estas limitaciones, se ha desarrollado la técnica percutánea de cerclaje del anillo mitral, hasta ahora sólo probada en modelos animales. El principio consiste en crear, mediante una guía de angioplastia coronaria (0,014”), un bucle alrededor del anillo mitral, que posteriormente se sustituye por una sutura, y un dispositivo de nitinol con forma de arco rígido, que se implanta igualmente en el SC para evitar la compresión coronaria. Inicialmente la guía se introduce a través del SC, la gran vena cardiaca y la primera septal perforante para llegar a cavidades derechas, donde se captura y posteriormente se sustituye por una sutura y un dispositivo de fijación-presión. La sutura constriñe el anillo mitral y el tracto de salida del VI. En un modelo animal de IM de origen isquémico, se consiguió implantar el dispositivo con éxito en el 88% de los casos, y se logró un acortamiento agudo de la distancia septolateral sin modificaciones en las dimensiones del tracto de salida y una disminución de la IM y los volúmenes ventriculares24. No obstante, a pesar de que este dispositivo potencialmente supera las limitaciones de las variaciones anatómicas del SC y la compresión coronaria con resultados iniciales prometedores, falta demostrar su factibilidad, su seguridad y su eficacia en humanos.
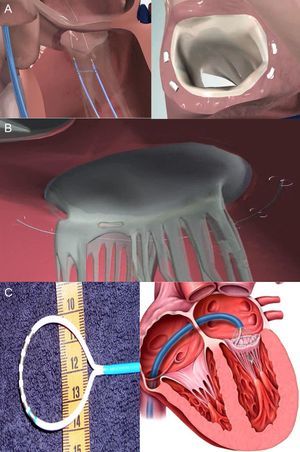
Anuloplastia directaEsta técnica también pretende salvar las limitaciones de la anuloplastia indirecta, a través de un acceso directo del anillo mitral, siguiendo el mismo principio del anillo de anuloplastia quirúrgico. Sin embargo, el acceso directo es más complejo técnicamente que a través del SC. Gracias a un acceso retrógrado por la arteria femoral, se coloca el catéter en el VI por debajo del velo mitral posterior para acceder al anillo mitral. Existen dos dispositivos con resultados de primeras experiencias en humanos, el Mitralign (Mitralign; Tewksbury, Massachusetts, Estados Unidos) y el Accucinch GDS (Guided Delivery Systems; Santa Clara, California, Estados Unidos).
El sistema Mitralign consta de dos anclajes que se colocan directamente en la porción posterior del anillo mitral y se conectan mediante una sutura que permite regular la distancia entre los anclajes (fig. 4A), con lo que se consiguen reducciones de 1-3cm de la circunferencia mitral25. El estudio prospectivo ALIGN (Mitralign Percutaneous Annuloplasty System for Chronic Functional Mitral Valve Regurgitation) (ClinicalTrials.gov: NCT01740583), actualmente en curso, pretende estudiar la factibilidad y la seguridad del dispositivo en 50 pacientes con IM ≥ 2 y disfunción ventricular (fracción de eyección, 20-45%). El segundo sistema de anuloplastia directa es el Accucinch GDS (fig. 4B), que utiliza 9-12 anclajes de nitinol alrededor del anillo mitral conectados por una sutura para ejercer tensión entre ellos. Se han presentado recientemente los primeros casos en humanos por vía percutánea con abordaje transfemoral26. Por último, el sistema QuantumCor (QuantumCor; Lake Forest, California, Estados Unidos) consiste en una sonda circular con electrodos térmicos, que inducen cicatrización y acortamiento anular tras una ablación con radiofrecuencia en diferentes puntos del anillo mitral (fig. 4C). Se avanza por vía transeptal y su uso se ha probado en modelos animales27.
La anuloplastia directa tiene la ventaja de evitar la compresión coronaria y el potencial de una mayor reducción del grado de IM. Sin embargo, la técnica es mucho más complicada que la utilizada en la anuloplastia indirecta, y hasta el momento hay muy poca información sobre el efecto mecánico de estos dispositivos en la VM.
Plicatura de velos o técnica «borde con borde»: MitraClipEsta técnica se basa en el método descrito por Alfieri et al28 en 1992, consistente en la realización de una sutura de los velos anterior y posterior que restablece la coaptación valvular y crea una VM con doble orificio. Habitualmente la plicatura se realiza en la porción central de cada velo (segmentos A2 y P2), aunque también se ha descrito la aproximación de los bordes de la comisura. La técnica de Alfieri se efectúa generalmente junto con una anuloplastia, aunque la eficacia y la durabilidad de los resultados también se han probado en una pequeña serie de pacientes con 12 años de seguimiento29.
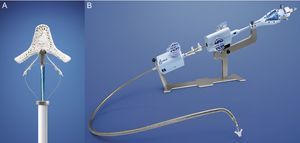
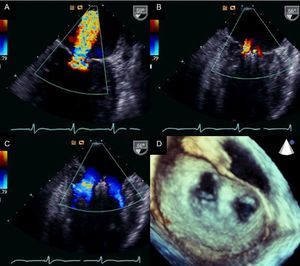
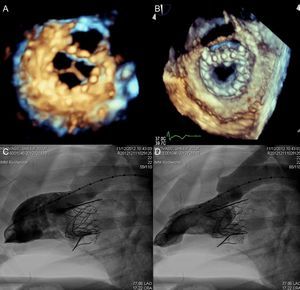
La técnica percutánea con el sistema MitraClip (Abbot Vascular; Abbot Park, Illinois, Estados Unidos) simula la técnica quirúrgica de Alfieri. El dispositivo consiste en un clip o grapa de cromo-cobalto, de 4 mm de ancho, con dos brazos articulados cuyo ángulo varía entre 0° (posición cerrada) y 240° (posición abierta) y que permiten pinzar y aproximar las valvas anterior y posterior (fig. 5). En la porción interior de los brazos existen pequeños ganchos (o púas) que aseguran un anclaje adecuado de las valvas una vez cerrado el dispositivo (fig. 5A). La parte externa está recubierta de una malla de poliéster para promover el crecimiento tisular y la formación de un puente de tejido fibroso entre ambas valvas. La liberación del dispositivo se realiza mediante un catéter guía de 24 Fr y con una punta móvil dirigible para posicionar el clip (fig. 5B). El catéter guía dispone de dos mandos (knobs) que controlan la dirección anteroposterior y mediolateral de la punta del catéter, y permiten a su vez la apertura, el cierre y la liberación del clip. El procedimiento se realiza generalmente con anestesia general guiado por fluoroscopia y ecocardiografía transesofágica (ETE), aunque se han descrito casos con anestesia local y sedación30,31. Se precisa un acceso venoso femoral con punción transeptal para acceder a la aurícula izquierda (fig. 6A). Tras alcanzar el orificio mitral, el clip se abre parcialmente para atravesar la VM y entrar en el VI. Tras abrir el clip en la cavidad ventricular, el sistema se retira hasta pinzar los dos velos mitrales (fig. 6B) y cerrarlo posteriormente (fig. 6C). En este punto, es trascendental realizar una evaluación rigurosa por ETE de la localización del pinzado en los velos y la magnitud de la IM residual. Si el resultado es óptimo, se libera el clip (fig. 6D) y se realiza una segunda evaluación de la IM. En caso de que el resultado fuera subóptimo (ausencia de disminución de la IM, aparición de estenosis mitral significativa), se puede reabrir el clip para reposicionarlo. Si después de varios intentos el resultado continúa sin ser el deseado, se puede retirar el clip completamente. Otra alternativa en caso de IM residual significativa tras implantación de un primer clip consiste en implantar un segundo clip para reducir el grado de IM residual (figs. 6E y F). Al igual que en la cirugía de reparación mitral32, la ETE durante el procedimiento es esencial para valorar la eficacia del dispositivo. La figura 7 muestra un ejemplo de la IM antes y después del procedimiento y una imagen de ETE tridimensional de la VM de doble orificio tras la implantación del MitraClip.
Secuencia fluoroscópica de implantación del dispositivo MitraClip. A: avance hasta el orificio mitral. B: apertura de las pinzas en la cavidad ventricular izquierda. C: retirada y cierre de las pinzas para plicar los dos velos mitrales. D: liberación del dispositivo. E: avance y apertura de un segundo dispositivo. F: implante de un segundo dispositivo MitraClip. Cortesía del Dr. Ted Feldman (Evanston Hospital, Evanston, Illinois, Estados Unidos).
Imágenes de ecocardiografía transesofágica antes y después de implantar el dispositivo MitraClip. A: insuficiencia mitral previa a la implantación. B: insuficiencia mitral tras la implantación. C y D: válvula de doble orificio por ecocardiografía transesofágica bidimensional y tridimensional. Cortesía de los Dres. Howard Herrmann y Frank E. Silvestry (Hospital of the University of Pennsylvania, Pennsylvania, Estados Unidos).
Un segundo sistema de plicatura percutánea de los velos mitrales es el dispositivo Mobius (Edwards Lifesciences, Inc.; Irvine, California, Estados Unidos), que también se implanta por vía transeptal y utiliza una sutura directa para la plicatura de las valvas. Aunque estudios en modelos animales demostraron la factibilidad del sistema, su desarrollo se interrumpió después de los primeros implantes en humanos por dificultades técnicas, imágenes de fluoroscopia subóptimas y dehiscencia de suturas33,34. Por último, el sistema MitraFlex (TransCardiac Therapeutics; Atlanta, Georgia, Estados Unidos), todavía en estudios preclínicos, utiliza un clip por vía transapical, con la posibilidad de implantar una cuerda tendinosa artificial en el mismo procedimiento.
El MitraClip es el dispositivo que acumula la evidencia científica más extensa sobre el tratamiento percutáneo de la IM y es el único dispositivo probado para el tratamiento de la IM orgánica o degenerativa. Este dispositivo tiene la aprobación de la Unión Europea desde 2008, y ya se han implantado más de 6.000 dispositivos en todo el mundo. Varias series de casos35–38 y registros multicéntricos39–42 que incluyen a un número considerable de pacientes y un ensayo clínico aleatorizado43 respaldan la comercialización y el uso clínico de este dispositivo. Los principales resultados de estos estudios se muestran en la tabla 2.
Resultados con el dispositivo MitraClip
| Estudio | Pacientes | Edad (años) | Escala de riesgo (%) | Etiología | Tasa de implantación (%) | IM residual ≤ 2 (%) | Mortalidad intrahospitalariaa o a los 30 días | Mortalidad a 1 año | IM ≥ 3 al año (%) | Necesidad de intervención quirúrgica |
| Franzen et al35 | 51 | 73 ± 10 | EuroSCORE, 29 ± 22; STS, 15 ± 11 | 31% IMD; 69% IMF | 96 | 94 | 0a; 2 | ND | ND | ND |
| Tamburino et al36 | 31 | 71 (62-79)* | EuroSCORE, 14 ± 12; STS, 10 ± 9 | 42% IMD; 58% IMF | 100 | 96,8 | 3,2 | ND | ND | ND |
| PERMIT-CARE37 | 51 | 70 ± 9 | EuroSCORE, 30 ± 19; STS, 14 ± 14 | 100 IMF | 100 | ∼82 | 4,2 | 18 | ND | ND |
| Rudolph et al38 | 104 | 74 ± 9 | EuroSCORE, 36 (21-54)* | 34% IMD; 66% IMF | 97 | 92 | 3,8a | 25 | 18 | 6,7; 13b |
| TRAMI39 | 479 | 75 ± 5 | EuroSCORE, 23 (12-38)*; STS, 11 (4-19)* | 33% IMD; 67% IMF | 98,7 | 94,3 | 2,5a | ND | ND | ND |
| EVEREST I40 | 107 | 71 (26-88)** | ND | 79% IMD; 21% IMF | 90 | 74 | 0,9a | 95,9c | ND | 29,9 |
| EVEREST HRR41 | 78 | 77 ± 10 | STS, 14 ± 8 | 41% IMD; 59% IMF | 96 | 79,5 | 3,8a; 7,7 | 24,4 | 22 | 0 |
| ACCESS-EUROPE42 | 567 | 74 ± 10 | EuroSCORE, 23 ± 18 | 23% IMD; 77% IMF | 99,6 | 79d | 3,4 | 17,3 | 21 | 6,3 |
| EVEREST II43 | 186 | 67 ± 13 | STS, 5 ± 4 | 73% IMD; 27% IMF | 98 | 77 | 1 | 6 | 21 | 20 |
IM: insuficiencia mitral; IMD: insuficiencia mitral degenerativa o mixta; IMF: insuficiencia mitral funcional; ND: no disponible; STS: escala de riesgo de la Society of Thoracic Surgeons.
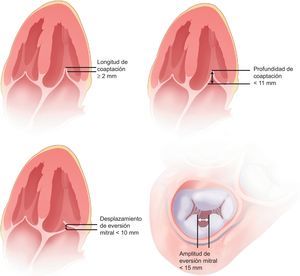
La cohorte EVEREST40 es un registro prospectivo multicéntrico que analizó factibilidad, seguridad y eficacia del dispositivo MitraClip en pacientes con IM moderada-grave (3+) o grave (4+) con indicación quirúrgica de clase I. Los principales criterios de inclusión y exclusión se resumen en la tabla 3. Se incluyó a un total de 107 pacientes (55 del EVEREST I y 52 de la fase de prealeatorización del EVEREST II), con un seguimiento medio de casi 2 años. Todos los ecocardiogramas fueron evaluados en un laboratorio central de ecocardiografía y se establecieron los siguientes criterios anatómicos para la selección de pacientes (fig. 8): origen del jet de IM en los segmentos A2 y P2, distancias de coaptación mínima de 2 mm y máxima de 11 mm, en caso de eversión de un velo mitral con un desplazamiento < 10 mm y una anchura < 15 mm, y área mitral >4cm2. El objetivo primario fue obtener una IM residual ≤ 2 a los 30 días tras la implantación de al menos un clip. El objetivo combinado de eficacia se definió como la ausencia de IM > 2, necesidad de cirugía por disfunción valvular o muerte a los 12 meses. Finalmente, con el objetivo de evaluar la seguridad del dispositivo, se registraron prospectivamente todos los efectos adversos (incluida la mortalidad) a los 30 días y a los 12 meses.
Criterios de inclusión y exclusión del estudio EVEREST
| Criterios de inclusión |
| Candidato a cirugía de reparación o reemplazo valvular mitral |
| Insuficiencia mitral moderada-grave (grado 3) o grave (grado 4) y síntomas con FEVI >25% y DSVI ≥55mm o asintomático con al menos uno de los siguientes criterios: |
| • FEVI entre el 25 y el 60% |
| • DSVI entre 40 y 55mm |
| • Fibrilación auricular de reciente comienzo |
| • Hipertensión pulmonar definida como presión sistólica de la arteria pulmonar >50mmHg en reposo o >60mmHg en esfuerzo |
| Criterios de exclusión |
| Infarto de miocardio reciente |
| Cualquier procedimiento invasivo en los 30 días previos |
| Área valvular mitral <4,0cm2 |
| Insuficiencia renal, endocarditits, enfermedad reumática |
| Cirugía mediastínica previa (en los primeros 27 pacientes) |
DSVI: diámetro sistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo.
Criterios anatómicos requeridos para el implante del MitraClip en el estudio EVEREST. Modificada de Feldman et al40, con permiso.
El 79% de los pacientes incluidos presentaban IM degenerativa o degenerativa-funcional y el 21%, IM funcional. La tasa de implantación del clip fue del 90%, y se implantaron 2 clips en un 29% de los casos. En 11 pacientes (10%) no se llegó a implantar el dispositivo (8 por ausencia de mejoría de la IM y 3 por complicaciones durante la punción transeptal). La tasa de éxito del procedimiento (IM ≤ 2) fue del 74%. Del subgrupo de pacientes tratados con éxito, el 77% tenía IM < 2 al alta hospitalaria y el 66% se mantenía libre de muerte, IM > 2 o cirugía mitral al año de seguimiento. La clase funcional y los síntomas mejoraron en el 74% de los pacientes, y los resultados fueron similares en la IM degenerativa y funcional. En cuanto a la seguridad del tratamiento, no hubo muertes durante el procedimiento y 10 pacientes (9,3%) habían sufrido un evento adverso a los 30 días: muerte (n=1), ictus (n=1), cirugía no electiva (n=2), transfusiones (n=4), necesidad de reintervención por disfunción del dispositivo (n=1) y necesidad de reintubación (n=1). No hubo ningún caso de embolización del clip o estenosis mitral significativa, pero un 9% de los pacientes presentaron desprendimiento parcial del clip, que se trató mediante cirugía en la mayoría de casos.
Esta primera experiencia inicial con el dispositivo MitraClip permitió establecer que:
- •
Es una técnica segura, con un tasa de complicaciones periprocedimiento baja.
- •
Es una técnica con una eficacia aceptable en casos bien seleccionados, y consigue una reducción significativa de la IM en más de dos tercios de los pacientes.
- •
La cirugía sigue siendo una alternativa en caso de fallo del tratamiento.
- •
Una evaluación rigurosa de la anatomía mitral es esencial para la selección de los pacientes y la obtención de buenos resultados.
El estudio EVEREST II es un ensayo clínico multicéntrico y aleatorizado diseñado para comparar la eficacia y la seguridad del tratamiento percutáneo con MitraClip frente a la cirugía convencional de reparación o reemplazo valvular mitral43. Los criterios de inclusión y exclusión son idénticos a los del EVEREST I (tabla 3). Los estudios ecocardiográficos también se analizaron de manera centralizada en un laboratorio independiente de ecocardiografía. Los pacientes fueron aleatorizados 2:1 a terapia percutánea frente a cirugía. El objetivo primario de eficacia se definió como ausencia de muerte, cirugía por disfunción mitral o IM de grado 3-4 al año de seguimiento. El objetivo primario de seguridad a los 30 días era el mismo que en el EVEREST I.
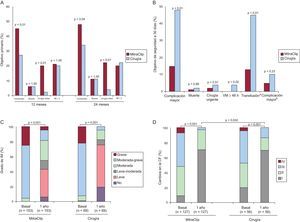
Se incluyó a un total de 258 pacientes con IM ≥ 3 (el 27% funcional y el 73% degenerativa), 178 en el brazo de MitraClip y 80 en cirugía. En total, 41 pacientes (23%) del grupo de MitraClip tenían IM de grado 3-4 al alta hospitalaria, y se remitió para cirugía a 28 (16%) de ellos. En el grupo quirúrgico, los 80 pacientes tenían IM ≤ 2 al alta hospitalaria. En el análisis por intención de tratar, un 55% de los pacientes con MitraClip cumplían el objetivo de eficacia al año de seguimiento (libres de muerte, cirugía por disfunción mitral o IM de grado 3-4), frente al 73% del grupo quirúrgico (p=0,007) (fig. 9A). No hubo diferencias en la tasa de mortalidad ni en la IM de grado 3-4 a los 12 meses de seguimiento. Sin embargo, el MitraClip se asoció a una mayor tasa de necesidad de cirugía por disfunción mitral (MitraClip, 20%; cirugía, 2,2%; p < 0,001) (fig. 9A). Se intervino quirúrgicamente al 21% de los pacientes del grupo de MitraClip por no implantarse el dispositivo (n=17), IM de grado 3-4 tras el implante del dispositivo durante el ingreso hospitalario (n=5), IM de grado 3-4 tras el implante del dispositivo durante el seguimiento (n=3), IM de grado 3-4 tras el implante del dispositivo en un único velo (n=9) y persistencia de los síntomas (n=3). Las diferencias en el objetivo primario con el grupo quirúrgico se mantenían a los 2 años de seguimiento (fig. 9A).
Resumen de los resultados principales del estudio aleatorizado EVEREST II. A: objetivo primario. B: objetivo de seguridad a 30 días. C: grado de insuficiencia mitral. D: cambios en la clase funcional. CF: clase funcional; IM: insuficiencia mitral; VM: ventilación mecánica. En la figura B complicación mayor incluye muerte, infarto, ictus, cirugía por disfunción mitral, cirugía urgente, fallo renal, infección de la herida quirúrgica, ventilación mecánica > 48 h, complicación gastrointestinal que requiera cirugía, fibrilación auticular de reciente comienzo, septicemia, y transfusión ≥ 2 concentrados. aTransfusión ≥ 2 concentrados de hematíes; bExcluyendo transfusión.
El MitraClip se asoció a menor tasa de eventos adversos mayores (el 15 frente al 48%; p < 0,001) a los 30 días, principalmente debido a las mayores tasas de transfusiones en el grupo quirúrgico (el 45 frente al 13%; p < 0,001) y necesidad de intubación > 48 h (el 4% frente a 0; p=0,02). No hubo diferencias en la tasa de mortalidad, ictus, infarto o necesidad de cirugía cardiaca urgente (fig. 9B). No se produjeron embolizaciones del dispositivo. Al año de seguimiento, en el análisis por intención de tratar, se observaba una reducción significativa del grado de IM en ambos grupos (p < 0,001), aunque era mayor en el grupo quirúrgico (fig. 9C). En las figuras 9C y D se resumen el grado de IM y la clase funcional al año de seguimiento en ambos grupos de tratamiento. En el análisis por subgrupos, los mejores resultados en el grupo MitraClip se obtuvieron en pacientes mayores (70 o más años), IM funcional y fracción de eyección baja.
El ensayo EVEREST II demostró que:
- •
La terapia percutánea con dispositivo MitraClip es efectiva en la reducción de la IM en la mayoría (77%) de los casos. Sin embargo, aunque el dispositivo se asocia a una tasa de complicaciones periprocedimiento menor que con cirugía (mejor perfil de seguridad), su eficacia es claramente inferior.
- •
En la mayoría de los casos en que no se consigue una reducción significativa de la IM con el dispositivo MitraClip, la opción quirúrgica todavía es factible.
- •
El MitraClip puede ser una opción terapéutica alternativa a la cirugía para pacientes seleccionados y con características anatómicas apropiadas.
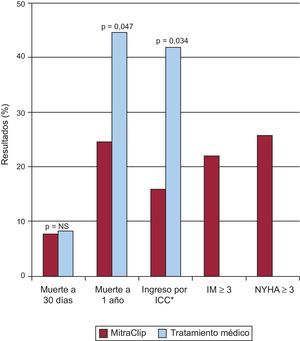
El registro EVEREST-HRR de alto riesgo incluyó a 78 pacientes con IM moderada-grave o grave con un riesgo quirúrgico estimado ≥ 12% (basado en la escala de riesgo de la Society of Thoracic Surgeons o en la estimación del equipo quirúrgico)41. La selección de pacientes se basó en los mismos criterios ecocardiográficos que el ensayo aleatorizado, y se utilizó como grupo control a otros 36 pacientes que no cumplían estos criterios. El 96% de los pacientes recibieron al menos 1 MitraClip; se manejó de manera conservadora al 86% de los pacientes del grupo control y con cirugía al 14%.
La mortalidad a los 30 días era del 7,7% en el grupo de tratamiento percutáneo, frente al 8,3% en el grupo control (diferencias no significativas) (fig. 10). Al año de seguimiento, la supervivencia era mayor en el grupo de intervención (el 76,4 frente al 55,3%; p=0,047), con una disminución de la tasa de hospitalización por insuficiencia cardiaca del 45% (p=0,034). Los pacientes con IM tanto funcional como degenerativa mejoraron con MitraClip la clase funcional, la calidad de vida y las dimensiones ventriculares a los 30 días y al año. Este estudio continúa la inclusión de pacientes como parte del registro REALISM (clinicaltrials.gov:NCT00209274), que consta de dos brazos: uno de pacientes de alto riesgo (en fase de reclutamiento) y otro de riesgo no alto, con más de 650 pacientes incluidos actualmente.
Registro europeo: ACCESS-EUROPEEn la primera fase del registro europeo ACCESS-EUROPE se incluyó a 567 pacientes con IM significativa en 14 centros de cuatro países europeos (Alemania, Dinamarca, Italia y Suiza)42. No se estipuló ningún criterio predefinido de inclusión o exclusión, por lo que representa un registro de aplicación de esta técnica a la «vida real». El 86% de los pacientes completaron el año de seguimiento. Los pacientes eran más añosos y tenían un perfil de riesgo mayor que los incluidos en el estudio EVEREST II, y la tasa de IM funcional era del 77% (tabla 2). Se implantó con éxito al menos un dispositivo MitraClip en el 99,6% (≥ 2 dispositivos en el 39%) de los pacientes. A los 12 meses de seguimiento, se mantenía una IM ≤ 2 en el 79% de los casos. La mortalidad a los 30 días fue del 3,4%, y las tasas de ictus, insuficiencia renal aguda y taponamiento cardiaco, el 0,7, el 4,8 y el 1,1% respectivamente. La mortalidad al año de seguimiento fue del 18,2%. No se produjeron embolizaciones del dispositivo, y hubo desprendimiento parcial en el 4,8% de los casos. Las tasas de intervención quirúrgica y reintervención percutánea en el primer año fueron el 6,3 y el 3,4% respectivamente. Al año de seguimiento había una mejora significativa en la clase funcional (el 72% con clasificación de la New York Heart Association ≤ 2 al año de seguimiento), la calidad de vida y la distancia recorrida en el test de 6 min de marcha.
Selección de pacientes para implantación del dispositivo MitraClipLa evidencia clínica de los diferentes registros multicéntricos y un estudio aleatorizado demuestran que el dispositivo MitraClip se puede implantar con relativa seguridad en una población diversa en cuanto a riesgo quirúrgico y tipo de afección mitral35–43. En comparación con el estudio EVEREST II, los registros EVEREST HRR y ACCESS-EUROPE incluyeron a pacientes de mayor riesgo y una mayor proporción de IM funcional. Los criterios anatómicos determinados por ETE se definieron rigurosamente en el estudio EVEREST (fig. 8), pero la experiencia europea ha demostrado que el dispositivo MitraClip se puede implantar con éxito en casos con anatomía mitral más compleja. Aunque futuros estudios tendrán que redefinir los criterios anatómicos aceptables para la implantación exitosa del dispositivo MitraClip, las dos principales limitaciones de este son que puede producir estenosis mitral y la capacidad para pinzar con éxito los dos velos de la VM. Por ello, la selección de los posibles candidatos para MitraClip está enormemente influida por criterios clínicos (riesgo quirúrgico), etiología de la disfunción valvular, anatomía valvular y calidad de imagen por ETE. En pacientes con IM degenerativa, los criterios anatómicos del estudio EVEREST son predictores importantes de éxito del procedimiento. MitraClip representa, pues, una alternativa al tratamiento quirúrgico para pacientes con IM degenerativa, criterios anatómicos favorables y alto riesgo quirúrgico. En caso de anatomía subóptima y alto riesgo quirúrgico, el MitraClip podría estar indicado para pacientes seleccionados. Para los pacientes con IM funcional grave y sintomática refractaria a tratamiento médico, el MitraClip puede considerarse como primera opción terapéutica en pacientes de edad avanzada y con comorbilidades (riesgo quirúrgico muy elevado o prohibitivo). En el estudio COAPT (clinicaltrials.gov: NCT01626079) se espera incluir a 420 pacientes con alto riesgo quirúrgico e IM funcional ≥ 3 aleatorizados 1:1 a la implantación de MitraClip frente a tratamiento médico estándar44. Los resultados de este estudio determinarán verdaderamente la eficacia de este dispositivo para el tratamiento de la IM grave funcional en pacientes no operables.
La amplia experiencia clínica acumulada con el dispositivo MitraClip evidencia su eficacia en la reducción de la IM en un alto porcentaje de casos, lo que se traduce en una mejora significativa de la capacidad funcional en la mayoría de los pacientes. No obstante, se debe considerar una serie de limitaciones potenciales en relación con este dispositivo:
- •
Los resultados de la técnica de Alfieri sin anuloplastia coadyuvante han sido subóptimos, con una tasa importante de recurrencia de IM y necesidad de reintervención a largo plazo, principalmente en IM isquémica o calcificación anular importante. De hecho, estudios in vitro han demostrado que la eficacia de MitraClip como único tratamiento es menor que cuando se acompaña de anuloplastia debido al efecto negativo de la dilatación del anillo45.
- •
Cuantificar la IM durante los efectos de la anestesia general es difícil46,47, y a veces es un reto diferenciar el efecto de la anestesia general y el del MitraClip en el grado de IM residual, por otra parte clave para evaluar la eficacia del dispositivo. De hecho, aproximadamente 1 de cada 5 pacientes incluidos en el estudio EVEREST II no mejoró el grado de IM tras la implantación del MitraClip.
- •
La implantación del MitraClip puede generar estenosis mitral, aunque hasta el momento no se han descrito casos de estenosis significativa48.
- •
Los criterios anatómicos de selección de pacientes han sido relativamente estrictos (especialmente en el estudio EVEREST), y hasta ahora sólo se ha demostrado su utilidad en la IM de jet central, lo que excluye a un amplio número de pacientes con IM.
- •
Dada la reciente aplicación de esta técnica, no hay datos de la durabilidad y la eficacia de este dispositivo a largo plazo.
La ablación directa de los velos y las cuerdas tendinosas del aparato valvular mitral es una nueva técnica de reparación mitral que se ha desarrollado recientemente. Esta tendría aplicación especialmente en la IM de origen mixomatoso, en la que se produce prolapso valvular mitral con elongación del aparato subvalvular. Por medio de un catéter de radiofrecuencia, se aplica energía térmica a los velos y las cuerdas tendinosas para producir la retracción del tejido49. Estudios in vitro han demostrado reducción del tamaño de la VM durante todas las fase del ciclo cardiaco, lo que se traduce en una mejor coaptación valvular. El catéter de radiofrecuencia se avanza por vía retrógrada a través de la aorta, y dispone de una punta criogénica que permite el anclaje y la estabilización del catéter50. En modelos animales se ha demostrado disminución de la IM hasta en el 50% de los casos, con persistencia del efecto durante al menos 6 semanas50. Sin embargo, por el momento no se dispone de datos en humanos. La ventaja de esta técnica es que no requiere la implantación de ningún dispositivo y que la estructura mitral no se modifica; sin embargo, presenta algunas limitaciones: a) el daño térmico es irreversible y se debe controlar estrictamente la energía de la radiofrecuencia para no producir una retracción excesiva; b) se puede producir daño en estructuras vecinas, como el miocardio; c) se desconoce la duración del efecto (podría ser temporal), y d) se generan zonas de necrosis térmica, cuyas consecuencias a medio-largo plazo aún no se conocen.
Implantación de cuerdas tendinosasLas cuerdas tendinosas artificiales se pueden implantar bien por vía transeptal o transapical con el objetivo de crear una conexión entre el miocardio y los velos mitrales. La longitud de la cuerda se ajusta para recuperar una coaptación óptima y reducir la IM. Es una técnica utilizada principalmente en la IM degenerativa.
Tres dispositivos están actualmente en desarrollo, dos por vía transapical, el Mitraflex (TransCardiac Therapeutics; Atlanta, Georgia, Estados Unidos) y el NeoChord (NeoChord, Inc.; Minnetonka, Minnesota, Estados Unidos) y otro por vía transapical y transeptal, el sistema Babic, que precisa la externalización de las suturas por vía transeptal para colocar una almohadilla y anclarlo en la cara auricular del velo, mediante una tracción de la suturas por el acceso apical51,52. El estudio TACT con Neochord incluyó a 30 pacientes con IM ≥ 3 y prolapso del velo posterior, con una tasa de implantación del 87%53. El 65% de los pacientes en que el procedimiento finalizó con éxito tenían IM ≤ 2 a los 30 días.
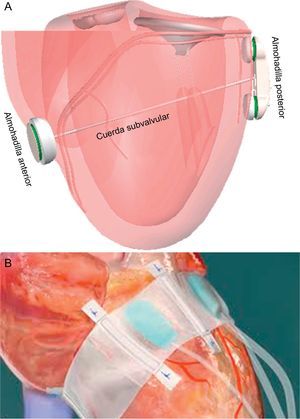
Remodelado del ventrículo izquierdoLa técnica percutánea iCoapsys se basa en el sistema quirúrgico Coapsys (Edwards Lifesciences; Irvine, California, Estados Unidos) (fig. 11A), y consiste en la implantación de dos almohadillas a nivel epicárdico en ambos lados del VI, unidas por una cuerda flexible de polietileno que atraviesa la cavidad ventricular y aplica tensión al anillo mitral y la pared basal del VI. Indirectamente se reduce la distancia septolateral y acerca los músculos papilares a los velos. Esta técnica es adecuada para IM funcional isquémica o secundaria a cardiomiopatía. Los datos quirúrgicos han mostrado disminución aguda de la IM y remodelado positivo del VI54. Aunque el acceso transpericárdico por vía subxifoidea en animales fue factible55, el desarrollo en humanos se ha detenido.
Dispositivos de remodelado ventricular. A: iCoapsys. B: Mardil-BACE. Modificada de Pedersen et al55, con permiso.
El sistema Mardil-BACE (Mardil, Inc.; Morrisville, North Carolina, Estados Unidos) no es un dispositivo completamente percutáneo porque requiere minitoracotomía, aunque sin necesidad de circulación extracorpórea. Consiste en una banda de silicona que se infla alrededor del surco auriculoventricular; el inflado se puede ajustar después del procedimiento por medio de una conexión subcutánea (fig. 11B)56. Permite modificar la forma del anillo mitral para conseguir una mejor coaptación de los velos. El dispositivo se implantó a 11 pacientes sometidos a cirugía de bypass coronario, y se consiguió una reducción media de la IM de 2,5 grados57. Aunque la evidencia clínica con las técnicas de remodelado ventricular izquierdo para el tratamiento de la IM ha mostrado resultados prometedores, se necesitarán más datos para poder sacar alguna conclusión sobre su seguridad y su eficacia.
TRATAMIENTO PERCUTÁNEO DE REEMPLAZO VALVULAR MITRALVálvula nativaEl reemplazo valvular aórtico por catéter en pacientes de alto riesgo quirúrgico ha experimentado un gran desarrollo en los últimos años. Igualmente, el reemplazo percutáneo valvular mitral tiene el potencial de convertirse en la técnica de elección en pacientes con IM grave de alto riesgo quirúrgico o rechazados para cirugía. Sin embargo, la complejidad estructural de la VM, su etiología diversa y la falta de conocimiento completo del mecanismo etiopatológico de la IM han impedido un desarrollo del reemplazo valvular mitral percutáneo paralelo al del tratamiento percutáneo de la estenosis aórtica. Varios factores intrínsecos al aparato valvular mitral dificultan el desarrollo de una prótesis mitral percutánea:
- •
La asimetría del anillo mitral y la ausencia de un plano valvular único.
- •
El movimiento constante del anillo mitral y de la porción basal del VI dificulta un anclaje estable de la prótesis.
- •
El gran tamaño de la VM y su proximidad a la válvula aórtica y el tracto de salida del VI.
- •
Las fugas paravalvulares en posición mitral se toleran peor que en otras localizaciones por los altos gradientes a través de ellas.
Existen varios modelos experimentales en desarrollo y recientemente se ha realizado el primer reemplazo valvular mitral por vía transeptal sobre válvula nativa en humanos58. Son cuatro los dispositivos en desarrollo de los que se dispone de datos (fig. 12). La prótesis Endovalve-Herrmann (Endovalve, Inc.; Princeton, New Jersey, Estados Unidos) (fig. 12A) se implanta mediante una minitoracotomía a través de la aurícula izquierda sin necesidad de circulación extracorpórea. La válvula se ancla mediante unos ganchos especialmente diseñados y es completamente reposicionable antes de liberarla. La válvula Lutter (University of Kiel, Alemania) de pericardio bovino está montada en un stent de nitinol autoexpandible (fig. 12B) y se ha implantado en modelos animales por vía transapical59. La válvula CardiAQ (CardiAQ Valve Technologies, Inc.; Winchester, Massachusetts, Estados Unidos) está constituida de pericardio porcino y se monta en un stent de nitinol autoexpandible diseñado para implantación por vía transeptal (fig. 12C). Esta es la primera válvula percutánea implantada en posición mitral sobre válvula nativa58. El procedimiento se realizó en Dinamarca en un varón de 86 años con IM grave (4/4) y múltiples comorbilidades. La IM residual era de grado 1 tras el procedimiento, y después de una buena evolución inicial, el paciente falleció al tercer día del procedimiento por fallo multiorgánico. En la autopsia no se observó fallo estructural de la válvula. Por último, Tiara (Neovasc, Inc.; Richmond, British Columbia, Canadá) es una válvula de pericardio bovino montada en un stent autoexpandible, con una porción auricular en forma de D para ajustarse mejor a la anatomía del anillo mitral y evitar la obstrucción al tracto de salida del VI (fig. 12D). La porción ventricular tiene un recubrimiento exterior para evitar las fugas paravalulares y tres estructuras de anclaje. Se implanta por abordaje transapical utilizando un catéter de 30 Fr. Los resultados en animales son prometedores, con una tasa de éxito de implantación del 81%, sin fuga paravalvular significativa ni obstrucción del tracto de salida (fig. 13)60.
Válvulas mitrales percutáneas. A: Endovalve-Herrmann, cortesía del Dr. Howard Herrmann (University of Pennsylvania, Estados Unidos). B: válvula de Lutter, reproducida con permiso de los Dres. Lino y Lutter et al59. C: válvula CardiAQ. D: válvula Tiara.
Imagen de válvula Tiara en modelo animal por ecocardiografía tridimensional, con vistas ventricular (A) y auricular (B) y ventriculografía izquierda en diástole (C) y sístole (D). Reproducida con permiso de Banai et al60.
La reparación valvular mitral y el uso de válvulas biológicas han aumentado en las últimas décadas para el tratamiento de la valvulopatía mitral en comparación con el reemplazo valvular mediante prótesis valvulares mecánicas. Sin embargo, con el paso del tiempo, tasas del 5 al 10% de recurrencia de la enfermedad obligan a una nueva cirugía1, frecuentemente compleja. El reemplazo valvular por catéter se ha convertido en los últimos años en una alternativa interesante para los pacientes con cirugía valvular mitral previa (prótesis biológica, anillo mitral) y riesgo quirúrgico muy alto o prohibitivo.
Recientemente se ha descrito la implantación de la válvula Melody (Medtronic; Minneapolis, Minnesota, Estados Unidos) en modelos animales con previa anuloplastia quirúrgica (válvula Melody en anillo) a través de acceso transeptal61,62. De 10 ovejas con cuatro anillos quirúrgicos diferentes implantados en las que se realizó el procedimiento, se consiguió la implantación exitosa de la válvula en 9 casos62. No hubo casos de IM paravalvular, y sólo 1 caso de IM moderada-grave central después del procedimiento. El estudio anatomopatológico demostró un anclaje seguro y el correcto sellado del stent de la válvula62.
Se han descrito varios casos de implantación de válvula por catéter en pacientes con cirugía mitral previa. Aunque las vías transauricular y transeptal se han ensayado en modelos animales63 y humanos64–66, el abordaje transapical, gracias a su acceso más directo y su posición coaxial al plano mitral, es el que más casos acumula67–70. Los resultados obtenidos han sido aceptables, con mínima IM residual, aunque los gradientes medios residuales son ligeramente altos (alrededor de 6-7mmHg). Todos los casos se han realizado con válvulas de tipo balón expandible, principalmente Edwards-SAPIEN (Edwards Lifesciences Inc.; Irvine, California, Estados Unidos) (fig. 14). El stent de la válvula percutánea asegura los adecuados anclaje y sellado dentro del anillo quirúrgico, con lo que se evitan las fugas paravalvulares. Resulta particularmente importante en estos pacientes la medición del diámetro interno de la prótesis quirúrgica, ya que el proporcionado por las especificaciones del fabricante suele ser el externo. La sobredimensión está limitada por el anillo rígido y la infraexpasión de la válvula podría aumentar los gradientes por distorsión de los velos y aumentar el riesgo de disfunción precoz. Recientemente se han presentado los resultados preliminares de una serie de 91 pacientes de muy alto riesgo (escala de riesgo de la Society of Thoracic Surgeons =16,3 y EuroSCORE logístico del 30%) con una mediana de 9 años desde la cirugía mitral previa (82 bioprótesis y 9 anillos)71. La disfunción mitral fue por IM, estenosis o ambas en el 46, el 25 y el 29% de los pacientes. El acceso fue predominantemente por vía transapical (86%), aunque hubo casos por vía transeptal (el 10%, incluido 1 caso por vía yugular) y punción directa de la aurícula izquierda (4%). Las medias de gradiente y área tras el procedimiento fueron de 6,4 mmHg y 1,96cm2, respectivamente, con un 4% de los pacientes en IM ≥ 2. La mortalidad a los 30 días era del 12%, con una tasa de ictus del 1% y de hemorragia mayor del 18%. Hubo una mejora significativa en la clase funcional, con un 78% de los pacientes en clase de la New York Heart Association ≤ 2 a los 30 días y supervivencia anual del 74,5%.
La experiencia actual con las técnicas de reemplazo valvular mitral por vía percutánea es muy escasa, y las técnicas de reparación mitral quirúrgica han mostrado un beneficio superior frente al reemplazo valvular, en parte debido a la conservación de las cuerdas tendinosas y los músculos papilares4,72. Lo mismo podría ocurrir en relación con las terapias percutáneas, si bien es cierto que actualmente no hay evidencia de que un reemplazo valvular mitral que conserve estas estructuras pueda tener el mismo beneficio que la reparación mitral73.
CONCLUSIONESEl tratamiento percutáneo de la IM ha surgido en los últimos años como una alternativa a la cirugía de reparación/reemplazo mitral. Aunque se han ensayado diferentes técnicas de anuloplastia percutánea indirecta y directa con resultados dispares, la plicatura de velos mediante el dispositivo MitraClip es lo que sin duda ha acumulado la mayor experiencia clínica. A pesar de que la seguridad de la técnica mostró ser superior a la cirugía debido a una tasa de complicaciones periprocedimiento baja, su eficacia fue claramente inferior a la de la cirugía valvular mitral. Sin embargo, hay datos preliminares que apuntan a supervivencia y capacidad funcional mejores con la utilización del MitraClip en comparación con el tratamiento médico en pacientes con riesgo quirúrgico muy elevado o prohibitivo. En espera de los resultados de otros estudios aleatorizados que clarifiquen el tipo de pacientes que mayor beneficio pueden obtener con esta técnica, parece obvio que el desarrollo y las indicaciones del tratamiento percutáneo de la IM deberían basarse en la evaluación y la selección de pacientes por equipos multidisciplinarios que incluyan a cardiólogos intervencionistas, cirujanos cardiacos y ecocardiografistas, con el apoyo de otros especialistas (geriatría, anestesia, etc.). Dado que los mecanismos de la IM son múltiples, es poco probable que el uso de una única técnica percutánea proporcione una reducción de la IM similar a la reparación quirúrgica, especialmente si se considera que las técnicas quirúrgicas suelen utilizar una combinación de técnicas dirigidas a los diferentes componentes involucrados en la IM. Por lo tanto, la combinación de varias técnicas percutáneas en un único o varios procedimientos escalonados probablemente sea la única posibilidad de obtener resultados similares a los quirúrgicos. Finalmente, el desarrollo de prótesis biológicas para reemplazo mitral percutáneo está en una fase incipiente y las primeras experiencias en humanos proliferarán de manera importante en un futuro próximo. La demostración de la factibilidad y la seguridad de estas válvulas probablemente sea uno de los grandes avances en la cardiología intervencionista en los próximos años. Los estudios aleatorizados, sin embargo, deberán establecer el verdadero papel de esta nueva técnica en el tratamiento de la valvulopatía mitral.
FINANCIACIÓNEl Dr. Nombela-Franco ha obtenido financiación de una beca de investigación de la Fundación Alfonso Martín Escudero de Madrid (España).
CONFLICTO DE INTERESESNinguno.