Los stents liberadores de fármacos de primera generación han reducido considerablemente las reestenosis en el stent y han ampliado las aplicaciones de las intervenciones coronarias percutáneas en el tratamiento de la enfermedad coronaria. El polímero es parte integrante de los stents liberadores de fármacos, ya que controla la liberación de un fármaco antiproliferativo. La principal preocupación respecto a los stents liberadores de fármacos de primera generación con polímeros permanentes —la trombosis del stent— se ha debido a la hipersensibilidad local, la cicatrización tardía del vaso y la disfunción endotelial. Esto ha llevado al desarrollo de stents liberadores de fármacos de nueva generación con polímeros biodegradables o incluso sin polímero. En ensayos clínicos recientes se ha observado la seguridad y la eficacia de los stents liberadores de fármacos con polímero biodegradable, que han mostrado una reducción demostrada de la trombosis de stent muy tardía, comparados con los de primera generación. Sin embargo, el concepto de utilizar prótesis metálicas permanentes tiene importantes inconvenientes, como la presencia de un cuerpo extraño en el interior de la arteria coronaria nativa, que causa inflamación vascular y neoaterosclerosis e impide también el restablecimiento de la función vasomotora del segmento tratado con el stent. Para superar esas limitaciones, se han introducido las estructuras de base bioabsorbible, que proporcionan un armazón temporal y luego al desaparecer liberan el vaso tratado de la jaula que le imponían. En este artículo de puesta al día se presenta el estado actual de estas nuevas tecnologías y se resaltan sus perspectivas futuras en cardiología intervencionista.
Palabras clave
Los stents coronarios se desarrollaron inicialmente a mediados de la década de los ochenta para superar las limitaciones inherentes a la angioplastia con balón, como la retracción elástica y la oclusión del vaso en la fase aguda, así como el remodelado constrictivo y la reestenosis en la fase tardía1–3. En la década de los noventa, esta tecnología pasó a ser ampliamente aceptada como una estrategia terapéutica prometedora para los pacientes con enfermedad coronaria, después del ensayo Belgian Netherlands Stent, que demostró la superioridad de los stents metálicos sin recubrimiento (SMSR) respecto a la angioplastia con balón4. Aunque la implantación de stents coronarios mejoró los resultados angiográficos y la evolución clínica, la hiperplasia de neoíntima y la reestenosis continuaron siendo limitaciones importantes de esta tecnología5. Los stents liberadores de fármacos (SLF) se desarrollaron para reducir al mínimo la hiperplasia de la neoíntima y, por lo tanto, la necesidad de nuevas revascularizaciones. En los primeros ensayos fundamentales con fines de registro de los SLF de primera generación, se obtuvieron resultados excelentes en cuanto a la reducción de la reestenosis en el stent, de manera que estos dispositivos sustituyeron rápidamente a los SMSR6,7. En 2006 se plantearon algunos motivos de preocupación respecto a la seguridad de los SLF tras la aparición de trabajos que relacionaban su uso con un aumento del riesgo de trombosis en el stent (TS)8,9. Los SLF de primera generación, con polímeros permanentes, se han asociado a un retraso de la endotelización, disfunción endotelial y reacciones de hipersensibilidad local, que han dado lugar a un aumento del riesgo de TS y a la necesidad de prolongar el tratamiento antiagregante plaquetario combinado doble10,11.
Los SLF de nueva generación, con unos puntales de fijación (struts) más delgados y polímeros más biocompatibles, han mejorado considerablemente su perfil de seguridad12–15. Sin embargo, sigue preocupando la presencia de polímeros persistentes, puesto que la evidencia obtenida en estudios en animales y humanos sigue apuntando a que estos polímeros persistentes pueden causar inflamación continua de la pared arterial y retraso en la cicatrización vascular, procesos que posteriormente pueden participar en el desencadenamiento de la TS y la reestenosis tardía en el stent (es decir, el fenómeno de puesta al día tardía)16. Los SLF de nueva generación, con un recubrimiento de polímeros biodegradables, aportan la atractiva combinación de una liberación controlada del fármaco junto con una biodegradación del polímero, que se convierte en monómeros inertes. Una vez completada la biodegradación, solamente persiste un «SMSR», con lo que se reduce el riesgo a largo plazo asociado a la presencia de un polímero permanente17. Una extensión de este concepto ha llevado al desarrollo de nuevos SLF que carecen completamente de polímero o que usan nuevos tipos de recubrimiento. Además, se han desarrollado armazones metálicos (p. ej., de magnesio) y poliméricos bioabsorbibles, que inicialmente salvaguardan la permeabilidad del vaso tratado y luego desaparecen. El objetivo de este artículo es presentar una revisión de las nuevas tecnologías de stents que se encuentran en este momento en fase de investigación clínica y comentar las perspectivas futuras existentes en el campo de la cardiología intervencionista.
STENTS METÁLICOS LIBERADORES DE FÁRMACOS DE NUEVA GENERACIÓNStents liberadores de fármacos con polímeros biodegradablesLos recubrimientos de polímeros biodegradables facilitan la liberación del fármaco hacia la pared vascular y luego se reabsorben sin dejar secuelas a largo plazo. Desde su introducción en 200418, se han desarrollado muchos SLF con polímeros biodegradables, sobre todo después de que se planteara la hipótesis de que esta tecnología podría reducir el riesgo de la TS muy tardía (TSMT), un evento adverso asociado a los SLF con polímeros persistentes. El ensayo aleatorizado ISAR-TEST 4 se llevó a cabo para verificar la no inferioridad de un stent liberador de rapamicina (SLR) con polímero biodegradable (Yukon Choice PC, Translumina; Hechingen, Alemania) respecto a un SLF con un polímero persistente, el stent liberador de sirolimus (SLS) de primera generación Cypher o el stent liberador de everolimus (SLE) de segunda generación Xience V, en lo relativo a los resultados clínicos. Se reclutó para el ensayo a un total de 2.603 pacientes. En un seguimiento a 3 años, no hubo diferencias significativas en el objetivo combinado que incluía la muerte cardiaca, el infarto de miocardio (IM) del vaso diana y la revascularización de la lesión diana (RLD) (SLR frente a SLF, el 20,1 frente al 20,9%; p=0,59) ni en la incidencia de la TS definitiva/probable (el 1,4 frente al 1,9%; p=0,51)19. Será necesario un seguimiento clínico a más largo plazo para evaluar la posible superioridad del SLR respecto a los SLF tradicionales en cuanto a la reducción del riesgo de TSMT.
Stent liberador de biolimus con polímero biodegradableEl biolimus A9 es un fármaco de la clase -limus, semisintético y diseñado para la aplicación en stents con una potencia similar a la del sirolimus, pero es 10 veces más lipófilo. Se basa en una inmersión a una concentración de 15,6 μg/mm en un polímero biodegradable de ácido poliláctico que recubre la superficie abluminal del stent. El ácido poliláctico se libera conjuntamente con el biolimus y se metaboliza por completo hasta dar lugar a dióxido de carbono y agua en un periodo de 6-9 meses. La plataforma del stent de acero inoxidable tiene un grosor del strut de fijación de 112 μm, con un diseño de cuadratura. En la actualidad, las plataformas de stents que emplean esta tecnología son las de BioMatrix Flex (Biosensors Inc.; Singapur), NOBORI (Terumo Corp.; Tokio, Japón) y Axxess (Biosensors Inc.).
En el ensayo LEADERS, se ha puesto de relieve que el stent BioMatrix no es inferior al SLS Cypher con polímero persistente de primera generación por lo que respecta al objetivo combinado de muerte cardiaca, IM y revascularización del vaso diana por isquemia a los 12 meses de seguimiento (BioMatrix frente a Cypher, el 10,6 frente al 12,0%; p=0,37)20. Esta no inferioridad se ha confirmado recientemente en un seguimiento a 5 años21. Es importante señalar que el stent BioMatrix mostró una incidencia significativamente inferior de TSMT definitiva en un seguimiento a 5 años ((hazard ratio = 0,26 [0,10-0,68]). Un análisis combinado de los ensayos aleatorizados ISAR-TEST 3, ISAR-TEST 4 y LEADERS puso de relieve también que los SLF con polímeros biodegradables se asociaban a riesgos de TSMT e IM inferiores que los de los SLS Cypher22. El ensayo LEADERS no sólo aportó la primera evidencia de mejor resultado clínico que con los SLF de primera generación, sino que constituye también la prueba de concepto respecto a los SLF con polímeros biodegradables.
Stent liberador de everolimus con polímero biodegradable: stent SYNERGYEl SYNERGY (Boston Scientific; Natick, Massachusetts, Estados Unidos) consta de un strut delgado (74 μm), una plataforma de platino-cromo que libera everolimus a partir de un polímero de polilactato-cohidroxiacetato bioabsorbible aplicado a la superficie abluminal. En el ensayo aleatorizado EVOLVE, se comparó la seguridad y la eficacia de dos formulaciones de dosis (dosis estándar [DS], 113 μg/20 mm, y mitad de dosis [MD], 56 μg/20 mm) del stent SYNERGY con las del SLE con polímero persistente PROMUS Element (Boston Scientific; Natick, Massachusetts, Estados Unidos)23. Se incluyó a un total de 291 pacientes en la asignación aleatoria (en una proporción 1:1:1) a los dispositivos SYNERGY, SYNERGY MD y SLE. El objetivo principal fue la tasa de fallos en la lesión diana (FLD) a 30 días, definidos como la combinación de muerte cardiaca, IM relacionado con el vaso diana y RLD. Los FLD se produjeron en el 3,1, el 1,1 y el 0% de los pacientes de los grupos tratados con los stents SYNERGY, SYNERGY MD y SLE respectivamente. La pérdida luminal tardía (PLT) en el stent a los 6 meses fue de 0,10 mm con el SYNERGY, 0,13 mm con el SYNERGY MD y 0,15 mm con el SLE (pno inferioridad<0,001). No hubo ningún episodio de TS en ninguno de los grupos en el periodo de seguimiento de hasta 6 meses. Recientemente, el stent SYNERGY ha recibido la aprobación de la marca de Conformité Européenne (CE); actualmente se está realizando un ensayo fundamental de registro, el EVOLVE II, que tiene como objetivo la comparación directa de los FLD a 12 meses con el uso de SYNERGY (842 pacientes) y SLE (842 pacientes).
Otros stents liberadores de fármacos con polímeros biodegradablesActualmente hay muchos SLF con polímeros biodegradables comercializados o en fase de investigación clínica (tabla 1). En estudios preliminares se han obtenido resultados a los 6-9 meses comparables a los del SLF con polímero biodegradable antes mencionados. Aunque los polímeros biodegradables parecen haberse convertido en una tecnología prometedora para la liberación de fármacos en la plataforma de SLF de nueva generación, sigue habiendo problemas que es preciso abordar antes de su aplicación clínica generalizada24. Serán necesarios nuevos estudios para optimizar la composición y la cinética de liberación de esos polímeros.
Cuadro general de los stents liberadores de fármacos con polímero biodegradable que están en fase de investigación clínica o ya se comercializan fuera de Estados Unidos
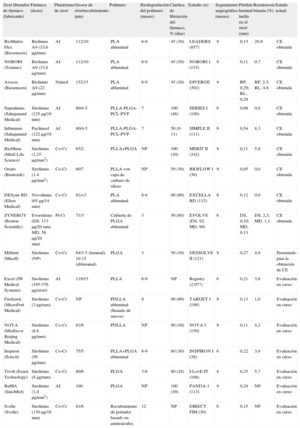
| Stent liberador de fármaco (fabricante) | Fármaco (dosis) | Plataforma de stent | Grosor de strut/recubrimiento (μm) | Polímero | Biodegradación del polímero (meses) | Cinética de liberación del fármaco, % (días) | Estudio (n) | Seguimiento angiográfico (meses) | Pérdida luminal tardía en el stent (mm) | Reestenosis binaria (%) | Estado actual |
| BioMatrix Flex (Biosensors) | Biolimus A9 (15,6μg/mm) | AI | 112/10 | PLA abluminal | 6-9 | 45 (30) | LEADERS (857) | 9 | 0,13 | 20,9 | CE obtenida |
| NOBORI (Terumo) | Biolimus A9 (15,6μg/mm) | AI | 112/10 | PLA abluminal | 6-9 | 45 (30) | NOBORI 1 (153) | 9 | 0,11 | 0,7 | CE obtenida |
| Axxess (Biosensors) | Biolimus A9 (22μg/mm) | Nitinol | 152/15 | PLA abluminal | 6-9 | 45 (30) | DIVERGE (302) | 9 | RP, 0,29; RL, 0,29 | RP, 2,3; RL, 4,8 | CE obtenida |
| Supralimus (Sahajanand Medical) | Sirolimus (125μg/19 mm) | AI | 80/4-5 | PLLA-PLGA-PCL-PVP | 7 | 100 (48) | SERIES I (100) | 6 | 0,09 | 0,0 | CE obtenida |
| Infinnium (Sahajanand Medical) | Paclitaxel (122μg/19 mm) | AI | 80/4-5 | PLLA-PLGA-PCL-PVP | 7 | 50 (9-11) | SIMPLE II (111) | 9 | 0,54 | 8,3 | CE obtenida |
| BioMime (Meril Life Science) | Sirolimus (1,25μg/mm2) | Co-Cr | 65/2 | PLLA+PLGA | NP | 100 (30) | MERIT II (242) | 8 | 0,11 | 5,0 | CE obtenida |
| Orsiro (Biotronik) | Sirolimus (1,4μg/mm2) | Co-Cr | 60/7 | PLLA con capa de carburo de silicio | NP | 50 (30) | BIOFLOW I (30) | 9 | 0,05 | 0,0 | CE obtenida |
| DESyne BD (Elixir Medical) | Novolimus (65μg/14 mm) | Co-Cr | 81/<3 | PLA abluminal | 6-9 | 90 (90) | EXCELLA BD (115) | 6 | 0,12 | 0,0 | CE obtenida |
| SYNERGY (Boston Scientific) | Everolimus (DS, 113μg/20 mm; MD, 56μg/20 mm) | Pt-Cr | 71/3 | Cubierta de PLGA abluminal | 3 | 50 (60) | EVOLVE (DS, 92; MD, 99) | 6 | DS, 0,10; MD, 0,13 | DS, 2,3; MD, 1,1 | CE obtenida |
| MiStent (Micell) | Sirolimus (NP) | Co-Cr | 64/3-5 (luminal), 10-15 (abluminal) | PLGA | 3 | 50 (30) | DESSOLVE II (121) | 9 | 0,27 | 4,9 | Presentado para la obtención de CE |
| Excel (JW Medical Systems) | Sirolimus (195-376μg/stent) | AI | 119/15 | PLLA | 6-9 | NP | Registry (2.077) | 6 | 0,21 | 3,8 | Evaluación en curso |
| Firehawk (MicroPort Medical) | Sirolimus (3μg/mm) | Co-Cr | NP | PDLLA abluminal (llenado de surcos) | 9 | 90 (90) | TARGET I (199) | 9 | 0,13 | 1,0 | Evaluación en curso |
| NOYA (Medfavor Beijing Medical) | Sirolimus (8,8μg/mm) | Co-Cr | 81/6 | PDLLA | NP | 80 (30) | NOYA I (150) | 9 | 0,11 | 4,2 | Evaluación en curso |
| Inspiron (Sctech) | Sirolimus (56μg/mm) | Co-Cr | 75/5 | PLLA+PLGA abluminal | 6-9 | 80 (30) | INSPIRON I (38) | 6 | 0,22 | 3,9 | Evaluación en curso |
| Tivoli (Essen Technology) | Sirolimus (8μg/mm) | Co-Cr | 80/6 | PLGA | 3-6 | 80 (28) | I-LovE-IT (168) | 8 | 0,25 | 5,7 | Evaluación en curso |
| BuMA (SinoMed) | Sirolimus (1,4μg/mm2) | AI | 100 | PLGA | NP | 100 (30) | PANDA-1 (113) | 9 | 0,24 | NP | Evaluación en curso |
| Svelte (Svelte) | Sirolimus (130μg/18 mm) | Co-Cr | 81/6 | Recubrimiento de portador basado en aminoácidos | 12 | NP | DIRECT FIM (30) | 6 | 0,15 | NP | Evaluación en curso |
AI: acero inoxidable; CE: Conformité Européenne; Co-Cr: cobalto-cromo; DS: dosis estándar; MD: mitad de dosis; NP: no procede; PCL: poli-L-lactato-co-ε-caprolactona; PDLLA: ácido poli-D,L-láctico; PLA: ácido poliláctico; PLGA: poli-lactato-co-glucolato; PLLA: ácido poli-L-láctico; Pt-Cr: platino-cromo; PVP: polivinilpirrolidona; RL: rama lateral; RP: rama principal.
El siguiente avance importante pueden ser las estructuras de stent metálicas que permitan una cinética de liberación del fármaco apropiada sin usar polímeros. Se han diseñado varios dispositivos para poner a prueba este enfoque incorporando fármacos a una superficie microporosa o nanoporosa del stent (tabla 2). La eficacia de un SLS sin polímero (SLS-SP; Yukon Choice, Translumina) se ha estudiado en el ensayo ISAR-TEST 325,26. Se comparó el SLS-SP (201 pacientes) con un SLS con polímero biodegradable (SLS-PB) (n=202) (Yukon Coice PC, Translumina) y con un SLS con un polímero permanente (SLS-PP) (n=202) (Cypher, Cordis; Miami Lakes, Florida, Estados Unidos). A los 2 años, no había diferencias significativas en cuanto a muerte, IM (SLS-SP, 6,5%; SLS-PB, 5,9%; SLS-PP, 6,4%), las RLD (SLS-SP, 13,4%; SLS-PB, 8,4%; SLS-PP, 10,4%) y TS definitiva/probable (SLS-SP, 1,0%; SLS-PB, 0,5%; SLS-PP, 1,0%). Los pacientes a los que se practicaron angiografías por pares a los 6-8 meses y a los 2 años (302 pacientes) presentaron después una PLT menor en el grupo de SLS-SP (–0,01 mm) que en los grupos de SLS-PB (0,17 mm) y SLS-PP (0,16 mm) (p<0,001). La ausencia de PLT en el grupo de SLS-SP puede indicar una menor propensión a las interacciones de la pared vascular con el stent, debido a unas reacciones inflamatorias o de hipersensibilidad menores. Recientemente se han descrito los resultados clínicos a los 5 años del ensayo ISAR-TEST27. No hubo diferencias estadísticamente significativas de episodios de TS entre el SLS-SP y el stent liberador de paclitaxel (SLP) TAXUS de primera generación (SLS-SP frente a SLP, el 0,5 frente al 1,6%; p=0,32). Es posible que los datos de un seguimiento ampliado aporten nueva información que respalde la durabilidad, la seguridad y la eficacia del SLS-SP.
Cuadro general de los stents sin polímeros y de los stents liberadores de fármaco con nuevos recubrimientos que están en fase de investigación clínica o ya se comercializan fuera de Estados Unidos
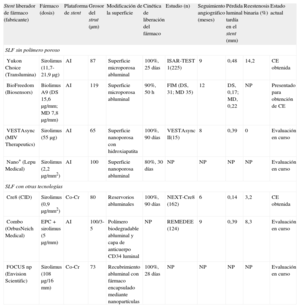
| Stent liberador de fármaco (fabricante) | Fármaco (dosis) | Plataforma de stent | Grosor del strut (μm) | Modificación de la superficie | Cinética de liberación del fármaco | Estudio (n) | Seguimiento angiográfico (meses) | Pérdida luminal tardía en el stent (mm) | Reestenosis binaria (%) | Estado actual |
| SLF sin polímero poroso | ||||||||||
| Yukon Choice (Translumina) | Sirolimus (11,7-21,9μg) | AI | 87 | Superficie microporosa abluminal | 100%, 25 días | ISAR-TEST 1(225) | 9 | 0,48 | 14,2 | CE obtenida |
| BioFreedom (Biosensors) | Biolimus A9 (DS 15,6μg/mm; MD 7,8μg/mm) | AI | 119 | Superficie microporosa abluminal | 90%, 50 h | FIM (DS, 31; MD 35) | 12 | DS, 0,17; MD, 0,22 | NP | Presentado para obtención de CE |
| VESTAsync (MIV Therapeutics) | Sirolimus (55μg) | AI | 65 | Superficie nanoporosa con hidroxiapatita | 100%, 90 días | VESTAsync II(15) | 8 | 0,39 | 0 | Evaluación en curso |
| Nano+ (Lepu Medical) | Sirolimus (2,2μg/mm2) | AI | 100 | Superficie nanoporosa abluminal | 80%, 30 días | NP | NP | NP | NP | Evaluación en curso |
| SLF con otras tecnologías | ||||||||||
| Cre8 (CID) | Sirolimus (0,9μg/mm2) | Co-Cr | 80 | Reservorios abluminales | 100%, 90 días | NEXT-Cre8 (162) | 6 | 0,14 | 3,2 | CE obtenida |
| Combo (OrbusNeich Medical) | EPC + sirolimus (5μg/mm) | AI | 100/3-5 | Polímero biodegradable abluminal y capa de anticuerpo CD34 luminal | NP | REMEDEE (124) | 9 | 0,39 | 8,3 | Evaluación en curso |
| FOCUS np (Envision Scientific) | Sirolimus (108μg/16 mm) | Co-Cr | 73 | Recubrimiento abluminal con fármaco encapsulado mediante nanopartículas | 100%, 28 días | NP | NP | NP | NP | Evaluación en curso |
AI: acero inoxidable; CE: Conformité Européenne; Co-Cr: cobalto-cromo; DS: dosis estándar; EPC: células progenitoras endoteliales (tecnología de captura); FIM: primera vez en el ser humano; MD: mitad de dosis; NP: no procede; RP: rama principal; SLF: stent liberador de fármaco.
El BioFreedom (Biosensors Inc.). es un stent sin polímero, de acero inoxidable 316L, recubierto de biolimus A9 (fig. 1). En estudios preclínicos se han descrito unas puntuaciones de lesión inferiores, menor número de struts con fibrina, granulomas y células gigantes, un porcentaje significativamente inferior de estenosis del diámetro y mayor endotelización que con el SLS Cypher28. El primer ensayo en humanos (first-in-man [FIM]) incluyó a 182 pacientes a los que se asignó aleatoriamente BioFreedom con sirolimus DS (15,6μg/mm), BioFreedom con dosis baja (DB) de sirolimus (7,8μg/mm) o el SLP TAXUS Liberté. A los 12 meses, la PLT en el stent fue de 0,17mm en el grupo de BioFreedom DS (p<0,0001 frente a SLP), 0,22mm en el grupo de BioFreedom DB (p=0,21 frente a SLP) y 0,35mm en el grupo de SLP. No hubo ningún episodio de TS y no se observaron diferencias en los eventos adversos cardiovasculares mayores (MACE), que incluían la muerte por cualquier causa, el IM y la cirugía urgente de revascularización o la RLD en un periodo de hasta 36 meses (BioFreedom DS, 11,9%; BioFreedom DB, 18,1%; SLP, 10,0%)29. Actualmente, está planificado el ensayo aleatorizado LEADERS FREE para examinar la no inferioridad (objetivo combinado de muerte cardiaca, IM y TS) y la superioridad (RLD por motivos clínicos) del stent BioFreedom respecto a un SMSR en más de 2.400 pacientes ancianos con tratamiento antiagregante plaquetario combinado doble durante 1 mes después de la implantación del stent.
Stent VESTAsyncEl stent VESTAsync (MIV Therapeutics; Atlanta, Georgia, Estados Unidos) combina una plataforma de acero inoxidable con un recubrimiento de superficie nanoporoso de hidroxiapatita (derivado cristalino de fosfato cálcico biocompatible), impregnada con 55 μg de mezcla de sirolimus (fig. 2). Se prevé que la liberación de sirolimus se habrá completado en los primeros 3 meses tras la implantación y que la hidroxiapatita se mantendrá estable durante 4 meses. Se ha evaluado la seguridad y la eficacia del stent VESTAsync en el ensayo VESTAsync I FIM. Se incluyó a 15 pacientes con lesiones coronarias únicas aparecidas de novo. La PLT en el stent fue de 0,36 mm a los 9 meses, sin que se registrara ningún MACE en un seguimiento de hasta 1 año30. Recientemente se ha presentado el ensayo aleatorizado VESTAsync II31. Los pacientes tratados con el stent VESTAsync (n=50) presentaron una PLT en el stent significativamente menor que los tratados con SMSR (n=25) a los 8 meses (VESTAsync 0,39mm frente a SMSR 0,74mm, p=0,03). No se observó ningún signo de TS en el seguimiento de hasta 2 años.
El sistema de stent liberador de sirolimus VESTAsync sin polímero. Imágenes de microscopio electrónico de barrido del recubrimiento de hidroxiapatita microporosa (A), el corte transversal del recubrimiento de hidroxiapatita (B), el recubrimiento final incluida la hidroxiapatita llenada con la formulación de sirolimus (C) y el corte transversal del recubrimiento final (D). Representación esquemática del recubrimiento de la superficie (E).
El Nano+ (Lepu Medical; Pekín, China) es un stent de acero inoxidable sin polímero, con una superficie nanoporosa recubierta de sirolimus (2,2 μg/mm2). La media de diámetro de los poros es de aproximadamente 400 nm y se prevé que casi un 80% del fármaco se libere en un plazo de 30 días. El stent Bicare es otro SLF sin polímero y de superficie nanoporosa que emplea tanto sirolimus como probucol. Estos dos stents tienen un diseño similar, y la única diferencia entre Bicare y Nano+ es el tipo de fármaco. Se incluyó a 30 pacientes con lesiones aparecidas de novo en el ensayo FIM de Bicare32. La PLT en el stent fue de 0,14 mm y la cobertura tisular de los struts fue del 98,3% según lo determinado mediante tomografía de coherencia óptica (OCT) a los 4 meses32. De igual modo, en el ensayo ISAR-TEST 5 se demostró la no inferioridad de los stents de sirolimus sin polímero y de los stents liberadores de probucol (Yukon Choice, Translumina) respecto a los stents liberadores de zotarolimus con polímero persistente (Medtronic Cardiovascular; Santa Clara, California, Estados Unidos) por lo que respecta a los MACE y la TS tras 1 año de seguimiento33. Actualmente se está realizando un estudio de poscomercialización del stent Nano+ en China, y se ha planificado otro ensayo destinado a obtener la aprobación de la marca CE en Europa.
Stents liberadores de fármacos con otras tecnologíasStent Cre8El Cre8 (CID; Saluggia, Italia) es un stent sin polímero que está íntegramente recubierto por una capa ultrafina de carbón pasivo (0,3μm) (i-Carbofilm, CID). La formulación de anfilimus, consistente en sirolimus (0,9 μg/mm2) con un excipiente formado por una mezcla de ácidos grasos de cadena larga que modula la liberación del fármaco, está cargada en reservorios abluminales. Se prevé una liberación completa del sirolimus en los primeros 3 meses tras el despliegue del stent. Se incluyó a un total de 323 pacientes en la asignación aleatoria al tratamiento con el stent Cre8 (162 pacientes) o el SLP TAXUS Liberté (161 pacientes) en el ensayo FIM NEXT34. El objetivo principal fue la PLT en el stent a los 6 meses, que fue significativamente inferior en el grupo de Cre8 (Cre8 0,14mm frente a SLP 0,34mm; p<0,0001). La incidencia acumulada de MACE (muerte cardiaca, IM y RLD) en el grupo de Cre8 fue del 6,7% a los 2 años, lo que indica que no hay diferencias respecto al SLP (7,1%). Tan sólo se observó 1 caso de TS tardía definitiva en cada grupo en un seguimiento de hasta 2 años35. Actualmente está en marcha un registro que incluye a todos los pacientes examinados (1.000) y se prevé completar la inclusión de casos a comienzos de 2013.
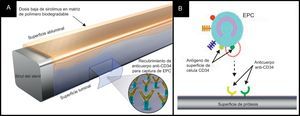
Stent ComboEl stent Combo (OrbusNeich Medical; Hong Kong, China) aplica la tecnología de captura de células progenitoras endoteliales para potenciar la cicatrización vascular (es decir, anticuerpos CD34 inmóviles en la superficie luminal del strut), e incorpora sirolimus DB abluminal y un polímero biodegradable en la tecnología actual de SLF (fig. 3). Datos de OCT y de histología a los 28 días en un modelo porcino indicaron que este stent híbrido fomenta la endotelización y reduce la formación y la inflamación de la neoíntima en comparación con el SLS Cypher y el stent de primera generación de células progenitoras endoteliales Genous36. El ensayo FIM REMEDEE incluyó en la asignación aleatoria a 180 pacientes al stent Combo (124 pacientes) o al SLP TAXUS Liberté (59 pacientes). La PLT en el stent a los 9 meses fue de 0,39mm en el grupo del Combo y de 0,44mm en el grupo de SLP (pno inferioridad=0,0012). Se observó reestenosis binaria en el 8,3% de los pacientes del grupo de Combo y el 13,5% de los pacientes del grupo de SLP (p=0,30). No se registraron casos de TS en ninguno de los dos grupos en un seguimiento de hasta 9 meses37. Serán necesarios nuevos estudios para determinar el efecto de fomento de la cicatrización y la eficacia clínica de este dispositivo.
El sistema de stent de tratamiento doble Combo. A: el stent Combo consta de una matriz de polímero biodegradable abluminal con una capa de anticuerpo CD-34 luminal y sirolimus. B: representación esquemática de la tecnología de captura de células progenitoras endoteliales. Los antígenos CD-34 de la superficie de las células progenitoras endoteliales se unen a los anticuerpos anti-CD34 en la superficie del stent y fomentan la endotelización. EPC: células progenitoras endoteliales.
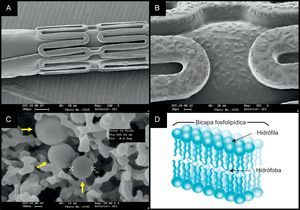
La plataforma de stent FOCUS np (Envision; Surat, India) utiliza un nuevo portador, una nanopartícula de doble capa de fosfolípidos que encapsula el sirolimus (fig. 4). El sirolimus encapsulado recubre la superficie del stent y el balón (108 μg de sirolimus en un sistema de 3,0×16,0 mm). Se ha programado una liberación completa del sirolimus en 28 días; sin embargo, la concentración de sirolimus en el tejido alcanza el máximo en las primeras 24 h. En un estudio preclínico del stent FOCUS np se observaron una PLT y unas puntuaciones de inflamación similares a las del SLS Cypher a los 28 días y a los 90 días. A comienzos de 2013 se completará un ensayo FIM38.
El stent liberador de sirolimus FOCUS np basado en nanotransportador. Imágenes de microscopio electrónico de barrido del stent aplicado (A) e imagen aumentada de la superficie del strut y el balón (B) recubierto por sirolimus encapsulado (C, flechas amarillas). El nanotransportador es una bicapa lipídica con una cabeza hidrófila y dos colas lipófilas/hidrófugas (D), y el fármaco se libera con el cambio de pH. Esta figura se muestra a todo color sólo en la versión electrónica del artículo.
Las estructuras bioabsorbibles (EBA) plenamente constituyen un nuevo enfoque, puesto que aportan un apoyo temporal al vaso sanguíneo, a diferencia del enjaulado permanente de los stents metálicos. El concepto de EBA lo introdujeron Stack et al. en 198839. Zidar et al. fueron los primeros en implantar una EBA de ácido poli-L-láctico (PLLA) en arterias femorales de perro40. A pesar de la degradación significativa de las estructuras con inflamación vascular de bajo grado en un seguimiento de 9 meses, esta tecnología no se desarrolló debido a la incapacidad de fabricar un polímero ideal que pudiera limitar la inflamación y la reestenosis41,42. En el 2000, Tamai et al. describieron su experiencia FIM con la implantación de EBA para el tratamiento de arterias coronarias humanas43. Este stent de PLLA «Igaki-Tamai» tiene un diseño único en espiral helicoidal en zigzag, con un grosor del strut de 170 μm. Este sistema era autoexpansible, pero requería también el hinchado de un balón con contraste calentado para su expansión. El estudio FIM del stent Igaki-Tamai (15 pacientes) no observó MACE o episodios de TS en 30 días, hubo 1 reintervención coronaria percutánea en el seguimiento realizado a los 6 meses. Nuestro grupo presentó los resultados de OCT 10 años después de la implantación de stents Igaki-Tamai, y demostró una ausencia de struts visibles, con recubrimiento endoluminal de la pared vascular44. Recientemente, Nishio et al. han descrito los resultados clínicos tras más de 10 años en los primeros 50 pacientes tratados con stents Igaki-Tamai. Las muestras de autopsia mostraron unos resultados histológicos interesantes, que indicaban una cicatrización de la neoíntima engrosada en el segmento tratado anteriormente con el stent, sin infiltración de células inflamatorias ni reacciones de cuerpo extraño. En las mediciones realizadas con angiografía coronaria cuantitativa, la PLT disminuyó de 0,91 mm a los 6 meses a 0,59mm a los 3 años, mientras que la ecografía intravascular (IVUS) mostró un aumento del área de la lámina elástica externa (15,0 mm2 después de la intervención y 16,9 mm2 a los 3 años). Estas observaciones indican que la arteria recuperó su capacidad de respuesta a un remodelado expansivo y un agrandamiento tardío de la luz una vez degradada la estructura.
Actualmente hay numerosas EBA en estudios clínicos o preclínicos. Se presenta un cuadro general de esta tecnología en la tabla 3 y la figura 5.
Cuadro general de estructuras bioabsorbibles actualmente en fase de investigación preclínica o clínica
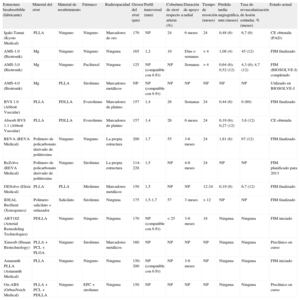
| Estructura bioabsorbible (fabricante) | Material del strut | Material de recubrimiento | Fármaco | Radioopacidad | Grosor del strut (μm) | Perfil transversal (mm) | Cobertura de stent respecto a arteria (%) | Duración de apoyo radial | Tiempo de resorción (meses) | Pérdida tardía angiográfica, mm (meses) | Tasa de revascularización de lesión estándar, % (meses) | Estado actual |
| Igaki-Tamai (Kyoto Medical) | PLLA | Ninguno | Ninguno | Marcadores de oro | 170 | NP | 24 | 6 meses | 24 | 0,48 (6) | 6,7 (6) | CE obtenida (PAD) |
| AMS-1.0 (Biotronik) | Mg | Ninguno | Ninguno | Ninguna | 165 | 1,2 | 10 | Días o semanas | < 4 | 1,08 (4) | 45 (12) | FIM finalizado |
| AMS-3,0 (Biotronik) | Mg | Ninguno | Paclitaxel | Ninguna | 125 | NP (compatible con 6 Fr) | NP | Semanas | > 4 | 0,64 (6); 0,52 (12) | 4,3 (6); 4,7 (12) | FIM (BIOSOLVE-I) completado |
| AMS-4.0 (Biotronik) | Mg | PLLA | Sirolimus | Marcadores metálicos | NP | NP (compatible con 6 Fr) | NP | NP | NP | NP | NP | Utilizado en BIOSOLVE-I |
| BVS 1.0 (Abbott Vascular) | PLLA | PDLLA | Everolimus | Marcadores de platino | 157 | 1,4 | 26 | Semanas | 24 | 0,44 (6) | 0 (60) | FIM finalizado |
| Absorb BVS 1.1 (Abbott Vascular) | PLLA | PDLLA | Everolimus | Marcadores de platino | 157 | 1,4 | 26 | 6 meses | 24 | 0,19 (6); 0,27 (12) | 3,6 (12) | CE obtenida |
| REVA (REVA Medical) | Polímero de policarbonato derivado de politirosina | Ninguno | Ninguno | La propia estructura | 200 | 1,7 | 55 | 3-6 meses | 24 | 1,81 (6) | 67 (12) | FIM finalizado |
| ReZolve (REVA Medical) | Polímero de policarbonato derivado de politirosina | Ninguno | Sirolimus | La propia estructura | 114-228 | 1,5 | NP | 4-6 meses | 24 | NP | NP | FIM planificado para 2013 |
| DESolve (Elixir Medical) | PLLA | PLLA | Miolimus | Marcadores metálicos | 150 | 1,5 | NP | NP | 12-24 | 0,19 (8) | 6,7 (12) | FIM finalizado |
| IDEAL BioStent (Xenogenics) | Polímero salicilato + enlazador | Salicilato | Sirolimus | Ninguna | 175 | 1,5-1,7 | 57 | 3 meses | > 12 | NP | NP | FIM finalizado |
| ART18Z (Arterial Remodeling Technologies) | PDLLA | Ninguno | Ninguno | Ninguna | 170 | NP (compatible con 6 Fr) | < 25 | 3-6 meses | 18 | Ninguna | Ninguna | FIM iniciado |
| Xinsorb (Huaan Biotechnology) | PLLA + PCL + PLGA | Ninguno | Sirolimus | Marcadores metálicos | 160 | NP | NP | NP | NP | Ninguna | Ninguna | Preclínico en curso |
| Amaranth PLLA (Amaranth Medical) | PLLA | Ninguno | Ninguno | Ninguna | 150-200 | NP (compatible con 6 Fr) | NP | 3-6 meses | NP | Ninguna | Ninguna | FIM iniciado |
| On-ABS (OrbusNeich Medical) | PLLA + PCL + PDLLA | Ninguno | EPC + sirolimus | Ninguna | 150 | NP | NP | NP | NP | Ninguna | Ninguna | Preclínico en curso |
CE: Conformité Européenne; EPC: células progenitoras endoteliales (tecnología de captura); FIM: primera vez en el ser humano; Mg: magnesio; NP: no procede; PAD: enfermedad arterial periférica; PCL: poli-L-lactato-co-ε-caprolactona; PDLLA: ácido poli-D,L-láctico; PLGA: poli-lactato-co-glucolato; PLLA: ácido poli-L-láctico.
El magnesio (Mg) es el cuarto catión más frecuente en el cuerpo humano. Es esencial para la síntesis de más de 300 enzimas y un cofactor de la ATPasa. La infusión de dosis altas de Mg puede causar vasodilatación y desarrollo de colaterales durante la isquemia. La degradación del Mg produce una carga eléctrica negativa que hace que el stent sea hipotrombogénico45.
El stent metálico absorbible de primera generación (AMS-1, Biotronik; Berlín, Alemania) estaba formado por un 93% de Mg y un 7% de metales del grupo de las tierras raras. En el modelo porcino, se observó que el AMS-1 sufría una endotelización rápida y se degradaba en gran parte para dar lugar a sales inorgánicas a los 60 días, con escasa respuesta inflamatoria asociada46. El ensayo PROGRESS del AMS es un estudio FIM de un solo grupo de pacientes, en el que se evaluó la eficacia y la seguridad de este stent en 63 sujetos con lesiones únicas de novo47. No se registró ningún caso de muerte, IM o TS en un seguimiento de hasta 12 meses. Resulta desalentador que la tasa de RLD fuera del 23,8% a los 4 meses y el 45% a los 12 meses. La PLT en el stent fue de 1,08mm, y en el seguimiento angiográfico realizado a los 4 meses la función vasodilatadora después de la administración de nitroglicerina pareció restablecerse en el segmento tratado con el stent48. Los datos de IVUS indican que el aumento de la PLT es atribuible a un aumento de formación de neoíntima y una resistencia radial insuficiente de la aleación de Mg, debido a la degradación rápida del stent, que daba lugar a un retraimiento del vaso. Esto ha hecho que se hayan desarrollado nuevos stents, el AMS-2 y el AMS-3. El AMS-2 se diseñó para abordar el exceso de retraimiento vascular observado con el AMS-1. Su empleo proporcionó una integridad mecánica prolongada por el uso de una aleación de Mg diferente, que no sólo resiste unas compresiones superiores, sino también un tiempo de degradación más largo. Además, el grosor del strut se redujo de 165 a 125 μm y la forma del corte transversal del strut se modificó de rectangular a cuadrada. Estas modificaciones facilitaron una integridad mecánica prolongada y una mejora de la resistencia radial y dieron lugar a una reducción de la proliferación de neoíntima en estudios realizados en animales. El stent AMS-3 (AMS liberador de fármaco [DREAMS]) se diseñó para incorporar una matriz bioabsorbible para la liberación controlada de paclitaxel con la plataforma AMS-2. Este dispositivo se evaluó en el ensayo BIOSOLVE-I (46 pacientes), y se demostró una PLT en el stent de 0,64 mm a los 6 meses y 0,52 mm a los 12 meses. La tasa de FLD fue del 7,0% tras un seguimiento de 12 meses, debido a 2 RLD por motivo clínico y 1 IM periintervención49. El DREAMS de segunda generación tiene una plataforma de stent modificada y utiliza sirolimus como fármaco antiproliferativo. En 2013 se iniciará el estudio BIOSOLVE-II, que tiene como objetivo evaluar la seguridad y la eficacia de este dispositivo.
Estructura de ácido poli-L-láctico liberadora de everolimus: Absorb BVSEl armazón del Absorb BVS (Abbott Vascular; Santa Clara, California, Estados Unidos) está hecho de PLLA. El recubrimiento consiste en poli-D,L-lactato (PDLLA), un copolímero aleatorio del ácido D-láctico y el ácido L-láctico, con una cristalinidad inferior a la de la estructura de PLLA. El recubrimiento de PDLLA controla la liberación del fármaco antiproliferativo everolimus. El Absorb BVS de primera generación (1.0) se evaluó en 30 pacientes incluidos en el ensayo FIM ABSORB (cohorte A). En este ensayo se utilizaron múltiples técnicas de diagnóstico por imagen y los resultados se resumen así: a) bioabsorción parcial de los struts poliméricos; b) ampliación tardía de la luz al cabo de entre 6 meses y 2 años; c) restablecimiento de la función vasomotora y la función endotelial a los 2 años; d) persistencia de la deformabilidad del andamiaje de la placa, documentada mediante palpografía, y e) posibilidad de examen con técnicas de imagen no invasivas usando tomografía computarizada multicorte50,51. Se dispone de un seguimiento de 5 años de 29 pacientes52. Sólo 1 paciente sufrió un IM sin onda Q relacionado con el tratamiento en una estenosis sin limitación de flujo a los 46 días de la implantación del Absorb BVS. No hubo ningún episodio de TS en todo el periodo y no se registró ningún MACE entre los 6 meses y los 5 años, con lo que la tasa general de MACE fue del 3,4% a los 5 años. La retracción tardía de la estructura fue la principal razón del aumento de la PLT en el stent (0,44mm) a los 6 meses. El área luminal se redujo en un 16,6%, mientras que el retraimiento tardío fue del 11,7%53. Para potenciar la resistencia radial de los struts y reducir el retraimiento tardío, se modificó el diseño y el proceso de fabricación del strut en el Absorb BVS de segunda generación (1.1). En primer lugar, el nuevo diseño utilizó unos aros en zigzag en fase unidos mediante puentes que permitían una distribución más uniforme de los struts. Esta estructura de nuevo diseño redujo el área circular máxima sin apoyo, lo que aportó mayor uniformidad al apoyo de la pared vascular y la liberación del fármaco. En segundo lugar, una modificación del proceso de fabricación dio lugar a una hidrolisis (degradación in vivo) del polímero más lenta, lo cual permitió prolongar su integridad mecánica54.
El Absorb BVS 1.1 se evaluó en 101 pacientes de la cohorte B del ensayo ABSORB. Esta cohorte se dividió en dos subgrupos: en el primero (B1) se utilizaron técnicas de imagen invasivas con angiografía coronaria cuantitativa, IVUS y OCT después de la intervención, a los 6 y a los 24 meses. En el segundo (B2) se utilizaron técnicas de imagen invasivas después de la intervención, a los 12 y a los 36 meses. En el conjunto de la población de la cohorte B, la tasa general de MACE fue del 9,0%, incluidos 3 casos de IM sin onda Q y 6 de RLD por causa isquémica, sin ninguna muerte cardiaca durante el seguimiento de 2 años. No hubo trombosis posible, probable o definitiva de la estructura, a pesar del tratamiento antiagregante plaquetario combinado doble en el 97% a los 6 meses, el 81,2% a los 12 meses y el 24,8% a los 24 meses.
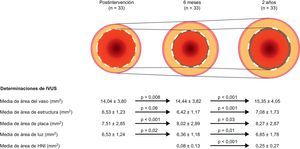
De la población de la cohorte B1, están disponibles los resultados de las exploraciones por imagen seriadas en múltiples modalidades55. Los análisis angiográficos seriados indican que la PLT en la estructura de 0,16mm a los 6 meses aumentó a 0,27 mm a los 2 años. Es de destacar que los análisis de IVUS seriadas muestran que el área media de la luz aumentaba, mientras que el área mínima de la luz se mantenía estable entre los 6 meses y los 2 años (fig. 6). El porcentaje de área hiperecogénica, que es un indicador más sensible para medir la degradación de un material polimérico, se redujo del 25,3 tras la intervención al 20,4 a los 6 meses y a 13,8% a los 2 años. De manera similar a lo observado con la IVUS, los estudios seriados de OCT confirman el aumento progresivo del área media de la estructura, que pasó de 7,47 mm2 después de la intervención a 7,70 mm2 a los 6 meses y 8,24 mm2 a los 24 meses.
Los resultados prometedores del Absorb BVS constituyen una prueba de concepto de que este dispositivo permite obtener una revascularización adecuada de los vasos coronarios y prevenir la reestenosis. El Absorb BVS obtuvo la aprobación para la marca CE en enero de 2011, y desde septiembre de 2012 se comercializa en diferentes diámetros (2,5, 3,0 y 3,5 mm) y longitudes (12, 18 y 28 mm). El registro ABSORB-EXTEND (~800 pacientes) está evaluando este dispositivo actualmente. Al mismo tiempo, se está llevando a cabo en Europa un ensayo fundamental de registro, el ABSORB II, en el que se compara el Absorb BVS con el SLE Xience Prime (Abbott Vascular) en 500 pacientes.
Stent de policarbonato de tirosinaEl stent REVA (REVA Medical; San Diego, California, Estados Unidos) consta de un policarbonato derivado de tirosina que se degrada hasta dar lugar a agua, dióxido de carbono y etanol. Además de ser radioopaco, el stent REVA tiene un diseño peculiar de «deslizamiento y bloqueo» que le proporciona flexibilidad. Este diseño mantiene la ganancia de luz inmediatamente tras el despliegue del stent y proporciona un apoyo adicional a la estructura durante el remodelado vascular. El ensayo FIM RESORB incluyó a un total de 27. La PLT en el stent fue decepcionantemente alta (1,81 mm) y los datos de IVUS no mostraron retracción del vaso según lo indicado por el área de la lámina elástica externa (15,5 mm2 después de la intervención y 15,3 mm2 a los 6 meses). Hubo una tasa de RLD elevada (66,7%) entre los 4 y los 6 meses, en su mayor por excesiva hiperplasia de neoíntima56. El stent ReZolve de segunda generación utiliza un polímero más resistente, un sistema de deslizamiento «en espiral» y bloqueo con recubrimiento de sirolimus. Además, el ReZolve2 tiene un perfil menor (1,52 mm) y alcanza aproximadamente un 30% de aumento de la resistencia radial. Se analizan actualmente la seguridad y la eficacia de los stents ReZolve y ReZolve2 en el estudio RESTORE (50 pacientes), que se inició en diciembre de 2011. Los datos preliminares (26 pacientes) muestran que la tasa de éxitos técnicos es del 85%, debido al fallo de la aplicación observado en 4 pacientes. En un seguimiento de 6 meses, se observaron dos casos de RLD como episodios de la variable de valoración principal57.
Estructura de ácido poli-L-láctico liberadora de miolimus: DESolveLa EBA DESolve (Elixir Medical; Sunnyvale, California, Estados Unidos) tiene un armazón de PLLA similar al del Absorb BVS, pero con recubrimiento de miolimus (3 μg/mm), una lactona macrocíclica inhibidora de mTOR, análogo de sirolimus. Se ha alcanzado una resistencia radial suficiente durante 3 meses y se ha observado la bioabsorción de la estructura en un plazo de entre 1 y 2 años. El ensayo FIM DESolve-I (16 pacientes) mostró una tasa de retracción aguda del 6,4%, y la PLT en la estructura fue de 0,19 mm a los 6 meses58. En los exámenes por IVUS, los respectivos valores de área media de la estructura y de área de la luz fueron 5,35 y 5,35 mm2 después de la intervención, y 5,61 y 5,10 mm2 a los 6 meses (p = no significativa). La OCT reveló que el 98,7% de los struts estaban recubiertos a los 6 meses. Todos los pacientes fueron objeto de seguimiento clínico de hasta 1 año, y 3 de ellos sufrieron MACE: 1 muerte cardiaca, 1 IM del vaso diana y 1 RLD. Ningún paciente presentó signos de TS. El ensayo DESolve Nx se encuentra actualmente en periodo de reclutamiento de 120 pacientes tratados con el stent de nueva generación DESolve Nx con novolimus (5 μg/mm), que es un metabolito activo de sirolimus59.
Stent de ácido polisalicílico: IDEALLa EBA IDEAL BRS (Xenogenics Corp.; Canton, Massachusetts, Estados Unidos) tiene dos componentes: el armazón y la capa de fármaco. El armazón del dispositivo está hecho de polilactato anhidro mixto, con un polímero de unión de ácido salicílico y ácido sebácico. La capa de fármaco está formada por salicilato, que controla la liberación del fármaco antiproliferativo sirolimus. La presencia de ácido salicílico proporciona al dispositivo las propiedades antiinflamatorias que se han confirmado en estudios preclínicos60. La EBA IDEAL se evaluó en un pequeño número de casos (11 pacientes) en 2008. Aunque este estudio no se ha publicado de forma completa, hubo una supresión insuficiente de la neoíntima y reducción del área luminal por dosis insuficiente del fármaco y liberación rápida del sirolimus61. La segunda generación del IDEAL BioStent tiene una dosis de fármaco superior, una cinética de liberación más lenta y un perfil del sistema más pequeño. El dispositivo actualmente es objeto de una evaluación preclínica.
Estructura bioabsorbible de Arterial Remodeling TechnologiesLa EBA de ART (Arterial Remodeling Technologies; Noisy le Roi, Francia) se elabora a partir de un polímero amorfo de PDLLA sin fármaco antiproliferativo. Este dispositivo es compatible con el calibre 6 Fr y proporciona una estructura temporal durante 5-7 meses. Se produce una absorción completa en un plazo de 18 meses. Se compararon los resultados de la EBA de ART con los del SMSR en modelos de conejo y de cerdo, y no se registró ningún MACE. La retracción aguda fue comparable a la del SMSR. Es interesante señalar que los análisis angiográficos mostraron el fenómeno de agrandamiento tardío de la luz, así como un aumento del área de la lámina elástica externa detectado mediante IVUS a los 9 meses. A la vista de los resultados obtenidos en los estudios preclínicos, se ha iniciado ya el ensayo FIM ARTDIVA, que está reclutando a pacientes en cinco centros de Francia. El objetivo es evaluar los resultados clínicos a los 6 meses62.
Estructura bioabsorbible XinsorbLa EBA Xinsorb (Huaan Biotechnology; Laiwu, China) es una estructura cargada con sirolimus, plenamente bioabsorbible, formada por PLLA, polilactato coglucolato y poli-L-lactato-co- ε-caprolactona. En un estudio experimental se ha evaluado la factibilidad de la EBA Xinsorb en comparación con el SLF Excel (JW Medical; Shandong, China). Se implantaron 16 estructuras Xinsorb y 16 stents Excel en arterias coronarias de modelos porcinos63. La cinética de liberación del fármaco in vitro indicó que el 78% del sirolimus se libera de la EBA Xinsorb en los primeros 14 días. La histomorfometría mostró un porcentaje de reestenosis del diámetro significativamente inferior en el grupo de EBA Xinsorb en comparación con el grupo de SLF Excel (el 18,6 frente al 21,4% a los 30 días y el 24,5 frente al 27,7% a los 90 días, respectivamente). Además, los struts de la EBA Xinsorb estaban cubiertos por completo por neoíntima a los 90 días64. Aunque estos resultados preliminares son alentadores, se necesitan nuevos estudios preclínicos amplios para determinar la seguridad y la eficacia de este dispositivo. La compañía prevé organizar un ensayo FIM en 2013.
Otras estructuras bioabsorbiblesLa estructura de PLLA Amaranth (Amaranth Medical; Mountain View, California, Estados Unidos) y la On-ABS (OrbusNeich Medical) se encuentran actualmente en fase de evaluación preclínica. Además, hay otros dispositivos que están aún en fase de desarrollo. Entre ellos se encuentran las EBA Sahajanand (Sahajanand Medical Technologies; Surat, India), la EBA Avatar (S3V; Hyderabad, India), la EBA MeRes (Meril Life Sciences; Vapi, Gujarat, India) y la EBA Zorion (Zorion Medical; Indianapolis, Indiana, Estados Unidos).
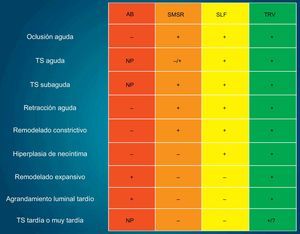
PERSPECTIVAS FUTURASEl nuevo enemigo en la era de los SLF —la TS— ha acelerado la evolución tecnológica en la cardiología intervencionista. Los SLF de nueva generación, con polímeros biodegradables, han mostrado una reducción impresionante de la TSMT, lo que ha contribuido a mejorar los resultados a largo plazo, en comparación con los SLF de primera generación. Las EBA o los SLF sin polímero son tecnologías relativamente nuevas sobre las que se están realizando todavía muchos ensayos. Las técnicas de diagnóstico por imagen angiográficas e intravasculares actualmente están disponibles y los datos clínicos sugieren una eficacia y seguridad aceptables de estas nuevas tecnologías. Sin embargo, sigue sin estar claro si los SLF de polímeros biodegradables o los SLF sin polímeros pueden minimizar los episodios de TS tardíos, sobre todo teniendo en cuenta que estos episodios tardíos se han observado también en pacientes tratados con SMSR65,66. Además, teniendo en cuenta las consecuencias mortales de la TS, el centro de interés debe seguir siendo eliminar esta complicación grave, más que minimizarla. Hay una diferencia de concepto fundamental entre las tecnologías de SLF y EBA, puesto que esta tiene la capacidad de liberar al vaso sanguíneo de la jaula metálica permanente. Así pues, la tecnología de la EBA tiene una ventaja teórica en cuanto a la reducción de la TS, debido a la eliminación de las prótesis endoluminales. La EBA facilita también el restablecimiento de la función vasomotora, lo que indirectamente comporta una curación completa del vaso. Al conjunto del proceso de este tratamiento se le ha denominado tratamiento de reparación vascular (fig. 7)67.
Representación esquemática en la que se muestra la evolución de las intervenciones coronarias percutáneas. AB: angioplastia con balón; NP: no procede debido a la ausencia de stent; SLF: stents metálicos liberadores de fármacos; SMSR: stents metálicos sin recubrimiento; TRV: tratamiento de reparación vascular; TS: trombosis en el stent. «+» significa evitado o no limitado, mientras que «–» significa no evitado o limitado. Modificado con permiso de Serruys et al67.
Una posible evolución de la lesión estenótica tratada con stents metálicos es la formación de un tejido de neoíntima en el interior del stent, formación que se observa incluso con los SLF, el fármaco antiproliferativo retarda o pospone el fenómeno. Este tejido de neoíntima, a su vez, sufre aterosclerosis y degeneración a placa vulnerable, y finalmente a rotura en el interior de la jaula del stent, es decir, una neoaterosclerosis68,69. Un stent metálico rígido puede modificar también la geometría y la biomecánica del vaso, lo que puede conducir a alteraciones del flujo a largo plazo e irritación crónica, además del riesgo de fracturas tardías de los struts, que pueden contribuir a producir la reestenosis y los eventos clínicos adversos70,71. Desde una perspectiva fisiológica, la ausencia de una jaula metálica rígida facilita el restablecimiento de la función vasomotora, el estrés tangencial adaptativo y el agrandamiento tardío de la luz. Después de la bioabsorción, no habría desencadenantes para la trombosis, como struts sin recubrimiento o polímeros permanentes. La ausencia de cuerpos extraños puede reducir también la preocupación respecto a futuras opciones de tratamiento, como que se impida una cirugía de revascularización, y las necesidades de tratamiento antiagregante plaquetario combinado doble, con una posible reducción de las complicaciones hemorrágicas asociadas a dicho tratamiento. Dado que las EBA solamente se han evaluado en un pequeño número de pacientes con lesiones no complejas, la utilidad de estos dispositivos en lesiones complejas requerirá evaluación clínica adicional. Además, serán necesarias nuevas exploraciones diagnósticas para establecer si la tecnología de EBA es superior a la de los SLF metálicos permanentes.
CONCLUSIONESLa tecnología de los nuevos SLF metálicos ha mostrado una reducción del riesgo de revascularización y de los episodios de TS. Sin embargo, el diseño óptimo de estructuras, polímeros, fármacos antiproliferativos y sus cinéticas de degradación/liberación están todavía en fase de investigación. Se prevé que la tecnología de EBA no solamente elimine el riesgo de TSMT, sino que contribuya también a restablecer la función fisiológica de los vasos tratados. Aunque serán necesarios nuevos avances técnicos y una evaluación clínica antes de que las EBA puedan ser aceptadas como el más avanzado dispositivo para el tratamiento de la enfermedad coronaria, esta nueva tecnología parece prometedora y podría constituir la próxima revolución de la cardiología intervencionista.
CONFLICTO DE INTERESESNinguno.