Palabras clave
En las enfermedades autoinmunitarias y en determinados procesos patológicos con alteraciones del sistema inmunológico, se detectan concentraciones elevadas de autoanticuerpos (AAC) que reaccionan con autoantígenos (AAG). Los AAC son huellas o señales de respuestas inmunitarias que pueden ser el resultado de estímulos desconocidos (infecciones, drogas, agentes medioambientales, alimentos, metales, etc.) o secundarias a lesiones previas con destrucción tisular1-5.
Un AAG es, por definición, cualquier molécula del individuo capaz de reaccionar con los brazos efectores de la respuesta inmunitaria del propio sujeto6. Los AAC están dirigidos contra un amplio espectro de AAG, localizados en el órgano de la lesión autoinmunitaria. La patogenicidad de los AAC depende de su actividad, de la accesibilidad a las dianas antigénicas y de la acción de los mecanismos efectores de la respuesta inmunitaria.
Distintas enfermedades con afección cardiológica, como la fiebre reumática, las miocarditis, la miocardiopatía dilatada (MD), los síndromes pospericardiotomía y las enfermedades del colágeno con afección cardíaca, se acompañan de respuestas inmunopatológicas (aunque no estén catalogadas como enfermedades autoinmunitarias). En pacientes con MD se ha identificado una gran variedad de AAC que reaccionan contra AAG cardíacos. Aún no queda claro su papel fisiopatológico, pudiendo tratarse de agentes patógenos o de epifenómenos secundarios a una agresión tisular. En cualquier caso, su presencia en muestras biológicas es un marcador diagnóstico de enfermedad, con significación patológica si acompaña a un estado de enfermedad consecuencia de una respuesta autoinmunitaria7.
Los diferentes AAG (y sus correspondientes AAC) encontrados en la MD se pueden clasificar, dependiendo de su localización en la célula, en: AAG de la membrana plasmática, AAG del citoesqueleto y AAG de estructuras internas (tabla 1).
AAG de la membrana plasmática
Se han identificado AAC dirigidos frente a receptores específicos de membrana ligados a proteínas G (receptores β1 adrenérgicos y muscarínicos colinérgicos). La unión antígeno (receptor)-autoanticuerpo (AAC) altera la actividad funcional del receptor, lo que puede producir inhibición o estimulación del mismo8.
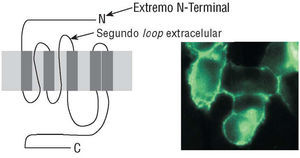
Entre los distintos AAC encontrados en pacientes con MD se incluyen los anticuerpos antirreceptor β1 y, más concretamente, contra sus epítopos inmunoactivos: segundo loop extracelular y extremo N-terminal del receptor9 (fig. 1).
Fig. 1. Receptor β1.
Es posible que los AAC encontrados en pacientes con MD sean meros marcadores pasivos del proceso. Sin embargo, algunos hallazgos sugieren un papel más activo de los mismos. Wallukat et al demostraron que los AAC antirreceptor β1 poseen un efecto agonista sobre el receptor, con la particularidad de que no provocan desensibilización del mismo10. El fenómeno de desensibilización es un mecanismo de retroalimentación negativo que protege al miocardio de una sobreexposición crónica a la estimulación betaadrenérgica, reduciendo el número de receptores en la superficie celular (ya sea mediante su inactivación o su destrucción). Probablemente, este fenómeno explique por qué la administración de estimulantes betaadrenérgicos en las fases agudas de la insuficiencia cardíaca consigue una respuesta inicial favorable y, sin embargo, si se mantiene en el tiempo, pierde su efecto o incluso puede resultar perjudicial al comportarse como una estimulación simpática crónica.
Los AAC, al unirse al receptor, inducen su activación, comportándose como agonistas simpáticos. Sin embargo, a diferencia de la estimulación simpática fisiológica, no inducen desensibilización de los receptores por provocar una unión no competitiva con los mismos, impidiendo el desplazamiento del agonista (AAC) del receptor β. La inexistencia de desensibilización perpetúa la activación del receptor, con los efectos deletéreos que la sobrestimulación adrenérgica crónica comporta.
Por contra, la administración de bloqueadores beta en las fases estables de la insuficiencia cardíaca tendría el efecto contrario, al inducir un mecanismo de retroalimentación positivo que incrementa secundariamente el número de receptores β, permitiendo una respuesta eficaz a una posterior estimulación por catecolaminas11.
La prevalencia de estos AAC en los pacientes con MD idiopática varía del 30 al 95% según los distintos autores12. Sin embargo, en MD de otras etiologías (valvular, hipertensiva) y en individuos sanos, se observa una baja prevalencia y un menor título13-15. La evolución del título de estos AAC en la MD no es bien conocida. En algunos estudios se ha observado que disminuyen con la progresión de la enfermedad, haciéndose casi indetectables en fases tardías, lo que podría estar en relación con el grado de fibrosis miocárdica que se va desarrollando. Si esto fuera así, la determinación de los valores de AAC podría utilizarse como un marcador no invasivo de cardiomiopatía, lo que permitiría establecer su fase de evolución. A favor de esta teoría se encuentra el estudio realizado por Caforio et al16, en el que la presencia de AAC en el diagnóstico de MD estaba asociada a menores síntomas y mayor capacidad de ejercicio (fase más temprana de la evolución), y la persistencia de anticuerpos en el seguimiento se asociaba con una enfermedad estable, lo que indicaría un menor grado de fibrosis.
Existen evidencias directas de que los anticuerpos antirreceptor muscarínico también se encuentran en la patogenia de la MD. Fu et al demostraron en estudios experimentales realizados en ratones que, tras la inyección del péptido sintético que correspondía al segundo loop extracelular del receptor humano de acetilcolina M2, se inducían cambios morfológicos similares a los encontrados en la MD17. Estos AAC contra el receptor muscarínico M2 están presentes en el suero de pacientes con MD idiopática en una mayor proporción que en otras etiologías. En un estudio realizado por Fu et al se observó que el 38% de los sueros de pacientes con MD idiopática presentaba anticuerpos contra el segundo loop extracelular del receptor M2, lo que no se observaba en ningún paciente con miocardiopatía de otra etiología15.
AAG del citoesqueleto
En pacientes con MD también se han observado AAC frente a proteínas intracelulares, como la miosina, la actina, la tropomiosina, etc. Al ser estructuras intracelulares y, por tanto, no expuestas al contacto con el sistema inmunitario, no cabría esperar la activación de éste. Sin embargo, determinadas circunstancias, como una necrosis tisular (secundaria a infección viral u otras causas), facilitaría la exposición de estas proteínas intracelulares, favoreciendo la respuesta autoinmunitaria. Esta exposición de proteínas intracelulares al sistema inmunológico permitiría, por tanto, relacionar la presencia de AAC y daño miocárdico18. Dangas et al19 realizaron un estudio observacional en pacientes con distintos síndromes coronarios agudos en el que demostraron que la presencia de AAC contra actina y miosina y su concentración están en proporción directa al daño miocárdico (medido por troponina I), lo cual conlleva implicaciones pronósticas: en el momento de su ingreso, todos los pacientes que sufrieron un infarto de miocardio presentaban una troponina I elevada y eran positivos para AAC antiactina y antimiosina. La persistencia de AAC antiactina y antimiosina tras 1 y 3 meses del acontecimiento coronario eran predictores de infarto de miocardio tardío.
Otro posible mecanismo de reacción autoinmunitaria frente a componentes intracelulares, sin que medie necrosis tisular, es el mimetismo molecular. Un virus podría provocar autosensibilización a las proteínas intracelulares si existiese similitud entre los antígenos exógenos (viral) y los endógenos (proteínas intracelulares). La respuesta inmunitaria ante el estímulo exógeno lesionaría también los antígenos del huésped20. En este sentido, diversos estudios han confirmado que anticuerpos monoclonales contra el virus Coxsackie B4 reaccionan con el músculo cardíaco, o que anticuerpos monoclonales contra la cápside proteica del Coxsackie VP-1 reaccionan con la cadena pesada de la miosina21.
En los pacientes con miocarditis se ha observado una notable prevalencia (52%) de AAC antimiosina22. Los pacientes con miocarditis sin AAC antimiosina evolucionan mejor clínicamente, mejorando su fracción de eyección con el tiempo, mientras que la presencia de estos AAC se asocia con empeoramiento de la fracción de eyección y mayor «rigidez» diastólica.
En pacientes con MD se han observado AAC contra la cadena pesada alfa (específica del tejido auricular) y beta (de ventrículo y músculo esquelético) de la miosina. Estos AAC se observan en una mayor proporción en los casos de MD idiopática que en pacientes con MD de otras etiologías23. Caforio et al han documentado que, en familiares asintomáticos de pacientes con MD, la presencia de AAC se observa en sujetos más jóvenes, con un mayor diámetro telediastólico del ventrículo izquierdo y peor función ventricular24.
Otros AAC del citoesqueleto encontrados con frecuencia en pacientes con MD son los AAC contra actina y tropomiosina. Los AAC antitropomiosina pueden observarse también en pacientes isquémicos y valvulares, pero no aparecen en sujetos normales ni en pacientes con miocardiopatía hipertrófica25,26.
AAG de estructuras internas
Otros componentes intracelulares han demostrado capacidad antigénica. Entre ellos cabe citar: AAG mitocondriales (M7 o flavoproteína), el adenine nucleotide translocator (ANT), el grupo de las cetoalfa ácido deshidrogenasa, AAG del retículo sarcoplasmático (ATP-asa del retículo sarcoplasmático) o proteínas de choque térmico.
Los AAC antimitocondriales dañarían el mecanismo energético de la célula actuando sobre diferentes enzimas mitocondriales. En pacientes con miocarditis y MD se han observado AAC antimitocondriales (anti-M7), que parecen estar dirigidos contra una flavoproteína de la membrana mitocondrial. Estos AAC antiflavoenzima se observaron en el 36% de los pacientes con MD y en el 25% de los pacientes con miocarditis, pero no en sujetos sanos27,28. La ANT es otra proteína intrínseca de la membrana mitocondrial que interviene en el mecanismo energético de la célula, permitiendo el transporte ADP/ATP transmembrana. En diferentes estudios experimentales y clínicos se ha observado que los AAC contra la ANT inhiben el transporte de nucleótidos transmembrana y, por tanto, pueden ser responsables de un empeoramiento de la función miocárdica. Estos anticuerpos se han detectado en pacientes con miocarditis y con MD idiopática, pero no en pacientes con MD de otras etiologías29-31.
Ansari et al demostraron también que el 60% de los pacientes con MD idiopática presentaba concentraciones elevadas de AAC contra BCKD (branched chain alpha-ketoacid dehydrogenase complex proteins). En cambio, no encontraron AAC en controles voluntarios sanos y solamente en el 4% de los pacientes con MD de origen isquémico32,33.
Es sabido que el transporte de calcio mediado por la ATP-asa del retículo sarcoplasmático del miocito está disminuido en pacientes con MD. Aunque los mecanismos aún no están claros, se sospecha que la existencia de AAC contra esta enzima desempeñaría un papel en la modificación de la función del retículo sarcoplasmático en, al menos, un tercio de los pacientes con MD. También se han observado diferencias en los mecanismos de disfunción del retículo sarcoplasmático de miocitos entre pacientes con MD isquémica y MD idiopática34,35.
Las proteínas de choque térmico o HSP (heat shock proteins) forman parte de la respuesta defensiva de la célula ante situaciones de estrés. En un principio se interpretó la expresión de las HSP como marcadores de daño celular, pero hoy día está ampliamente documentado su papel citoprotector contra el daño molecular en una amplia variedad de enfermedades. La célula que incrementa la expresión de HSP ante una situación de agresión se convierte en un objetivo de la respuesta inmunitaria, con la formación de AAC contra estas proteínas. Aún se conoce poco de la expresión de las HSP en el fracaso cardíaco, pero se ha comprobado que los valores de AAC contra la HSP 27, HSP 60, HSP 70 y HSC (heat shock cognate protein) se encuentran aumentados al menos el doble en pacientes con MD en comparación con sujetos sanos36,37.
IMPLICACIONES TERAPÉUTICAS
Paralelamente, y a medida que se postulaba la hipótesis etiopatológica autoinmunitaria de la MD, fueron apareciendo los primeros ensayos terapéuticos basados en la misma (tabla 2). Sin embargo, la extrapolación de los resultados de muchos de los estudios que comentaremos a la práctica clínica tropieza con dos dificultades: una de carácter general se refiere a la metodología y diseño de los estudios (tamaño y características de la muestra, precisión en el diagnóstico de MD idiopática, grado evolutivo de la enfermedad, tratamientos acompañantes, especialmente desde la incorporación de inhibidores de la enzima conversiva de la angiotensina [IECA] y bloqueadores beta, etc.); la segunda dificultad deriva del difícil diagnóstico diferencial entre miocarditis en evolución a MD y MD en su fase inicial de evolución.
Tratamiento inmunodepresor
Muchos de los ensayos con terapia inmunodepresora se realizan en pacientes con diagnóstico de presunción de miocarditis, mientras otros incluyen a pacientes con diagnóstico clínico de MD idiopática con hallazgos histológicos sugestivos de «proceso inflamatorio agudo».
El tratamiento de la MD y la miocarditis con fármacos inmunodepresores presenta resultados controvertidos, ya que se han publicado efectos tanto beneficiosos como nocivos. Parrillo et al38 realizaron el primer estudio (aleatorizado y prospectivo, con grupo control y doble ciego) sobre los efectos de la prednisona en 102 pacientes diagnosticados de MD idiopática de más de 8 meses y menos de 2 años de evolución desde el diagnóstico, y clasificados según los hallazgos histológicos derivados de la biopsia miocárdica en «reactivos» (presencia de infiltrado linfocitario o de fibroblastos, depósito de inmunoglob ulinas, un test de captación cardíaca de galio positivo o elevación de velocidad de sedimentación globular) y «no reactivos» (ausencia de los hallazgos mencionados). A corto plazo (3 meses) los pacientes incluidos en el grupo tratado con prednisona y con biopsia «reactiva» presentaron una mejoría estadísticamente significativa de la fracción de eyección del ventrículo izquierdo (FEVI) (18-23%). Sin embargo, esta mejoría inicial no se mantenía a los 9 y 15 meses de seguimiento. El grupo de pacientes con biopsia «no reactiva» presentó una mejoría relativa que no fue estadísticamente significativa. A los 9 meses de seguimiento no había diferencias significativas entre ambos grupos (tratamiento y control). Los autores concluyen que el tratamiento con prednisona induce una ligera mejoría en la FEVI, que no se mantiene a largo plazo. Esta discreta mejoría, junto con los importantes efectos secundarios asociados al tratamiento con corticoides, no justifica el uso de esta terapéutica de forma estándar en pacientes con MD.
Mason et al39 publicaron en 1995 el mayor ensayo clínico en pacientes con miocarditis en el que se evaluó el posible efecto beneficioso de una terapia inmunodepresora con prednisona y azatioprina o ciclosporina, concluyendo que no está justificado el uso rutinario de inmunodepresores. Otros estudios realizados en niños sobre el efecto de fármacos inmunodepresores no esteroideos (azatioprina, ciclosporina) en grupos reducidos de pacientes diagnosticados de MD secundaria a miocarditis documentada por biopsia endomiocárdica, han documentado una mejoría significativa en parámetros histológicos y de función ventricular en los casos en los que se utilizó una terapia combinada de ciclosporina o azatioprina más prednisona, pero no tras la utilización de prednisona aislada40,41.
Creemos que el conjunto de la información disponible en la actualidad no aporta evidencia suficiente como para justificar el empleo sistemático de terapia inmunodepresora en pacientes con MD idiopática, tengan o no evidencia histológica de inflamación aguda, siendo tan sólo una recomendación clase IIb en pacientes graves sin alternativas terapéuticas42.
Tratamiento antiinflamatorio-inmunomodulador
La presencia de valores elevados de mediadores de la inflamación en pacientes con MD (TNF-α, IL-1, IL-6) se ha interpretado no sólo como expresión de la activación inmunitaria, sino también como inductores de la disfunción miocárdica a través de varios mecanismos inductores-reguladores de la apoptosis43-45.
La insuficiencia cardíaca crónica se asocia con una activación celular inflamatoria crónica, como lo demuestran las concentraciones elevadas de citocinas circulantes y de sus receptores solubles, así como valores elevados de las moléculas de adhesión circulantes. Las citocinas inflamatorias desempeñan un importante papel en la patogenia del fallo cardíaco. Las concentraciones plasmáticas de TNF-α (una citocina producida por los macrófagos, células endoteliales y miocitos entre otras células) están significativamente elevadas en pacientes con MD y parece que sus valores plasmáticos se correlacionan con la severidad de los síntomas, por lo que podrían utilizarse como indicadores de mal pronóstico46. Varios estudios han demostrado los efectos que esta citocina induce en el miocardio y que, en síntesis, reproducen la situación de MD (dilatación y disfunción ventricular izquierda). Skudicky et al47,48 analizaron los efectos de la pentoxifilina (una xantina que reduce o suprime la producción de TNF-α e inhibe la apoptosis in vitro e in vivo) en pacientes diagnosticados de MD (en clase funcional II-III de la NYHA y FEVI < 40%). Estos estudios revelan que los pacientes que reciben pentoxifilina (además del tratamiento convencional, incluyendo bloqueadores beta) durante 6 meses mejoran de forma significativa tanto la clase funcional como la FEVI. Todos los pacientes que recibieron tratamiento con pentoxifilina presentaron una reducción de las concentraciones de TNF-α, y esta reducción fue mayor en aquellos con una mayor mejoría.
Deswal et al, en un estudio con 18 pacientes en clase III de la NYHA (aleatorio, con grupo placebo y doble ciego) demuestran cómo la administración intravenosa de etanercept (un antagonista específico del TNF-α) mejoraba tanto la clase funcional (mejoría de índices de calidad de vida y distancia en la prueba de 6 min andando) como la FEVI, al tiempo que disminuían los valores de TNF activo49.
Inmunoglobulinas intravenosas (IGIV)
Las IGIV comenzaron a utilizarse como una terapia efectiva en el tratamiento de una serie de enfermedades de reconocido origen inmunológico, como el síndrome de Kawasaki, la dermatomiositis, la esclerosis múltiple, la púrpura trombocitopénica idiopática, el síndrome de Guillain-Barré, etc. Posteriormente, se comprobó su eficacia en el tratamiento de la miocarditis y las miocardiopatías de reciente comienzo en niños. Drucker et al publicaron un estudio retrospectivo en el que se compararon las historias de 21 niños diagnosticados de miocarditis y tratados con IGIV con otras 25 historias clínicas de pacientes ingresados con idénticos criterios de selección, pero que no recibían IGIV. Los niños que recibieron tratamiento con altas dosis de IGIV (con o sin presencia de infiltrado inflamatorio en la biopsia endomiocárdica) presentaban una mejoría significativa de la FEVI ya desde las primeras semanas de tratamiento, mejoría que se mantuvo al año de seguimiento, con aumento de la supervivencia50.
Takada et al51 demostraron, en un interesante estudio experimental con ratones, cómo la terapia con IGIV suprimía la miocarditis causada por el virus Coxsackie B3. En línea con los resultados de Takada et al se encuentran los de Weller et al52, que confirman que el tratamiento con IGIV previene la inflamación miocárdica en ratones infectados intraperitonealmente con virus Coxsackie B3. Los animales que recibieron IGIV murinas 2 días antes de la infección presentaron una reducción > 50% en la tasa de miocarditis comparados con el grupo control. La terapia con IGIV murinas también redujo el daño miocárdico cuando se administró 24-48 h después de la infección.
Sin embargo, la terapia con IGIV en pacientes adultos con MD aún no había sido estudiada. En 1997, McNamara et al53 publicaron un estudio no aleatorio en 10 pacientes diagnosticados de MD «aguda» (en terminología de los autores) en clase funcional III-IV de la NYHA de menos de 6 meses de evolución, con FEVI < 40% por ventriculografía isotópica y con arterias coronarias normales. Los pacientes recibieron un tratamiento con IGIV (una dosis total de 2 g/kg que se administraba a un ritmo de 0,5 g/kg durante 6 h en 4 días consecutivos). Tras un año de seguimiento, todos los pacientes presentaron un incremento significativo de la FEVI (del 24 al 41%), así como una mejoría de la clase funcional (al año de seguimiento todos ellos estaban en clase funcional I-II y ninguno había sido hospitalizado por fallo cardíaco). Aunque este primer estudio tenía importantes limitaciones (no era aleatorio e incluía un escaso número de pacientes), los autores comparaban los resultados obtenidos con la evolución de otro grupo de 72 pacientes con MD que fueron tratados de forma convencional, y de los cuales el 31% murió o tuvo que recibir un trasplante cardíaco durante el primer año. Lo resultados obtenidos por McNamara y su grupo son similares a los observados en estudios previos en niños con MD y consistentes con los estudios experimentales realizados en modelos animales. Recientemente, Gullestad et al54 han publicado un estudio aleatorio y doble ciego en 40 pacientes diagnosticados de insuficiencia cardíaca (FE < 40% cuantificada por ventriculografía isotópica y clase funcional II-III de la NYHA). Los sujetos que recibieron tratamiento con IGIV (infusión de 0,4 g/kg/día al día durante 5 días y posteriormente infusiones mensuales de 0,4 g/kg durante 5 meses) experimentaron al finalizar las 26 semanas de tratamiento una mejoría ligeramente significativa de la FEVI (de 26 a 31%; p < 0,01).
Aunque la terapia con IGIV se inició hace casi dos décadas, todavía no se conoce bien su mecanismo de acción. Se han propuesto varios posibles mecanismos: las inmunoglobulinas se comportarían como anticuerpos frente a superantígenos virales, neutralizando antígenos y anticuerpos virales, bloqueando los receptores Fc de los macrófagos, inactivando el complemento y reduciendo los AAC frente a los distintos componentes del miocito. También ejercen un efecto antiinflamatorio, modulando (down regulation) la síntesis de citocinas y complemento, así como la expresión intracelular de moléculas de adhesión y complejos de histocompatibilidad55-58.
Recientemente se ha descrito un mecanismo que puede explicar la eficacia de las IGIV en una variedad de enfermedades autoinmunitarias mediadas por anticuerpos59: el efecto acelerador del catabolismo de las IgG inducido por la administración de altas dosis de inmunoglobulinas exógenas. El catabolismo de las inmunoglobulinas del plasma está mediado por unos receptores especializados intracelulares FcRn (fracción Fc receptor neonato, identificado por primera vez en células del epitelio intestinal de neonatos), abundantes en las células endoteliales y otros tejidos. La fracción Fc de la IgG regula las características efectoras de la molécula, pero no su especificidad inmunológica, que reside en los brazos de la Y. En circunstancias normales, las IgG plasmáticas, tras unirse a los receptores FcRn, entrarían dentro de la célula a través de un proceso de pinocitosis, formando vesículas intracelulares (endosomas) en las que las inmunoglobulinas unidas al receptor FcRn, gracias a su medio ácido interno, estarían protegidas de su degradación. Cuando el endosoma se dirige de nuevo a la superficie de la célula, libera la IgG intacta al plasma. En cambio, aquellas IgG que entrasen en la célula no unidas al receptor pasarían a los lisosomas para su degradación. Una situación de hipergammaglobulinemia saturaría los receptores FcRn, con lo que aumentaría el número de inmunoglobulinas no «protegidas» y, por tanto, degradables, ya que su degradación es proporcional a su concentración libre en plasma. Este mecanismo explicaría también, en parte, el efecto de los corticoides: los glucocorticoides regulan a la baja la expresión del ARN mensajero del FcRn, disminuyendo la proporción de IgG «protegida» del proceso de degradación y aumentando, por tanto, la degradación de AAC. Se han diseñado otros posibles agentes que podrían saturar el receptor FcRn (ligandos sintéticos y AC monoclonales que se unen de forma covalente al receptor) y, en consecuencia, disminuir las inmunoglobulinas plasmáticas59.
Aféresis, plasmaféresis e inmunoadsorción
La aféresis engloba varias técnicas terapéuticas de purificación extracorpórea de diversas sustancias de alto peso molecular presentes en la sangre. La plasmaféresis y la inmunoadsorción son las técnicas empleadas con más frecuencia.
La plasmaféresis es un método de eliminación extracorpórea no selectiva de elementos tóxicos presentes en la sangre; para ello se separan los elementos formes del plasma eliminando el mismo. Posteriormente, se reinfunden los elementos formes y los demás constituyentes fisiológicos del plasma eliminado. Esta técnica se usa para eliminar de la sangre sustancias no deseadas, como toxinas y constituyentes fisiológicos del plasma implicados en la patogenia de diversas enfermedades, como el complemento o anticuerpos.
La inmunoadsorción es una técnica de aféresis selectiva que pretende la eliminación extracorpórea de inmunoglobulinas humanas por medio de adsorbentes específicos. Para ello se realiza una separación del plasma del paciente, haciéndolo circular posteriormente a través de columnas específicas que, por diferentes mecanismos, fijan y eliminan de manera selectiva inmunoglobulinas, retornando el plasma una vez tratado al paciente.
Ambas técnicas comparten la extracción de sangre, la separación del plasma de los elementos celulares y la reinfusión al paciente de los mismos, diferenciándose en que la plasmaféresis es una técnica no selectiva, mientras que la inmunoadsorción elimina de forma selectiva la sustancia deseada.
La demostración en pacientes con MD idiopática de la presencia de AAC frente a distintos epítopos del receptor β, y la hipótesis de que podrían desempeñar un papel determinante en la fisiopatología de la enfermedad, puso en marcha una línea de investigación basada en que la retirada del agente causal conllevaría una mejoría sustancial de la enfermedad. Según esta hipótesis, la disminución del título de est del miocardio como el curso clínico de la enfermedad.
La cinética de la producción, depósito y vida media de las inmunoglobulinas se ha estudiado a través de su marcación con isótopos60. La vida media de las inmunoglobulinas es relativamente larga (21 días para las IgG y cinco para las IgM), con un importante depósito tisular (extravascular) (60% para las IgG y 20% para las IgM) y un equilibrio extraintravascular de 1 a 3 h. Teniendo epresores (que actúan sólo sobre su síntesis) no provocaría un descenso significativo de los valores de inmunoglobulinas hasta transcurridas varias semanas desde su inicio. Por otro lado, el «aclarado» relativamente lento de la fracción extravascular hace que, tras una sesión de aféresis, la concentración de inmunoglobulinas vuelva a recuperarse (aunque no por completo) en aproximadamente 24-48 h. Transcurrido este tiempo, volvería a ser «rentable» realizar una nueva sesión. Después de 3 sesiones en días consecutivos, se estima que se consigue eliminar un 70% de IgG y un 80% de la IgM total61. Por tanto, se considera necesario realizar, al menos, tres sesiones de aféresis para cada tratamiento, independientemente de la decisión de tratamientos complementarios encaminados a disminuir una posterior producción mediante inmunodepresores o gammaglobulinas. Debe recordarse, sin embargo, que las cifras de eliminación citadas se refieren al pool total de IgG, pero no a anticuerpos concretos; en efecto, se ha comprobado que en algunas enfermedades autoinmunes en las que la tasa de producción de AAC es relativamente lenta (miastenia grave), la correlación entre los valores de IgG total y AAC específicos es buena tras la aféresis, mientras que en otras (síndrome de Goodpasture, lupus eritematoso), la producción de AAC específicos excede, con mucho, el valor de IgG total62,63. Por tanto, se requiere una monitorización específica de los AAC postratamiento para confirmar la posible correlación entre sus concentraciones y la evolución clínica del paciente. En este sentido, la historia natural del valor de AAC en diferentes enfermedades suele presentar una evolución irregular, cíclica en algunas y continua en otras. En cualquier caso, los datos sobre la evolución de los valores de los AAC frente a receptor β en la MD son escasos y discordantes, y siempre referidos a seguimientos tras tratamientos con inmunoadsorción.
Desde 1997 se han publicado varios trabajos en los que se analizan los resultados de la inmunoadsorción en pacientes con MD idiopática, valorando tanto parámetros hemodinámicos a corto plazo, la función ventricular mediante ecocardiografía, como el seguimiento clínico y la valoración del grado funcional de la NYHA65-68. El primer artículo publicado por Dörffel et al es un estudio que incluye a 9 pacientes diagnosticados de MD idiopática y con valores elevados de AAC antirreceptor β. El estudio analiza los cambios en una serie de parámetros hemodinámicos, como índice y gasto cardíaco, presión capilar pulmonar y resistencias vasculares sistémicas y pulmonares. Tras un ciclo de 5 a 7 sesiones consecutivas de inmunoadsorción, se observa una mejoría estadísticamente significativa en los parámetros hemodinámicos analizados, paralela a la reducción de los valores de AAC65. Este primer estudio preliminar y sin grupo control no analiza los parámetros de función ventricular ni realiza un seguimiento clínico de los pacientes. El mismo autor confirma posteriormente una mejoría en el grado funcional a corto plazo en una segunda publicación de resultados de seguimiento clínico66. Unos años después, Felix et al, en un estudio en el que ya incluyeron a un grupo control, analizaron tanto los parámetros hemodinámicos agudos como la FEVI y el grado funcional de la NYHA a los 3 meses de seguimiento, observando una clara mejoría de todos los parámetros estudiados67.
Recientemente, Müller et al68 llevaron a cabo un estudio prospectivo, con grupo control, en el que analizaron los parámetros ecocardiográficos (diámetro telediastólico del ventrículo izquierdo y FEVI) y clínicos (clase funcional de la NYHA). Tras un año de seguimiento, estos autores observaron que el diámetro telediastólico disminuyó un 14,5% (de 74,5 ± 7,1 mm a 63,7 ± 6 mm en el grupo de tratamiento) y la FEVI aumentó del 22,3 ± 3,3% al 37,9 ± 7,9% (p = 0,0001), con un incremento relativo del 69,9% que se mantuvo invariable en el grupo control (23,8 ± 3,0% a 25,2 ± 5,9%; p = 0,031). Paralelamente, el grado funcional mejoró en todos los casos (p = 0,0001), encontrándose todos los pacientes en grados I y II de la NYHA al finalizar el estudio.
Ninguno de los procedimientos terapéuticos ensayados hasta el momento actual en pacientes con MD idiopática, a excepción del trasplante cardíaco, ha puesto de manifiesto mejorías tan importantes.
Las complicaciones de estas técnicas son muy poco frecuentes, aunque se han descrito reacciones anafilácticas, tromboembolismo pulmonar, perforación vascular, hepatitis, hemorragia sistémica, coagulación intravascular diseminada y sepsis. Se estima que la mortalidad es de 3/10.000 procedimientos69. En la revisión de los estudios publicados en los que se realiza inmunoadsorción a pacientes con insuficiencia cardíaca congestiva y MD no hemos encontrado referencia a efectos adversos específicos, complicaciones graves, ni mortalidad en el curso del tratamiento. No obstante, es preciso tener en cuenta que estos primeros estudios presentan una serie de limitaciones metodológicas, que analizaremos a continuación.
Tamaño de la muestra y seguimiento
Todos los estudios publicados se han realizado en un número reducido de pacientes y con un seguimiento máximo de un año. Es necesario confirmar sus resultados en grupos más amplios y con seguimientos más prolongados.
Diferencias en la metodología referida al valor de AAC
El valor de AAC no permanece estable a lo largo de la historia natural de las enfermedades autoinmunes: en algunos casos sufre oscilaciones cíclicas no necesariamente relacionadas con el curso clínico. En otras, en cambio, se utiliza como control del mismo, ya que una elevación del valor de AAC antecede al «brote» agudo. No hay datos específicos sobre la evolución en el tiempo de las concentraciones de AAC frente a receptor β ni su posible relación con el grado evolutivo de la enfermedad, salvo la evidencia ya comentada de que en estadios finales de la enfermedad en los que predomina la fibrosis de AAC disminuye. En el primer estudio publicado por Wallukat et al en 199664 se realiza un seguimiento de la concentración de AAC tras un tratamiento con inmunoadsorción y posterior reposición de inmunoglobulinas, observándose que los AAC recuperan el valor inicial a los 75 días del tratamiento. Sin embargo, Müller et al publicaron en el año 200068 un estudio controlado en el que, tras un tratamiento inicial con inmunoadsorción sin reposición posterior de inmunoglobulinas, pero sí con antioxidantes, la concentración de AAC se mantenía en concentraciones bajas tras controles a los 3, 6, 9 y 12 meses, sin que recuperara los valores iniciales. Los autores especulan sobre la posible influencia de los tratamientos coadyuvantes a la inmunoadsorción (reposición de inmunoglobulinas y administración de antioxidantes) en la concentración de los AAC, sin que las características de diseño de los estudios permitan extraer conclusiones definitivas en este aspecto crucial.
Alteraciones en la volemia y parámetros hemodinámicos a corto plazo
En el trabajo de Dörffel et al65 se realiza un control hemodinámico antes y después de cada sesión, comprobándose que no hay cambios en los parámetros hemodinámicos tras cada sesión (incluyendo la presión venosa), pero sí tras el conjunto de las 5 sesiones. No parece probable que los efectos beneficiosos de la inmunoadsorción sean secundarios a una reducción de la volemia ya que, tras una sesión de inmunoadsorción, el plasma se reinfunde en su totalidad, comprobándose que el hematocrito, la viscosidad sanguínea, así como las concentraciones de TNF e IL permanecieron también invariables67.
Utilización de tratamientos adicionales
Bloqueadores beta. Dörffel inicia el tratamiento con bloqueadores beta sólo un día antes del inicio de las sesiones de aféresis, con la intención de que desplacen a los AAC del receptor, aumentando la fracción circulante de los mismos. Podría argumentarse que el inicio del tratamiento con bloqueadores beta es el responsable de la mejoría de los pacientes; sin embargo, no parece probable que tras 3 días de tratamiento pueda conseguirse una mejoría tan significativa en los parámetros hemodinámicos y de función ventricular65. En 1996 (año de realización del estudio) no estaba tan generalizada la utilización de bloqueadores beta en la insuficiencia cardíaca, por lo que no es extraño que los pacientes no estuviesen previamente en tratamiento crónico con bloqueadores beta. En este sentido, el estudio de Felix et al67, publicado en enero de 2000, ya incluyó a 4 pacientes en tratamiento previo con bloqueadores beta y, sin embargo, no incluyeron en su protocolo el empleo de los mismos antes de iniciar la inmunoadsorción. En el estudio de Müller et al (coetáneo en su realización con el de Felix), todos los pacientes, tanto del grupo control como de inmunoadsorción, fueron tratados desde el inicio con bloqueadores beta (bisoprolol). En el seguimiento realizado a los 3 meses, los parámetros de función ventricular mejoraron por igual en ambos grupos, observándose a partir de los 3 meses una clara mejoría (p = 0,0001) en el grupo tratado con inmunoadsorción68. Este estudio sugiere que la mejoría de los parámetros de función ventricular observada en el grupo tratado con inmunoadsorción no sólo es atribuible al uso añadido de bloqueadores beta.
Inmunoglobulinas. El objetivo de las técnicas de aféresis es la eliminación (más o menos selectiva) de la molécula que se supone patógena (en este caso la eliminación de los AAC frente a receptor β que son una fracción de la IgG total). En el momento actual no disponemos de ninguna técnica que elimine de forma selectiva los AAC específicos, por lo que se elimina una mayor o menor proporción de IgG, con el consiguiente riesgo potencial de infección secundaria al estado transitorio de inmunodepresión humoral. Por este motivo, se incluyó la utilización de IGIV en el primer estudio publicado66. Felix et al, sin embargo, mantienen la utilización de IGIV no sólo con el fin de prevenir la inmunodepresión, sino también como método para evitar el rebote en la producción de AAC al saturar los receptores Fc68. La utilización de IGIV es, al menos, discutible si se fundamenta en el riesgo de infección. Phol et al, en un estudio aleatorio valoran el riesgo añadido de infección en pacientes tratados con inmunodepresores y aféresis, comprobando que el riesgo de infección no aumenta en el grupo de aféresis con respecto a los tratados sólo con inmunodepresores70. Müller et al no utilizan IGIV tras la inmunoadsorción argumentando que en el estudio inicial de Wallukat, en el que sí se utilizan, se observa un rebote en la concentración de AAC. Sus resultados parecen confirmar esta argumentación ya que, sin aumentar las infecciones, el valor de AAC en los pacientes tratados con inmunoadsorción permanece bajo a los 12 meses de seguimiento.
CONCLUSIÓN
La hipótesis fisiopatológica que atribuye a los AAC un papel trascendente en el inicio y progresión de la enfermedad en, al menos, algunos casos de MD idiopática, se ha visto reforzada por la demostración de la eficacia de tratamientos basados en la eliminación de los mismos por diversas técnicas, entre las que se incluye la inmunoadsorción. La mejora, muy sustancial, tanto en los parámetros de función ventricular como clínicos que se demuestra en los estudios publicados hasta el momento, en fases avanzadas de la enfermedad en las que la única alternativa terapéutica actual es el trasplante, justifica plenamente la realización de estudios posteriores que confirmen o rechacen y, en cualquier caso, maticen sus indicaciones.
Correspondencia: Dr. I. Terol Esteban.
Laboratorio de Hemodinámica. Hospital Carlos III.
Sinesio Delgado, 10. 28029 Madrid.
Correo electrónico: iterol@hciii.insalud.es