El número de pacientes ancianos con insuficiencia cardiaca terminal ha crecido espectacularmente. Considerando que el número de trasplantes cardiacos se ha estancado, se requiere una alternativa terapéutica. Desde hace poco se están aplicando como terapia de destino (TD) dispositivos de asistencia ventricular izquierda (DAVI). Asumiendo que los pacientes de más edad tienen mayor riesgo quirúrgico, es presumible que la cirugía menos invasiva (CMI) para el DAVI contribuya a mejorar los resultados operatorios en pacientes en TD.
MétodosSe realizó un estudio prospectivo con un seguimiento de 2 años de 46 pacientes en TD (edad mayor de 60 años) consecutivos a los que se trató con DAVI (HVAD, HeartWare) en nuestra institución entre 2011 y 2013. Se formaron 2 grupos según el método quirúrgico de implante: CMI (n = 20) o cirugía convencional (n = 26).
ResultadosA pesar de que no se hallaron diferencias estadísticas significativas respecto a la supervivencia a 2 años, sí se observó una tendencia a mayor supervivencia en el grupo CMI (el 85,0 frente al 69,2%; p = 0,302). Asimismo, los pacientes del grupo de CMI presentaron menor incidencia de hemorragias tras la cirugía (0 frente al 26,9%; p < 0,05), junto con menores tasas de uso prolongado de inotrópicos tras la cirugía (el 15,0 frente al 46,2%; p < 0,05).
ConclusionesLos datos indican que los pacientes sometidos a CMI para implante de DAVI como TD muestran tras la cirugía menor incidencia de hemorragias, menor necesidad de apoyo con inotrópicos y una tendencia a menor mortalidad que los pacientes operados de manera convencional.
Palabras clave
Los tratamientos conservadores modernos para la insuficiencia cardiaca han mejorado los resultados en los pacientes adultos1. A pesar de los avances médicos en el tratamiento de este trastorno, la enfermedad en sí continúa teniendo un carácter progresivo. Las proyecciones existentes estiman que al llegar al año 2020 el número de pacientes que mueran por enfermedad cardiovascular aumentará a más de 7 millones en todo el mundo2,3. El trasplante cardiaco como opción terapéutica se ve muy limitada por la escasez de órganos de donantes y, por consiguiente, se aplica principalmente tan solo a pacientes de menos de 60 años4,5. En una época de cambios demográficos, que se reflejan en el envejecimiento de la población, hay una urgente necesidad de alternativas terapéuticas eficaces para tratar la insuficiencia cardiaca en fase terminal de los pacientes de edad avanzada6. Así, los dispositivos de asistencia ventricular izquierda (DAVI) se aplican actualmente de manera amplia como terapia de destino (TD)7–13. Sin embargo, entre los pacientes en TD hay un aumento del riesgo perioperatorio con gran mortalidad8. En su artículo fundamental, Slaughter et al.14 señalaron que el tratamiento con DAVI de flujo continuo mejoraba la supervivencia de los pacientes en TD en hasta un 58% después de 2 años de permanencia en tratamiento con bomba. En dicho estudio, se trató a todos los pacientes con la técnica quirúrgica estándar, que se realiza mediante una esternotomía completa. En ese momento, este abordaje quirúrgico era imprescindible debido al gran tamaño de la bomba y a la falta de alternativas quirúrgicas. Es de destacar que una esternotomía completa implica un traumatismo operatorio importante, mayor riesgo de insuficiencia respiratoria posoperatoria, estancia hospitalaria más larga y hemorragia perioperatoria15–17. En la cirugía del DAVI, resulta especialmente crítico evitar la hemorragia, puesto que el tratamiento en sí conlleva alteraciones de la hemostasia, como el síndrome de von Willebrand adquirido, que aumenta también el riesgo de hemorragia perioperatoria18. Según lo indicado por una revisión de la literatura, la incidencia de hemorragia con necesidad de cirugía y apoyo inotrópico prolongado oscila entre el 30 y el 40% de los pacientes en TD a los que se practica una esternotomía completa14,19–21. Además, la esternotomía completa implica que se abre por completo el pericardio, lo cual elimina el confinamiento natural del ventrículo derecho, con lo que contribuye a aumentar el peligro de insuficiencia cardiaca derecha posoperatoria una vez iniciado el uso del DAVI22.
Una característica clave de los DAVI más recientes es el tamaño de la bomba notablemente reducido23,24. Esto ha facilitado el desarrollo de técnicas de cirugía menos invasiva (CMI) para implantar, extraer y cambiar los dispositivos de asistencia ventricular25–28. Es de prever que la nueva era de implantes de DAVI con CMI mejore los resultados del tratamiento reduciendo complicaciones operatorias tan importantes como la hemorragia o la insuficiencia ventricular derecha29,30.
Este estudio presenta los primeros resultados a largo plazo en pacientes en TD con insuficiencia cardiaca en fase terminal a los que se aplica una técnica mínimamente invasiva para el implante de una bomba de flujo continuo.
MÉTODOSEn 2011, nuestro grupo desarrolló una técnica de implante de un DAVI minimizado22. Entre los años 2011 y 2013, se llevó a cabo un estudio prospectivo en 46 pacientes consecutivos de más de 60 años que necesitaban cirugía para el implante de un DAVI como TD, ya que no eran aptos para el trasplante cardiaco. Todos los pacientes fueron operados por el mismo equipo quirúrgico, que fue el que decidió qué técnica utilizar para el implante. Se compararon los datos de 20 pacientes a los que se implantó un DAVI con CMI (HVAD, HeartWare Inc.; Miami Lakes, Estados Unidos) con los de un grupo de control formado por 26 pacientes a los que se practicó una esternotomía convencional. Los criterios de indicación clínica del implante de un DAVI fueron los siguientes: deterioro significativo de la función cardiaca (fracción de eyección del ventrículo izquierdo <30%) con un índice cardiaco <2,2 l/min/m2 y refractaria al tratamiento médico, incluida la dependencia de inotrópicos. Se excluyó del estudio a todo paciente con antecedentes de cirugía cardiaca y/o cirugía cardiaca concomitante. El apoyo prolongado con inotrópicos se definió como un tratamiento inotrópico durante 14 o más días después del implante del DAVI. La insuficiencia respiratoria se definió como una insuficiencia pulmonar que requiriera intubación y ventilación durante 96 h o más en algún momento del periodo posoperatorio, a causa de una saturación de oxígeno en sangre <96% mientras se administraba oxigenoterapia con una fracción inspiratoria de oxígeno ≥ 0,50. La insuficiencia renal se definió por la necesidad de diálisis.
La CMI incluye 2 etapas: primero se introduce la bomba del DAVI a través de una toracotomía anterolateral (en el quinto o sexto espacio intercostal). Segundo, el equipo quirúrgico realiza una hemiesternotomía alta en forma de J hasta el tercer espacio intercostal para anastomosar el injerto de salida del DAVI en sentido terminolateral a la aorta ascendente22. Por último, en todos los pacientes se utilizó el mismo sistema de DAVI (HVAD, HeartWare) y se implantó empleando circulación extracorpórea. Tras el implante hubo un periodo de seguimiento de 2 años, durante el cual los pacientes acudieron a la consulta ambulatoria 4 veces al año.
La investigación se atiene a los principios establecidos en la Declaración de Helsinki. Todos los pacientes dieron su consentimiento informado por escrito y el estudio fue aprobado por el comité de ética local. La asistencia médica posoperatoria se realizó según la práctica habitual.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS 20.0 (IBM SPSS Statistics, IBM Corp.; Armonyk, Nueva York, Estados Unidos). Para el análisis estadístico se utilizó la prueba de la t para datos no emparejados, la prueba exacta de Fisher, la prueba de la χ2 de Pearson y la estimación de la supervivencia de Kaplan-Meier. Las curvas de supervivencia se compararon mediante test de log-rank. Las diferencias se consideraron significativas para un valor de p <0,05. Todas los datos de variables continuas se resumen mediante los valores de media ± desviación estándar.
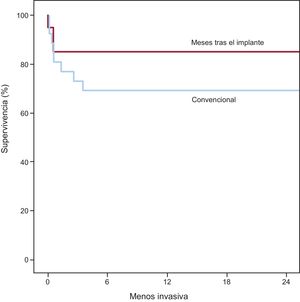
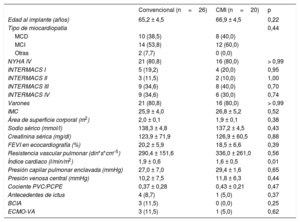
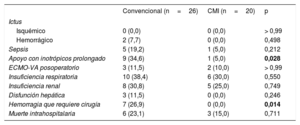
RESULTADOSLas características iniciales se resumen en la tabla 1 y fueron similares en los 2 grupos de pacientes. Predominaron los pacientes varones, con medias de fracción de eyección preoperatoria medida en la ecocardiografía transtorácica del 20,2% (convencional) y el 18,5% (CMI). El cateterismo cardiaco derecho mostró medias de índice cardiaco de 1,9 (convencional) y 1,6 l/min/m2 (CMI), con medias de resistencia vascular pulmonar de 336,0 (CMI) y 290,4 din*s*cm–5 (convencional) respectivamente. La media de la presión capilar pulmonar enclavada fue de entre 29,4 (CMI) y 27,0mmHg (convencional). El soporte preoperatorio con un oxigenador extracorpóreo de membrana (ECMO) se aplicó a 3 pacientes del grupo de tratamiento convencional y 1 del grupo de CMI. Las curvas de supervivencia de ambos grupos se presentan en la figura. La supervivencia hospitalaria fue del 85,0% (CMI) y el 76,9% (convencional) (p=0,71). La supervivencia a 2 años fue del 85,0% de los pacientes de CMI y el 69,2% del grupo de tratamiento convencional (p=0,302). Las curvas de supervivencia se compararon con la prueba de Mantel-Cox y mostraron p=0,242. Las causas de muerte en el grupo de tratamiento convencional fueron: hemorragia intracraneal (25,0%), sepsis (25,0%), fallo multiorgánico (25,0%), insuficiencia cardiaca derecha (12,5%) y hemorragia relacionada con la cirugía (12,5%). En el grupo de CMI, causaron la muerte la insuficiencia cardiaca derecha (33,3%), la sepsis (33,3%) o el fallo multiorgánico (33,3%). Se presenta un cuadro general de todos los eventos adversos en la tabla 2 y la tabla 3. Hubo menor incidencia de apoyo inotrópico prolongado en el grupo de CMI (5%), en comparación con el 34,6% de los pacientes del grupo de tratamiento convencional (p=0,028). El total de permanencia en la unidad de cuidados intensivos fue de 15,2 ± 17,1 días los pacientes en tratamiento convencional y 12,1 ± 12,1 días el grupo de CMI (p=0,513). El total de pacientes que no sobrevivieron en la unidad de cuidados intensivos fue el 19,2% del grupo de tratamiento convencional y el 15,0% del grupo de CMI (el porcentaje se refiere al número total de pacientes de cada grupo que no sobrevivieron). En el grupo de tratamiento convencional, en los 3 pacientes con un tratamiento previo con ECMO se utilizó circulación extracorpórea posoperatoria. En el grupo de CMI, hubo 2 pacientes con uso de ECMO posoperatorio; uno de ellos recibió el tratamiento con ECMO antes del implante del DAVI. El tratamiento con ECMO en el posoperatorio fue más largo en el grupo de tratamiento convencional: 10,0 ± 5,9 frente a 5,0 ± 5,7 días en los pacientes tratados con CMI (p=0,381). En el grupo de CMI, ninguno de los pacientes necesitó una reintervención a causa de una hemorragia posoperatoria, a diferencia de la frecuencia de hemorragias que requirieron cirugía (26,9%) en el grupo de tratamiento convencional (p <0,05). Se documentaron infecciones relacionadas con el DAVI en un 4% (convencional) y el 0% (CMI) del total de pacientes (p=1,00). Hubo solo 1 paciente del grupo de tratamiento convencional para el que fue necesario cambiar la bomba a causa de la formación de un trombo.
Características basales
| Convencional (n=26) | CMI (n=20) | p | |
|---|---|---|---|
| Edad al implante (años) | 65,2 ± 4,5 | 66,9 ± 4,5 | 0,22 |
| Tipo de miocardiopatía | 0,44 | ||
| MCD | 10 (38,5) | 8 (40,0) | |
| MCI | 14 (53,8) | 12 (60,0) | |
| Otras | 2 (7,7) | 0 (0,0) | |
| NYHA IV | 21 (80,8) | 16 (80,0) | > 0,99 |
| INTERMACS I | 5 (19,2) | 4 (20,0) | 0,95 |
| INTERMACS II | 3 (11,5) | 2 (10,0) | 1,00 |
| INTERMACS III | 9 (34,6) | 8 (40,0) | 0,70 |
| INTERMACS IV | 9 (34,6) | 6 (30,0) | 0,74 |
| Varones | 21 (80,8) | 16 (80,0) | > 0,99 |
| IMC | 25,9 ± 4,0 | 26,8 ± 5,2 | 0,52 |
| Área de superficie corporal (m2) | 2,0 ± 0,1 | 1,9 ± 0,1 | 0,38 |
| Sodio sérico (mmol/l) | 138,3 ± 4,8 | 137,2 ± 4,5 | 0,43 |
| Creatinina sérica (mg/dl) | 123,9 ± 71,9 | 126,9 ± 60,5 | 0,88 |
| FEVI en ecocardiografía (%) | 20,2 ± 5,9 | 18,5 ± 6,6 | 0,39 |
| Resistencia vascular pulmonar (din*s*cm–5) | 290,4 ± 151,6 | 336,0 ± 261,0 | 0,56 |
| Índice cardiaco (l/min/m2) | 1,9 ± 0,6 | 1,6 ± 0,5 | 0,01 |
| Presión capilar pulmonar enclavada (mmHg) | 27,0 ± 7,0 | 29,4 ± 1,6 | 0,65 |
| Presión venosa central (mmHg) | 10,2 ± 7,5 | 11,8 ± 6,3 | 0,44 |
| Cociente PVC/PCPE | 0,37 ± 0,28 | 0,43 ± 0,21 | 0,47 |
| Antecedentes de ictus | 4 (8,7) | 1 (5,0) | 0,37 |
| BCIA | 3 (11,5) | 0 (0,0) | 0,25 |
| ECMO-VA | 3 (11,5) | 1 (5,0) | 0,62 |
BCIA: balón de contrapulsación intraaórtico; CMI: cirugía menos invasiva; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial FEVI: fracción de eyección del ventrículo izquierdo; IMC: índice de masa corporal; MCD: miocardiopatía dilatada MCI: miocardiopatía isquémica; NYHA: New York Heart Association; PCPE: presión capilar pulmonar enclavada; PVC: presión venosa central.
Los valores expresan media ± desviación estándar o n (%).
Eventos adversos tras el implante (resultados hospitalarios)
| Convencional (n=26) | CMI (n=20) | p | |
|---|---|---|---|
| Ictus | |||
| Isquémico | 0 (0,0) | 0 (0,0) | > 0,99 |
| Hemorrágico | 2 (7,7) | 0 (0,0) | 0,498 |
| Sepsis | 5 (19,2) | 1 (5,0) | 0,212 |
| Apoyo con inotrópicos prolongado | 9 (34,6) | 1 (5,0) | 0,028 |
| ECMO-VA posoperatorio | 3 (11,5) | 2 (10,0) | > 0,99 |
| Insuficiencia respiratoria | 10 (38,4) | 6 (30,0) | 0,550 |
| Insuficiencia renal | 8 (30,8) | 5 (25,0) | 0,749 |
| Disfunción hepática | 3 (11,5) | 0 (0,0) | 0,246 |
| Hemorragia que requiere cirugía | 7 (26,9) | 0 (0,0) | 0,014 |
| Muerte intrahospitalaria | 6 (23,1) | 3 (15,0) | 0,711 |
CMI: cirugía menos invasiva; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial.
Eventos adversos tras el implante (resultados tras el alta)
| Convencional (n=20) | CMI (n=17) | p | |||
|---|---|---|---|---|---|
| Subgrupo | N (%) | N.o de eventos/paciente, año | N (%) | N.o de eventos/paciente, año | |
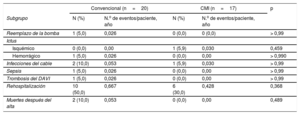
| Reemplazo de la bomba | 1 (5,0) | 0,026 | 0 (0,0) | 0 (0,0) | > 0,99 |
| Ictus | |||||
| Isquémico | 0 (0,0) | 0,00 | 1 (5,9) | 0,030 | 0,459 |
| Hemorrágico | 1 (5,0) | 0,026 | 0 (0,0) | 0,00 | > 0,990 |
| Infecciones del cable | 2 (10,0) | 0,053 | 1 (5,9) | 0,030 | > 0,99 |
| Sepsis | 1 (5,0) | 0,026 | 0 (0,0) | 0,00 | > 0,99 |
| Trombosis del DAVI | 1 (5,0) | 0,026 | 0 (0,0) | 0,00 | > 0,99 |
| Rehospitalización | 10 (50,0) | 0,667 | 6 (30,0) | 0,428 | 0,368 |
| Muertes después del alta | 2 (10,0) | 0,053 | 0 (0,0) | 0,00 | 0,489 |
CMI: cirugía menos invasiva; DAVI: dispositivos de asistencia ventricular izquierda.
En la subcategoría «rehospitalización», los porcentajes se calcularon con las rehospitalizaciones relacionadas con el DAVI en los 12 meses posteriores al alta hospitalaria inicial.
Las técnicas de CMI han contribuido a reducir el traumatismo quirúrgico que se produce en la cirugía cardiaca. Además, en la cirugía cardiaca general, los métodos de CMI reducen las tasas de complicaciones como la hemorragia posoperatoria, el dolor posoperatorio y la insuficiencia respiratoria15. En el tratamiento con DAVI, la CMI se ha introducido muy recientemente, y solo hay unos pocos estudios que describen resultados iniciales29–31. Hasta la fecha, no hay evidencia de que el implante de DAVI con CMI pueda llevarse a cabo de manera segura en pacientes con alto riesgo en TD. Así pues, el presente estudio se llevó a cabo para recoger datos relevantes para la estimación del riesgo de la cirugía de DAVI en esos pacientes. Recientemente, nuestro grupo ha desarrollado una técnica de implante de DAVI menos traumática, que consta de 2 pasos principales: hemiesternotomía alta en forma de J y toracotomía anterolateral izquierda22. La principal ventaja de este abordaje es que el pericardio se mantiene cerrado en su mayor parte, lo cual preserva los límites naturales del ventrículo derecho. Esto permite conservar la función del corazón derecho y evitar una sobredilatación ventricular derecha al inicio del funcionamiento del DAVI. El deterioro de la función ventricular derecha se trata a menudo con un aumento de los inotrópicos durante la fase posoperatoria inicial. En consecuencia, se incluyó ese aspecto en nuestra investigación. Nuestros datos indican que hubo una incidencia significativamente menor de apoyo prolongado con inotrópicos en el grupo de CMI. Además, todos estos pacientes fueron compensados satisfactoriamente mientras estaban en este tratamiento. En los pacientes (n=4) que sufrieron una descompensación cardiaca general preoperatoria y recibieron tratamiento con ECMO antes del implante, no hubo diferencias estadísticamente significativas entre los 2 grupos. No obstante, el tratamiento con ECMO mostró tendencia a ser de menor duración en el grupo de CMI. La desconexión de la circulación extracorpórea resultó también más sencilla en el grupo de CMI; además, los pacientes estaban más estables hemodinámicamente. En el grupo de CMI hubo también otra ventaja de la técnica operatoria, en cuanto a que no hubo que reintervenir por hemorragia perioperatoria a ninguno de los pacientes. Esto puede explicarse por la considerable reducción de las incisiones y el menor traumatismo quirúrgico. Además, la técnica de CMI permite realizar pasos quirúrgicos importantes, como la sutura de los puntos en anillo del bombeo extracorpóreo sin heparinización plena. Además de permitir unas incisiones más pequeñas, esto contribuyó a reducir la pérdida hemática en el grupo de CMI. El análisis del grupo de control mostró que la incidencia de intervenciones quirúrgicas relacionadas con hemorragias en el grupo de esternotomía convencional fue comparable a la descrita en estudios previos23.
El abordaje mediante CMI evitó también las adherencias tisulares para futuras intervenciones quirúrgicas, si bien este factor puede tener una importancia secundaria en pacientes en TD. Así pues, las reintervenciones pasan a tener menos riesgo tras un implante de DAVI con CMI.
Aunque nuestro análisis no mostró diferencias estadísticamentes significativas en cuanto a la mortalidad, la curva de supervivencia de Kaplan-Meier muestra una clara tendencia favorable al abordaje mediante CMI, con una mortalidad del 85 frente al 69% en los primeros 2 años tras la intervención.
LimitacionesUna limitación importante del estudio es que no hubo aleatorización. Dado que el objetivo del estudio era investigar la seguridad de la CMI en el implante de DAVI, se diseñó un estudio prospectivo observacional. Por consiguiente, nuestros resultados deben evaluarse en este contexto. Teniendo en cuenta que el análisis de las características iniciales no mostró diferencia alguna entre los 2 grupos, se considera que el diseño del estudio es apropiado para responder a esa pregunta. Aunque la mejora de la supervivencia en el grupo de CMI no fue estadísticamente significativa, se demuestra que los pacientes tratados con CMI tenían menos incidencia de complicaciones quirúrgicas que el grupo de tratamiento convencional. Dado que se considera que este es el primer estudio de este tipo, estos resultados preliminares contribuirán a poner en marcha ensayos aleatorizados multicéntricos con un tamaño muestral que proporcione una mayor potencia estadística. La ampliación de nuestra experiencia a otros centros con mayor número total de pacientes tratados podría ser útil para demostrar nuestras observaciones.
CONCLUSIONESNuestros datos indican que el implante de un dispositivo de flujo continuo miniaturizado mediante CMI es una técnica segura, viable y que conlleva varios efectos positivos, como la protección del ventrículo derecho y una menor incidencia de hemorragias posoperatorias. A pesar del carácter preliminar de los resultados obtenidos de este estudio, estos indican que los pacientes en TD de más de 60 años a los que se implanta un DAVI pueden alcanzar una tasa de supervivencia a 2 años superior al 80%. Ello hace necesario realizar estudios multicéntricos con mayor número de pacientes, con objeto de investigar si pueden mantenerse estadísticamente estos porcentajes. Sin embargo, dado que el proceso de miniaturización de los DAVI continua avanzando, es probable que en el futuro la CMI para DAVI continúe adquiriendo cada vez más importancia.
CONFLICTO DE INTERESESS.V. Rojas, M. Avsar y J.D. Schmitto son consultores de HeartWare Inc y SJM.
- –
El tratamiento con un DAVI está adquiriendo mayor importancia en la insuficiencia cardiaca congestiva. Estos nuevos dispositivos, que inicialmente se diseñaron como estrategia puente para el trasplante, se han utilizado recientemente como apoyo a largo plazo. Además, teniendo en cuenta los cambios demográficos que se están produciendo, el número de pacientes con insuficiencia cardiaca de edad avanzada no aptos para un trasplante cardiaco aumentará, y ello incrementará a su vez el número de candidatos a TD. Sin embargo, en este grupo hay un alto grado de comorbilidad, con el consiguiente aumento de la mortalidad perioperatoria.
- –
Los nuevos abordajes quirúrgicos que minimizan el traumatismo operatorio podrían facilitar la mejora de la supervivencia inicial al reducir las complicaciones quirúrgicas. El presente estudio es el primero de su clase que compara la CMI con el implante convencional del DAVI en pacientes en TD. Nuestros resultados indican que el implante de DAVI mediante CMI es viable y seguro como TD.