La fibrilación auricular (FA) causa cambios estructurales y eléctricos en las aurículas que se pueden resumir dentro del concepto general de remodelado auricular. Paralelamente, otras características clínicas y comorbilidades también pueden afectar a las propiedades del tejido auricular y favorecer tanto el inicio como el mantenimiento de la FA. En general, estos cambios patológicos en las aurículas configuran un estado de miocardiopatía auricular con importantes implicaciones en el control del ritmo. Aunque hay acuerdo general sobre el papel del sustrato auricular en las posibilidades de obtener un control eficaz del ritmo en la FA, la clasificación actual simplifica el tratamiento clínico utilizando criterios temporales y no establece una estrategia bien definida para precisar el grado de miocardiopatía auricular que afecta a un paciente concreto para así tomar decisiones sobre la opción terapéutica más adecuada a las características de la enfermedad del paciente. El trabajo revisa la evidencia científica actual y propone una caracterización práctica del sustrato auricular basada en 3 pasos de evaluación, comenzando con una valoración médica (paso 1) para luego evaluar datos de pruebas complementarias habituales (paso 2) y finalmente incluir información de medios diagnósticos avanzados (paso 3). La información de cada uno de los pasos o su combinación pueden utilizarse para una clasificación práctica de los pacientes con FA en 4 estadios de miocardiopatía auricular con implicaciones en las posibilidades de un control eficaz del ritmo.
Palabras clave
La fibrilación auricular (FA) supone una carga creciente para los sistemas de salud a nivel mundial, lo cual es cada vez más importante en el contexto actual de opciones terapéuticas limitadas para un control eficaz del ritmo a largo plazo1,2. Aunque parte del problema puede atribuirse a las limitaciones de los tratamientos invasivos y farmacológicos actuales, un examen más cuidadoso de la progresión de la FA indica que el grado de miocardiopatía auricular subyacente puede tener consecuencias importantes en cuanto al éxito de las estrategias de control del ritmo3,4.
En la práctica clínica, hemos venido utilizando una clasificación simplista de la FA basada en criterios temporales, que contempla un umbral de 7 días (FA persistente) como límite para diferenciar los episodios con menor probabilidad de éxito cuando se intenta el control del ritmo5,6. Además, después de >1 año en FA, la probabilidad de alcanzar un control satisfactorio del ritmo disminuye aún más7, lo cual resalta la utilidad práctica de la clasificación actual para el tratamiento de la FA5. Las guías de práctica clínica más recientes reconocen que la FA se enmarca dentro de un espectro continuo que requiere una adaptación del tratamiento en función del tipo de FA, incluyendo también a los pacientes con riesgo de FA8. Sin embargo, en los pacientes con FA, la duración de los episodios sigue siendo el criterio principal de clasificación, y se dispone de una información muy limitada sobre el papel que desempeñan distintos indicadores del remodelado en el control eficaz del ritmo4,9. Esto tiene especial importancia durante los primeros meses de evolución en episodios de FA persistente, en los que los pacientes no se encuentran necesariamente en el mismo estadio de remodelado auricular a pesar del mismo tiempo en FA4. Además, en pacientes con FA paroxística, la miocardiopatía auricular subyacente asociada a otras comorbilidades puede predisponer a algunos a tener una baja probabilidad de control eficaz del ritmo10. En consecuencia, una nueva clasificación de la FA que incluya el grado de miocardiopatía auricular subyacente, ya sea asociada a un remodelado relacionado con la FA, o a otras comorbilidades, proporcionará una evaluación más personalizada del sustrato, lo cual facilitará la toma de decisiones clínicas y la selección apropiada de los pacientes candidatos a control del ritmo.
Se ha avanzado en esta dirección con el esquema 4S-AF, que incluye una evaluación del sustrato auricular para clasificarlo en 1 de las 4 categorías del esquema11. Esto se alinea con las recomendaciones de las guías actuales respecto a una aproximación holística o integrada del tratamiento de la FA5, que demuestra que la adherencia a la vía del Atrial fibrillation Better Care se asocia a una mejora de los resultados clínicos12. Sin embargo, la caracterización estructurada del esquema 4S-AF no incluye la evidencia que respalda la amplia variedad de comorbilidades y factores de riesgo cardiovascular que podrían afectar al sustrato auricular. Además, la caracterización del sustrato auricular requiere una integración organizada del remodelado eléctrico, estructural y fibrótico involucrados, para poder proporcionar una evaluación más completa de la miocardiopatía auricular subyacente.
En esta revisión, proponemos una caracterización práctica del sustrato auricular en los pacientes con FA basada en la evidencia científica disponible, con implicaciones en el control eficaz del ritmo. La caracterización se basa en 3 pasos que empiezan con una evaluación clínica básica (paso 1), seguida de una evaluación complementaria del paciente ambulatorio (paso 2) con información disponible en la rutina clínica, y finalmente, la inclusión de información más avanzada (paso 3) que puede estar disponible en los centros especializados. Cada paso puede utilizarse de forma independiente o en combinación con los otros 2 pasos, lo cual permite a los médicos que trabajan en entornos clínicos diferentes obtener una evaluación del grado de miocardiopatía auricular de los pacientes con FA. Proponemos el uso de estos 3 pasos de caracterización para clasificar a los pacientes con FA en 4 estadios de miocardiopatía auricular que pueden usarse para estimar el éxito de una estrategia de control del ritmo.
La asociación entre las variables y los parámetros incluidos en los pasos de caracterización y el sustrato auricular patológico se definieron con base en la evidencia científica sobre su relación con la fibrosis auricular, las zonas de bajo voltaje en los mapas electroanatómicos invasivos o las regiones con realce tardío de gadolinio (RTG) en las imágenes de resonancia magnética cardíaca (RMC). En los casos donde no hubo evidencia disponible a partir de ensayos clínicos o metanálisis, utilizamos series prospectivas o registros retrospectivos grandes (> 100 pacientes).
LA MIOCARDIOPATÍA AURICULAR Y SUS CONSECUENCIAS CLÍNICAS PARA LA CLASIFICACIÓN DE LA FIBRILACIÓN AURICULARLa FA es, a la vez, causa y consecuencia de alteraciones morfológicas y funcionales en el tejido auricular, lo cual aumenta el riesgo de perpetuación de la arritmia a largo plazo3,4,10. Estos cambios, que se definen como remodelado auricular (incluyendo anomalías en el tratamiento del Ca2+, el acortamiento de la duración del potencial de acción, la fibrosis auricular y la desregulación del sistema nervioso autónomo), generan un sustrato auricular heterogéneo que favorece el desarrollo de FA10. Aunque no todo el remodelado auricular se asocia a miocardiopatía auricular, la presencia de un remodelado y fibrosis amplios aumenta el riesgo de aparición y recurrencia de la FA3,13. El tejido adiposo epicárdico también contribuye al avance del remodelado fibrótico del miocardio auricular a través de adipocinas e infiltración fibroadiposa de las capas subepicárdicas de la pared auricular14. Además, existen cardiopatías y factores de riesgo que pueden conducir a un estado de miocardiopatía auricular basal independiente de la FA.
En general, se acepta que la fibrosis auricular es un indicador irreversible de miocardiopatía auricular progresiva4, que puede usarse como indicador objetivo para la caracterización del sustrato3,13. Aunque el análisis histopatológico constituye el patrón de referencia para la identificación y cuantificación de la fibrosis, la disponibilidad de muestras auriculares humanas para la evaluación de la fibrosis y su ulterior correlación con las variables clínicas rara vez se encuentra en las series clínicas3. Sin embargo, hay otras herramientas clínicas, como los mapas electroanatómicos de aurículas y las imágenes de RMC no invasivas, que se han validado para identificar marcadores indirectos de fibrosis auricular3,15,16. Así pues, en este artículo hemos incluido la fibrosis auricular a partir de datos histopatológicos como referencia principal del grado de atriopatía subyacente. Como alternativa, usamos los valores de voltaje o las imágenes de RMC-RTG como indicadores indirectos del sustrato fibrótico subyacente.
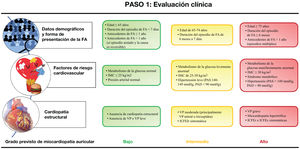
PASO 1: EVALUACIÓN CLÍNICAFactores de riesgo cardiovascular y comorbilidadesLa incidencia de FA aumenta con la edad, tanto en los varones como en las mujeres, con una incidencia superior en los primeros. Sin embargo, en sujetos con edades por encima de los 75 años, el 60% de los pacientes con FA son mujeres1,5. Tiene interés señalar que el aumento del riesgo de FA con la edad se asocia a una tendencia lineal de regiones progresivamente mayores de la aurícula izquierda (AI) con RTG en las imágenes de RMC17. Esto último podría explicar al menos algunos de los resultados de un reciente subanálisis del ensayo CABANA, en el que se han observado tasas progresivamente superiores de recurrencia de la FA tras 4 años de seguimiento, después de una ablación con catéter o del empleo de fármacos antiarrítmicos, en subgrupos de población con edad < 65 años y por encima de los 75 años18. Aunque el avance de la edad se asocia a valores superiores de fibrosis auricular y a una mayor incidencia de FA, es posible que la edad biológica sea más importante que un umbral de edad específico a la hora de determinar el riesgo de recurrencia y de complicaciones de la FA19. Así pues, la combinación de la edad biológica con otras variables debiera ser útil a los médicos para identificar la importancia de la edad en el sustrato auricular específico de cada paciente20.
La diabetes mellitus es un factor de riesgo bien establecido para la FA. La diabetes favorece la presencia de un entorno proarrítmico a través de diversos mecanismos, como la hiperinsulinemia, la inflamación crónica y la activación de vías profibróticas. Se ha demostrado que la diabetes es un factor que predice de manera independiente la presencia de zonas de fibrosis en imágenes de RMC-RTG en pacientes con FA13. Varios estudios prospectivos han confirmado que la diabetes es un factor predictivo independiente de recurrencias de FA después de una ablación con catéter21,22. De hecho, los valores de hemoglobina glicosilada (HbA1c) constituyen un biomarcador del estado diabético, con implicaciones clínicas prácticas para la estratificación del riesgo cardiovascular23. Chao et al.22 han mostrado que los pacientes con un metabolismo de la glucosa normal (HbA1c=5,5±0,5%) tienen unos valores de voltaje bipolar auricular superiores a los de los pacientes con un metabolismo de la glucosa anormal (HbA1c=6,2±1,3%). La evidencia adicional aportada por un metanálisis indicó que un aumento de 1 punto en la hemoglobina glicosilada inicial (con valores de entre el 6,04 y el 7,96%) aumenta la odds ratio de recurrencia de FA en 0,5 durante el seguimiento a largo plazo tras ablación con catéter24. Ese mismo metanálisis indicó que el aumento del índice de masa corporal (IMC) tiene un valor predictivo independiente para las recurrencias de FA después de la ablación con catéter. De hecho, la obesidad está directamente relacionada con la fibrosis auricular, de tal manera que las zonas de bajo voltaje son de mayor tamaño en los pacientes obesos que en los delgados25. Más concretamente, los pacientes con valores de IMC de 30,2±2,6kg/m2 muestran un aumento de regiones auriculares con bajo voltaje comparado con un grupo de referencia e IMC de 25,2±1,3kg/m2.
La hipertensión se asocia a un aumento de la incidencia de FA, y a un remodelado auricular eléctrico y estructural significativo, que se caracteriza por una prevalencia más alta de regiones de conducción lenta y zonas de bajo voltaje en los mapas electroanatómicos3,26. Esto concuerda con tasas superiores de recurrencia de la FA después de una ablación con catéter en los pacientes con una hipertensión no controlada comparado con aquellos sin hipertensión o con una hipertensión controlada27. Los datos de un ensayo aleatorizado en el que se evaluó la eficacia de un tratamiento más agresivo de la presión arterial y su relación con recurrencias de FA después de ablación indican que esta estrategia, más agresiva, no es superior a la de un objetivo estándar de control de la presión arterial (<140/90mmHg) para reducir las recurrencias de la FA28.
No se ha esclarecido aún de manera concluyente el papel que desempeñan otros factores de riesgo cardiovascular clásicos, como la dislipidemia, en la fisiopatología de la FA. Aunque el colesterol unido a lipoproteínas de baja densidad favorece procesos proinflamatorios que podrían estar implicados en el remodelado auricular, varios grupos de investigación han mostrado una relación inversa entre las concentraciones de colesterol total y colesterol unido a lipoproteínas de baja densidad con la incidencia y recurrencias de FA29.
Se ha demostrado que la combinación de factores de riesgo del síndrome metabólico predice de forma independiente las zonas de bajo voltaje en los mapas electroanatómicos auriculares30. De hecho, el síndrome metabólico se asocia también a un mayor riesgo de recurrencia de la FA después de una ablación con catéter31.
La apnea obstructiva durante el sueño (AOS) se ha asociado a cambios estructurales auriculares y anomalías de la conducción que hacen que las aurículas sean propensas a desarrollar FA32. Sin embargo, la AOS está presente a menudo en pacientes con FA y otras comorbilidades asociadas, y no está clara la contribución relativa de cada una de ellas. Además, por el momento no se ha demostrado la asociación entre la AOS y las recurrencias de FA después de una ablación con catéter. Un metanálisis en el que se incluyeron principalmente series retrospectivas sugirió que la AOS se asocia a recurrencias de FA después de la ablación33. Sin embargo, el único estudio aleatorizado realizado hasta la fecha no ha mostrado diferencias significativas en las recurrencias de FA entre los pacientes con AOS tratados con presión positiva continua en vía aérea y los que recibieron tratamiento estándar después de la ablación34. Además, los autores de ese estudio no observaron diferencias en las recurrencias de FA entre los pacientes con y sin AOS34.
Forma de presentación de la fibrilación auricularUna variable clínica que es relativamente fácil de obtener durante una entrevista médica es el tiempo que el paciente ha estado en FA. La transición de la FA paroxística a la FA persistente y la FA persistente de larga duración se caracteriza por un aumento progresivo del remodelado estructural auricular y un empeoramiento de la miocardiopatía auricular35. Sin embargo, el remodelado auricular durante la FA sigue patrones paciente-específicos y, por consiguiente, el simple hecho de que haya episodios de una duración ≥ 7 días no implica que todos los pacientes se encuentren en el mismo estadio de remodelado4,9. De todas maneras, cuanto mayor es el tiempo de permanencia en FA, mayor es la probabilidad de que haya estadios más avanzados de remodelado auricular y de miocardiopatía auricular3,4. Un estudio reciente ha indicado que los pacientes con una FA persistente de larga duración tienen grados de fibrosis en las muestras de biopsia auricular significativamente superiores a los de aquellos con episodios de FA paroxística y persistente3. Esto último sugiere que los pacientes con episodios de FA paroxística y persistente, antes de llegar a cumplir el criterio de FA persistente de larga duración, muestran una amplia variedad de patrones de remodelado auricular, con sustratos auriculares subyacentes significativamente distintos entre pacientes. Esto se pone también de manifiesto en las series clínicas y experimentales en las que un 75% de los individuos desarrollan un remodelado eléctrico auricular completo en un periodo de 6 meses de episodios de FA ininterrumpidos (en pacientes) o con una carga elevada (> 99%) de episodios de FA paroxística (en modelos animales)4,9. Este remodelado eléctrico se refleja en una activación eléctrica más rápida a partir de registros intracardiacos, en comparación con lo observado en estadios iniciales del remodelado eléctrico. De hecho, el remodelado eléctrico tiene una repercusión pronóstica directa en el control de ritmo6,9. De hecho, 6 meses parecen ser el umbral temporal que puede permitir diferenciar estadios iniciales de remodelado asociado a la FA de los tardíos.
La evidencia que respalda las consecuencias del tiempo en FA para el éxito de una estrategia de control de ritmo puede obtenerse del ensayo EAST-AFNET 4 y de subanálisis ulteriores36,37. Los datos de este estudio indicaron que el 56% de los pacientes que tenían una FA persistente en el grupo de ritmo temprano del estudio EAST-AFNET 4 estuvieron en ritmo sinusal a los 24 meses de seguimiento. En cambio, solo el 20% de los pacientes con una FA persistente en el grupo de asistencia estándar mantuvieron el ritmo sinusal tras el mismo periodo de seguimiento37. Cabe destacar que se había diagnosticado a los pacientes con FA persistente, en promedio, 77 días antes, lo cual sugiere que las aurículas estaban dentro de estadios iniciales de remodelado (< 6 meses) debido a la FA4.
Un metanálisis de 6 estudios observacionales también indicó que el tiempo transcurrido entre el diagnóstico de la FA y el primer procedimiento de ablación con catéter es un marcador significativo para el control eficaz de ritmo durante el seguimiento. Un tiempo entre el diagnóstico y ablación ≤ 1 año se asoció a un riesgo relativo de recurrencia de la FA un 27% inferior comparado con lo observado tras un tiempo entre diagnóstico y ablación >1 año7. Aunque en estos estudios no se abordó específicamente el tiempo de permanencia en FA, los datos resaltan también que la propia FA puede conducir a estadios avanzados de miocardiopatía auricular.
Cardiopatía estructuralHay varias enfermedades cardiacas que afectan también al sustrato estructural y electrofisiológico auricular3,38. Sin embargo, la evidencia disponible no respalda en todas ellas un mayor riesgo de recurrencias de FA después de intentar una estrategia de control del ritmo que puede incluir la ablación con catéter. Este es el caso de la enfermedad coronaria crónica, donde diversas series han mostrado resultados discordantes en lo que respecta a los resultados de la ablación con catéter en el control de recurrencias de FA39,40.
Entre las cardiopatías, las valvulopatías con una disfunción como mínimo moderada, y en particular, la insuficiencia y la estenosis de la válvula mitral, afectan de manera significativa al sustrato auricular41,42. Las valvulopatías (que afectan principalmente a las válvulas mitral y tricúspide) se han asociado también a un mayor riesgo de recurrencias de FA después de una ablación con catéter43,44. Además, se ha descrito un riesgo superior de recurrencias de FA en pacientes con historia de reemplazo valvular mitral en los que se ha realizado ablación42.
Existe mayor acuerdo en lo que respecta a las implicaciones de la miocardiopatía hipertrófica en la aparición de FA y el riesgo de recurrencias. De hecho, la FA es la arritmia más frecuente en los pacientes con miocardiopatía hipertrófica, con una prevalencia del 22,4%45. Los mapas electroanatómicos auriculares de pacientes con miocardiopatía hipertrófica y FA muestran un mayor grado de sustrato patológico auricular comparado con controles también con FA46. En un metanálisis reciente, también se ha descrito un incremento en las recurrencias de FA después de ablación con catéter en los pacientes con miocardiopatía hipertrófica comparado con los que no tenían la enfermedad47.
Con el empleo de una perspectiva general dentro de la definición de la insuficiencia cardiaca (IC)48, varias series han indicado que la IC sintomática, tanto con fracción de eyección reducida como conservada, se asocia a un mayor grado de fibrosis auricular subyacente y de zonas de bajo voltaje, en comparación con controles sin IC3,38. Resulta más difícil establecer el papel de la IC con fracción de eyección levemente reducida, aunque en los casos sintomáticos también puede verse afectado el sustrato auricular49. Datos multicéntricos indican que los pacientes con IC que han presentado síntomas en algún momento tienen un riesgo de recurrencias de FA después de la ablación con catéter superior al de los pacientes sin IC50.
El paso 1 se resume en la figura 1.
El grado de miocardiopatía auricular se basa en la evidencia que respalda la relación entre cada variable clínica y la fibrosis auricular subyacente o sus indicadores indirectos. La información médica necesaria para este paso podría obtenerse en cualquier visita clínica convencional. Metabolismo normal de la hemoglobina glicosilada (HbA1c) ≤ 5,5%; metabolismo de la glucosa anormal leve/manifiesto: HbA1c: 5,5-6,2%/≥ 6,2%. FA: fibrilación auricular; ICFEr/lr/c: insuficiencia cardiaca con fracción de eyección reducida/levemente reducida/conservada (FE ≤ 40%/FE=41-49%/FE ≥ 50%); IMC: índice de masa corporal; PAD/PAS: presión arterial diastólica/sistólica; VP: valvulopatía.
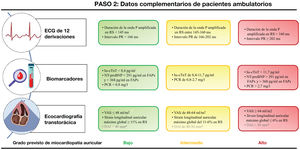
En este segundo paso, proponemos utilizar otros parámetros adicionales de los que se dispone con frecuencia en las consultas de pacientes ambulatorios.
Parámetros electrocardiográficosParámetros derivados del electrocardiograma no se aplican de manera sistemática en la práctica clínica para la evaluación del sustrato auricular, debido probablemente a su baja especificidad. No obstante, algunos de ellos son fáciles de medir en consultas rutinarias de pacientes ambulatorios, y su utilidad puede aumentar en el contexto de un conjunto completo de datos complementarios. Entre ellos, la prolongación del intervalo PR en ritmo sinusal se ha asociado a un aumento de la incidencia de FA en un estudio poblacional con seguimiento a largo plazo51. En otro estudio prospectivo de pacientes con FA, la prolongación del intervalo PR también se asoció con una disminución del voltaje de AI y un aumento de las recurrencias de FA tras ablación con catéter. En ese mismo estudio, se documentaron recurrencias de FA en un 14% de los pacientes del primer cuartil de valores del intervalo PR (<166ms) en comparación con un 22% en los pacientes del cuarto cuartil (PR ≥ 202ms)52.
Jadidi et al.53 describieron un método para medir la duración de la onda P con mayor exactitud en registros en ritmo sinusal, que utiliza señales amplificadas digitalmente (40 a 50mm/mV). Este enfoque mostró una buena correlación con el sustrato asociado a áreas de bajo voltaje en la AI de pacientes sometidos a ablación con catéter. En otra serie, también se demostró que la duración de la onda P predice de manera independiente el sustrato de bajo voltaje en la AI y las recurrencias de FA después del aislamiento de venas pulmonares (AVP)54. Concretamente, se estimó un riesgo de recurrencia de FA 3 veces superior en los pacientes con una duración de la onda P amplificada >160ms comparado con aquellos con valores <145ms54. Además, la duración de la onda P predijo el sustrato de bajo voltaje en los pacientes con FA paroxística, lo cual resalta nuevamente la importancia de caracterizar el sustrato auricular arritmogénico en vez de usar una clasificación basada solo en la duración de episodios.
Biomarcadores sanguíneosLos biomarcadores sanguíneos de fibrosis, inflamación, sobrecarga hemodinámica y estrés oxidativo pueden ser útiles para mejorar la estratificación del riesgo de FA. Concretamente, se ha demostrado que la troponina T cardiaca de alta sensibilidad (hs-cTnT) predice de manera independiente la mortalidad por cualquier causa, la incidencia de FA y la mortalidad por causa cardiovascular55,56. En un estudio retrospectivo de pacientes a los que se les practicó una primera intervención de ablación de FA, Kornej et al.57 mostraron que las concentraciones séricas de hs-cTnT previas a la ablación predecían de manera independiente las zonas de bajo voltaje de la AI. En otra cohorte prospectiva de 125 pacientes consecutivos a los que se les practicó una primera intervención de ablación, los autores observaron que las concentraciones plasmáticas de hs-cTnT eran significativamente superiores en los pacientes con recurrencias de FA comparada con aquellos sin recurrencias (11,7±8,3 pg/ml frente a 8,4±4,7 pg/ml)58. La importancia pronóstica de la hs-cTnT, a diferencia de la troponina i, se ha confirmado también en un metanálisis en el que se incluyeron 27 estudios59.
Los péptidos natriuréticos, incluido el péptido natriurético tipo B y el fragmento N-terminal del propéptido natriurético cerebral o tipo B (NT-proBNP), son neurohormonas secretadas por los cardiomiocitos en respuesta a un aumento de la tensión de la pared debido a la sobrecarga de presión o de volumen. En la FA, la dilatación auricular es una característica frecuente del remodelado y, en algunos subgrupos con trastornos cardiacos específicos, las aurículas pueden estar sometidas también a una sobrecarga de presión4,37,60. Los datos clínicos obtenidos mediante una monitorización Holter de 3 días, antes de la obtención de muestras de sangre, han mostrado que las concentraciones tanto del propéptido de la región media del péptido natriurético auricular como del NT-proBNP difieren significativamente entre 3 categorías de carga de FA/taquicardia auricular (0%, 0-99% y 99-100%)61. Más recientemente, Rossi et al.62 describieron una asociación estadísticamente significativa entre las concentraciones de NT-proBNP y las zonas de bajo voltaje en los mapas electroanatómicos invasivos de pacientes a los que se les realizó AVP. Además, un valor de corte del NT-proBNP sérico >400 ng/l proporcionó una sensibilidad de un 59% y una especificidad de un 65% en la predicción de zonas de bajo voltaje de ≥ 20% de la superficie de la AI62.
Las concentraciones de NT-proBNP se han asociado también a recurrencias de FA después de una ablación con catéter en varios estudios de diferentes grupos de investigación63,64. Estos resultados se han confirmado en metanálisis recientes63,65. En un estudio prospectivo de pacientes sometidos a ablación de FA, las concentraciones plasmáticas de NT-proBNP ≥ 291 pg/ml en pacientes con FA paroxística y ≥ 368 pg/ml en pacientes con FA persistente proporcionaron la mayor sensibilidad y especificidad para la discriminación entre pacientes con y sin recurrencias de FA durante un seguimiento de 12 meses64. En general, los datos relativos al NT-proBNP sugieren que este biomarcador puede ser un buen indicador del remodelado auricular subyacente y que también predice un mayor riesgo de recurrencias después de la ablación con catéter.
De entre los biomarcadores inflamatorios, la proteína C reactiva se utiliza ampliamente en la práctica clínica en varias situaciones patológicas. La proteína C reactiva es un predictor independiente de la aparición de FA66, y ello puede estar relacionado con un mayor grado de fibrosis de la AI y de remodelado estructural en presencia de concentraciones elevadas de proteína C reactiva67. En un estudio prospectivo y multicéntrico reciente de gran tamaño, con 711 pacientes, que se centró en la asociación entre la proteína C reactiva y la recurrencia de FA a largo plazo tras una ablación con catéter, los pacientes del cuartil más alto de proteína C reactiva (>2,7mg/l) presentaron un riesgo de recurrencia un 60% superior al de aquellos del cuartil más bajo (<0,8mg/l). Esto resultados se obtuvieron después de aplicar un ajuste respecto a los factores de riesgo conocidos para recurrencia88. Los resultados también han sido reproducibles en varios estudios observacionales y en un metanálisis reciente, lo cual respalda nuevamente el papel de este biomarcador en la FA65.
Sobre la base de la relación entre el remodelado estructural y la progresión de la FA4, se han estudiado varios biomarcadores asociados a vías profibróticas y al recambio de la matriz extracelular como posibles indicadores del estadio de la FA y predictores de resultados clínicos. Concretamente, en los pacientes con hipertensión e IC sometidos a AVP, los biomarcadores séricos de complejidad del colágeno y de depósito de colágeno de tipo i se han asociado a la prevalencia e incidencia de FA y a recurrencias durante el seguimiento68. Sin embargo, la validación tisular de los biomarcadores séricos de complejidad del colágeno muestra una correlación pobre con la cantidad de fibras de colágeno no solubles en muestras de tejido miocárdico69. Además, otros estudios no han mostrado una correlación significativa entre los biomarcadores sanguíneos de fibrosis y las zonas de bajo voltaje auriculares en pacientes a los que se les realiza un mapeo intracardiaco70. También se han obtenido resultados negativos similares en pacientes sometidos a cirugía cardiaca, en los que la correlación de biomarcadores sanguíneos de fibrosis con los datos histopatológicos de las orejuelas izquierda y derecha ha sido pobre71.
En estudios de investigación traslacional, se ha observado que la galectina-3 tiene también un valor significativo en la predicción de resultados clínicos en pacientes con FA. Los pacientes con FA persistente muestran valores aumentados de galectina-3 en el plasma, y este biomarcador predice de manera independiente la fibrosis intersticial en muestras de orejuela derecha procedentes de pacientes sometidos a cirugía cardiaca72. Algunas series también han descrito que las concentraciones de galectina-3 son mayores en los pacientes con recurrencias de FA después de un procedimiento de ablación, comparado con lo observado en aquellos sin recurrencias, especialmente en casos de FA persistente73-75. Las concentraciones plasmáticas del factor de diferenciación del crecimiento-15 (GDF-15), un miembro distante de la familia de citocinas del factor de crecimiento transformador-β, muestran también una asociación con los resultados clínicos en pacientes con FA76. Además, se ha identificado que las concentraciones de GDF-15 predicen de forma independiente las recurrencias de FA después de una ablación con catéter. Concretamente, un estudio prospectivo reciente ha mostrado que las concentraciones séricas de GDF-15 >1.287,3 ng/l previas a la intervención se asociaron a un aumento de recurrencias de FA después de la AVP77. Sin embargo, a menudo no se dispone del análisis del GDF-15 en los análisis de sangre habituales. Menos claro es el papel de otros biomarcadores, como el ST2 soluble, que forma parte de la familia del receptor de la interleuquina-1 78.
En resumen, algunos estudios han puesto de manifiesto el papel de los biomarcadores para evaluar el sustrato auricular subyacente en pacientes con FA. Sin embargo, los datos de biomarcadores deben interpretarse de forma individual basándose en el contexto clínico específico de cada paciente.
Parámetros ecocardiográficosLa ecocardiografía transtorácica permite una evaluación cuantitativa de los diámetros, el volumen y la función de la AI, junto con una evaluación indirecta de la rigidez y la presión de la AI. Esto hace que la ecocardiografía sea una herramienta no invasiva de gran utilidad para el estudio de la miocardiopatía auricular79.
Varios metanálisis recientes han indicado que el aumento del volumen AI indexado (VAIi) se asocia de manera significativa a un mayor riesgo de eventos cardiovasculares mayores en la FA y a un mayor riesgo de recurrencia de FA después de una ablación con catéter80,81. También se identificó que un diámetro de la AI ≥ 50mm predice de forma independiente las recurrencias de FA. No obstante, el diámetro de la AI supone solo una estimación aproximada del tamaño real de la AI, especialmente en el contexto de aurículas dilatadas y con un remodelado asimétrico79. En consecuencia, proponemos el empleo del VAIi en estudios de ecocardiografía transtorácica, lo cual proporciona una evaluación más exacta de la estructura tridimensional de la AI. De hecho, el VAIi muestra una asociación significativa con el grado RTG en AI a partir de imágenes de RMC (48±18ml/m2 en estadios con <10% de RTG en el volumen de miocardio auricular, y 64±24ml/m2 en estadios con >30% de RTG en el volumen de miocardio auricular)13. Además, puntos de corte similares de VAIi (50±13ml/m2 y 64±19ml/m2) también se han asociado a zonas de bajo voltaje en la AI del 0 y >15%, respectivamente, a partir de estudios con mapeo invasivo82.
Algunos índices funcionales ecocardiográficos también han mostrado una asociación significativa con el sustrato subyacente. De entre los parámetros funcionales, la deformación (strain) longitudinal auricular máxima global en imágenes ecocardiográficas de rastreo de marcas (speckle tracking) indica una correlación negativa con el grado de fibrosis miocárdica de la AI en muestras de pacientes con insuficiencia mitral grave sometidos a cirugía cardiaca83. Además, se ha descrito que el strain longitudinal auricular máximo global y el VAIi predicen de manera independiente la extensión de las zonas de bajo voltaje de la AI en pacientes con FA persistente a los que se les realiza una ablación con catéter82. Más concretamente, los pacientes sin zonas de bajo voltaje auriculares mostraron un strain longitudinal auricular máximo global medio significativamente mayor que el de los aquellos con >15% de zonas de bajo voltaje en la AI (11,3±5,3% frente al 6,2±2,9%, respectivamente). También se ha descrito que estos mismos parámetros predicen de manera independiente las recurrencias de FA después de 9 meses de seguimiento82. El paso 2 se resume en la figura 2.
El grado de miocardiopatía auricular se basa en la evidencia que respalda la relación entre cada parámetro y la fibrosis auricular subyacente o sus indicadores indirectos. El número de biomarcadores y de parámetros electrocardiográficos y de ecocardiografía transtorácica disponibles puede variar en función del contexto clínico. Ello no impide utilizar los parámetros disponibles para caracterizar el sustrato auricular subyacente. DAI: diámetro de aurícula izquierda; ECG: electrocardiograma; FAPx/FAPs: fibrilación auricular paroxística/persistente; hs-cTnT: troponina T cardiaca de alta sensibilidad; NT-proBNP: fragmento N-terminal del propéptido natriurético cerebral o tipo B; PCR: proteína C reactiva; RS: ritmo sinusal; VAIi: volumen de aurícula izquierda indexado. * No se recomienda el uso del DAI cuando se dispone del VAIi.
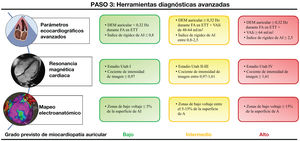
La fibrosis auricular como marcador de la miocardiopatía auricular puede evaluarse con mayor detalle con herramientas diagnósticas avanzadas. Estas herramientas no están disponibles de manera habitual en los centros de atención primaria y consultas ambulatorias, y por lo general solamente pueden aplicarse en centros de referencia para el tratamiento de la FA, en los que es posible utilizar una estrategia más personalizada.
El índice de rigidez de la AI (cociente de E/e’ respecto al strain longitudinal auricular máximo global) es un nuevo parámetro ecocardiográfico con un valor predictivo independiente para zonas de bajo voltaje de la AI en pacientes con FA persistente sometidos a ablación con catéter82. El índice de rigidez de la AI fue superior al strain longitudinal auricular máximo global y al VAIi en la predicción de zonas de bajo voltaje en la AI82. Este índice también predice de manera independiente las recurrencias de FA tras ablación.
Recientemente, Enríquez-Vázquez et al.4 han descrito un parámetro práctico y no invasivo que puede permitir la evaluación del estadio del remodelado auricular subyacente en pacientes con FA. Los datos del estudio mostraron que la evaluación simultánea de la actividad electromecánica auricular durante FA permite identificar cambios incipientes en el remodelado auricular que tienen implicaciones directas en la estrategia de control de ritmo a corto y largo plazo. Más concretamente, los autores demostraron que, durante FA, la activación eléctrica auricular puede ser más rápida que las contracciones mecánicas registradas de forma simultánea. Este fenómeno se definió como disociación electromecánica auricular, que, de hecho, representa un indicador temprano e individuo-específico del grado de remodelado auricular en pacientes con episodios de FA de duración ≤ 6 meses. Este nuevo parámetro mostró una capacidad predictiva del control eficaz de ritmo superior a la de los parámetros ecográficos o biomarcadores sanguíneos convencionales en pacientes que se encontraban en los estadios iniciales de progresión del remodelado auricular.
La fibrosis de la AI se asocia a la FA de nueva aparición, la perpetuación de la FA y las recurrencias después de un procedimiento de ablación3,4,10,17. En las imágenes de RMC-RTG, es posible evaluar de manera no invasiva zonas con un aumento de la matriz extracelular, que es la característica distintiva de la fibrosis auricular y que se correlaciona con el análisis histológico como patrón de referencia13,84. Marrouche et al.85 han descrito un valor de hazard ratio global sin ajustar de 1,06 por cada 1% del aumento de la fibrosis auricular a partir de imágenes de RMC-RTG de la AI. Los resultados fueron similares tras el ajuste por covariables. De hecho, la cuantificación de la fibrosis auricular a partir de imágenes de RMC-RTG mejoró la capacidad predictiva de recurrencias comparado con un modelo con covariables clínicas convencionales85. En la misma línea, Quail et al.86 describieron un aumento del doble en el riesgo de arritmias auriculares de nueva aparición por cada desviación estándar de aumento en los valores RTG en imágenes de RMC.
Debe tenerse en cuenta que el aumento de realce en imágenes de RMC-RTG no está relacionado exclusivamente con la fibrosis o con un tipo específico de fibrosis. Ello hace que sea difícil diferenciar las zonas con hiperrealce causadas por una fibrosis de reemplazo, cicatrices yatrogénicas o matriz extracelular fisiológica, y las zonas adyacentes con posible interferencia por hiperrealce intrínseco (por ejemplo, grasa epicárdica). Además, el umbral de intensidad de señal para diferenciar el tejido auricular normal del fibrótico no es homogéneo en las distintas series, y ello hace que la evaluación de las zonas de fibrosis sea sensible a sesgos16. Por otra parte, la obtención de imágenes de gran calidad con una gran resolución espacial es crucial para la evaluación precisa de la fibrosis auricular de forma no invasiva. La normalización del RTG respecto al conjunto de la sangre es también un paso importante para reducir al mínimo la variabilidad entre los pacientes, ya que permite introducir una corrección respecto a la farmacocinética específica del medio de contraste en cada paciente. Las imágenes de RMC-RTG también son sensibles a artefactos causados por el pulso de restablecimiento del navegador respiratorio, lo cual da lugar a una intensidad de señal superior en el tejido de alrededor del navegador (por ejemplo, la pared auricular próxima o el conjunto de la sangre)87.
El mapeo electroanatómico invasivo de las aurículas permite a los electrofisiólogos intervencionistas detectar regiones de bajo voltaje, lo cual constituye un enfoque alternativo para evaluar el sustrato fibrótico auricular. Además de la fibrosis, el aumento del espacio intercelular, la pérdida de miofibrillas y la disminución de la densidad nuclear miocárdica se asocian de forma significativa a una reducción del voltaje y a zonas de conducción lenta3. De hecho, en varias series se ha descrito una reducción proporcional del voltaje bipolar por cada unidad de aumento del cociente de intensidad de imagen en secuencias de RMC-RTG de la AI. Este cociente se calcula mediante la media de intensidad de señal miocárdica en la AI, dividido por la media de intensidad de señal en el conjunto de la sangre88,89. Zghaib et al.89 han indicado que un cociente de intensidad de imagen >0,74 corresponde a un voltaje bipolar <0,5mV. Khurram et al.88 observaron un cociente de intensidad de imagen ligeramente superior (>0,97) para los mismos valores de voltaje bipolar <0,5mV.
Hay múltiples estudios que respaldan también el valor pronóstico de la determinación del área de bajo voltaje auricular durante el mapeo electroanatómico invasivo90,91. Los datos más recientes indican que la extensión del área de bajo voltaje (tomando como bajo voltaje un valor <0,5mV en ritmo sinusal o <0,24mV en la FA) puede representar un riesgo diferente de recurrencias después de ablación en pacientes con FA paroxística o persistente91. Más concretamente, las zonas de bajo voltaje que afectan a >5% de la superficie de la AI aumentan el riesgo de recurrencias en pacientes con FA paroxística. Sin embargo, en la FA persistente, este umbral predictivo del bajo voltaje se ha observado cuando el área de bajo voltaje supone >15% de la superficie de la AI91. Esto podría evidenciar que, en la FA paroxística, las zonas de bajo voltaje constituyen un marcador de una miocardiopatía auricular difusa subyacente. En cambio, en la FA persistente, el bajo voltaje puede estar causado en parte por un remodelado reversible intensificado por la propia FA. No obstante, los mapas de voltaje no están exentos de limitaciones y de posibles sesgos. De hecho, los valores de voltaje bipolar son sensibles al ritmo intrínseco en el momento del mapeo, el tamaño del electrodo, el espacio entre electrodos, la orientación del catéter y el contacto tisular92.
Por último, las actuales herramientas diagnósticas han proporcionado avances significativos en la definición de la arquitectura genética de los pacientes con FA. Se han descrito variantes genéticas raras y frecuentes que han mostrado una asociación con la aparición de FA y con resultados clínicos a largo plazo. Además, el componente genético de la FA es alto, suponiendo hasta un 62% en gemelos y del 22% en la población general. Varios grupos han investigado la asociación de los polimorfismos de un solo nucleótido relacionados con la FA con el control satisfactorio del ritmo después de un procedimiento de ablación. Los polimorfismos más importantes asociados a recurrencias de FA después de la ablación con catéter son los del cromosoma 4q25 que afectan al gen PITX293. Sin embargo, las recientes observaciones de estudios de asociación de genoma completo con grandes cohortes de pacientes no aportan una evidencia concluyente respecto a la capacidad de predecir recurrencias de FA después de una ablación con catéter basándose en variantes genéticas o polimorfismos de un solo nucleótido en el locus PITX294,95. El paso 3 se resume en la figura 3.
El grado de miocardiopatía auricular se basa en la evidencia que respalda la relación entre cada parámetro y la fibrosis auricular subyacente o sus indicadores indirectos. El número de parámetros disponibles puede variar en función del contexto clínicos, pero ello no impide utilizar los parámetros disponibles para caracterizar el sustrato auricular subyacente. Los estadios Utah y el cociente de intensidad de imagen se evalúan en secuencias 3D de resonancia magnética cardíaca con realce tardío de gadolinio de la aurícula izquierda. AI: aurícula izquierda; DEM: disociación electromecánica; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; VAIi: volumen de la aurícula izquierda indexado.
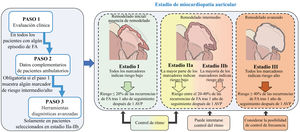
Proponemos una clasificación pragmática de los pacientes con FA en 4 estadios de miocardiopatía auricular, basada en los datos clínicos disponibles y la información complementaria obtenida en cada uno de los pasos de la evaluación. Esto permitirá a los médicos que trabajan en diferentes contextos clínicos, desde consultas ambulatorias hasta unidades especializadas de centros de referencia, estimar el grado subyacente de miocardiopatía auricular, lo cual tiene implicaciones en el éxito de las estrategias de control de ritmo. En realidad, la clasificación muestra la probabilidad prevista de recurrencias de FA después de un año de seguimiento dentro de cada estadio de miocardiopatía auricular (figura 4). Las recurrencias de la FA se han establecido a partir de series que estudiaron el efecto de la fibrosis auricular y las zonas de bajo voltaje (como indicador indirecto de fibrosis auricular) en el control de ritmo después de ablación90,91,96,97. La predicción de las recurrencias de FA después de la ablación con catéter también se ha propuesto en otras series con el empleo de diferentes puntuaciones, aunque en general hay resultados muy variables entre ellas con rendimientos subóptimos98. Cabe destacar que no pudimos acceder a las bases de datos originales para analizar los datos brutos de las variables y los parámetros que proponemos para evaluar la miocardiopatía auricular subyacente. En consecuencia, no podemos presentar una puntuación de riesgo con la contribución específica de cada variable. Por lo tanto, este documento debe interpretarse como descriptivo, con el fin de resaltar la necesidad de una mejor clasificación de los pacientes con FA. No obstante, la propuesta de clasificación se basa en la evidencia científica disponible para cada uno de los pasos.
Figura central. Esta clasificación debe interpretarse como descriptiva, con la finalidad de resaltar la necesidad de una mejor clasificación de los pacientes con FA. Dada la falta de acceso a las variables y parámetros usados para generar los estadios, no podemos proporcionar una puntuación de riesgo con la contribución específica de cada variable que permita una estratificación más exacta. Las recurrencias de la FA se han estimado a partir de series que estudiaron el efecto de la fibrosis auricular y las zonas de bajo voltaje en el control de ritmo después de ablación90,91,96,97. AVP: aislamiento de venas pulmonares; FA: fibrilación auricular.
Serán necesarias nuevas series prospectivas para demostrar el valor clínico de la clasificación propuesta en este trabajo, no solo para el control de ritmo, sino también para otros objetivos clínicos en los pacientes con FA. Por otro lado, la tasa de éxito después del AVP puede variar si se considera la posibilidad de intervenciones posteriores para abordar el sustrato. Por lo tanto, las decisiones clínicas respecto al control de ritmo deben interpretarse siempre en el contexto clínico individual de cada paciente, teniendo en cuenta sus preferencias, la presencia de síntomas y, lo que es más importante, el tratamiento optimizado de las comorbilidades concomitantes y los factores de riesgo cardiovascular5.
FINANCIACIÓNEste trabajo contó con el apoyo del programa de investigación e innovación Horizonte 2020 de la Unión Europea bajo el acuerdo de subvención #965286 y #899871. El estudio contó también con el apoyo del Ministerio de Ciencia e Innovación (MCIN) (PID2019-109329RB-I00) con la financiación de MCIN/AEI/10.13039/501100011033 y la Fundación Interhospitalaria para la Investigación Cardiovascular. El Centro Nacional de Investigaciones Cardiovasculares (CNIC) cuenta con financiación por parte del Instituto de Salud Carlos III (ISCIII), el Ministerio de Ciencia e Innovación (MCIN) y la Fundación Pro CNIC, y es un Centro de Excelencia Severo Ochoa (financiado por MICIN/AEI/10.13039/501100011033). El trabajo también fue apoyado parcialmente con fondos del ISCIII y MCIN (PI18/01268 y PI23/00520).
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizó inteligencia artificial para ninguna de las tareas asociadas a la preparación de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESD. Filgueiras-Rama, F. Marín, G. La Rosa y L. Sanchis participaron en la conceptualización, metodología y redacción de la versión inicial del manuscrito. Todos los autores participaron en la corrección y redacción de la versión final del manuscrito. La obtención de la financiación corrió a cargo de D. Filgueiras-Rama, F. Marín, L. Sanchis, S.N. Hatem, J. Jalife, N. Pérez-Castellano, D. Calvo y J. Pérez-Villacastín.
CONFLICTO DE INTERESESD. Filgueiras-Rama y L. Sanchis son editores asociados de Rev Esp Cardiol. Se ha seguido el procedimiento editorial establecido por la revista para garantizar un procesamiento imparcial del manuscrito. D. Filgueiras-Rama, J.G. Quintanilla y D. Calvo son inventores y tienen solicitudes de patentes pendientes en relación con herramientas avanzadas para la evaluación de la fibrilación cardiaca.
Damos las gracias a Carlos Galán-Arriola por su apoyo en el diseño de los estadios de la miocardiopatía auricular de la figura 4.