La miocarditis se define como la inflamación del miocardio y su etiología es muy diversa e incluye procesos infecciosos, tóxicos o enfermedades autoinmunitarias. La presentación clínica es muy diversa, más allá del cuadro clásico con dolor torácico agudo, e incluye casos de miocardiopatía no filiada cuya etiología puede ser inflamatoria. Teniendo en cuenta que hay pacientes que pueden beneficiarse de tratamientos dirigidos, la búsqueda de la etiología debe iniciarse desde el momento en que se sospecha una miocarditis. Son todavía muchas las áreas de incertidumbre en el diagnóstico y el tratamiento de esta afección, por lo que este documento de consenso se ha creado con el objetivo de proporcionar recomendaciones claras en relación con su diagnóstico y tratamiento. Se propone un algoritmo diagnóstico que especifica en qué pacientes se puede establecer un diagnóstico no invasivo con resonancia magnética cardiaca frente a invasiva con biopsia endomiocárdica, y se indaga en aspectos más novedosos como cuándo sospechar una etiología genética subyacente. Asimismo se establecen recomendaciones en cuanto al tratamiento de la miocarditis y la miocardiopatía inflamatoria, tanto de las complicaciones generales como de entidades clínicas específicas.
Palabras clave
La miocarditis se define como una enfermedad inflamatoria que afecta al músculo cardiaco con muy diversas etiologías, que incluyen infecciones, toxicidades y procesos autoinmunitarios1–3. Su diagnóstico presenta dificultades por la variabilidad de presentación y la falta de instrumentos diagnósticos precisos; además, las opciones terapéuticas son escasas, dependientes de la etiología y con áreas de incertidumbre. Por ello, el Grupo de Trabajo de Miocarditis de la Sociedad Española de Cardiología (SEC) ha redactado este documento de consenso cuya finalidad es dar respuesta a la necesidad de disponer de recomendaciones claras acerca de esta patología y homogeneizar su diagnóstico y tratamiento en la práctica clínica. Un grupo reducido de autores y 2 coordinadores, elegidos de entre los miembros del grupo de trabajo, se han encargado de la redacción inicial y de consensuar las diferentes recomendaciones en diversas reuniones. Después, el documento se ha sometido a la valoración y las aportaciones de todos los miembros del grupo de trabajo y a una aprobación final por todo el grupo de trabajo.
El documento se inicia estableciendo las diferentes definiciones aceptadas para esta patología1–3 (tabla 1).
Definiciones
| Sospecha clínica de miocarditisPresentación clínica que incluye síntomas sugestivos y al menos 1 alteración objetiva en:a) Pruebas básicas (alteraciones sugestivas en electrocardiograma o ecocardiografía)b) Marcadores bioquímicos de daño miocárdicoc) Signos sugestivos en la CRM, pero sin que lleguen a cumplir criterios diagnósticos de confirmación |
| Miocarditis confirmadaSospecha clínica de miocarditis más al menos 1 de los siguientes:a) Criterios por CRM (diagnóstico no invasivo):• Existencia de al menos 1 criterio en T1 (T1 nativo anormal, aumento del volumen extracelular o presencia de realce tardío) junto con al menos 1 criterio en T2 (hiperintensidad de señal en secuencias potenciadas en T2 o mapeo en T2 anormal)b) Criterios histológicos o inmunohistológicos por biopsia endomiocárdica (diagnóstico invasivo):• Criterios histológicos (Dallas): evidencia histológica de infiltrados inflamatorios en el miocardio asociados junto con necrosis de origen no isquémico• Criterios inmunohistológicos: ≥ 14 leucocitos/mm2 incluyendo hasta 4 monocitos/mm2 con la presencia de más de 7 células CD3 positivas (linfocitos T) por mm2• Miocarditis borderline: evidencia histológica de infiltrados inflamatorios pero sin presencia de necrosis |
| Miocarditis fulminanteEnfermedad inflamatoria del miocardio que cursa con insuficiencia cardiaca aguda e inestabilidad hemodinámica (< 2-4 semanas desde el inicio de síntomas). La biopsia endomiocárdica muestra focos linfocitarios. No se debe confundir con otros cuadros etiológicos que pueden presentarse con inestabilidad, como las miocarditis de células gigantes, eosinofílica o la sarcoidosis, que sí tienen tratamientos específicos |
| Según la evolución temporal, se distingue:Miocarditis agudaCuando el tiempo transcurrido desde el inicio de los síntomas y el diagnóstico de la enfermedad es menor de 1 mes - Complicada: FEVI < 50%, arritmias ventriculares sostenidas, trastornos graves de la conducción, insuficiencia cardiaca o shock cardiogénico- No complicada: en ausencia de criterios de miocarditis aguda complicadaMiocarditis crónicaCuando el tiempo transcurrido desde el inicio de síntomas y el diagnóstico de la enfermedad es superior a 1 mes |
| Miocardiopatía inflamatoriaMiocarditis crónica en asociación con disfunción ventricular (FEVI <50%) |
CRM: cardiorresonancia magnética; FEVI: fracción de eyección del ventrículo izquierdo.
Recomendación: se recomienda un alto grado de sospecha diagnóstica de miocarditis, considerando sus diferentes presentaciones clínicas.
En la miocarditis aguda es común la fiebre y la presencia en las semanas previas de síntomas prodrómicos que indican un cuadro viral (orofaríngeos, respiratorios, gastrointestinales, exantema cutáneo, etc.)4. Las presentaciones clínicas más probables son:
- a)
Asintomática. Se detecta a raíz de otras alteraciones, en particular en el electrocardiograma (ECG) como alteraciones de la repolarización o extrasistolia ventricular5.
- b)
Dolor torácico similar a la pericarditis o el síndrome coronario agudo. Es la forma más frecuente, que suele acompañarse de alteraciones en la repolarización ST-T, así como elevación persistente de troponinas2,3.
- c)
Disnea o insuficiencia cardiaca (IC), aguda o subaguda (< 1-3 meses de evolución2,3). Es la segunda forma más frecuente y se acompaña de anomalías de la contractilidad, con aumento variable del grosor y ventrículos de tamaño normal o ligeramente dilatados6.
- d)
Palpitaciones, síncope o arritmias. El tipo de arritmias es variable, desde taquicardia sinusal inapropiada hasta extrasístoles frecuentes, habitualmente ventriculares, taquiarritmias sostenidas, alteraciones de la conducción de novo o bradiarritmias, o incluso presentarse como muerte súbita o ser diagnosticada en autopsia.
- e)
Miocardiopatía establecida (> 3 meses2,3). En este caso, el proceso de miocarditis ha pasado desapercibido y ha evolucionado a disfunción cardiaca y miocardiopatía establecidas, con troponina que puede ser normal, y cursando con grados variables de dilatación y disfunción biventricular.
Recomendación: el diagnóstico etiológico debe iniciarse junto al diagnóstico de sospecha.
Es importante considerar las diferentes etiologías desde el momento en que se establece la sospecha diagnóstica e incluirlas en la anamnesis y las pruebas complementarias, pues su identificación puede condicionar un tratamiento distinto. En la tabla 2 se reflejan las diferentes etiologías2,3,6-8. Aunque la causa aceptada como más frecuente son los virus2,3,6-8, pocas veces se llega a un diagnóstico etiológico definitivo. Sin embargo, identificar determinadas entidades es importante, pues puede conllevar un tratamiento diagnóstico-terapéutico distinto.
Etiologías de la miocarditis2,3,6–8
| Infecciosa | |
| Virus | ARN: enterovirus, coronavirus, influenza A y B, VRS, VHC, VIH, metapneumovirus, dengue, paperas, sarampión, rubeola, fiebre amarilla, chikunguya, fiebre de Lassa, rabia |
| ADN: Adenovirus, Parvovirus B19, VHH6, VEB, CMV, VHS, VHZ. | |
| Bacterias | Estreptococo (especialmente Pyogenes), Borrellia burgdorferi (Lyme), Mycoplasma pneumoniae, Rickettsia (especialmente Coxiella burnetti), Brucella, Micobacterium tuberculosis, estafilococo, Haemophilus, Salmonella, Tularemia, Clostridium, Corynebacterium diphtheriae, sífilis, Leptospira |
| Protozoos | Toxoplasma gondii, Trypanosoma cruzi (Chagas), Plasmodium (Malaria), Entamoeba, Leishmania |
| Hongos | Aspergilosis, actinomicosis, blastomicosis, candidiasis, coccidiomicosis, criptococosis, esporotricosis, histoplasmosis, nocardia |
| Parásitos* | Cisticercosis, esquistomosiasis, equinococosis, triquinosis |
| Inmunomediada | |
| Autoinmunitarias | Anticuerpos anticardiacos, LES, artritis reumatoide, esclerodermia, miopatias inflamatorias (polimiositis/dermatomiositis, síndrome antisintetasa, miositis por cuerpos de inclusión, necrosante), vasculitis, granulomatosis con poliangeítis, granulomatosis eosinofílica con poliangeítis*, miastenia grave, enfermedad celiaca |
| Autoinflamatorias | Sarcoidosis, enfermedad inflamatoria intestinal, enfermedad de Behçet, enfermedad de Still, espondilitis anquilopoyética, tirotoxicosis, enfermedad de Kawasaki, enfermedad de Takayasu |
| Genética | Genes desmosomales (DSP, PKP2), TTN,FLNC, BAG3, RBM20, genes relacionados con miopatías (DMD, DYSF) |
| Otros | Síndrome hipereosinofílico, neoplasias |
| Tóxica | |
| Hipersensibilidad* | • Antibióticos: penicilina, cefalosporina, sulfonamidas, isoniazida• Antipsicóticos: clozapina• Antiinflamatorios: indometacina• Diuréticos: tiazidas• Inotrópicos: dobutamina• Otros: vacunas, metildopa, carbamacepina, toxoide tetánico |
| Antineoplásicos | Inhibidores del punto de control inmunitario, fluoropirimidinas, antraciclinas |
| Otros fármacos | Ciclofosfamida, vacunas, anfetaminas |
| Hormonas | Feocromocitoma, Beri-beri |
| Otros | Cocaína, cobre, hierro, plomo, arsénico, picaduras (serpiente, escorpión, araña, abeja, avispas), electrocución, radiación |
ADN: ácido desoxirribonucleico; ARN: ácido ribonucleico; CMV: citomegalovirus; LES: lupus eritematoso sistémico; VEB: virus de Epstein-Barr; VHC: virus de la hepatitis C; VHH6: virus del herpes humano tipo 6; VIH: virus de la inmunodeficiencia humana; VHS: virus del herpes simple; VHZ: virus del herpes zoster; VRS: virus respiratorio sincitial.
Recomendación: el ECG, la analítica y la ecocardiografía son pruebas necesarias en todos los casos, ante la sospecha diagnóstica inicial.
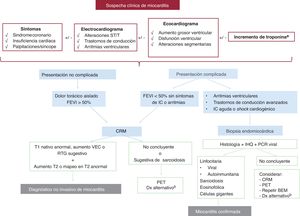
En la figura 1 se establece el algoritmo diagnóstico recomendado, que debe iniciarse con la sospecha clínica inicial.
Algoritmo diagnóstico en sospecha de miocarditis. BEM: biopsia endomiocárdica; CRM: cardiorresonancia magnética; Dx: diagnóstico; FEVI: fracción de eyección del ventrículo izquierdo; IHQ: inmunohistoquímica; PCR: reacción en cadena de la polimerasa; PET: tomografía por emisión de positrones; RTG: realce tardío de gadolinio; VEC: volumen extracelular.
aEn la miocarditis crónica o sospecha de miocardiopatía inflamatoria, una troponina normal no excluye completamente el diagnóstico.
bConsidere estudio genético (junto con recomendaciones de la figura 2).
Está alterado en la mayoría de los casos, pero suele ser inespecífico y un ECG normal no descarta el diagnóstico3. La alteración más frecuente es la elevación del ST en las derivaciones inferolaterales o difusa, pero pueden observarse otras alteraciones de la repolarización, ondas Q patológicas, anomalías de la onda T, QRS prolongado, bloqueos o extrasístoles frecuentes3. La presencia de bloqueo auriculoventricular avanzado debe hacer que se sospeche sarcoidosis cardiaca, enfermedad de Lyme o miocarditis asociada con inmunoterapia2. La presencia de bajos voltajes (por edema miocárdico), arritmias ventriculares y trastornos de la conducción deben motivar la sospecha de una forma de alto riesgo que puede evolucionar a miocarditis fulminante8.
AnalíticaSe recomienda solicitar las siguientes pruebas ante la sospecha:
- •
Troponina de alta sensibilidad: suele estar elevada en fase aguda, ya sea persistente en meseta o con cinética de elevación y descenso; tiene baja correlación con la gravedad del cuadro y su negatividad no descarta el diagnóstico3.
- •
Fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) o péptido natriurético cerebral (BNP): se relacionan con el grado de IC.
- •
Marcadores inflamatorios (proteína C reactiva y velocidad de sedimentación globular): positivos en la mayoría de los casos y su persistencia aumentaría la sospecha de una enfermedad autoinmunitaria de base2.
- •
Hemograma completo: permite detectar eosinofilia que orienta a miocarditis eosinofílica9.
- •
Bioquímica: función hepática, renal, iones, perfil tiroideo y creatincinasa.
Recientemente se ha descrito que la determinación de un micro-ARN circulante (hsa:Chr8:96) puede facilitar un diagnóstico precoz y diferenciarlo de un síndrome coronario agudo, con elevada precisión diagnóstica10. Sin embargo, su traslación a la práctica clínica aún está pendiente.
En caso de sospecha específica, se deben realizar estudios dirigidos a ella, que se recogen en la tabla 1 del material adicional. En ausencia de causa específica y ante una alta sospecha de miocarditis autoinmunitaria, se debe considerar la determinación de anticuerpos anticardiacos, antidiscos intercalares y antirreceptor β-1 si están disponibles3.
EcocardiogramaRecomendación: la ecocardiografía debe realizarse tan pronto haya sospecha clínica, y es urgente si existe inestabilidad hemodinámica. Debe considerarse repetirla en los días siguientes, en particular si la evolución no es favorable.
La valoración precoz de la función ventricular permite estratificar el nivel de cuidados requeridos y el pronóstico del paciente. En la fase inicial, el ventrículo izquierdo presenta tamaño y función sistólica normales hasta en el 75% de los pacientes1. Sin embargo, la función cardiaca puede deprimirse rápidamente durante los primeros días del cuadro clínico, por lo que se recomienda repetir el ecocardiograma ante cambios clínicos durante la evolución. Entre los hallazgos compatibles están el aumento de grosor miocárdico y de la ecogenicidad granular, ambos en relación con la presencia de edema. Son frecuentes las alteraciones de la contractilidad segmentaria, especialmente hipocinesia en las regiones inferior e inferolateral del ventrículo izquierdo, y diferentes grados de derrame pericárdico1. El grado de deformación miocárdica (speckle-tracking) predice la existencia de realce tardío en el estudio de cardiorresonancia magnética (CRM)11 y está disminuida en los segmentos afectados.
Resonancia magnética cardiacaRecomendación: la presencia de síntomas compatibles junto con alguna alteración objetiva en las pruebas básicas (ecocardiograma, analítica y ECG) respalda el diagnóstico de sospecha de miocarditis y justifica la realización de una CRM.
Recomendación: ante la sospecha de miocarditis aguda, la CRM debe hacerse pronto, idealmente en los primeros 7 días, e incluir mapeo en T1/T2 para facilitar un diagnóstico de confirmación, como alternativa a la biopsia endomiocárdica, si bien no permite un diagnóstico etiológico.
La CRM estaría indicada para todo paciente con sospecha clínica de miocarditis y elevación de biomarcadores de daño miocárdico o alteraciones que lo indiquen en el ECG o la ecocardiografía (véase el apartado «Evaluación de anatomía coronaria»).
Los criterios de Lake-Louise actualizados en 2018 están basados en una combinación de secuencias que permiten determinar la existencia de edema y fibrosis miocárdica. El diagnóstico se basa en la existencia de al menos 1 criterio en T1 (T1 nativo anormal, aumento del volumen extracelular o presencia de realce tardío) junto con 1 criterio en T2 (hiperintensidad de señal en secuencias potenciadas en T2 o mapeo en T2 anormal) determinado mediante CRM. Existen otros criterios de apoyo como la coexistencia de pericarditis o disfunción sistólica global o regional. Se recomienda realizar la CRM en las primeras 2 semanas de inicio del cuadro clínico e idealmente durante los primeros 7 días tras su sospecha12. Técnicas de imagen avanzada como la deformación miocárdica (feature-tracking) o el análisis de texturas (radiómica) han mostrado resultados iniciales prometedores13. La inclusión de las técnicas paramétricas ha permitido aumentar la rentabilidad diagnóstica del 84 al 90-96%14.
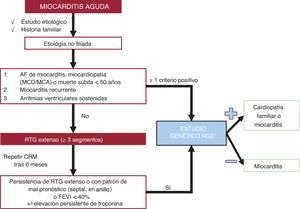
Estudio genéticoEn la figura 2 se resumen las situaciones en que se debe considerar realizarlo.
Recomendaciones para la realización de estudio genético en loa miocarditis. AF: antecedentes familiares; CRM: cardiorresonancia magnética; FEVI: fracción de eyección del ventrículo izquierdo; MCA: miocardiopatía arritmogénica; MCD: miocardiopatía dilatada; NGS: next generation sequencing; RTG: realce tardío de gadolinio.
*Genes que testar prioritariamente, por orden alfabético: ACTC1, BAG3, DES, DSC2, DSG2, DSP, EMD, FLNC, JUP, MYBPC3, MYH7, PKP2, PLN, TMEM43, LMNA, RBM20, SCN5A, TNNC1, TNNI3, TNNT2, TPM1, TTN.
Recomendación: la biopsia endomiocárdica (BEM) debe realizarse cuando se sospeche una etiología específica que pueda beneficiarse de tratamiento dirigido y debe incluir técnicas inmunohistoquímicas.
La BEM es la única prueba capaz de establecer un diagnóstico etiológico definitivo, lo que permite instaurar un tratamiento dirigido en casos específicos. Se recomiendan técnicas inmunohistoquímicas, dado que la sensibilidad se incrementa significativamente respecto al solo uso de los criterios histológicos de Dallas15,16. Las situaciones clínicas que justifican utilizarlas se incluyen en la tabla 3.
Situaciones clínicas que justifican la realización de biopsia endomiocárdica
| Formas agudas |
| Sospecha de miocarditis fulminante o miocarditis aguda con disfunción del ventrículo izquierdo + IC aguda y/o trastornos del ritmo (bloqueo auriculoventricular de alto grado, arritmias ventriculares refractarias al tratamiento) |
| Sospecha de cardiotoxicidad mediada por inhibidores del punto de control inmunitario |
| Sospecha de miocarditis eosinofílica |
| Formas crónicas |
| IC progresiva que no responde al tratamiento±trastornos del ritmo en pacientes con enfermedades autoinmunitarias de base y potencial afección cardiaca |
| Disfunción ventricular con IC refractaria tras al menos 3 meses de tratamiento estándar y tras descartar otras causas de disfunción sistólica |
IC: insuficiencia cardiaca.
Las actuales indicaciones para la BEM de las diferentes sociedades científicas internacionales se recogen en la tabla 2 del material adicional2,17,18.
Por otro lado, en la tabla 3 del material adicional se detallan las especificaciones técnicas para la BEM.
Tomografía por emisión de positrones y fluorodesoxiglucosa-18Recomendación: la tomografía por emisión de positrones (PET) con fluorodesoxiglucosa-18 para el diagnóstico o evaluar la respuesta terapéutica debe reservarse para situaciones en que la CRM o la BEM no están disponibles o son no concluyentes.
La PET aporta información metabólica acerca de la inflamación miocárdica, detectada como un incremento de captación del trazador fluorodesoxiglucosa-18. Se precisa una adecuada preparación en las 36-72 h previas para suprimir el metabolismo fisiológico de la glucosa en el miocardio (tabla 3 del material adicional). Se puede considerar una alternativa diagnóstica para pacientes estables con contraindicación para la CRM, como portadores de dispositivos, o con resultados no concluyentes. Es una técnica muy útil para el diagnóstico y la monitorización de la sarcoidosis19 o en enfermedades autoinmunitarias en las que puede haber afección inflamatoria de otros órganos.
Se ha demostrado que la PET con fluorodesoxiglucosa-18 tiene elevadas sensibilidad y especificidad (del 75 y el 67% respectivamente) frente a la BEM en casos de sospecha de miocarditis20. Además, permite monitorizar la progresión del daño miocárdico y la respuesta o la retirada del tratamiento inmunosupresor durante el seguimiento20. La integración de la PET y la CRM se perfila con un valor incremental para el diagnóstico de miocarditis frente a ambas técnicas por separado y es un campo actual de investigación21.
Evaluación de la anatomía coronariaRecomendación: debe considerarse la probabilidad a priori de enfermedad coronaria y descartarla mediante tomografía computarizada coronaria (probabilidad baja o intermedia) o angiografía coronaria (probabilidad alta).
Para los adultos con factores de riesgo cardiovascular conocidos, dolor torácico, cambios en el ECG que indiquen isquemia, inestabilidad clínica, elevación aguda de troponinas o alteraciones de contractilidad regional en la ecocardiografía, se prefiere la valoración mediante angiografía invasiva precoz. Sin embargo, para los pacientes jóvenes sin factores de riesgo, con hemodinámica estable y una sospecha baja-intermedia de etiología isquémica, la tomografía computarizada coronaria debe tener prioridad. Además, la tomografía computarizada también permite descartar diagnósticos como la anomalía o la disección coronaria. La valoración anatómica coronaria puede obviarse si la sospecha de etiología isquémica es baja y una CRM precoz muestra hallazgos compatibles con miocarditis.
TRATAMIENTO DE LA MIOCARDITISMedidas generalesRecomendación: se recomienda el ingreso hospitalario de todo paciente con miocarditis aguda probable o sospecha clínica.
El reposo y la observación clínica son necesarios durante la fase inicial de la enfermedad, dado que toda miocarditis aguda tiene una evolución incierta, y por ello se recomienda el ingreso para confirmar el diagnóstico, evaluar etiologías y definir la evolución como complicada o no complicada.
Se recomienda la monitorización continua de constantes de los pacientes sin datos de gravedad y ECG en planta de hospitalización. Los pacientes con sospecha de miocarditis y arritmias ventriculares, trastornos de la conducción, afección de la función ventricular o IC deben ser ubicados en unidades de cuidados agudos.
El tratamiento general de la miocarditis depende de si se trata de una presentación no complicada o complicada. En formas no complicadas (dolor torácico aislado y fracción de eyección del ventrículo izquierdo [FEVI] >50%), se recomienda monitorización y analgesia convencional (paracetamol o metamizol). Hay controversia sobre los antiinflamatorios no esteroideos en la miocarditis aguda no complicada y no se recomienda usarlos por sistema3. La evidencia científica que sustenta la recomendación de evitar los antiinflamatorios no esteroideos se reduce a estudios en animales de los años ochenta y noventa en los que se observó un efecto deletéreo, con aumentos de viremia y mortalidad22. No obstante, se podrían valorar en caso de dolor persistente o afección pericárdica concomitante, ya que registros recientes muestran la seguridad de su uso23.
Por su parte, sí se recomienda el uso de colchicina en los casos con afección pericárdica asociada24.
El tratamiento de soporte de la miocarditis complicada se detalla en el apartado «Tratamiento de las complicaciones» del material adicional y el de las formas específicas, en la tabla 42,25–37 y en el material adicional.
Tratamiento inmunosupresor usado en los diferentes tipos de miocarditis
| Fármaco | Acción | Dosis y duración del tratamiento | |||||
|---|---|---|---|---|---|---|---|
| Miocarditis de células gigantes | Linfocítica fulminante | Linfocítica crónica | Eosinofílica | Sarcoidosis | Checkpoint | ||
| Corticoides | Suprime la migración de leucocitos | Metilprednisolona i.v. o 500-1.000 mg 3 días; luego, 1 mg/kg/24 h y disminución gradual25 | *Metilprednisolona i.v., 7-14 mg/kg o 500-1.000 mg, 3 días, luego 1 mg/kg/24 h y disminución gradual25 | *Metilprednisolona i.v., 1 mg/kg/24 h primeras 4 semanas y disminución gradual2 | *Metilprednisolona i.v., 1 mg/kg/24 h primeras 4 semanas y disminución gradual | *Prednisona 0,5 mg/kg durante 1 mes, después disminución gradual durante al menos 12 meses26 | *Metilprednisolona i.v., 1.000 mg, 3 días, luego 1 mg/kg/24 h y disminución gradual27 |
| Ciclosporina | Inhibe la activación de células T inducida por IL-2 | Duración: indefinida25,28,29Objetivo concentración: 0-3 meses: 150-250 ng/ml4-12 meses: 100-150 ng/ml>12 meses: 80-100 ng/ml | |||||
| Azatioprina | Inhibe la síntesis de purinas, lo que afecta la producción de ADN en las células T y B | Duración: 1 año2 1-2 mg/kg/día divididos en 2 dosis | Duración: 6 meses1-2 mg/kg/día divididos en 2 dosis30 | Duración: 6 meses1-2 mg/kg/día divididos en 2 dosis | |||
| Metotrexato | Inhibe la dihidrofolato-reductasa, enzima encargada de convertir el ácido fólico a tetrahidrofolato. Inhibe la proliferación e induce la «apoptosis» de los linfocitos T activados | Segunda línea, si persiste la inflamación con corticoidesDosis inicial de 10-15 mg oral/subcutánea semanal, con un incremento de 5 mg cada 2 semanas para llegar a dosis de 20 mg31 | |||||
| Tacrolimus | Inhibe la activación de células T mediada por calcineurina | Duración: indefinida2Objetivo de concentración: 0-6 meses: 10-15 ng/ml>6 meses: 5-10 ng/ml | |||||
| Micofenolato mofetilo | Inhibe la síntesis de purinas y selectivamente la producción de ADN en las células T y B | Duración: 1 año, 500-1.000 mg/12 h | Segunda línea, si persiste la inflamación con corticoides | ||||
| Globulina antitimocito (GTM) | Anticuerpo policlonal anticélulas T | • GTM conejo: 100 mg/24 h o 1 mg/kg durante 3-5 días32• GTM equina: 500 mg día 1, 250 mg días 2-3 o 10 mg/kg 3-4 días33 | GTM conejo27:día 1: 1,5 mg/kgdías 2-6: 0,5-1,5 mg/kg (control según CD3) | ||||
| Alemtuzumab | Anticuerpo monoclonal que se une a CD-52 en B y T, linfocitos, macrófagos, monocitos y células NK | 30 mg en dosis única o 2 dosis de 15 mg2 | 30 mg dosis única | ||||
| Inmunoglobulinas | Actividad específica de antígeno, actividad inmunomoduladora múltiple | 2 g/kg en infusión continua durante 24-48 h o dividida en 4 días. Mayor experiencia en niños34 | |||||
| Interferon beta | Actividad antiviral e inmunorreguladora, mediada por receptores celulares | 4×106 UI s.c./48 h primera semana8×106 UI de segunda semana a >6 meses | |||||
| Rituximab | Citotoxicidad por anticuerpos contra células B CD20 | 375 mg/m2/semana i.v. durante 4 semanas35 | 375 mg/m2/semana durante 4 semanas36 | ||||
| Infliximab/adalimumab | Inhibidores del factor de necrosis tisular | Tercera línea si no hay de respuesta con corticoides u otros inmunosupresores37 | |||||
| Imatinib | Inhibe la actividad de la tirosincinasa de las proteínas BCR-ABL, c-kit y PDGFR | Síndrome hipereosinofílico (variante mieloproliferativa) |
Células NK: células natural killer; GTM: globulina antitimocito; IL-2: interleucina 2; i.v.: intravenoso; s.c.: subcutáneo.
Recomendación: en presencia de IC, el tratamiento debe ser el mismo que para otras etiologías según las recomendaciones de las guías, dado que la evidencia es escasa y no permite establecer recomendaciones específicas.
Aunque no hay estudios específicos en miocarditis, el consenso es extrapolar los resultados de los ensayos clínicos y las recomendaciones de las guías de IC38 para los fármacos con demostrada mejora de la supervivencia, en particular la cuádruple terapia. En el caso de pacientes con disfunción sistólica transitoria y FEVI recuperada, no existe evidencia específica, pero la recomendación es mantener el tratamiento, sobre todo si persiste el realce tardío en la CRM39.
Shock cardiogénicoRecomendación: en presencia de datos incipientes de shock cardiogénico, se debe disponer de un acceso rápido a asistencia circulatoria.
No existe evidencia científica que respalde un tratamiento específico para el shock cardiogénico en pacientes con miocarditis. Los pacientes con IC grave que requieran agentes inotrópicos deben recibir atención precoz en unidades de cuidados agudos con disponibilidad inmediata de asistencia circulatoria mecánica mediante dispositivos de asistencia ventricular u oxigenador extracorpóreo de membrana (ECMO)40,41.
Dado que es un cuadro clínico potencialmente reversible, los principales objetivos son facilitar la descarga biventricular, la perfusión sistémica y coronaria adecuadas y la descongestión venosa para prevenir la disfunción multiorgánica y como puente hacia la recuperación o, en su caso, el trasplante o dispositivos de asistencia duradera. Los dispositivos van desde el ECMO venoarterial a la asistencia ventricular con bomba rotatoria o axial. Parece que el uso combinado del ECMO con dispositivos que reducen la poscarga del ventrículo izquierdo y las presiones intracavitarias, como Impella (Abiomed, Estados Unidos), promueve una mayor recuperación miocárdica que el ECMO en monoterapia42–44.
La elección del dispositivo debe considerar también la función del ventrículo derecho y la experiencia local. Si después de 2-3 semanas no se puede retirar la asistencia circulatoria mecánica al paciente, se debe considerar el paso a asistencia ventricular duradera o trasplante45.
ArritmiasRecomendación: las arritmias pueden ser reversibles en la fase aguda, por lo que se debe considerar esta posibilidad en la toma de decisiones. En presencia de arritmias ventriculares, se debe considerar como etiologías más probables la sarcoidosis o la miocarditis de células gigantes.
Aunque en general las arritmias ventriculares no son frecuentes3,46, pueden presentarse tanto en la miocarditis aguda como en la crónica, en particular en la sarcoidosis47 y la miocarditis de células gigantes48. En la fase aguda se recomienda tratamiento médico y observación cercana, evitando en general procedimientos terapéuticos invasivos, pues el origen suele ser la inflamación aguda y su resolución conlleva mejoría. Los bloqueadores beta pueden ser útiles para el tratamiento de la extrasistolia ventricular u otras arritmias49. En casos con menos inflamación, las arritmias ventriculares son menos frecuentes y predominan las de origen supraventricular50. Por otro lado, aunque son menos frecuentes, las bradiarritmias pueden aparecer, sobre todo en la enfermedad chagásica, la miocarditis de células gigantes y las enfermedades autoinmunitarias con afección miocárdica51.
Las arritmias en fase crónica o tardía de la miocarditis suelen deberse a fibrosis residual como sustrato52,53. No hay recomendaciones específicas para la fase crónica, por lo que el tratamiento debe seguir las directrices de las guías de práctica clínica54.
La indicación de implante de desfibrilador automático implantable es controvertida, por el carácter transitorio y potencialmente recuperable de la mayoría de las miocarditis agudas. En general, el implante de un desfibrilador automático implantable en prevención secundaria está indicado tras una parada cardiaca debida a fibrilación ventricular o en caso de taquicardia ventricular sintomática, especialmente si las arritmias persisten después de la fase aguda a pesar de la farmacoterapia54. Siempre se debe valorar la presencia, el alcance y la potencial reversibilidad de la disfunción del ventrículo izquierdo, así como considerar tratamientos puente como los chalecos desfibriladores55. Esto adquiere mayor relevancia cuando se habla de prevención primaria.
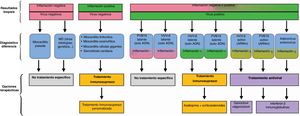
FORMAS ESPECÍFICAS DE MIOCARDITIS Y TRATAMIENTOMiocarditis aguda linfocitariaRecomendación: se recomienda restringir el uso de corticoides a la miocarditis linfocitaria fulminante o la miocarditis aguda con evolución complicada en espera de BEM, que debe dirigir el tratamiento una vez esté disponible el resultado (figura 3).
Opciones propuestas para el tratamiento de la miocarditis y la miocardiopatía inflamatoria en función de los resultados de la biopsia endomiocárdica. ADN: ácido desoxirribonucleico; ARN: ácido ribonucleico; HVVV-6: herpesvirus 6; MD: miocardiopatía dilatada; PVB19: parvovirus B19.
Histológicamente, se caracteriza por un infiltrado inflamatorio parcheado, dominado por linfocitos y en ausencia de células gigantes o granulomas. Tampoco es frecuente que contenga eosinófilos o neutrófilos, a excepción de estadios crónicos56. Este patrón de miocarditis es el menos específico y los virus son la causa más frecuente. No obstante, la alta tasa de infección viral y la elevada sensibilidad de la reacción en cadena de la polimerasa viral hacen que hallarlos no siempre implique que estos sean el factor causal. El tratamiento es de soporte, y puede incluir el uso empírico de corticoides en la miocarditis fulminante o con evolución complicada a la espera de la BEM (tabla 4). Actualmente está en marcha el ensayo clínico MYTHS (NCT05150704), que está evaluando el uso de corticoides a altas dosis en la miocarditis complicada con IC o shock cardiogénico.
Miocarditis de células gigantesRecomendación: en caso de miocarditis por células gigantes, se recomienda un tratamiento agresivo y precoz basado en una combinación de inmunosupresores y acceso a asistencia circulatoria, dada la incertidumbre de su evolución.
La miocarditis de células gigantes es una entidad rara que conlleva muy mal pronóstico. Esto ha limitado la posibilidad de realizar estudios aleatorizados, y la escasa evidencia proviene de estudios observacionales, la mayoría retrospectivos, y análisis de casos25,29.
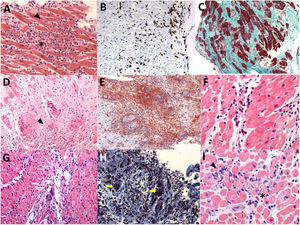
A la microscopia se caracteriza por infiltrado linfocitario y células mononucleares, pero con mayor número de macrófagos y un hallazgo distintivo y necesario para el diagnóstico: numerosas células gigantes (figura 4). Es la forma más grave de miocarditis y la BEM suele tener más rentabilidad diagnóstica que en la linfocitaria. La etiología propuesta más probable es la autoinmunitaria, aunque también se ha sugerido la posviral. En cuanto al tratamiento dirigido, en la tabla 4 se muestran diferentes regímenes farmacológicos que se han utilizado y en la figura 1 del material adicional, las posibles combinaciones2,32,33,57.
Muestras de biopsias endomiocárdicas de pacientes con sospecha de miocarditis. A: (H-E×200) miocarditis linfocítica con criterios de Dallas positivos; infiltrado linfocitario (asterisco) y necrosis con rotura de fibras miocárdicas (punta de flecha). B: miocarditis linfocítica con criterios inmunohistoquímicos positivos; las inclusiones de color marrón corresponden a linfocitos CD3+ (punta de flecha). C: (tricrómico de Masson,×100) miocardiopatía dilatada; presencia de extensa fibrosis (representada por tinción azul-verdosa). D: (H-E, ×200) sarcoidosis cardiaca con presencia de granulomas (punta de flecha). E: otro ejemplo de sarcoidosis cardiaca con granulomas (punta de flecha) F: (H-E, ×400) miocarditis eosinolífica (eosinófilos señalados con punta de flecha). G: (H-E, ×200) miocarditis de células gigantes (punta de flecha). H: otro ejemplo de miocarditis de células gigantes (flechas amarillas, células gigantes multinucleadas). I: (H-E, ×400) miocarditis por pembrolizumab (inhibidor del punto de control inmunitario); se observa infiltrado linfocitario (punta de flecha) y eosinófilos aislados (asterisco). H-E: hematoxilina-eosina.
Recomendación: si se sospecha, siempre se debe suspender el tratamiento con inmunoterapia e iniciar precozmente corticoides.
La miocarditis aparece en las primeras 6 semanas desde el inicio del tratamiento y puede presentarse con un curso clínico fulminante, con mortalidad de hasta un 20-50%. Si bien es cierto que son infrecuentes (incidencia estimada, 0,04-1,14%)58, es esperable que con el mayor uso de estos tratamientos se vea incrementada su incidencia en los próximos años. El patrón histológico es el infiltrado linfocitario, dado que la citotoxicidad está mediada en su mayoría por células T CD8 positivas, el mismo subtipo celular que media en la miocarditis viral (figura 4). La base del tratamiento son los corticoides a altas dosis (tabla 4).
SarcoidosisRecomendación: los corticoides son el tratamiento de elección; se debe monitorizar estrechamente la respuesta y la evolución, en particular el riesgo de arritmias ventriculares, para considerar otros inmunosupresores o el implante de desfibrilador.
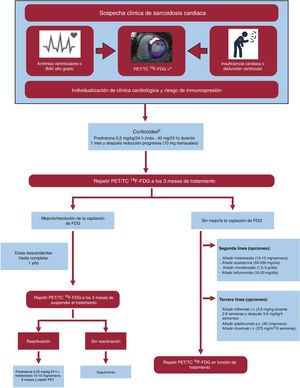
La sarcoidosis es una enfermedad inflamatoria con afección sistémica y predisposición genética, caracterizada por la presencia de granulomas no caseificantes. Su prevalencia oscila entre 5 y 64 casos/100.000 habitantes, y es más común entre los afroamericanos que en los caucásicos59,60. El patrón diagnóstico es la demostración de granulomas no caseificantes en el miocardio. Sin embargo, se acepta el diagnóstico con la demostración histológica extracardiaca y la presencia de al menos 1 de los siguientes: hallazgos sugestivos en la CRM o la PET con fluorodesoxiglucosa-18, presencia de arritmias ventriculares, bloqueo auriculoventricular avanzado, disfunción ventricular o respuesta al tratamiento inmunosupresor61,62 (figura 5).
Algoritmo de tratamiento de la sarcoidosis cardiaca. BAV: bloqueo auriculoventricular: TC: tomografía computarizada; 18F-FDG: flúor-18 con fluorodesoxiglucosa; PET: tomografía por emisión de positrones.
aSe recomienda complementar con gammagrafía u otra prueba de perfusión para valorar si la inflamación se asocia con un defecto de perfusión (inflamación más grave) o no. Los casos con defectos de perfusión sin inflamación asociada pueden corresponder a fibrosis establecida.
bEn caso de que no se toleren o estén contraindicadas las dosis altas de esteroides, se puede iniciar con pauta combinada de corticoides a dosis bajas + metotrexato (prednisona 0,25mg/kg/24 h + metotrexato 10-15mg/semana).
El tratamiento de la sarcoidosis cardiaca se basa en inmunosupresores para controlar la inflamación miocárdica y el tratamiento de soporte para la IC, para tratar las consecuencias del daño miocárdico y la fibrosis (tabla 4, figura 5). Las guías europeas recomiendan el implante de desfibrilador automático implantable en prevención primaria (recomendación II A) en estos casos: a) pacientes que requieren estimulación cardiaca; b) presencia de fibrosis extensa en la CRM tras la resolución de la inflamación independientemente de la FEVI, y c) si la FEVI está entre el 35 y el 50% y se induce taquicardia ventricular sostenida en un estudio electrofisiológico63.
Miocarditis eosinofílicaEl diagnóstico definitivo requiere confirmación histológica por hallazgos típicos de infiltrado inflamatorio difuso, con predominio de eosinófilos y extensa necrosis, y en ocasiones presencia de trombos murales e intravasculares (figura 4). La base del tratamiento son los corticoides (tabla 4). En caso de la miocarditis eosinofílica por hipersensibilidad, debe retirarse inmediatamente el fármaco o la sustancia causales, y en casos de síndrome hipereosinofílico por trastorno mieloproliferativo, se emplea imatinib64. En la granulomatosis eosinofílica con poliangeítis, está indicado el tratamiento inmunosupresor combinado, que incluye corticoides y ciclofosfamida, azatioprina o metotrexato64. Por su parte, en la miocarditis eosinofílica asociada con infección por Toxocara canis, se debe administrar albendazol y corticoides2.
Miocarditis asociada con la COVID-19 y la vacunación contra el SARS-CoV-2Recomendación: en su forma aislada, durante el curso de una infección no grave o tras la vacunación, no requiere medidas dirigidas, salvo el tratamiento propio para la COVID-19 o la recomendación de no repetir la vacunación.
Tanto la infección por SARS-CoV-2 como la vacunación contra este virus se han asociado con miocarditis, con más frecuencia en el contexto de infección65. En caso de presentación fulminante o asociada con síndrome inflamatorio sistémico, se recomienda la administración de corticoides intravenosos en combinación con tocilizumab o inmunoglobulinas66. Las vacunas de ARNm se asocian con casos muy infrecuentes de miocarditis/pericarditis, habitualmente en varones jóvenes, durante los primeros días tras la segunda o la tercera dosis y con evolución benigna65–67.
Miocarditis o miocardiopatía inflamatoria crónicaRecomendación: su tratamiento debe individualizarse según los hallazgos de la BEM y la detección de virus específicos o etiologías inflamatorias/autoinmunitarias sistémicas específicas.
La miocardiopatía crónica inflamatoria puede estar relacionada con un trastorno sistémico autoinmunitario (p. ej.: lupus, esclerosis sistémica, etc.) o enfermedades inflamatorias (intestinales, herpéticas, etc.) específicas de órgano o sistema. No obstante, no siempre existe otro trastorno sistémico de base. El tratamiento debe ser individualizado por equipos multidisciplinarios y dirigido contra la enfermedad sistémica, y se recomiendan tratamientos más agresivos, dado que estas miocarditis conllevan peor pronóstico68. En la figura 3 se describen las opciones terapéuticas con base en los hallazgos en la BEM en cuanto a presencia de inflamación y genoma viral.
En presencia de inflamación en la BEM y con virus negativos, el tratamiento inmunosupresor combinado con prednisona y azatioprina se ha asociado con una mejoría de la función ventricular30. Este tratamiento puede extenderse a los pacientes en que se detecta infección latente por parvovirus B19 o HVV-6 (sin replicación activa y con detección de ADN viral con bajo número de copias e inflamación en la BEM)69.
Miocarditis en edad pediátricaEn la población pediátrica, la miocarditis presenta dos picos de incidencia notables: uno en la infancia temprana, de pronóstico más desfavorable, y otro durante la adolescencia. Se diagnostica miocarditis en hasta el 5% de los niños en listas de espera para trasplante cardiaco pediátrico, lo que subraya la gravedad potencial de esta condición. Particularmente en neonatos, se observa una correlación significativa entre la juventud del paciente y peores desenlaces clínicos70.
En cuanto a la etiología, esta puede ser diversa: causas autoinmunitarias, de hipersensibilidad, tóxicas o infecciosas. Los agentes virales representan la causa más común. Es interesante que los estudios previos a la COVID-19, basados en BEM, revelan que el parvovirus B19 es el más prevalente (59%), seguido del herpesvirus 6, enterovirus, citomegalovirus, virus de Epstein-Barr, virus de la influenza A y B y coronavirus71.
La BEM se ha considerado el método diagnóstico de referencia para la identificación de virus cardiotrópicos y guiar el tratamiento y el pronóstico; sin embargo, a sus limitaciones en términos de sensibilidad se añade un alto riesgo de complicaciones, especialmente en neonatos y lactantes. Por lo tanto, la BEM debe restringirse a situaciones en que afecte al tratamiento clínico y en centros con experiencia comprobada y se puede apoyar en técnicas electrocardiográficas para optimizar los puntos de muestreo. En la actualidad, la CRM, fortalecida por los criterios de Lake Louise, está reemplazando gradualmente a la BEM. Sin embargo, su sensibilidad es escasa en pacientes pediátricos y debe realizarse en la fase aguda de la enfermedad. Entre el 11 y el 55% de los casos pediátricos de miocarditis pueden requerir asistencia circulatoria mecánica, ya sea como puente hacia la recuperación o como preparación para el trasplante70.
Se puede encontrar información adicional sobre el tratamiento de las formas específicas de miocarditis en el material adicional.
ESTRATIFICACIÓN DEL RIESGO, SEGUIMIENTO A LARGO PLAZO Y PRÁCTICA DEPORTIVARecomendación: tras establecer el diagnóstico, siempre se debe estratificar el riesgo y establecer un seguimiento estructurado.
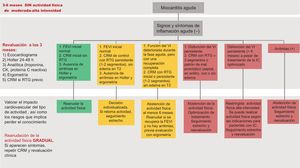
En general se establecen 3 grupos de riesgo en función de la evolución clínica y los resultados de las pruebas diagnósticas, con diferentes protocolos de seguimiento, tal y como se muestra en la tabla 5. En cuanto al tiempo de restricción de la práctica deportiva, tanto las guías europeas72 como las norteamericanas73 aconsejan evitar el ejercicio de moderada-alta intensidad durante 3-6 meses para facilitar la resolución de la inflamación. El tiempo de reincorporación a la actividad deportiva debe individualizarse según la valoración y la estratificación del riesgo (figura 6).
Seguimiento de pacientes con miocarditis según perfil de riesgo
| Riesgo bajo |
| Hemodinámica estableCambios inespecíficos en ECG (ST, onda T)Ausencia de arritmias complejasFEVI conservada, sin alteraciones en la contractilidad regionalCRM con edema, realce tardío de gadolinio mínimo o ausente |
| SeguimientoEvaluación clínica en 3-6 meses con ECG y analítica (hemograma, bioquímica con perfil hepático y renal, reactantes de fase aguda y troponina).Si normal, alta a atención primariaSi persisten cambios en el ECG y/o las alteraciones analíticas, seguimiento como los pacientes con riesgo intermedio |
| Riesgo intermedio |
| Hemodinámica estableCambios inespecíficos ECG (ST, onda T)Ausencia de arritmias complejasFEVI 35-50%±alteraciones en la contractilidad regionalPresencia de RTG en CRM (sobre todo en septo ventricular) |
| SeguimientoEvaluación clínica en 3, 6 y 12 meses con ECG y analítica (hemograma, bioquímica con perfil hepático y renal, reactantes de fase aguda y troponina). Alta o revisión anual según los resultados de la CRM a los 12 mesesEcocardiograma de control a los 6 mesesCRM a los 12 mesesPrueba de esfuerzo antes de volver a la práctica de deporte |
| Riesgo alto |
| Hemodinámica inestableInsuficiencia cardiacaArritmias complejas (alteración grave de la conducción o arritmias ventriculares sostenidas)FEVI muy deprimida (FEVI <35%)Fibrosis extensa en CRM ≥ 3 segmentos o patrón de mal pronóstico (septal, en anillo) |
| SeguimientoEvaluación clínica en 3, 6 y 12 meses con ECG y analítica (hemograma, bioquímica con perfil hepático y renal, reactantes de fase aguda y troponina)Ecocardiograma y ECG Holter a los 3 meses del diagnóstico, y después cada 3-6 meses o anual según los resultadosBiopsia endomiocárdica a los 3 meses si la etiología es incierta y no responde al tratamiento médico óptimoCRM a los 6 mesesPrueba de esfuerzo antes de volver a la práctica de deporte |
CRM: cardiorresonancia magnética; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; RTG: realce tardío de gadolinio.
Recomendaciones en cuanto a práctica deportiva tras un episodio de miocarditis. CK: creatincinasa; CRM: resonancia magnética cardiaca; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; RTG: realce tardío de gadolinio; VI: ventrículo izquierdo.
No existe financiación específica para el documento de consenso.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se han utilizado herramientas de inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han colaborado en la búsqueda bibliográfica y redacción del documento (F. Domínguez, A. Uribarri, J.M. Larrañaga-Moreira, L. Guerrero-Ruiz, P. Pastor-Pueyo, J. Gayán-Ordás, B. Fernández-González, A. Esteban-Fernández, M. Barreiro, S. López Fernández, F. Gutiérrez-Larraya Aguado y D. Pascual Figal). F. Domínguez y D. Pascual Figal han diseñado el documento y han realizado labores de coordinación entre los diferentes autores.
CONFLICTO DE INERESESNo hay conflictos de intereses.