La telangiectasia hemorrágica hereditaria (THH) o síndrome de Rendu-Osler-Weber es un trastorno vascular autosómico dominante minoritario, causado por mutaciones en los genes de la endoglina ACVRL1 o SMAD4, que contienen el código de proteínas involucradas en la superfamilia del factor de crecimiento transformador beta y dan lugar a una displasia vascular multiorgánica. Las manifestaciones clínicas incluyen epistaxis espontánea, hemorragia digestiva, anemia, telangiectasias mucocutáneas y malformaciones arteriovenosas multiorgánicas1.
La afección cardiovascular engloba una insuficiencia cardiaca de alto gasto, embolias paradójicas y tromboembolia venosa. Las arritmias son frecuentes, mientras que las tasas de infarto de miocardio parecen ser bajas1,2.
La angiografía coronaria (AC) y la intervención coronaria percutánea (ICP) en pacientes con THH pueden ser difíciles por lo que respecta a la anatomía coronaria subyacente (ateromatosis, disección arterial coronaria espontánea [DACE] y espasmos), los aspectos técnicos, el tratamiento antitrombótico y el aumento del riesgo de hemorragia2–4. El objetivo de nuestro estudio es evaluar los posibles riesgos de la AC y la ICP en pacientes con THH mediante la identificación retrospectiva de todos los pacientes con THH a los que se practicó una AC en los hospitales universitarios de Lovaina entre enero de 2002 y julio de 2017.
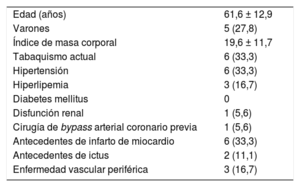
Durante este periodo de 15 años, se realizó el seguimiento de 655 pacientes con THH en nuestro centro de referencia terciario, y en 18 de ellos se llevó a cabo una AC. En la tabla se presenta una lista completa de sus características basales. A 6 pacientes (33,3%) se les realizó una AC a causa de un síndrome coronario agudo (SCA); a 2 (11,1%), por una angina estable; a 5 (27,7%), por insuficiencia cardiaca; a 3 (16,6%), debido a una valvulopatía, y a 2 (11,1%), como parte de un estudio diagnóstico previo al trasplante. Tenían coronarias normales 13 pacientes (72,2%), mientras que 5 (27,8%) tuvieron resultados anormales. Se observó enfermedad coronaria en 2 pacientes (11,1%), 1 con infarto agudo de miocardio con elevación del segmento ST (IAMCEST), al que se trató con un stent metálico en la arteria descendente anterior izquierda (DAI), y 1 con angina inestable, tratado con un stent metálico en la arteria coronaria derecha. En 3 pacientes (16,7%) se produjo DACE de la DAI, 1 sufrió un IAMCEST, que se trató con un stent farmacoactivo, y 2 presentaron un IAMSEST y recibieron un tratamiento conservador. En 1 paciente con SCA se observaron unas arterias coronarias normales. Se produjeron complicaciones periintervención en 3 pacientes (16,6%), todos ellos con SCA. Así pues, 3 de 6 pacientes con THH (50%) a los que se practicó una AC en el contexto de un SCA sufrieron una complicación grave periintervención, en 2 de los casos durante la ICP.
Características basales (n = 18)
| Edad (años) | 61,6 ± 12,9 |
| Varones | 5 (27,8) |
| Índice de masa corporal | 19,6 ± 11,7 |
| Tabaquismo actual | 6 (33,3) |
| Hipertensión | 6 (33,3) |
| Hiperlipemia | 3 (16,7) |
| Diabetes mellitus | 0 |
| Disfunción renal | 1 (5,6) |
| Cirugía de bypass arterial coronario previa | 1 (5,6) |
| Antecedentes de infarto de miocardio | 6 (33,3) |
| Antecedentes de ictus | 2 (11,1) |
| Enfermedad vascular periférica | 3 (16,7) |
Los valores expresan media ± desviación estándar o n (%). La disfunción renal se definió como una tasa de filtrado glomerular estimada < 60 ml/min/1,73 m2.
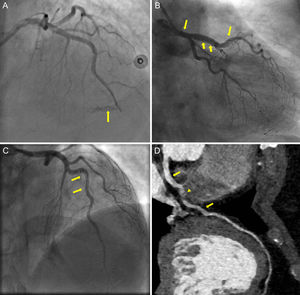
El primer paciente era un varón de 67 años con angina inestable, que presentaba una disección de tipo D con un defecto de repleción luminal espiral durante la ICP de la arteria coronaria derecha, que se trató con un stent metálico. El segundo caso es el de una mujer de 73 años que acudió con un IAMCEST; la AC mostró una DACE con flujo TIMI 0 en la DAI. La predilatación con un balón de tamaño insuficiente produjo una perforación en el segmento medio de la DAI (figura A, flecha), que se selló satisfactoriamente prolongando el hinchado del balón, y posteriormente se trató con un stent farmacoactivo. Se trató a la paciente con ácido acetilsalicílico y ticagrelor. Pocas horas después, sufrió una hemorragia gastrointestinal y pericárdica masiva que resultó mortal. La tercera paciente es una mujer de 47 años que acudió por un IAMSEST; la AC urgente mostró una DACE en el segmento medio de la DAI. Con las inyecciones de contraste, la disección mostró una propagación retrógrada hasta afectar al tronco común izquierdo (figura B yC, flechas). Dado que la paciente se mantenía hemodinámicamente estable, se optó por un tratamiento médico conservador con tratamiento antiagregante plaquetario combinado doble. Durante el seguimiento, la paciente se mantuvo asintomática, aunque una AC con tomografía computarizada obtenida a los 3 meses evidenció un colgajo de íntima residual que se extendía del tronco común izquierdo al segmento medio de la DAI (figura D, flechas) con un hematoma intramural que causaba una estenosis mínima en el segmento medio de la DAI (figura D, punta de flecha).
Angiografía coronaria que muestra una perforación en el segmento medio de la DAI (A, flecha). Colgajo de disección que se extiende desde el segmento medio de la DAI hasta el tronco común izquierdo, observada en la angiografía coronaria (B y C, flechas) y en la AC de tomografía computarizada (D, flechas), con un hematoma intramural que causa una estenosis mínima en el segmento medio de la DAI (D, punta de flecha). DAI: descendente anterior izquierda.
Nuestros datos ponen de relieve que la AC rara vez es necesaria en los pacientes con THH (2,7%). En una población de 1.025 pacientes con THH, Shovlin et al.1 observaron bajas tasas de infarto de miocardio y de anomalías en la AC (del 2,2 y < 54% respectivamente), mientras que en nuestros datos se observan unas tasas aún menores, del 0,9 y el 27,8%. No obstante, algunos estudios han señalado que la anatomía coronaria subyacente y los riesgos de la intervención pueden complicar la AC y la ICP en estos pacientes2–4. Concretamente, aparte de las lesiones de ateroesclerosis, se han descrito otras causas de infarto de miocardio, como la DACE, la disfunción endotelial y las embolias2–4. En nuestro estudio, el 50% de los pacientes con THH que presentaron un SCA tuvieron una DACE. Además, el 50% de los pacientes que acudieron por un SCA sufrieron una complicación grave periintervención, la mayoría de ellos durante la ICP.
En los pacientes con THH, el daño endotelial se atribuye a mutaciones que causan un desacoplamiento de la óxido nítrico sintasa endotelial y la generación de especies moleculares de oxígeno reactivas, mientras que el deterioro de la señalización del factor de crecimiento transformador beta induce desorganización del esqueleto celular y fragilidad de la pared vascular5,6. La fragilidad de la pared vascular podría agravarse aún más como consecuencia del medio proinflamatorio existente durante un SCA, lo que haría a los pacientes con THH más vulnerables a las complicaciones durante la AC y la ICP urgentes. Además, estos pacientes tienen un sustancial riesgo hemorrágico relacionado con el tratamiento antitrombótico en la ICP y su predisposición inherente al sangrado1. Es esencial investigar más para esclarecer la fisiopatología subyacente.
En conclusión, los médicos deben estar pendientes de los posibles problemas periintervención durante la AC y la ICP en los pacientes con THH que presentan un SCA, y deben tener en cuenta esta posibilidad en la toma de decisiones y en la planificación de las intervenciones.