El ancho de distribución eritrocitaria se ha relacionado con incremento del riesgo hemorrágico intrahospitalario en pacientes con síndrome coronario agudo sin elevación del ST. Sin embargo, se desconoce su utilidad para predecir complicaciones hemorrágicas tras el ingreso hospitalario. El objetivo fue evaluar el papel complementario del ancho de distribución eritrocitaria sobre la escala CRUSADE en la predicción del riesgo a largo plazo de hemorragias en estos pacientes.
MétodosSe midió el ancho de distribución eritrocitaria al ingreso en 293 pacientes con síndrome coronario agudo sin elevación del ST; a todos se les dio seguimiento clínico y se registró la aparición de hemorragias mayores, definidas según los criterios del Bleeding Academic Research Consortium.
ResultadosDurante un seguimiento de 782 [intervalo intercuartílico, 510-1.112] días, 30 pacientes (10,2%) presentaron eventos hemorrágicos. El análisis por cuartiles reveló un incremento abrupto de hemorragias a partir del cuarto cuartil (> 14,9%; p=0,001). Tras el análisis multivariable, el ancho de distribución eritrocitaria >14,9% se asoció con mayor riesgo de eventos (hazard ratio=2,67; intervalo de confianza del 95%, 1,17-6,10; p=0,02). Los pacientes con valores ≤ 14,9% y CRUSADE ≤ 40 presentaron las menores tasas de hemorragias, mientras que los pacientes con valores >14,9% y CRUSADE >40 puntos (alto y muy alto riesgo) presentaron las mayores (log rank test, p<0,001). Además, la adición del ancho de distribución eritrocitaria a la escala CRUSADE para predecir hemorragias mostró tasas de mejora integrada del 5,2% (p<0,001) y de reclasificación del 10% (p=0,001).
ConclusionesLos valores elevados del ancho de distribución eritrocitaria se asocian a mayor riesgo hemorrágico y aportan información adicional a la escala CRUSADE.
Palabras clave
Las complicaciones hemorrágicas constituyen un importante factor de pronóstico adverso en los pacientes con síndrome coronario agudo (SCA)1–3. Estudios anteriores han indicado que los pacientes con una hemorragia mayor (HM) en este contexto tienen un riesgo de hasta un 20% de muerte, infarto de miocardio o ictus durante los primeros 30 días, en comparación con el 5% de los pacientes que no padecen una HM durante los primeros 30 días1. Este riesgo se extiende más allá del periodo periprocedimiento incluso cuando la gravedad de la hemorragia no supone un peligro para la vida1. Desde el punto de vista fisiopatológico, se cree que el riesgo asociado a la HM es multifactorial, e incluye la interrupción del tratamiento con fármacos antitrombóticos efectivos, la reducción del aporte de oxígeno al miocardio a causa de hipoperfusión, la activación plaquetaria y los posibles efectos adversos de la transfusión4.
Dada la asociación nociva existente entre la HM y la evolución clínica en el SCA, es importante identificar factores de riesgo capaces de predecir la hemorragia. Parece lógico explorar parámetros analíticos que puedan proporcionar información adicional a las escalas de riesgo hemorrágico. El ancho de distribución eritrocitaria (ADE) es una medida cuantitativa de la variabilidad del tamaño de los eritrocitos circulantes5, recientemente se ha observado que tiene un alto valor predictivo de eventos cardiovasculares en múltiples poblaciones de pacientes, incluidos los que han padecido un SCA6–12. Muy recientemente, se ha relacionado el aumento del ADE con una mayor tasa de hemorragia en pacientes con SCA13,14. Sin embargo, estos estudios solo evaluaron el papel del ADE para predecir eventos hemorrágicos durante la hospitalización y no describieron su utilidad para predecir hemorragias durante el seguimiento.
En consecuencia, el objetivo del presente estudio es determinar el papel del ADE en la predicción del riesgo de HM durante el seguimiento de pacientes con SCA sin elevación del segmento ST (SCASEST) y establecer si el ADE añade valor predictivo a un modelo ampliamente aceptado para la predicción del riesgo de HM, la escala CRUSADE15.
MÉTODOSParticipantes y diseño del estudioEntre septiembre de 2006 y diciembre de 2008, se incluyó prospectivamente a 293 pacientes consecutivos con diagnóstico final establecido de angina inestable de alto riesgo o infarto agudo de miocardio sin elevación del segmento ST. El de SCASEST de alto riesgo se definió por la presencia de síntomas isquémicos de duración ≥ 10min aparecidos en las 72h previas al ingreso, junto con una desviación del segmento ST ≥ 1mm o una elevación de concentraciones de los biomarcadores de necrosis cardiaca16. Se excluyó a los pacientes con evidencia de enfermedad infecciosa, del tejido conjuntivo o inflamatoria, así como a los que tomaban suplementos de hierro, ácido fólico, vitamina B12 o fármacos inmunosupresores. Se excluyó también a los pacientes que rechazaron participar o no tenían capacidad de dar su consentimiento informado.
Durante todo el periodo de hospitalización, se registraron prospectivamente las características clínicas basales. El riesgo de HM se calculó con la escala de riesgo CRUSADE. Se clasificó a los pacientes en cinco categorías en función de dicha escala: muy bajo, ≤ 20 puntos; bajo, 21-30 puntos; moderado, 31-40 puntos; alto, 41-50 puntos, y muy alto, >50 puntos. Las decisiones de tratamiento clínico acerca de cada paciente las tomaron los cardiólogos responsables, que tenían acceso clínico a los valores de ADE. El estudio recibió la aprobación del comité ético local y se obtuvo el consentimiento informado de cada paciente en el momento de su inclusión.
BioquímicaTodas las muestras de sangre se obtuvieron a la llegada al servicio de urgencias y se procesaron inmediatamente después de la extracción. Todos los parámetros hematológicos se determinaron con un analizador automático XE-2100 (Sysmex; Kobe, Japón) y todos los parámetros bioquímicos se obtuvieron con el analizador modular PE (Roche Diagnostics; Manheim, Alemania). La anemia se definió según los criterios de la Organización Mundial de la Salud17: hemoglobina <13g/dl para los varones y<12g/dl para las mujeres. Los datos de función renal se estimaron a partir del filtrado glomerular estimado utilizando la fórmula de Cockroft-Gault18: ([140 – edad]×peso [kg]) / (creatinina sérica [mg/dl]×72) (× 0,85 para las mujeres).
Seguimiento y variables de valoraciónTras el alta hospitalaria, los pacientes fueron objeto de seguimiento durante una mediana de 782 [intervalo intercuartílico, 510-1.112] días. Se examinaron cuidadosamente todas las historias clínicas y se contactó con los pacientes o sus familiares para determinar la incidencia de episodios hemorrágicos durante el seguimiento. El objetivo clínico se definió como la aparición de una HM, definida según los criterios del Bleeding Academic Research Consortium19, correspondiente a una hemorragia de los tipos 3 a 5: tipo 3a, hemorragia manifiesta junto con disminución de hemoglobina de 3-5g/dl, cualquier transfusión con hemorragia manifiesta; tipo 3b, hemorragia manifiesta junto con disminución de hemoglobina de 5g/dl, taponamiento cardiaco, hemorragia cuyo control requiere intervención quirúrgica (excluidas las dentales, nasales, cutáneas o hemorroidales), hemorragia que requiere fármacos vasoactivos intravenosos; tipo 3c, hemorragia intracraneal (no incluye las microhemorragias, la transformación hemorrágica o la intramedular), subcategorías confirmadas mediante autopsia o técnicas de imagen o punción lumbar, hemorragia intraocular que compromete la visión; tipo 4, hemorragia relacionada con revascularización coronaria (hemorragia intracraneal perioperatoria en un plazo de 48h, reintervención tras el cierre de esternotomía para controlar una hemorragia, transfusión ≥ 5 U de sangre total o concentrados de hematíes en un plazo de 48h, drenaje de tubo de tórax ≥ 2 l en 24h); tipo 5, hemorragia mortal (tipo 5a, probable; tipo 5b, demostrada).
Análisis estadísticoPara determinar si tenían una distribución normal se evaluaron las variables continuas con la prueba de Kolmogorov-Smirnov. Los datos con distribución normal se presentan en forma de media±desviación estándar y los de distribución anormal se presentan en forma de mediana [intervalo intercuartílico]. Las variables discretas se expresan en porcentajes. Se agrupó a los pacientes según los cuartiles de ADE. Se compararon las diferencias en las características basales mediante análisis de la varianza o prueba de Kruskal-Wallis para las variables continuas y prueba de la χ2 para las discretas. Las comparaciones de los dos biomarcadores en los grupos con y sin eventos se realizaron con la prueba de la U de Mann-Whitney. Se calcularon las hazard ratio y los intervalos de confianza del 95% (IC95%) obtenidos del análisis de regresión de Cox para identificar los factores predictivos de HM durante el seguimiento. Se calculó el efecto independiente del ADE en las complicaciones de HM empleando un análisis de regresión multivariable de Cox en el que se incluyeron las covariables con p<0,05 en el análisis univariable. Se evaluó el supuesto de linealidad con la prueba de residuos martingales. Se utilizaron gráficos de riesgos acumulativos logarítmicos, covariables dependientes del tiempo y residuos de Schoenfeld para evaluar la adherencia a los supuestos de riesgos proporcionales de Cox. Las covariables de la escala de riesgo CRUSADE con p<0,05 se incluyeron inicialmente una a una en el modelo multivariable (modelo 1). A continuación, se analizaron como una sola variable, la escala de riesgo, todas las covariables que forman parte de la puntuación de riesgo CRUSADE, incluidas la que obtuvieron p>0,05 en el modelo 2. Se evaluó la mejora de la exactitud predictiva mediante el cálculo de la mejora de reclasificación neta y la mejora de la discriminación integrada, según lo descrito por Pencina et al20. Finalmente, se estimó la incidencia acumulativa de HM según el método de Kaplan-Meier y se usó log rank test para las comparaciones. La significación estadística se estableció en un valor de p<0,05. El análisis estadístico se realizó con el programa SPSS versión 18.0 para Windows (SPSS Inc.; Chicago, Illinois, Estados Unidos).
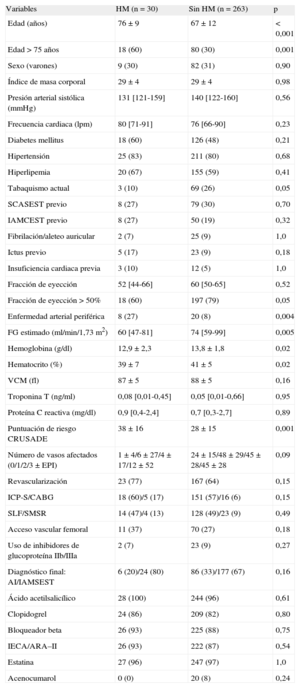
RESULTADOSFormaron la población del estudio 293 pacientes con SCASEST (tabla 1). La mediana del ADE fue del 13,9% [13,2-14,9]. Los pacientes con valores de ADE superiores eran de más edad, con más frecuencia de mujeres y mayor prevalencia de comorbilidades como hipertensión, diabetes mellitus, hiperlipemia, anemia, ictus previo y disfunción renal. Estos pacientes tenían también peores valores en la escala de riesgo CRUSADE y en ellos era menos frecuente el tratamiento de revascularización. Tal como se preveía, los pacientes con cifras ADE superiores tenían cifras de hemoglobina y de volumen corpuscular medio inferiores, mientras que las de proteína C reactiva eran superiores. En el momento del alta, los pacientes con valores de ADE superiores recibían con menor frecuencia tratamiento con clopidogrel (tabla 1 del material suplementario).
Características clínicas de la población en estudio según la hemorragia mayor
| Variables | HM (n=30) | Sin HM (n=263) | p |
| Edad (años) | 76±9 | 67±12 | < 0,001 |
| Edad>75 años | 18 (60) | 80 (30) | 0,001 |
| Sexo (varones) | 9 (30) | 82 (31) | 0,90 |
| Índice de masa corporal | 29±4 | 29±4 | 0,98 |
| Presión arterial sistólica (mmHg) | 131 [121-159] | 140 [122-160] | 0,56 |
| Frecuencia cardiaca (lpm) | 80 [71-91] | 76 [66-90] | 0,23 |
| Diabetes mellitus | 18 (60) | 126 (48) | 0,21 |
| Hipertensión | 25 (83) | 211 (80) | 0,68 |
| Hiperlipemia | 20 (67) | 155 (59) | 0,41 |
| Tabaquismo actual | 3 (10) | 69 (26) | 0,05 |
| SCASEST previo | 8 (27) | 79 (30) | 0,70 |
| IAMCEST previo | 8 (27) | 50 (19) | 0,32 |
| Fibrilación/aleteo auricular | 2 (7) | 25 (9) | 1,0 |
| Ictus previo | 5 (17) | 23 (9) | 0,18 |
| Insuficiencia cardiaca previa | 3 (10) | 12 (5) | 1,0 |
| Fracción de eyección | 52 [44-66] | 60 [50-65] | 0,52 |
| Fracción de eyección>50% | 18 (60) | 197 (79) | 0,05 |
| Enfermedad arterial periférica | 8 (27) | 20 (8) | 0,004 |
| FG estimado (ml/min/1,73 m2) | 60 [47-81] | 74 [59-99] | 0,005 |
| Hemoglobina (g/dl) | 12,9±2,3 | 13,8±1,8 | 0,02 |
| Hematocrito (%) | 39±7 | 41±5 | 0,02 |
| VCM (fl) | 87±5 | 88±5 | 0,16 |
| Troponina T (ng/ml) | 0,08 [0,01-0,45] | 0,05 [0,01-0,66] | 0,95 |
| Proteína C reactiva (mg/dl) | 0,9 [0,4-2,4] | 0,7 [0,3-2,7] | 0,89 |
| Puntuación de riesgo CRUSADE | 38±16 | 28±15 | 0,001 |
| Número de vasos afectados (0/1/2/3±EPI) | 1 ± 4/6 ± 27/4 ± 17/12 ± 52 | 24 ± 15/48 ± 29/45 ± 28/45 ± 28 | 0,09 |
| Revascularización | 23 (77) | 167 (64) | 0,15 |
| ICP-S/CABG | 18 (60)/5 (17) | 151 (57)/16 (6) | 0,15 |
| SLF/SMSR | 14 (47)/4 (13) | 128 (49)/23 (9) | 0,49 |
| Acceso vascular femoral | 11 (37) | 70 (27) | 0,18 |
| Uso de inhibidores de glucoproteína IIb/IIIa | 2 (7) | 23 (9) | 0,27 |
| Diagnóstico final: AI/IAMSEST | 6 (20)/24 (80) | 86 (33)/177 (67) | 0,16 |
| Ácido acetilsalicílico | 28 (100) | 244 (96) | 0,61 |
| Clopidogrel | 24 (86) | 209 (82) | 0,80 |
| Bloqueador beta | 26 (93) | 225 (88) | 0,75 |
| IECA/ARA–II | 26 (93) | 222 (87) | 0,54 |
| Estatina | 27 (96) | 247 (97) | 1,0 |
| Acenocumarol | 0 (0) | 20 (8) | 0,24 |
AI: angina inestable; ARA–II: antagonistas del receptor de la angiotensina II; CABG: cirugía de revascularización aortocoronaria; EPI: enfermedad en coronaria principal izquierda; FG: filtrado glomerular; IAMCEST: infarto agudo de miocardio con elevación del ST; IAMSEST: infarto agudo de miocardio sin elevación del ST; ICP-S: intervención coronaria percutánea con implante de stent; IECA: inhibidores de la enzima de conversión de la angiotensina; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SLF: stent liberador de fármacos; SMSR: stent metálico sin recubrimiento; VCM: volumen corpuscular medio.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Durante el seguimiento, 30 pacientes (2,3/104 años-paciente) padecieron HM; 16 (53,3%) tuvieron episodios de tipo 3a; 8 (26,7%), de tipo 3b; 2 (6,7%), de tipo 3c; 2 (6,7%), de tipo 4, y 2 (6,7%), de tipo 5b. La localización de la HM fue gastrointestinal en 12 casos (40%), intracraneal en 4 (13,3%), taponamiento cardiaco en 4 (13,3%), pulmonar en 2 (6,7%), osteomuscular en 2 (6,7%), urológica en 2 (6,7%); se produjeron hemorragia relacionada con injerto aortocoronario en 2 (6,7%) y en el lugar de punción en 2 (6,7%). Padecieron HM durante la hospitalización índice 8 pacientes (27%); 14 pacientes (47%), en los primeros 30 días; 22 (73%), durante el primer año, y 25 (83%), el segundo.
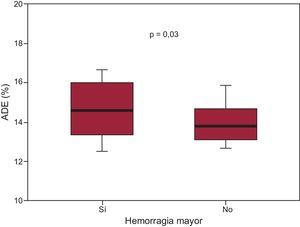
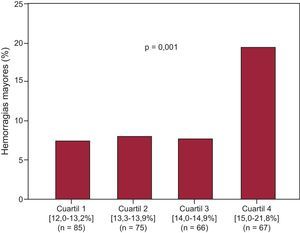
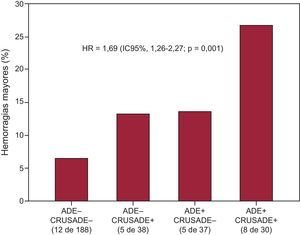
En la tabla 1 se muestra la distribución de las características y parámetros de laboratorio según la aparición de HM. Es de destacar que los pacientes que presentaron HM tenían valores ADE superiores (el 14,6% [13,4-16,0] frente al 13,8% [13,1-14,7]; p=0,03) (figura 1). Los análisis por cuartiles de los valores de ADE examinados en función de las tasas de HM revelaron que había un aumento brusco de las HM en el cuarto cuartil de ADE (ADE ≤ 13,2%, 5,1/104 años-paciente; ADE del 13,3 al 13,9%, 5,8/104 años-paciente; ADE del 14,0 al 14,9%, 8,7/104 años-paciente; ADE>14,9%, 2,1/104 años-paciente) (figura 2). Además, los análisis de supervivencia de Kaplan-Meier pusieron de manifiesto que, en comparación con los pacientes con ADE ≤ 14,9%, los que tenían valores de ADE superiores al cuarto cuartil (ADE>14,9%) presentaban una tasa de HM más elevada (el 19,4 frente al 7,5%; log rank test,p<0,001). En el análisis de regresión de Cox multivariable (tabla 2), el ADE>14,9% (hazard ratio=2,41;IC95%, 1,15-5,02; p=0,02) se asoció a un aumento a más del doble en el riesgo de HM. En el análisis de reclasificación, el ADE>14,9% añadía una información significativa a la escala de riesgo CRUSADE. La mejora de discriminación integrada relativa con la adición del ADE>14,9% fue del 5,2% (p=0,01), mientras que la mejora de la reclasificación neta fue del 10% (IC95%, 6-19; p=0,02). La probabilidad de una predicción correcta de los eventos de HM y la ausencia de HM cuando se añadía el ADE>14,9% a la escala de riesgo CRUSADE se reflejaba en el porcentaje de casos de ausencia de HM y de HM reclasificados correctamente (el 7 y el 3% respectivamente). Además, la adición de un ADE>14,9% se asoció a una mejora significativa del índice C, que pasó de 0,63 (IC95%, 0,57-0,69) a 0,68 (IC95%, 0,62-0,73; p=0,15). Este hecho se pone de manifiesto (figura 3) en que los pacientes con escala de riesgo CRUSADE < 40 puntos (riesgo de hemorragia no alto) y un ADE ≤ 14,9% fueron los que tuvieron una tasa de HM más baja (6,4%), mientras que los pacientes con escala de riesgo CRUSADE>40 puntos (riesgo alto de hemorragia) y un ADE>14,9% fueron los que presentaron la tasa más alta (26,7%; p<0,001).
Gráficos de cajas de los valores del ancho de distribución eritrocitaria en pacientes con y sin hemorragias mayores. Las líneas inferior y superior indican los percentiles 5 y 95; los límites inferior y superior de las cajas corresponden a los percentiles 25 y 75, y la línea horizontal en el interior de la caja es el valor de la mediana.
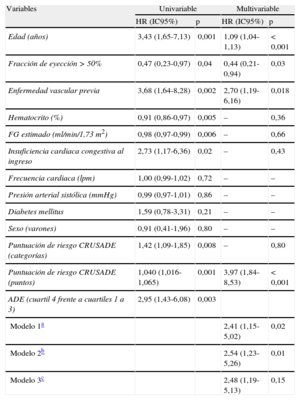
Análisis de riesgos proporcionales de Cox para la predicción de hemorragias mayores
| Variables | Univariable | Multivariable | ||
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad (años) | 3,43 (1,65-7,13) | 0,001 | 1,09 (1,04-1,13) | < 0,001 |
| Fracción de eyección>50% | 0,47 (0,23-0,97) | 0,04 | 0,44 (0,21-0,94) | 0,03 |
| Enfermedad vascular previa | 3,68 (1,64-8,28) | 0,002 | 2,70 (1,19-6,16) | 0,018 |
| Hematocrito (%) | 0,91 (0,86-0,97) | 0,005 | – | 0,36 |
| FG estimado (ml/min/1,73 m2) | 0,98 (0,97-0,99) | 0,006 | – | 0,66 |
| Insuficiencia cardiaca congestiva al ingreso | 2,73 (1,17-6,36) | 0,02 | – | 0,43 |
| Frecuencia cardiaca (lpm) | 1,00 (0,99-1,02) | 0,72 | – | – |
| Presión arterial sistólica (mmHg) | 0,99 (0,97-1,01) | 0,86 | – | – |
| Diabetes mellitus | 1,59 (0,78-3,31) | 0,21 | – | – |
| Sexo (varones) | 0,91 (0,41-1,96) | 0,80 | – | – |
| Puntuación de riesgo CRUSADE (categorías) | 1,42 (1,09-1,85) | 0,008 | – | 0,80 |
| Puntuación de riesgo CRUSADE (puntos) | 1,040 (1,016-1,065) | 0,001 | 3,97 (1,84-8,53) | <0,001 |
| ADE (cuartil 4 frente a cuartiles 1 a 3) | 2,95 (1,43-6,08) | 0,003 | ||
| Modelo 1a | 2,41 (1,15-5,02) | 0,02 | ||
| Modelo 2b | 2,54 (1,23-5,26) | 0,01 | ||
| Modelo 3c | 2,48 (1,19-5,13) | 0,15 | ||
ADE: ancho de distribución eritrocitaria; FG: filtrado glomerular; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
La puntuación de riesgo CRUSADE se evaluó por separado como variable continua y como variable dicotomizada, y se indican los valores de hazard ratio multivariable y los valores de p para las demás variables tomadas del modelo 1.
Ajustado por edad, fracción de eyección > 50%, hematocrito, filtrado glomerular estimado, enfermedad vascular previa e insuficiencia cardiaca congestiva al ingreso.
Adición de los valores del ancho de distribución eritrocitaria a la puntuación de riesgo CRUSADE para la estratificación del riesgo de hemorragia mayor. Las tasas de hemorragia mayor fueron significativamente superiores con el aumento de las puntuaciones combinadas. ancho de distribución eritrocitaria (–): ≤ 14,9%;ancho de distribución eritrocitaria (+): >14,9%; CRUSADE (+): >40 puntos (riesgo alto de hemorragia);CRUSADE (–): < 40 puntos (sin riesgo alto de hemorragia). Hazard ratio por categoría y ajustada por edad (años) y fracción de eyección del ventrículo izquierdo >50%. ADE: ancho de distribución eritrocitaria; IC95%: intervalo de confianza del 95%; HR: hazard ratio.
En el presente estudio, se evaluó el papel del ADE en la predicción de HM en una cohorte de pacientes con SCASEST. En esa población, se observó que la mayoría de los episodios de HM se producían bastante después de la hospitalización. Además, los pacientes con elevación del ADE (> 14,9%) en el momento de la hospitalización tenían mayor riesgo de HM, con un aumento al doble del riesgo de los pacientes con ADE ≤ 14,9%. Además, se observó también que el ADE añade una información útil a la escala de riesgo CRUSADE respecto a la predicción de este importante resultado clínico. Finalmente, el riesgo asociado con la elevación del ADE se producía de forma temprana y persistía durante todo el periodo de seguimiento.
El ADE se determina sistemáticamente como parte del hemograma para obtener información sobre la heterogeneidad del tamaño de los hematíes circulantes. Por lo que se refiere a su cálculo, el ADE es el coeficiente de variación del volumen corpuscular medio y, en consecuencia, los valores superiores de ADE reflejan mayor heterogeneidad del volumen corpuscular medio (anisocitosis), que generalmente se debe a la alteración de la maduración o la degradación de los eritrocitos5. El ADE se emplea como índice complementario para facilitar el diagnóstico de diferentes tipos de anemia, pero se ha evaluado también su uso como posible marcador en la detección sistemática de cáncer de colon y enfermedad celíaca21. Además, el aumento del ADE se ha relacionado también con la presencia de deficiencias nutricionales (p. ej., hierro, folato o vitamina B12)21,22 y con la liberación de citocinas en respuesta a la inflamación23. Así pues, el estrés oxidativo daña directamente los eritrocitos y conduce a una reducción del periodo de supervivencia eritrocitaria; de igual modo, estas citocinas atenúan la actividad de la eritropoyetina y causan la producción de hematíes ineficaces, lo cual conduce a elevación del ADE24–26.
Como se ha mencionado antes, varios estudios han señalado que el aumento del ADE es un predictor de riesgo de eventos adversos en pacientes con una amplia gama de trastornos cardiovasculares diferentes6–12. Sin embargo, hay pocos datos sobre la relación entre el ADE y las complicaciones hemorrágicas en los pacientes con SCA. Además, el mecanismo por el que el ADE tiene relación con la hemorragia continúa siendo en gran parte desconocido, aunque parece tener carácter multifactorial. Dado que la elevación del ADE se observa a menudo en pacientes con diversas comorbilidades27, el ADE puede predecir la aparición de estas enfermedades, así como de otros trastornos asociados a la edad. En consecuencia, en el presente estudio, los pacientes con una elevación del ADE tenían un perfil clínico basal desfavorable que incluía edad avanzada y mayores frecuencia del sexo femenino y prevalencia de comorbilidades que se sabe que aumentan el riesgo de hemorragia, como hipertensión, diabetes mellitus, anemia, ictus previo y disfunción renal. Además, estos pacientes tenían también mayores concentraciones de proteína C reactiva y, por consiguiente, la inflamación puede desempeñar un papel en el riesgo de hemorragia. De hecho, los estados proinflamatorios se han relacionado con alteraciones de la hemostasia, con un estado protrombótico que predispone a la tromboembolia y la coagulopatía con tendencia a la hemorragia28,29. Además, otros mecanismos indirectos como la deficiencia de eritropoyetina pueden contribuir a producir el aumento del riesgo de HM27. Se necesitan nuevas investigaciones para determinar las vías a través de las cuales el ADE se asocia a la hemorragia.
En un reciente estudio en el que participaron 513 pacientes con SCASEST, Gonçalves et al13 pusieron de manifiesto que los pacientes con un ADE > 15,7% presentaban un aumento de 3 veces en las HM durante la hospitalización en comparación con los pacientes con un ADE<15,7%. De igual modo, Fatemi et al14 demostraron un aumento de 2,3 veces del riesgo de HM durante la hospitalización al comparar el cuartil más alto de ADE (> 14,3%) con el más bajo (< 12,7%) en una población amplia formada por 6.689 pacientes tratados con intervención coronaria percutánea. Los resultados de nuestro estudio no solo confirman estos resultados previos, sino que los amplían, dado que demostramos también que el ADE es un predictor potente de la HM más allá del periodo de hospitalización. Por otra parte, a diferencia de estos estudios previos, nosotros empleamos una definición estandarizada de la HM basada en los criterios del Bleeding Academic Research Consortium19, y ello puede ser útil para futuras comparaciones. Se observó también que la determinación del ADE aporta una información clínica útil para la predicción de HM, adicional a la proporcionada por la escala de riesgo hemorrágico CRUSADE en pacientes con SCASEST.
Tiene interés señalar que en este estudio la mejora de la predicción aportada por el ADE al añadirlo a la escala de riesgo CRUSADE pareció ser resultado de un aumento del porcentaje de reclasificaciones correctas de los episodios y los casos sin episodios, con una mejora de la reclasificación neta del 10%. Otra observación importante en nuestro estudio es que, incluso en el contexto de una puntuación de la escala de riesgo CRUSADE < 40 puntos (riesgo no alto de hemorragia), la presencia de un ADE>14,9% comporta un riesgo de HM elevado, lo cual indica que la adición de este parámetro a las puntuaciones del riesgo hemorrágico puede resultar útil.
LimitacionesEl presente estudio tiene ciertas limitaciones. Se trata de un análisis pequeño, llevado a cabo en un solo centro. Además, como ocurre en todos los estudios de investigación observacionales, la aplicabilidad de los resultados obtenidos se debe tomar con precaución en los centros que atienden a otros tipos de pacientes y de situaciones médicas, y se debe considerarlos generadores de hipótesis. Aunque los resultados resultan concluyentes, no se puede atribuir causalidad a la relación entre ADE y hemorragia; dado que los pacientes con un ADE alto tienen a menudo otros factores concomitantes de riesgo de hemorragia —como edad avanzada, mayor prevalencia de hipertensión o peor función renal—, es probable que el ADE indique el riesgo, y no medie en él6,14,30. Otra limitación de este estudio es que los análisis de laboratorio se realizaron en una sola ocasión y, en consecuencia, no se puede evaluar las fluctuaciones de los valores de ADE. Además, las cifras de ADE no se manejaron con un diseño ciego, lo que puede haber influido en el tratamiento clínico de los pacientes. Por otro lado, no se dispuso de datos de los marcadores de la eritropoyesis, el estado nutricional y el estrés oxidativo, que podrían ser indicios de interés respecto a la fisiopatología subyacente a la anisocitosis. Finalmente, por lo que respecta a la predicción de los resultados clínicos, el número de covariables incluidas en los modelos multivariables fue>1 cada 10 episodios. En consecuencia, los modelos pueden haber sido sobreajustados y, por lo tanto, los presentes resultados podrían no reproducirse en futuras muestras.
CONCLUSIONESAunque se examinó en una cohorte relativamente pequeña, los resultados de este estudio indican que el ADE puede ser un predictor de la HM más allá del periodo de hospitalización en los pacientes con SCASEST, lo cual es novedoso. A la vista de estas observaciones y puesto que los resultados de estudios previos han establecido claramente una intensa relación entre las complicaciones hemorrágicas y la posterior evolución clínica adversa, se propone que la investigación futura debiera abarcar el posible papel de incluir los valores de ADE en las escalas de riesgo hemorrágico con objeto de mejorar el proceso de estratificación de estos pacientes, en especial tras el alta hospitalaria.
CONFLICTO DE INTERESESEl Dr. Marín ha recibido financiación para investigación, consultoría y conferencias de Abbott, Boston Scientifics, Bayer, AstraZeneca, Daiichi-Sankyo, BMS/Pfizer y Boehringer Ingelheim. El Dr. Januzzi declara subvenciones de Roche Diagnostics, Critical Diagnostics, Siemens y Singulex.