Palabras clave
Introducción
La hipercolesterolemia familiar (HF) es un trastorno genético frecuente, que se transmite de forma autosómica dominante y afecta al gen del receptor de lipoproteína de baja densidad LDL1. Se estima que afecta a 1 de cada 400-500 personas en la población general, y es el trastorno monogénico más común asociado con el desarrollo de enfermedad cardiovascular prematura. Así, se ha demostrado que un 50% de los varones y un 20% de las mujeres con HF heterocigótica que no reciben un tratamiento farmacológico adecuado sufrirán un episodio coronario agudo en la década de los 50 años2-4. También se ha observado un mayor riesgo de eventos coronarios fatales en personas con HF por debajo de los 40 años5. Por otra parte, desde la introducción de las estatinas ha disminuido la mortalidad, especialmente en personas con HF menores de 60 años6. Por lo tanto, un diagnóstico precoz y un tratamiento adecuado son fundamentales para prevenir la enfermedad cardiovascular en la HF7. Varios estudios han mostrado que la estrategia que presenta un mejor resultado coste-efectividad es el cribado de los familiares directos de las personas con HF diagnosticada8,9. Los resultados son robustos frente a variaciones en las tasas de descuento empleadas y en los costes relacionados con la medicación (estatinas), los episodios cardiovasculares, el test empleado y otros parámetros incluidos en el análisis8-10.
Tras el diagnóstico, la mayor parte de las personas iniciarán tratamiento farmacológico con el objetivo de controlar el colesterol de las lipoproteínas de baja densidad (cLDL) y reducir el riesgo de un episodio cardiovascular en el futuro11. Una nueva herramienta para el diagnóstico genético de la HF basada en un ADN-array está disponible en España desde 200412. Este método ofrece un análisis altamente sensible y específico del gen del receptor de lipoproteínas de baja densidad (rLDL) en un período corto12.
El objetivo de este estudio consiste en estimar la relación coste-efectividad incremental de un programa de cribado en familiares directos de pacientes diagnosticados de HF con su posterior tratamiento frente a la alternativa de no realizar dicho programa de cribado.
Métodos
Se realizó un análisis coste-efectividad en el que las estrategias consideradas fueron el cribado genético a los familiares directos (padres, hermanos, hijos) de una persona con diagnóstico genético previo de HF y su tratamiento con estatinas y la alternativa de no cribar. La primera estrategia incluye, además, el seguimiento y el tratamiento de las personas que han tenido un evento cardiovascular. La segunda estrategia consiste en no realizar el programa de cribado genético y tratar solamente a los pacientes que ya han tenido un evento cardiovascular. La perspectiva empleada en el trabajo es la del financiador (Sistema Nacional de Salud). La medida de efectividad principal empleada son los años de vida ganados (AVG) por nuevo caso detectado y tratado, resultado del diagnóstico y posterior tratamiento con estatinas.
Programa de diagnóstico genético en casos índice y de cribado en familiares directos
Para el análisis del programa de detección genética de HF en España, se utilizaron los datos de un estudio piloto realizado por la Fundación de Hipercolesterolemia Familiar12. En este estudio, los casos índices con sospecha de HF se identificaron de acuerdo con un protocolo uniforme de diagnóstico clínico13 y el análisis genético se realizó utilizando la plataforma Lipochip®. Esta plataforma diagnóstica incluye tres procedimientos que se realizan secuencialmente: a)ADN-array, que incluye las mutaciones en el rLDL más frecuentes en España y se actualiza periódicamente; b) si el análisis por el ADN-array es negativo, se estudia el gen en búsqueda de grandes reordenamientos mediante PCR multiplex cuantitativa, y c) si los dos análisis previos son negativos, la muestra se analiza mediante secuenciación completa del gen del rLDL. Los resultados de este estudio mostraron que aproximadamente el 59% de los casos con sospecha clínica de HF son diagnosticados correctamente. Esta tasa de detección es muy superior (72%) en los casos con un diagnóstico clínico de certeza. La especificidad y la sensibilidad del ADN-array son del 99,7 y el 99,9% respectivamente12.
Para el estudio de los familiares no es necesario aplicar la plataforma diagnóstica completa, y sólo analiza siguiendo los pasos 1 o 2, dependiendo de la mutación presente en el caso índice (mutación puntual o grandes reordenamientos). Esta información será empleada en el cálculo del coste de cribado a familiares. Para ello asumimos que los casos índice son diagnosticados genéticamente y luego se realiza el cribado genético a sus familiares directos. En el análisis de sensibilidad reflejamos este supuesto para considerar el caso de familiares directos de pacientes diagnosticados genéticamente.
Marco analítico
La distribución por grupos de edad y sexo de los pacientes y sus familiares se obtuvo a partir del estudio de cohorte de familias con HF que lleva a cabo la Fundación de Hipercolesterolemia Familiar. Concretamente, empleamos la distribución por edades y sexo de 503 pacientes menores de 60 años de dicha cohorte3,13. Se utilizaron datos sobre esperanza de vida ajustada por edad y sexo del Instituto Nacional de Estadística (INE) para aplicar los riesgos relativos encontrados en la literatura6,10 a pacientes diagnosticados de HF y tratados con estatinas y a personas que no han sido diagnosticadas de HF.
Efectividad: años de vida ganados
Los índices de mortalidad se calcularon a partir de los índices de mortalidad nacionales específicos por edad y sexo de la población general. Para asignar la probabilidad de supervivencia de un paciente con HF (con y sin tratamiento de estatinas), se emplearon los riesgos relativos específicos por edad y sexo de acuerdo con la metodología de Wonderling et al10.
Los datos del programa de cribado se complementaron con datos de la cohorte del Simon Broome Register del Reino Unido6. Ésta es una cohorte de 1.185 pacientes con HF heterocigótica que han sido seguidos prospectivamente desde 1980 y estaban en tratamiento principalmente con estatinas desde 1992 hasta la fecha de realización del análisis. Según nuestro conocimiento, ésta es la única cohorte estudiada de pacientes con HF durante un período suficientemente amplio de tiempo, lo cual permite comparar la situación de los pacientes antes y después de recibir tratamiento con estatinas. Para los pacientes con HF menores de 20 años y mayores de 60, el riesgo de mortalidad estimado de los tratados con estatinas no fue significativamente diferente del de los pacientes no tratados con estatinas. Por lo tanto, en nuestros modelos no consideramos beneficios en salud para los pacientes tratados de más de 60 años.
Costes sanitarios
Las estatinas (inhibidores de la HMG-CoA reductasa) son los fármacos de elección en el tratamiento de la hipercolesterolemia. Se consideró una dosis de tratamiento de 40 mg/día de dos tipos de estatina (simvastatina y atorvastatina) para el adecuado control lipídico de los pacientes con HF. El coste medio anual del tratamiento se calculó a partir de los precios de mercado (PVP + IVA).
Como caso base se seleccionó el precio de la simvastatina 40 mg correspondiente al precio de referencia marcado por el Ministerio de Sanidad y Consumo. El precio más bajo de la presentación de simvastatina 40 mg y el precio de la presentación de atorvastatina 40 mg son los utilizados en el análisis de sensibilidad. El coste anual medio de tratamiento con estatinas para el caso base asciende a 282,5 euros. Se asumió que el tratamiento consiste en el coste anual del medicamento más dos visitas anuales con un especialista. Se asumió como coste unitario de visita al especialista 55 euros, el cual corresponde al coste unitario de visita a un cardiólogo14.
Por lo tanto, el coste anual del tratamiento de estatinas más dos visitas se estableció en 392,5 euros. Los costes se obtuvieron en euros actualizados al año 2005. Tanto los pacientes que reciben estatinas como los que no incurren en riesgo de sufrir un evento cardiovascular agudo (mayor en los últimos). Además, se estiman los casos de infarto de miocardio y el coste unitario de cada caso a partir del grupo relacionado con el diagnóstico (GRD) 12115.
El coste total del tratamiento y los sucesos evitados se calcula utilizando las tablas de supervivencia del INE adaptadas al riesgo relativo de mortalidad de la cohorte Simon Broome tratada con estatinas, siguiendo la misma metodología10. La incidencia del infarto de miocardio fatal se obtuvo de los datos estadísticos nacionales de España, utilizando el riesgo relativo del registro de la cohorte de Simon Broome como motivo de todas las causas de muerte. Se asume que se producirían 1,4 infartos agudos de miocardio (IAM) no fatales por cada uno fatal en varones y 1,2 IAM en mujeres10.
Una vez diagnosticado el paciente de HF, se asume una reducción del riesgo de sufrir un evento cardiovascular y, por lo tanto, una ganancia en términos de años de vida, siempre que el paciente se encuentre en tratamiento y bien controlado. Es importante señalar que el diagnóstico y el tratamiento no suponen que el riesgo de mortalidad del paciente sea el mismo que el de la población general, ajustando por edad y sexo, sino que el riesgo de la población identificada y tratada es menor que el de la población con HF no tratada6,10.
Coste del cribado más tratamiento
Para el cálculo del coste del cribado a los familiares, se tuvo en cuenta los resultados del estudio piloto descrito previamente12, según los cuales para detectar 1 cribado positivo de HF en familiares de primer grado es necesario realizar 3,4 cribados. Siendo el coste de realizar un cribado igual a 425 euros, impuestos incluidos (fuente del dato: Progenika SA), y puesto que la estrategia consiste en realizar el cribado a los familiares directos de los pacientes y se asume que 1 de cada 2 (50%) también tendrá hipercolesterolemia familiar, el coste por caso positivo detectado asciende a 1.447 euros.
Coste por año de vida ganado
El coste incremental por AVG se calculó como el coste del cribado más tratamiento por paciente diagnosticado menos el ahorro resultante de reducir la incidencia de un evento coronario, todo ello dividido por los AVG. En el caso base se utiliza una tasa de descuento anual del 3% aplicada tanto a costes como a efectos para la salud.
Análisis de sensibilidad
Para contrastar la robustez del caso base, se realizaron varios tipos de análisis de sensibilidad univariables más un análisis de sensibilidad probabilístico. El modelo lleva a cabo 5.000 simulaciones de tipo Monte Carlo. El resultado de cada simulación del modelo se resume en una razón coste-efectividad incremental (RCEI) compuesta a partir del coste y la efectividad incrementales.
Resultados
Años de vida ganados
Utilizando el riesgo relativo del registro de la cohorte de Simon Broome6 aplicada a la mortalidad de España, se estimó que la esperanza de vida para un varón de 20 años de edad con HF heterocigótica tratado con estatinas desde los 20 años es de 70,6 años. Su esperanza de vida sin tratamiento de estatinas sería de 65,6 años. Para una mujer de 20 años de edad, las cifras son 77,2 años sin tratamiento y 82,3 años con tratamiento. Los AVG por el tratamiento varían de acuerdo con la edad al diagnóstico (tabla 1). Para los nuevos casos diagnosticados por el programa de cribado, se espera que ganen una media de 3,3 años de vida cada uno (1,3 años cuando aplicamos una tasa de descuento del 3%).
Costes incrementales
El coste incremental del programa de cribado incluye el coste del cribado más el coste de los medicamentos y dos visitas anuales al especialista menos el coste del ahorro asociado por menos casos de eventos coronarios que tratar. El coste del cribado por cada nuevo caso diagnosticado es de 1.447 euros, mientras que la media de los costes esperados del tratamiento con medicamento más visitas asciende a 4.529 euros. Se estimó que se evitaría 26 IAM/100 personas tratadas con estatinas entre los 18 y 60 años10. Por lo tanto, el ahorro de los IAM evitados por persona diagnosticada (1.384 euros) compensa en buena parte el coste del programa de cribado, no así el coste del tratamiento.
Coste-efectividad
Dividiendo el coste total incremental por los AVG adicionales, resulta un ratio incremental de 3.423 euros/AVG (costes y años de vida descontados al 3%). La interpretación de este coeficiente es: frente a la alternativa de no cribar, un programa de cribado genético a familiares de primer grado de pacientes diagnosticados de HF supondría invertir 3.423 euros por cada AVG adicional (tabla 2).
Análisis de sensibilidad
Se realizó un análisis de sensibilidad univariable en el modelo determinista para evaluar su impacto en los costes y la efectividad del cribado. La elección de la tasa de descuento hace variar de manera apreciable la razón incremental de coste-efectividad, pasando de un mínimo (mejor resultado) de 1.073 euros/AVG a un máximo (peor resultado) de 5.206 euros/AVG (tabla 3). Sin embargo, para cualquiera de estas situaciones la relación incremental de coste-efectividad es muy favorable a la intervención de cribado genético a familiares frente a la alternativa de no cribar, de acuerdo con los criterios comúnmente empleados en España16. Por lo tanto, se puede considerar que los resultados son robustos frente a cambios en la tasa de descuento.
Se realizaron varios análisis alternativos modificando las partidas de costes consideradas en el análisis base. Al modificar variables relacionadas sólo con costes, los AVG permanecen constantes. En la tabla 4 puede observarse que los resultados sólo varían de manera apreciable si todos los pacientes fueran tratados con atorvastatina, con lo que la razón incremental alcanza 9.708 euros/AVG. Si los pacientes fueran tratados con la simvastatina de menor precio (una EFG), ascendería a 2.569 euros/ AVG, mientras que si no consideramos ningún tipo de ahorro derivado de la prevención de infartos de miocardio, sería de 4.454 euros/AVG.
Por otra parte, si todos los pacientes estuvieran correctamente diagnosticados de HF porque el método de diagnóstico fue el genético, el coste de detectar 1 caso de HF entre sus familiares directos sería igual al precio del test (425 euros) multiplicado por la probabilidad de que un familiar directo padezca HF. Asumiendo que dicha probabilidad es del 50%, el coste de detectar 1 caso de HF bajaría hasta los 850 euros y el coste incremental en que habría que incurrir por AVG sería cercano a los 3.000 euros/AVG.
Análisis probabilístico
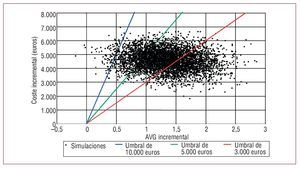
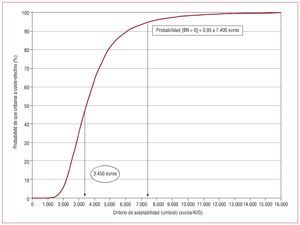
Los parámetros y distribuciones empleadas se recogen en la tabla 5. Los resultados se complementan con el análisis gráfico del plano coste-efectividad y la curva de aceptabilidad. El plano coste-efectividad (fig. 1) consiste en la representación en un plano del coste incremental y de la efectividad incremental de cada simulación17. Por su parte, la curva de aceptabilidad (fig. 2) representa la probabilidad de que la intervención x sea óptima, dados los datos generados por el análisis estocástico. Es decir, la curva de aceptabilidad puede ser interpretada como la probabilidad de que la intervención x sea coste-efectiva18.
Fig. 1. El plano coste-efectividad muestra que la mayor parte de los puntos representados se encuentran en el cuadrante de mayor coste y mayor efectividad (4.997 de las 5.000 simulaciones realizadas). La mayor parte de los puntos se encuentran por debajo de la frontera de los 10.000 euros/AVG incrementales, y también es elevado el volumen de puntos por debajo de los 3.000 euros/AVG incrementales. AVG: años de vida ganados.
Fig. 2. La curva de aceptabilidad ilustra que si la disposición a pagar social o del financiador público fuera de 7.400 euros por AVG incremental, la probabilidad de que la estrategia cribado más tratamiento frente a la alternativa de no cribar fuera óptima, sería del 95%. Para una disposición a pagar mayor o igual que 15.000 euros/AVG incremental, la probabilidad ascendería a cerca del 100%.
Por último, a partir del beneficio neto se calculó el valor esperado de la información perfecta (VEIP)19. El VEIP del modelo en su totalidad cuantifica el coste de la incertidumbre general sobre el resultado final del análisis de coste-efectividad incremental. Por lo tanto, por cada umbral (máxima disposición a pagar) obtenemos el límite máximo que podríamos estar dispuestos a pagar en la búsqueda de mejor información (información perfecta)
para informar nuestra decisión con mayor seguridad teniendo en cuenta la población diana que se va a favorecer de esta estrategia (prevalencia). La curva del VEIP general presenta su valor máximo de 650 euros por persona, alcanzado cuando la máxima disposición a pagar por 1 AVG adicional es de aproximadamente 3.500 euros (punto de coste-efectividad). Después de este punto, el VEIP se reduce drásticamente; por ejemplo, el VEIP es de 30 euros cuando se alcanza el umbral de 10.000 euros.
Discusión
Este estudio demuestra de forma consistente que la realización del cribado genético en los familiares directos de un probando diagnosticado previamente de HF presenta una buena relación coste-efectividad. Estos resultados son especialmente favorables cuando se comparan con otras medidas de intervención en salud, y las conclusiones de nuestro estudio son similares a las encontradas por otros análisis económicos realizados en Reino Unido y Países Bajos8-10. Hay que señalar que aunque el ratio costeefectividad más elevado es el resultante de considerar tratamiento con atorvastatina, este resultado está condicionado por una estimación conservadora. Esto es, hemos considerado el mismo efecto en los AVG pese a que las dosis de simvastatina y atorvastatina consideradas no eran equipotentes. Hemos mantenido este supuesto para mostrar que incluso empleando una estatina más cara la razón incremental de coste/AVG sigue siendo atractiva. No obstante, en un estudio reciente, se demuestra que el tratamiento de la HF utilizando atorvastatina en monoterapia hasta 80 mg/día e incluso en tratamiento combinado con ezetimiba es igualmente costeefectivo20, por lo que el tratamiento farmacéutico óptimo es un aspecto que estudiar en futuros análisis.
Las personas que padecen HF presentan tasas de mortalidad, ajustadas por edad y sexo, entre 4 y 5 veces mayores que las de la población general6,21 y la identificación de la HF es una condición previa necesaria para su correcto tratamiento. El diagnóstico clínico de HF se basa fundamentalmente en la concentración de cLDL y los antecedentes familiares de hipercolesterolemia y enfermedad cardiovascular prematura. El cLDL no se puede considerar el estándar para el diagnóstico de HF debido a los problemas de sensibilidad y especificidad en que incurre, pues en ocasiones se solapa con los valores de la población general. Se ha demostrado que utilizando el cLDL el error diagnóstico en los casos índice es del 17% en los portadores de una mutación funcional y del 12,5% en los no afectos de HF22. Por otra parte, las concentraciones de cLDL parecen ser un pobre predictor de HF en los familiares, ya que el 23,5% de los familiares con mutación tienen el cLDL por debajo del percentil 90 y el 15% de los no afectos lo tendrán por encima de ese percentil23.
Nuestro estudio posiblemente subestima los resultados en la salud que se obtendrían en caso de aplicar un programa y un tratamiento posterior a casos detectados de HF. La causa radica en que los resultados del seguimiento de la cohorte Simon Broome provienen de pacientes tratados con estatinas desde 1992 hasta el momento de realización de su estudio, publicado en 1999. Los pacientes fueron tratados generalmente con dosis más bajas de las que hoy sabemos que serían las indicadas24-26.
Por lo tanto, las ganancias en eventos cardiovasculares evitados, muertes prematuras evitadas y, por ende, AVG posiblemente estén subestimados en nuestro estudio y sean más elevados en la realidad.
Por otra parte, los resultados serían más favorables en cuanto a AVG si el diagnóstico de la HF se realizase a edades más jóvenes. En España, más de la mitad de los casos en varones y mujeres han sido diagnosticados después de los 50 años (datos de la cohorte española de HF no mostrados). Ello tiene importantes implicaciones económicas y sanitarias, ya que el beneficio sanitario (AVG) es mayor cuanto antes se diagnostica la HF10. Por lo tanto, nuestros resultados deben ser interpretados como estimaciones conservadoras.
Limitaciones del estudio
No hay que ocultar las dificultades encontradas a la hora de estimar los resultados en la salud. No se dispone de ensayos clínicos aleatorizados (ECA) que permitan comparar los resultados de una cohorte de pacientes con HF tratados con estatinas de otro grupo de pacientes con la misma enfermedad y no tratados. Y habrá que asumir que no se va a disponer de ellos puesto que la realización de ECA en esta población sería éticamente inaceptable, ya que es bien conocido el beneficio del tratamiento con estatinas en la HF6,24-26.
Por otra parte, el correcto diagnóstico de pacientes con HF sí podría abrir paso a ensayos clínicos y estudios observacionales de cohortes donde se compare la efectividad en el empleo de diferentes estatinas, diferentes dosis terapéuticas y otra medicación que ayudara a complementar el uso de las estatinas. Además del tratamiento farmacológico, debería estudiarse el efecto de otros factores como la dieta, el ejercicio físico, no fumar, etc., condicionantes del riesgo cardiovascular de los pacientes.
Dada la perspectiva del análisis, lo correcto era centrarse en los costes sanitarios directos, si bien podría haber otros costes de organización local y general o de formación de personal que se podría haber incluido. No obstante, ello no cambiaría la conclusión del análisis. Por otra parte, la puesta en marcha de un programa selectivo de cribado genético en familiares de pacientes con diagnóstico de HF o un cribado a un grupo de población más amplia podría presentar beneficios adicionales en forma de costes sociales evitados tales como pérdidas de productividad laboral. Johannesson et al27, en el marco de un análisis de coste-efectividad de simvastatina en el tratamiento de pacientes con baja concentración de colesterol y enfermedad coronaria, estimaban un coste incremental por AVG que oscilaba entre los 3.800 y los 27.000 dólares, en función de la concentración de colesterol, la edad del paciente y su sexo. Cuando se incluían las pérdidas laborales evitables, los resultados eran mucho más favorables y oscilaban entre una situación de ahorro neto de costes más los beneficios de la terapia y una relación coste-efectividad de 13.000 dólares por AVG. De hecho, las pérdidas laborales generadas por las enfermedades isquémicas del corazón en España son de una extraordinaria magnitud28,29. Por lo tanto, una futura línea de análisis abierta sería el estudio de los costes evitados, empleando la perspectiva social e incluyendo todos los costes que afectan a la sociedad. Asimismo, hubiera sido deseable que la unidad de medida de resultado final fuera los años de vida ajustados por calidad. Desafortunadamente, la información disponible no hacía posible realizar un análisis con tal medida de resultado.
Conclusiones
La estrategia de cribado genético a los familiares directos de personas diagnosticadas de HF, con el posterior tratamiento, es una alternativa eficiente si la comparamos con la alternativa de no cribar. El empleo del análisis de sensibilidad indica que los resultados obtenidos son robustos frente a cambios en los parámetros utilizados. Asimismo, la combinación de la simulación probabilística empleada arroja mayor claridad a los resultados del estudio. En este caso, el ratio incremental de la tecnología que nos ocupa es de 3.423 euros por AVG, el cual es muy razonable. Del mismo modo, utilizando la información aportada por el análisis de sensibilidad, podemos señalar que en el caso de que el umbral de aceptabilidad se sitúe en España en torno a los 7.500 euros, la estrategia de cribado genético más tratamiento en los familiares directos de personas diagnosticadas de HF sería eficiente con una probabilidad del 95%.
En España se está realizando la detección genética de HF en algunas comunidades por médicos especialistas. Hasta la fecha se han realizado aproximadamente 5.000 análisis genéticos, con un porcentaje de detección para el caso índice en torno al 65%. Se ha demostrado que la detección genética identifica a pacientes más jóvenes y mejora el tratamiento y el cumplimiento terapéutico22. Por lo tanto, los resultados obtenidos respaldan la puesta en marcha de un plan de detección de la HF.
AGRADECIMIENTOS
Julio López y Juan Oliva agradecen el apoyo del CIBER Epidemiología y Salud Pública (CIBERESP).
Pedro Mata y Rodrigo Alonso agradecen el apoyo de la Red Temática Hiperlipemias Genéticas (G03/181).
ABREVIATURAS
AVG: año de vida ganado.
cLDL: colesterol de las lipoproteínas de baja densidad.
HF: hipercolesterolemia familiar.
IAM: infarto agudo de miocardio.
rLDL: receptor de lipoproteínas de baja densidad.
Full English text available from: www.revespcardiol.org
Este trabajo se ha realizado en parte gracias a una ayuda económica concedida por Lácer SA, y a los datos aportados por la Fundación Hipercolesterolemia Familiar.
Correspondencia: Dr. J. Oliva.
Departamento de Análisis Económico y Finanzas. Facultad de Ciencias Jurídicas y Sociales de Toledo. Universidad de Castilla-La Mancha. Cobertizo de San Pedro Mártir, s/n. 45071 Toledo. España.
Correo electrónico: juan.olivamoreno@uclm.es
Recibido el 15 de abril de 2008.
Aceptado para su publicación el 21 de octubre de 2008.