En la cirugía de trasplante cardiaco ortotópico, la anastomosis biauricular de Lower y Schumway es una técnica ampliamente utilizada1. Esta intervención ocasiona una distorsión en la geometría y la hemodinámica de la aurícula derecha que origina aumento de la presión media, insuficiencia tricuspídea y mitral, asincronía eléctrica y mayor incidencia de aleteo auricular2. Las formas más frecuentes descritas en la literatura son las dependientes del istmo cavotricuspídeo, donde la barrera posterior del circuito sería la línea de sutura auriculoauricular en lugar de la crista terminalis. Sin embargo, cuando hay conducción eléctrica entre la aurícula receptora (AuR) y la donante (AuD) a través de la anastomosis auricular, ya sea por mecanismos de transmisión electrotónica o por la conductividad directa3, la AuR podría contribuir al desarrollo de arritmias en el corazón donante4.
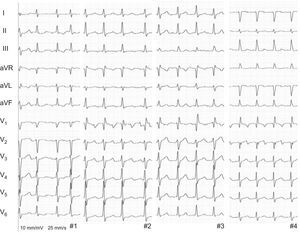
Se presenta a 4 pacientes con trasplante cardiaco ortotópico según técnica de anastomosis biauricular, que sufrieron aleteo auricular atípico mucho después de la cirugía (mediana, 5,5 [intervalo, 3-10] años). Todos refirieron una clínica de palpitaciones sin insuficiencia cardiaca, y en el electrocardiograma se documentó aleteo auricular con conducción auriculoventricular variable (figura 1). Tras descartar rechazo como causa aguda, mediante biopsia endomiocárdica se realizó un procedimiento de ablación guiado por sistema de navegación tridimensional (CARTO; catéter de ablación ThermoCool SmartTouch; Biosense Webster).
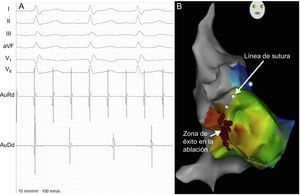
El mapeo intracavitario demostró en todos los casos una taquicardia macrorreentrante con relación variable entre AuR y AuD. Había un gradiente de frecuencia que se establecía desde la AuR, la cual soportaba la longitud de ciclo más corta y regular, a la AuD que mostraba la longitud de ciclo más larga (figura 2A). Esta última era además variable en 2 casos con una periodicidad tipo Wenckebach. Guiados por la presencia de dobles potenciales, se procedió a la delimitación anatómica de la sutura biauricular (AuR-AuD) y se realizó una cartografía de activación de la AuD para determinar puntos de actividad precoz sobre la sutura (figura 2B). En 3 casos se encontró un área de máxima precocidad en la cara lateral de la aurícula derecha (posición horaria 9–10 de la sutura en una visión anteroposterior) y en 1 caso se encontraron dos áreas de máxima precocidad (posiciones horarias 10 y 12). Las maniobras de encarrilamiento desde la AuR demostraron: mayor variabilidad en los ciclos de retorno con valores medios de éstos más prolongados en la AuD en todos los casos y ciclos de retorno cortos en la AuR derecha en un paciente. Los electrogramas de las áreas de máxima precocidad en la AuD derecha mostraron rasgos de continuidad interauricular y su ablación con radiofrecuencia obtuvo la disociación eléctrica AuR-AuD. Tras esto, las AuR permanecieron en aleteo auricular, mientras que las AuD mostraban ritmo sinusal, y se obtuvo el cese de las palpitaciones. A 1 paciente se le realizó ablación de la taquicardia macrorreentrante sobre la AuR derecha; en los otros 3 se confirmaron los ciclos de retorno prolongados y, con la sospecha de origen en la AuR izquierda, se realizó una reversión a ritmo sinusal mediante sobrestimulación.
A: registros intracavitarios (AuRd: dipolo distal del catéter en aurícula receptora; AuDd: dipolo distal del catéter en aurícula donante) y derivaciones electrocardiográficas durante la taquicardia macrorreentrante. B: imagen en oblicua anterior derecha de la reconstrucción electroanatómica y mapa de activación en la aurícula donante en el que se observa la línea de sutura quirúrgica (bolas blancas) y la zona de ablación con radiofrecuencia a nivel anterolateral de la aurícula derecha (bolas rojas). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Por norma general, mientras que la fibrilación auricular ocurre frecuentemente en el posoperatorio inmediato del trasplante cardiaco, la aparición de taquicardia macrorreentrante se produce a largo plazo, con predominio de las formas dependientes del istmo cavotricuspídeo5. Sin embargo, algunas series describen una incidencia similar de aleteo atípico con origen en la AuR y trasmisión a la AuD mediante conexiones transauriculares6. El diagnóstico electrocardiográfico a menudo resulta complicado, pues la distorsión de la propagación eléctrica en las aurículas genera patrones distintos de las ondas F aun en las formas comunes de aleteo auricular6. Por lo tanto, en los estudios electrofisiológicos se debería estudiar la conducción eléctrica entre la AuR y la AuD como parte de un estudio sistematizado que también incluya: a) el análisis de gradientes de frecuencias; b) maniobras de encarrilamiento en el istmo cavotricuspídeo, y c) maniobras de encarrilamiento en la AuR derecha.
La mejor estrategia de tratamiento en las formas atípicas no está del todo esclarecida y, como demostramos en nuestra serie, la ablación de las conexiones interauriculares en la línea de la sutura quirúrgica sería suficiente para eliminar la taquicardia macrorreentrante en la AuD y con ello los síntomas asociados en forma de palpitaciones. Sin embargo, la persistencia de dicha taquicardia en la AuR deja abiertas algunas incógnitas como, por ejemplo, el riesgo embólico que se confiere a los pacientes. Idealmente, la ablación del istmo de conducción lenta de la taquicardia macrorreentrante localizado en la AuR sería la mejor estrategia. Pero esto solo fue posible en 1 (25%) de nuestros casos desde la AuR derecha. Los demás casos mostraron signos de origen en la AuR izquierda, lo que habría obligado a una punción transeptal. A nuestros pacientes se los trató de manera conservadora a este respecto. Ninguno de los pacientes recibió tratamiento anticoagulante durante el seguimiento (54, 35, 5 y 4 meses respectivamente), y se observó buena evolución clínica libre de síntomas y de complicaciones, así como ritmo sinusal en el electrocardiograma.