Palabras clave
INTRODUCCIÓN
El corazón es el principal órgano afectado en la enfermedad de Chagas, y un 20-30% de los pacientes sufren miocardiopatía chagásica crónica (MCC), caracterizada por insuficiencia cardiaca, arritmias y muerte súbita.
En la patogenia de la MCC se ha implicado la lesión microvascular que produce múltiples lesiones focales isquémicas1, que originarían un aumento en las concentraciones de adenosina, cuyos efectos cardiovasculares están mediados por receptores acoplados a proteínas G2.
La utilización terapéutica de la adenosina se ha asociado a efectos proarrítmicos. En pacientes con corazones estructuralmente normales se ha observado fibrilación auricular, incremento de la conducción nodal auriculoventricular (AV) y taquicardia ventricular polimorfa no sostenida3. En niños y adultos con síndrome de QT prolongado, ha inducido taquicardia ventricular tipo torsade de pointes (TP)4.
La muerte súbita en la enfermedad de Chagas se debe a fibrilación ventricular (FV), la cual está condicionada por anomalías humorales, vasculares y estructurales. La FV se ha relacionado con trastornos en la repolarización ventricular reflejados en un intervalo QT largo5 y complejos de ventriculares prematuros de acoplamiento temprano (fenómeno R sobre T) y tardío6. La isquemia miocárdica focal en el mal de Chagas induciría la liberación de adenosina, que desencadenaría arritmias mortales facilitadas por trastornos de repolarización. En el presente trabajo se estudia el papel del sistema adenosinérgico en la inducción de arritmias ventriculares.
MÉTODOS
Muestra
Se dividió en dos grupos un total de 28 ratas Sprague-Dawley: grupo control, conformado por 14 ratas sanas, y grupo experimental, constituido por 14 ratas con MCC con comprobación histopatológica de miocarditis crónica (fig. 1).
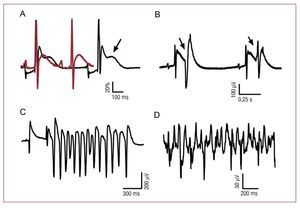
Fig. 1. Evidencias histopatológicas y electrocardiográficas de miocardiopatía chagásica crónica. Las secciones de corazón mostradas fueron fijadas con PBS-formalina, incluidas en parafina y coloreadas con hematoxilina-eosina. En A se muestra la fibrosis y en B, el infiltrado inflamatorio mononuclear. Los registros mostrados son de ratas sanas (C) y chagásicas (D-E) en anestesia con pentobarbital (40 mg/kg) antes de la extracción del corazón. Obsérvese que las ratas chagásicas presentaron extrasístoles nodales (D) y bloqueos auriculoventriculares (E).
Corazón aislado
Se realizó en un sistema de perfusión retrógrada continua tipo Langendorff, utilizando una solución modificada tipo Krebs-Henseleit que contenía 10 nmol de isoproterenol, con un pH entre 7,35 y 7,45, gasificada con un 95% de O2 y un 5% de CO2 a 37 °C. El isoproterenol se utilizó para mantener un tono adrenérgico elevado y facilitar la aparición de arritmias. El registro electrocardiográfico se realizó en configuración bipolar; los electrodos fueron colocados en la punta y en la aurícula derecha. La adenosina fue ensayada en concentraciones crecientes (10-3.333 μmol). Los antagonistas selectivos de los receptores A1 (1,3-dipropil-8-ciclopentilxantina [DPCPX]), A2a (8-cloroestirilcafeína [8-CSC]), A2b (aloxazina [ALLO]) y el antagonista A3 (VUF 5574) fueron ensayados en ausencia y en presencia de adenosina 0,33-1 mmol.
Análisis de los datos
La significación estadística se determinó por el test de la t de Student o ANOVA para datos apareados, seguido de prueba de Bonferroni. Las variables cualitativas se analizaron utilizando la prueba de la χ2. Se consideró significativo p < 0,05.
RESULTADOS
Los electrocardiogramas realizados con anestesia con pentobarbital, antes del montaje de la preparación de Langendorff, mostraron en 5 ratas chagásicas trastornos del ritmo (extrasístoles nodales) y de conducción (bloqueos AV y fasciculares). Las ratas controles (n = 3) sólo mostraron variabilidad RR (fig. 1).
Parámetros electrocardiográficos
En las tablas 1 y 2 se muestran los valores de los intervalos PR, QRS y QT obtenidos con dosis crecientes de adenosina y de DPCPX en presencia de 333 μmol de adenosina; se puede observar que la adenosina indujo un incremento del intervalo QT, que se revirtió con DPCPX. No se observaron diferencias significativas para los intervalos PR y QRS.
En la figura 2A se ilustra el incremento del intervalo QT y la presencia de despolarizaciones tempranas (flecha); en la figura 2B se muestran complejos ventriculares prematuros emergiendo de la onda T, y en la figura 2C, el fenómeno de TP emergiendo de una onda T prolongada.
Fig. 2. La prolongación del intervalo QT induce posdespolarizaciones tempranas, fenómenos R sobre T, torsade de pointes y fibrilación ventricular. A: registros obtenidos en corazones chagásicos en presencia (línea negra) y ausencia (línea roja) de adenosina 100 μmol, donde observamos prolongación del QT y despolarizaciones tempranas (flecha); la amplitud fue normalizada para facilitar la superposición de los registros. B: complejos ventriculares prematuros emergiendo de la onda T (fenómeno R sobre T). C: fenómeno de torsade de pointes. D: fibrilación ventricular.
Trastornos del ritmo
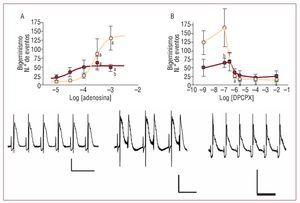
La adenosina indujo un incremento significativo del número de extrasístoles nodales y ventriculares y bigeminismos en ambos grupos en función de la dosis, y se revirtieron con DPCPX. Al comparar ambos grupos, el grupo control presentó un mayor número de bigeminismos (p < 0,05) (fig. 3).
Fig. 3. Los bigeminismos son inducidos por receptores A1. El beis representa al grupo control y el rojo al experimental. Todos los registros fueron obtenidos a partir de una misma rata chagásica. A: curva dosis-respuesta de adenosina. B: curva dosis-respuesta de DPCPX en presencia de adenosina 333 μmol; los registros representan condiciones basales (izquierda), perfusión con adenosina (medio) y perfusión con DPCPX-adenosina (derecha); la línea vertical representa 100 μV y la horizontal, 0,5 s. ap < 0,05 con respecto al registro basal. bp < 0,05 entre ambos grupos para la dosis indicada.
Fibrilación ventricular
La adenosina indujo FV en el 50% (n = 7) de los corazones chagásicos y en el 7,14% (n = 1) de los sanos (fig. 2D); la probabilidad de fibrilar se asoció con los corazones chagásicos (p < 0,05). En presencia de DPCPX y 8-CSC no se observó FV, pero la 8-CSC en el grupo experimental indujo taquicardia ventricular en el 50% (n = 2) de los corazones. La aloxazina 1 mmol y VUF 176 nmol no lograron prevenir la FV.
DISCUSIÓN
En las taquicardias ventriculares graves inducidas por adenosina, se ha observado como factor predisponente el síndrome del QT largo, congénito4 o adquirido7. En estos pacientes la bradicardia inducida por adenosina causa TP, que podría degenerar en fibrilación ventricular8. La TP es una arritmia poco frecuente y depende de que haya bradicardia9 y una descarga adrenérgica incrementada10.
La sobrecarga de Ca2+ intracelular inducida por isoproterenol11 y por adenosina mediada por los receptores A2a2 activaría el intercambiador de Na+/ Ca2+, lo cual prolongaría el intervalo QT. En estas condiciones se favorece la aparición de posdespolarizaciones tempranas y tardías; las posdespolarizaciones tempranas son exacerbadas a bajas frecuencias cardiacas y contribuyen a la aparición de arritmias ventriculares polimórficas relacionadas con un QT largo11. Se ha confirmado que la administración simultánea de adenosina e isoproterenol es capaz de inducir arritmias en pacientes propensos a la fibrilación auricular12.
Al administrar DPCPX se observó una disminución significativa del intervalo QT, lo cual coincidió con la reversión de las arritmias. La relación entre los receptores A1 y la inducción de arritmias se ha demostrado en modelos transgénicos13.
La adenosina fue capaz de inducir FV en ratas chagásicas, efecto que se evita con la administración de DPCPX y 8-CSC, lo que indica mediación de receptores A1 y A2a. Se ha demostrado que la probabilidad de que aparezca la FV facilitada por fenómenos de hipoxia y reoxigenación disminuye con DPCPX14, lo que confirma que los receptores A1 están involucrados en la FV. Asimismo, la capacidad de adenosina de inducir FV se bloquea por depleción de catecolaminas en el corazón15, lo que ratifica que la adenosina induce FV en condiciones de hipoxia-reoxigenación en un mecanismo facilitado por la activación del sistema adrenérgico.
En la MCC, los trastornos de la microcirculación coronaria conducen a ciclos de hipoxia, isquemia y reoxigenación1. Estos acontecimientos condicionarían al corazón chagásico a la acción profibrilatoria de la adenosina, la cual en nuestro modelo experimental se vio favorecida por la activación sostenida de los receptores betaadrenérgicos.
La relevancia médica de la presente comunicación es que involucra las arritmias asociadas a QT prolongado observadas en los corazones chagásicos con el sistema adenosinérgico A1, lo que abre la posibilidad de estudios terapéuticos sobre la efectividad del uso de antagonistas A1 en estas arritmias.
Full English text available from: www.revespcardiol.org
El trabajo ha sido financiado por CDCHT, UCLA, Barquisimeto-Venezuela, Proyecto N.o 001-ME-2005.
Correspondencia: Dr. R. Bonfante-Cabarcas.
Unidad de Bioquímica. Decanato de Ciencias de la Salud. Universidad Centro-Occidental Lisandro Alvarado.
Avda. Libertador con Andrés Bello. 3001 Barquisimeto. Venezuela.
Correo electrónico: rcabarca@ucla.edu.ve
Recibido el 27 de abril de 2009.
Aceptado para publicación el 18 de junio de 2009.