El ventrículo derecho está implicado con frecuencia en las cardiopatías congénitas, y la disfunción ventricular derecha es un factor determinante del pronóstico. La evaluación de la morfología, las dimensiones y la función del ventrículo derecho es de gran importancia en el manejo clínico de los pacientes, pero presenta limitaciones por la forma compleja del ventrículo y por su alta dependencia de las condiciones de carga. En los últimos años, y gracias al avance de técnicas de imagen como la ecocardiografía y, principalmente, la resonancia magnética cardiovascular, se ha profundizado en el estudio del ventrículo derecho y se ha mejorado en el conocimiento de su estructura y su función.
Palabras clave
Históricamente, se ha subestimado la relevancia de la morfología y la función del ventrículo derecho (VD). En las cardiopatías adquiridas, el ventrículo izquierdo (VI) suele ser el principal implicado; sin embargo, en el campo de las cardiopatías congénitas el VD está afectado con mayor frecuencia1,2. En las cardiopatías congénitas el VD puede estar situado: a) en posición subpulmonar, como en la comunicación interauricular (CIA), la anomalía de Ebstein, la tetralogía de Fallot y la estenosis del tracto de salida del VD (TSVD), o b) en posición sistémica, como en la transposición de grandes arterias (TGA) tras una intervención de intercambio auricular (operación de Mustard o Senning) y en la TGA congénitamente corregida (TGAcc).
VENTRÍCULO DERECHO NORMALEl VD en el corazón normal es la cámara cardiaca más anterior, situada justo detrás del esternón. A diferencia del VI, que tiene una forma elipsoidal, el VD posee una forma compleja que se puede definir como un tubo aplanado que envuelve el VI. El VD consta de tres componentes3: la porción de entrada, que se extiende desde la unión auriculoventricular hasta los músculos papilares, la porción trabecular apical y el tracto de salida del VD (TSVD) o infundíbulo. El VD se diferencia del VI por su estructura, y no por su posición, y se caracteriza por: las trabeculaciones gruesas, la banda moderadora y la válvula tricúspide, cuya inserción septal está ligeramente más desplazada hacia el ápex que el velo anterior de la válvula mitral, y que además tiene cuerdas tendinosas que se anclan en el septo interventricular.
FisiopatologíaEn situaciones de sobrecarga de volumen, el VD se dilata y puede funcionar durante largos periodos sin una reducción significativa de la función sistólica. Sin embargo, a largo plazo, la sobrecarga de volumen puede dar lugar a un empeoramiento progresivo de la función sistólica ventricular y un aumento de la morbilidad y la mortalidad. Las situaciones de sobrecarga de presión del VD también suelen ser bien toleradas. El VD se hipertrofia y, pese a soportar presiones arteriales sistémicas durante largos periodos, la disfunción ventricular no suele desarrollarse hasta estadios avanzados. Tanto la sobrecarga de presión como la de volumen producen un desplazamiento del septo interventricular hacia el VI que modifica su geometría (morfología en «D»). La dilatación del VD aumenta además el efecto constrictivo del pericardio. Todo esto puede producir secundariamente una reducción de la distensibilidad y del llenado del VI4. En situaciones de disfunción diastólica, se produce un aumento de presiones de llenado de VD y aumento de presión de la aurícula derecha, lo que da lugar a síntomas de congestión venosa sistémica.
Las arritmias supraventriculares (fibrilación auricular, flutter auricular) son frecuentes en situaciones de disfunción del VD, por lo que, cuando éstas se presentan en pacientes con cardiopatías congénitas, hay que descartar la existencia de lesiones estructurales que tengan repercusión hemodinámica. En pacientes con cardiopatías congénitas reparadas, los parches y las cicatrices posquirúrgicas son un sustrato que favorece la aparición de arritmias auriculares y ventriculares.
Algunos pacientes con cardiopatías congénitas y disfunción sistólica del VD presentan una activación neurohormonal similar a la de la insuficiencia cardiaca secundaria a cardiopatías adquiridas. El grado de activación neurohormonal se correlaciona con el grado de disfunción ventricular y la clase funcional5. Es tentador extrapolar los resultados de los estudios realizados en cardiopatías adquiridas respecto a la utilidad de los inhibidores de la enzima de conversión de angiotensina y los bloqueadores beta en insuficiencia cardiaca, pero no hay estudios que demuestren su utilidad en el campo de las cardiopatías congénitas. En un estudio multicéntrico aleatorizado que incluyó a 29 pacientes con VD sistémico, el losartán no mejoró la capacidad de ejercicio ni redujo la concentración de NT-proBNP, aunque una activación basal mínima del sistema renina-angiotensina de estos pacientes podría explicar ese resultado6.
EVALUACIÓN DEL VENTRÍCULO DERECHO MEDIANTE TÉCNICAS DE IMAGENLa evaluación de la función del VD es de gran importancia a la hora de tomar decisiones clínicas en pacientes con cardiopatías congénitas. La valoración del VD incluye parámetros de geometría, volúmenes, masa, contractilidad y perfusión miocárdica. Estos parámetros pueden obtenerse mediante diversos métodos diagnósticos y permiten establecer si hay enfermedad o no y valorar su progresión en estudios seriados. Sin embargo, a la hora de valorar la función del VD hay que tener en cuenta que algunos parámetros de función presentan limitaciones por la gran interdependencia que existe entre la contractilidad miocárdica intrínseca y las condiciones de carga del VD7.
El ecocardiograma es el método diagnóstico de elección inicial para el estudio de las cardiopatías congénitas. La valoración ecocardiográfica bidimensional del VD, sin embargo, presenta diversas limitaciones. A diferencia del VI, el VD tiene una forma compleja, sin eje de simetría, por lo que no se pueden aplicar medidas de función sistólica tradicionales como la fracción de eyección o el acortamiento fraccional, ya que su cálculo se basa en la presunción de modelos geométricos. Además, la localización retroesternal del VD en el tórax limita la ventana acústica y dificulta la delineación del borde endocárdico. La excursión sistólica del anillo lateral de la válvula tricúspide hacia el ápex medida con modo M en el plano de cuatro cámaras presenta una buena correlación con la fracción de eyección del VD8. La utilización de contraste ecocardiografico puede mejorar la visualización del VD. La ecocardiografía tridimensional es una técnica prometedora para estudiar la función del VD, pero sigue estando limitada por la mala determinación del borde endocárdico.
Los métodos Doppler son una alternativa atractiva en la evaluación de la función del VD, ya que no dependen de medidas anatómicas precisas. El Doppler tisular es una técnica ecocardiográfica que mide las velocidades del movimiento miocárdico y permite la evaluación de la función sistólica y diastólica. La onda S sistólica se correlaciona con la función sistólica del VD medida mediante ventriculografía isotópica9. La aceleración isovolumétrica del anillo tricúspide es un parámetro que se obtiene al dividir la velocidad de contracción isovolumétrica máxima por el tiempo que transcurre desde el inicio hasta la velocidad máxima de esa onda. Este índice ha demostrado ser independiente de las condiciones de precarga y poscarga, con una buena correlación con la manometría invasiva10. El índice Tei se obtiene al dividir por el tiempo de eyección la suma del tiempo de contracción y relajación isovolumétrica, y es un parámetro que valora de forma global la función sistólica y diastólica ventricular11.
La resonancia magnética cardiovascular (RMC) se ha establecido como el patrón de referencia para la evaluación cuantitativa de volúmenes, masa y función sistólica del VD12. Con la RMC se pueden realizar múltiples cortes tomográficos en cualquier dirección espacial y con un amplio campo de visión. La RMC con gadolinio permite la detección de áreas de realce tardío que se corresponden con áreas de fibrosis miocárdica tanto en cardiopatías adquiridas como en las congénitas13-15.
La tomografía computarizada (TC) multidetector es una técnica prometedora que obtiene imágenes de alta calidad. Es de gran utilidad en pacientes con dispositivos implantables en los que la RMC está contraindicada y para valorar las estructuras vasculares.
El cateterismo cardiaco, que en su momento fue la técnica de imagen de elección, ha sido ampliamente reemplazado en la actualidad por técnicas no invasivas, como la ecocardiografía, la RMC y la TC multidetector. El cateterismo se reserva para los pocos pacientes en que no se puede obtener los parámetros hemodinámicos de forma no invasiva o para los que se planea practicar intervencionismo percutáneo.
VENTRÍCULO DERECHO SUBPULMONARComunicación interauricularExisten tres tipos de CIA: la CIA tipo ostium secundum, que es la más frecuente, situada en la fosa oval, la CIA tipo ostium primum y la CIA tipo seno venoso. En la CIA se produce un cortocircuito izquierda-derecha con sobrecarga de volumen e hiperaflujo pulmonar. La aurícula derecha y el VD se dilatan cuando el tamaño del defecto es grande (> 10mm). El grado del cortocircuito puede aumentar con el tiempo en defectos de menor tamaño por una reducción de la distensibilidad del VI secundaria a cardiopatía isquémica, hipertensión o valvulopatía adquirida. Aunque el VD tolera la dilatación ventricular durante largos periodos con contractilidad aumentada, los pacientes con CIA pueden sufrir arritmias auriculares (fibrilación o flutter auricular), insuficiencia cardiaca o embolia paradójica. El cierre de la CIA, tanto percutáneo como quirúrgico, está indicado cuando haya dilatación de la aurícula derecha y el VD, con o sin síntomas, para prevenir las complicaciones a largo plazo16. Tras el cierre del defecto, se produce una reducción del tamaño ventricular y mejoran los síntomas de insuficiencia cardiaca y la tolerancia al ejercicio, incluso en pacientes asintomáticos. La incidencia de arritmias auriculares se reduce cuando el cierre se realiza antes de los 40 años. En cambio, cuando la CIA se cierra en adultos de más de 40 años no se elimina por completo el riesgo de nuevas arritmias, lo cual podría explicarse por una menor regresión del tamaño auricular cuando el cierre se realiza en edades avanzadas17,18.
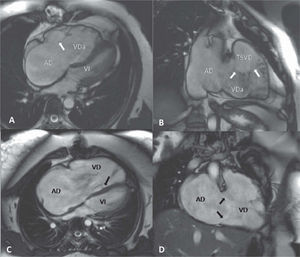
Anomalía de EbsteinLa anomalía de Ebstein abarca un amplio espectro de alteraciones de la válvula tricúspide y del VD. Se caracteriza por un desplazamiento apical de la inserción de los velos septal y posterior de la válvula tricúspide en el anillo auriculoventricular de más de 20mm y por una rotación apical y anterior del anillo funcional de la válvula tricúspide. El velo anterolateral tiene una inserción normal en la unión auriculoventricular, pero generalmente es redundante y puede tener cuerdas cortas y bandas musculares que lo sujetan a la pared libre del VD, lo que restringe su movimiento (fig. 1). Estas alteraciones anatómicas y funcionales causan principalmente insuficiencia tricuspíde y, en algunas ocasiones, estenosis tricuspídea. El VD se divide en: una porción de entrada o VD atrializado, que suele estar adelgazado y dilatado y forma parte funcional de la aurícula derecha, que también está dilatada, y el VD funcional, que está compuesto por la porción apical y el infundíbulo, que habitualmente está dilatado para poder acomodar el volumen diastólico aumentado, siendo en ocasiones aneurismático. La mitad de los pacientes con anomalía de Ebstein tienen una CIA o foramen oval permeable que, en caso de elevación de presiones de la aurícula derecha, puede tener un cortocircuito derecha-izquierda que es causa de cianosis y embolia paradójica. La presentación clínica depende del grado de distorsión de la válvula tricúspide y la insuficiencia valvular, el tamaño y la función del VD y la existencia de lesiones concomitantes como CIA, estenosis pulmonar o vías accesorias. En la adolescencia y la edad adulta, la anomalía de Ebstein suele diagnosticarse por la presencia de un soplo o aparición de arritmias. Los pacientes con mínima alteración hemodinámica habitualmente están asintomáticos y el pronóstico a largo plazo suele ser bueno. En pacientes con insuficiencia tricuspídea severa, los síntomas más frecuentes son intolerancia al ejercicio, disnea, fatiga, arritmias e insuficiencia cardiaca derecha19.
Resonancia magnética cardiaca, secuencia gradiente eco. Plano de cuatro cámaras (A y C) y oblicuo sagital de VD (B y D) en protosístole. A: anomalía de Ebstein de la válvula tricúspide; velo anterolateral (flecha) insertado en el anillo auriculoventricular, con bandas musculares que lo anclan a la pared libre del VD; el velo septal se encuentra totalmente adherido al septo interventricular. B: el mismo paciente, con desplazamiento rotacional de la válvula tricúspide hacia el TSVD (flechas); el plano de cierre valvular está situado en un plano horizontal y se visualiza el chorro de insuficiencia tricuspídea. C: desplazamiento de la inserción del velo septal (flecha) con flujo turbulento de baja velocidad de insuficiencia tricuspídea. D: en el mismo paciente, inserción normal de velo anterolateral y velo posterior (flechas). AD: aurícula derecha; TSVD: tracto de salida del VD; VDa: ventrículo derecho atrializado; VI: ventrículo izquierdo.
La intervención quirúrgica está indicada si hay síntomas de insuficiencia cardiaca, empeoramiento de la capacidad funcional, dilatación progresiva del VD, disfunción del VD, cianosis y embolia paradójica. La válvula debería ser reparada siempre que sea posible. En caso contrario, se realizaría una sustitución valvular por una prótesis, preferiblemente biológica. Frecuentemente se asocia también una auriculoplastia reductora. En pacientes con disfunción ventricular severa o en presencia de un VD funcional reducido a la porción infundibular incapaz de asumir la totalidad del retorno venoso sistémico, debería considerarse una reparación ventricular «uno y medio», que combina la intervención valvular con una anastomosis cavopulmonar bidireccional. En pacientes con disfunción severa del VI habría que valorar el trasplante cardiaco.
Tetralogía de Fallot reparadaLa insuficiencia pulmonar severa es frecuente en pacientes con tetralogía de Fallot reparada. La insuficiencia pulmonar produce dilatación y disfunción del VD y se asocia con reducción de la tolerancia al ejercicio, arritmias auriculares y ventriculares y muerte súbita.
Hay controversia respecto al momento óptimo en el que reemplazar la válvula pulmonar, ya que es posible que haya que reintervenir al paciente en el futuro por disfunción del homoinjerto o prótesis biológica. La dilatación severa del VD, sobre todo cuando es progresiva, es indicación de recambio valvular pulmonar, que debería realizarse antes de que se produzca disfunción sistólica. Después del reemplazo valvular pulmonar, los volúmenes del VD disminuyen y no se ha encontrado un límite por encima del cual los volúmenes del VD no se reduzcan tras la cirugía. En cambio, no se produce una normalización de volúmenes del VD cuando el volumen telediastólico indexado es20 > 160ml/m2 o el volumen telesistólico indexado es > 82ml/m2.
El TSVD en muchos pacientes con tetralogía de Fallot presenta áreas acinéticas que tienen impacto en la función sistólica del VD independientemente del tamaño ventricular y del grado de insuficiencia pulmonar y pueden ser un sustrato arritmogénico21,22. Hay controversia respecto a cómo medir la extensión de las regiones acinéticas, ya que cuando son importantes pueden contribuir a sobrestimar los volúmenes telesistólicos y enmascarar así cambios en el cuerpo del VD, los cuales pueden tener mayor importancia. La presencia de regiones acinéticas en el TSVD tiene implicaciones terapéuticas a la hora del reemplazo valvular pulmonar, ya que será necesario realizar una cirugía remodeladora extensiva con exclusión de los segmentos acinéticos para que se produzca una óptima recuperación del VD.
La RMC con realce tardío con gadolinio con frecuencia permite detectar áreas de fibrosis miocárdica, principalmente a nivel del TSVD y del parche de cierre de la CIV, pero también en el punto de inserción inferior del VD y en el miocardio trabecular. La presencia de realce tardío se relacionó con disfunción ventricular, intolerancia al ejercicio, activación neurohormonal y arritmias14.
En algunos pacientes el VD presenta una fisiología restrictiva, definida por un flujo telediastólico anterógrado pulmonar que coincide con la sístole auricular. Habitualmente se presenta en ventrículos hipertróficos poco distensibles y con presiones de arteria pulmonar bajas. A largo plazo, la presencia de fisiología restrictiva se asocia con un VD de menor tamaño, intervalo QRS más corto y mejor tolerancia al ejercicio23.
Estenosis del tracto de salida del ventrículo derechoLa estenosis valvular pulmonar es la causa más frecuente de estenosis del TSVD, aunque la obstrucción puede producirse también a nivel supravalvular o infundibular, como en la tetralogía de Fallot. El VD de doble cámara es una forma de obstrucción subinfundibular en el que una hipertrofia muscular excesiva de la trabécula septoparietal y la banda moderadora dividen el VD en una cámara proximal de alta presión hipertrófica y una cámara distal infundibular de baja presión con pared de grosor normal. La hipertrofia muscular excesiva suele desarrollarse como consecuencia de una CIV restrictiva.
En la estenosis del TSVD se produce sobrecarga de presión del VD. El VD se hipertrofia de forma proporcional al grado de obstrucción y, aunque los síntomas son infrecuentes durante la infancia y la adolescencia, a largo plazo pueden producirse dilatación y disfunción ventricular e insuficiencia tricuspídea. La intolerancia al ejercicio es consecuencia de la imposibilidad de aumentar el gasto cardiaco pulmonar. La fisiología restrictiva del VD es frecuente en pacientes con estenosis valvular pulmonar. Su presencia se relaciona con una peor función longitudinal del VD y una reducción de la tolerancia al ejercicio24.
VENTRÍCULO DERECHO SISTÉMICOCirugía de intercambio auricular (Mustard o Senning)La TGA presenta una altísima mortalidad durante los primeros años de vida si no se realiza cirugía de intercambio a nivel auricular (técnica de Mustard o Senning) o arterial. La cirugía de intercambio arterial es, desde hace años, la técnica quirúrgica de elección si la anatomía es favorable. Sin embargo, en la actualidad, muchos adultos con TGA habrán sido sometidos durante la infancia a cirugía de intercambio auricular. En esta intervención la sangre venosa sistémica es redirigida mediante conductos a nivel auricular hacia la válvula mitral y el VI, situado en posición subpulmonar, y el retorno venoso pulmonar es redirigido hacia la válvula tricúspide y el VD, que sigue soportando la circulación sistémica. Esta intervención presenta complicaciones a largo plazo, como la obstrucción y la dehiscencia de los conductos venosos, obstrucción subpulmonar por compresión del VI por el VD dilatado, disfunción del VD y arritmias.
El VD habitualmente se hipertrofia y tolera bien la presión sistémica con un funcionamiento normal a corto y medio plazo. Sin embargo, a largo plazo se puede producir dilatación y deterioro progresivo de la función del VD, con aparición de insuficiencia tricuspídea secundaria a dilatación del anillo en un alto porcentaje de pacientes. La disfunción sistólica del VD es determinante del pronóstico de estos pacientes y de la aparición de síntomas de insuficiencia cardiaca, intolerancia a ejercicio, arritmias y mortalidad.
La etiología de la disfunción ventricular no está clara. La presencia de alteración de la reserva de flujo coronario, defectos de perfusión miocárdica y acortamiento longitudinal posteyectivo del VD con dobutamina indican isquemia miocárdica, probablemente secundaria a un desequilibrio entre el aporte y la demanda, ya que el VD hipertrófico está irrigado únicamente por la coronaria derecha25-27. Es frecuente que haya áreas de realce tardío en RMC con gadolinio, que representan fibrosis local. La extensión de estas áreas de fibrosis se correlaciona con el grado de disfunción sistólica y la edad del paciente, lo que indica que con el tiempo el VD se podría deteriorar tanto estructural como funcionalmente15.
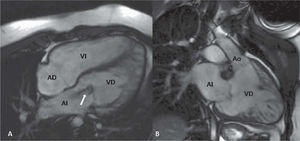
Transposición de grandes arterias congénitamente corregidaLa transposición de las grandes arterias congénitamente corregida (TGAcc) se caracteriza por una discordancia en las conexiones auriculoventricular y ventriculoarterial (fig. 2). La circulación está fisiológicamente corregida, pero el VD y la válvula tricúspide soportan la presión sistémica. Esta anomalía se asocia frecuentemente con otras lesiones como la CIV, la estenosis pulmonar o subpulmonar, la displasia o la anomalía tipo Ebstein de la válvula tricúspide y el bloqueo auriculoventricular completo.
Resonancia magnética cardiaca, secuencia gradiente eco. Transposición de grandes arterias congénitamente corregida. A: plano de cuatro cámaras en protosístole; las venas pulmonares drenan en la aurícula izquierda, que está conectada al VD; éste se reconoce por las trabeculaciones gruesas y por la inserción más apical de la válvula tricúspide, que presenta un chorro de insuficiencia moderada (flecha); el VI, que está en una posición más anterior, tiene trabeculaciones finas. B: plano oblicuo sagital del VD que muestra la conexión del VD con la aorta. AD: aurícula derecha; AI: aurícula izquierda; Ao: aorta; VD: ventrículo derecho; VI: ventrículo izquierdo.
La expectativa de vida en pacientes con TGAcc es reducida, con una alta mortalidad desde una edad precoz. La supervivencia a largo plazo es posible, pero suele darse en pacientes sin anomalías asociadas y que no han precisado intervención quirúrgica28,29. La disfunción sistólica del VD y la insuficiencia tricuspídea son los principales determinantes pronósticos en la TGAcc30. La interrelación entre la insuficiencia tricuspídea y la función ventricular, sin embargo, es compleja. Aunque hay controversia sobre si el VD sistémico puede soportar la circulación sistémica durante los años de vida de un adulto, la evidencia indica que en ausencia de lesiones asociadas la disfunción primaria del VD sistémico es poco habitual y en la mayoría de los casos la insuficiencia tricuspídea precede a la aparición de la disfunción ventricular. La válvula tricúspide suele ser morfológicamente anormal, lo que favorece que con el paso del tiempo se vaya produciendo progresivamente la insuficiencia valvular. La sobrecarga de volumen secundaria a la insuficiencia produce dilatación y disfunción sistólica del VD y dilatación del anillo, con empeoramiento del grado de insuficiencia valvular. La función de la válvula tricúspide también depende de las condiciones de carga de los ventrículos y de la geometría del septo interventricular. Las situaciones que aumentan el volumen del VD o reducen la presión del VI (p. ej., al liberar la obstrucción pulmonar) favorecen la aparición de insuficiencia tricuspídea por desplazamiento del septo hacia el VI. Al contrario, cuando el volumen del VD disminuye o la presión del VI aumenta (p. ej., tras cerclaje de la arteria pulmonar), el septo se desplaza hacia el VD y el grado de insuficiencia puede disminuir.
La válvula tricúspide no se suele poder reparar, por lo que en la mayoría de las ocasiones será necesario el reemplazo valvular. El VD sistémico parece tolerar la sobrecarga de volumen de la regurgitación de la válvula tricúspide peor que el VI tolera la insuficiencia mitral, por lo que se debe considerar la operación ante los primeros datos de progresión de los síntomas o evidencia de deterioro ventricular progresivo. La fracción de eyección preoperatoria del VD se correlaciona con la supervivencia tras la cirugía de la válvula tricúspide, con un peor pronóstico si el recambio valvular se realiza cuando la fracción de eyección del VD es < 44%31. Por el contrario, cuando el recambio valvular se realiza con grados menores de disfunción ventricular, la clase funcional mejora y la función del ventrículo derecho se mantiene32. El pronóstico a largo plazo de pacientes que desarrollan insuficiencia tricuspídea tras la cirugía de reparación de otras lesiones también es peor. Los pacientes con insuficiencia tricuspídea más que leve, a los que no se había reemplazado la válvula durante cirugía reparadora de otras lesiones asociadas, tuvieron peores resultados, por lo que debería considerarse el recambio de la válvula tricúspide en pacientes con insuficiencia preoperatoria de al menos grado 2 sobre 433.
CONCLUSIONESEl VD frecuentemente está implicado en las cardiopatías congénitas. El VD puede estar situado en posición subpulmonar o sistémica, y su función es un factor determinante del pronóstico. La ecocardiografía y la RMC son métodos diagnósticos que, de forma combinada, permiten la valoración del tamaño y la función ventriculares y tienen una gran relevancia en el manejo de los pacientes.