A pesar de los progresos en el tratamiento médico y quirúrgico de las cardiopatías congénitas en la infancia, aproximadamente un 5% de los adultos sufre desaturación crónica de oxígeno en sangre arterial causada por un cortocircuito derecha a izquierda. El síndrome hipoxémico crónico representa una verdadera enfermedad multisistémica que afecta a la viscosidad de la sangre, los órganos hematopoyéticos, el sistema de coagulación, la dinámica respiratoria, la fisiología del ejercicio, el sistema nervioso central, la función renal, el metabolismo del ácido úrico, la función endotelial, la circulación coronaria, los mecanismos de infección, la secreción biliar de bilirrubina, el aparato locomotor o la neoformación de tumores neuroendocrinos. Son pacientes con alto riesgo cuando acuden a los servicios de urgencias, ingresan en un hospital, tienen que ser intervenidos quirúrgicamente o se presentan con un embarazo. El manejo de estos pacientes precisa un abordaje multidisciplinario y debe ser individualizado, pero el médico debe tener presente el principio clásico de primum non nocere y evitar provocaciones en el débil equilibrio de una fisiología difícilmente balanceada.
Palabras clave
La cianosis es una coloración azulada de la piel y las mucosas que aparece cuando la hemoglobina reducida en territorio capilar es > 5g/dl. La cianosis periférica se produce por aumento de la extracción de O2 en los tejidos. La cianosis central depende de la disminución de la saturación de O2 en sangre arterial (hipoxemia). La hipoxemia puede ser de causa ambiental (gran altitud), hipoventilación alveolar, alteración de la difusión alveolocapilar, desajuste en la ventilación/perfusión o cortocircuito anatómico. La hipoxemia es causa de hipoxia tisular, pero la hipoxemia no implica que haya hipoxia ni la hipoxia implica necesariamente hipoxemia. Las principales causas de hipoxia están resumidas en la tabla 1.
Causas de hipoxia tisular
| Estasis circulatoria | Obstrucción vascular |
| Vasoconstricción arterial | |
| Disminución del gasto cardiaco | |
| Cortocircuito arteriovenoso | |
| Disminución del contenido de O2 en sangre arterial | Anemia |
| Metahemoglobinemia | |
| Carboxihemoglobinemia | |
| Aumento de la afinidad del O2 por la hemoglobina | Hipotermia |
| Alcalosis | |
| Disminución del 2,3 DPG | |
| Hipoxia histotóxica | Envenenamiento por cianuro |
| Hipoxemia | Gran altitud |
| Hipoventilación alveolar | |
| Alteración en la difusión | |
| Desajuste ventilación/perfusión | |
| Cortocircuito anatómico |
Este capítulo aborda el tema de la hipoxemia crónica que resulta de la mezcla de sangre venosa causada por un cortocircuito derecha a izquierda a nivel auricular, ventricular o vascular, que habitualmente se manifiestan por cianosis central. La cianosis central aparece tanto en la piel como en las mucosas y se manifiesta habitualmente cuando la saturación arterial de O2 es < 85%, pero depende del color y el grosor de la piel, el estado de los capilares cutáneos y la concentración de hemoglobina. Si la concentración de hemoglobina disminuye, puede no haber cianosis a pesar de hipoxemia extrema. Por el contrario, si la concentración de hemoglobina aumenta, la cianosis es más intensa a pesar de la disminución de la hipoxia tisular.
CARDIOPATÍAS CIANÓTICAS EN EL NIÑO Y EN EL ADULTOLas cardiopatías congénitas cianóticas (CCC) comprenden un heterogéneo grupo de lesiones con diferentes anatomía y fisiopatología. Aunque el mecanismo de la hipoxemia sea idéntico, el espectro de CCC es muy diferente en el niño que en el adulto. Las CCC más frecuentes en el recién nacido están recogidas en la tabla 2. En general son malformaciones muy graves que no sobreviven hasta la vida adulta sin corrección quirúrgica. En el adulto los principales grupos de CCC son el síndrome de Eisenmenger y las cardiopatías congénitas graves no corregidas con obstrucción en la vía de salida derecha (tabla 3). Existe un tercer grupo de pacientes sin hipertensión pulmonar o estenosis de la vía de salida derecha que tienen un cortocircuito derecha a izquierda a nivel auricular. La anomalía de Ebstein de la válvula tricúspide asociada a CIA o distensión del foramen oval es el principal exponente del grupo. En el cuarto grupo de CCC del adulto, el cortocircuito tiene habitualmente un origen extracardiaco en relación con la cirugía de Fontan o con las fístulas arteriovenosas pulmonares.
Cardiopatías congénitas cianóticas en el adulto
| Grupo | n (%) |
| Síndrome de Eisenmenger | 52 (33) |
| Cardiopatías simples | 16 |
| Cardiopatías complejas | 36 |
| Situación de Fallot | 82 (53) |
| Atresia pulmonar con CIV | 15 |
| Atresia tricuspídea | 10 |
| Ventrículo único | 23 |
| Heterotaxia | 8 |
| Transposiciones complejas | 6 |
| Transposición corregida | 10 |
| Tetralogía de Fallot | 7 |
| Otras anomalías complejas | 3 |
| Cortocircuito interauricular | 16 (10) |
| Anomalía de Ebstein | 8 |
| Aurícula única | 1 |
| CIA o FOP con cortocircuito D-I | 4 |
| Drenaje de vena cava en aurícula izquierda | 2 |
| Síndrome de platipnea-ortodeoxia | 1 |
| Fístulas vasculares | 6 (4) |
| Cirugía de Fontan | 5 |
| Síndrome de Rendu-Weber-Osler | 1 |
| Total | 156 |
Datos no publicados, recogidos de la serie de cardiopatías congénitas del adulto del Hospital La Paz.
No hay datos fiables de prevalencia de CCC en el adulto. Los datos varían dependiendo de la selección de la serie y de los criterios de definición. Habitualmente se incluyen como CCC a los pacientes con un cortocircuito congénito que tienen saturación arterial de O2 < 90% en condiciones basales y respirando aire ambiente. Utilizando esta definición, Dimopoulos et al1 encontraron un 17% de CCC entre 1.102 adultos consecutivos con CC. De un total de 187 pacientes cianóticos, el 45% tenía fisiología de Eisenmenger; el 30%, una cardiopatía compleja en situación Fallot; el 10%, cirugía de Fontan, y el 2%, anomalía de Ebstein o transposición congénitamente corregida. El resto se repartía entre diversas cardiopatías, todas ellas con una incidencia menor del 2% de los casos.
En la serie del Hospital La Paz (tabla 3), la prevalencia de las CCC en adultos es mucho más baja. Entre 3.118 adultos con cardiopatías congénitas, hemos encontrado a 156 pacientes con cianosis (5%). El 33% de los casos presenta un síndrome de Eisenmenger; el 53%, CC complejas en situación Fallot, y destacan los pacientes con fisiología univentricular o con atresia pulmonar y CIV; el 10% tiene un cortocircuito derecha-izquierda interauricular, asociado principalmente a anomalía de Ebstein de la válvula tricúspide, y en el 4% restante, la cianosis está producida por fístulas arteriovenosas pulmonares o por circulación colateral en pacientes operados con técnica de Fontan.
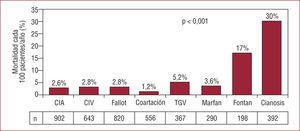
Aunque su prevalencia sea relativamente baja, la morbimortalidad de los adultos con CCC es la más elevada de todas las CC. En el Euro Heart Survey on Adult Congenital Heart Disease, la incidencia de muerte de los pacientes con CCC fue 30/1.000 pacientes-año, comparado con 17/1.000 pacientes/año en el grupo con cirugía de Fontan y de 1-5/1.000 pacientes/año en el resto de los grupos diagnósticos (fig. 1). A los 5 años de seguimiento, el 14% de los adultos con CCC habían fallecido, comparado con una mortalidad del 8% en los pacientes con cirugía de Fontan, el 2,5% en la transposición de grandes arterias y el 1% en el resto. Más aún, el 82% de los casos habían fallecido de causa cardiovascular y las incidencias de complicaciones hemorrágicas y accidentes cerebrovasculares fueron las más elevadas de todos los grupos diagnósticos2. Las elevadas morbilidad y mortalidad de los pacientes con CCC han aconsejado su inclusión en el nivel 1 asistencial, con seguimiento permanente en unidades clínicas especializadas.
Mortalidad cada 1.000 pacientes/ año entre 4.168 adultos con cardiopatía congénita seguidos durante 5 años en el Euro Heart Survey on Adult Congenital Heart Disease2. CIA: comunicación interauricular; CIV: comunicación interventricular; n: número de casos en cada grupo diagnóstico; TGV: transposición de grandes vasos.
La capacidad de esfuerzo está disminuida en la mayoría de los adultos con CC, aun en aquellos que se consideran a sí mismos asintomáticos, en un grado similar al de los pacientes con insuficiencia cardiaca de etiología adquirida. Diller et al3 han demostrado que la disminución de la capacidad de ejercicio, valorada objetivamente por el consumo máximo de O2, se correlaciona con el riesgo de muerte y la necesidad de hospitalización en estos pacientes. Los principales factores que determinan la disminución de la capacidad de esfuerzo son la respuesta cronotrópica, la función pulmonar, la hipertensión pulmonar y la cianosis. En la serie de Diller, la mayor limitación funcional correspondía a los pacientes con CCC, con o sin fisiología Eisenmenger. Los valores promedio del consumo de O2 pico en estos pacientes estaban en intervalos similares a los de los pacientes con insuficiencia cardiaca grave con indicación de trasplante cardiaco3.
La limitación al esfuerzo de los pacientes cianóticos está relacionada con la alteración de la dinámica respiratoria al ejercicio4. El equivalente ventilatorio, expresado como el volumen ventilatorio por unidad de CO2 producido por el ejercicio (VE/ VCO2), es el principal determinante de la dinámica respiratoria. La relación VE/VCO2 está muy elevada en los pacientes con CCC y el grado de hipoxemia es el estímulo que mejor se correlaciona con el exceso del coste ventilatorio para aclarar la producción metabólica de CO2. En los sujetos normales la saturación arterial de O2 se mantiene durante toda la fase del ejercicio, pero en los pacientes con CCC la saturación de O2 cae estrepitosamente durante el esfuerzo, y fácilmente llega a niveles de hipoxemia extrema. En el paciente cianótico el incremento del consumo de O2 se produce muy lentamente utilizando pronto la vía anaeróbica. La producción de CO2 se incrementa también lentamente, mientras que se produce un incremento rápido e intenso del volumen ventilatorio.
El ejercicio produce una disminución de la resistencia vascular sistémica y de la saturación de O2 en sangre venosa, con aumento de la producción de CO2. Como consecuencia, el cortocircuito derechaizquierda se incrementa y el flujo pulmonar efectivo disminuye, la saturación arterial de O2 cae y se produce acidosis por incremento de la pCO2. Las consecuencias son mayor hipoxemia, hipercapnia y acidosis, que estimulan los quimiorreceptores, y se produce una respuesta hiperventilatoria. La disminución del flujo pulmonar aumenta el espacio muerto, altera la relación ventilación/perfusión (mismatch) y contribuye también a la hiperventilación. Esta respuesta hiperventilatoria desproporcionada al incremento del consumo de oxígeno y del gasto cardiaco efectivo se manifiesta clínicamente como disnea intensa.
COMPLICACIONES HEMATOLÓGICASEl principal hallazgo hematológico en este grupo de pacientes es el incremento de la concentración de hemoglobina y del hematocrito. Se trata de una eritrocitosis secundaria debida a estimulación de la eritropoyetina renal. Aunque los mecanismos últimos aún no están aclarados, la hipoxemia es el principal estímulo hiperproductor de eritropoyetina en el aparato yuxtaglomerular. La eritropoyetina estimula la eritropoyesis en la médula ósea y el aumento de los eritrocitos en sangre periférica. Hay gran diferencia entre eritrocitosis y poliglobulia. En la poliglobulia vera todos los componentes celulares de la sangre están aumentados, mientras que en la eritrocitosis sólo hay incremento de los glóbulos rojos. La eritrocitosis secundaria es una respuesta fisiológica y beneficiosa necesaria para mejorar el aporte de O2 a los tejidos y disminuir la hipoxia tisular, pero se ha relacionado con el aumento de las complicaciones trombóticas que presentan los pacientes con CCC. De hecho, el aumento de los glóbulos rojos condiciona un incremento de la viscosidad sanguínea que puede causar enlentecimiento del flujo, estasis y bloqueo de la circulación capilar. Los pacientes con marcada eritrocitosis pueden manifestar síntomas de hiperviscosidad (tabla 4), pero estos síntomas rara vez aparecen hasta que el hematocrito es > 65% y están más relacionados con el aumento progresivo que con los niveles en sí. Hablamos de eritrocitosis compensada cuando los valores del hematocrito permanecen estables, aún por encima del 70%, y de eritrocitosis descompensada cuando son inestables y el hematocrito aumenta progresivamente. Los pacientes con eritrocitosis compensada rara vez presentan síntomas de hiperviscosidad, pero estos síntomas son frecuentes en pacientes con eritrocitosis descompensada.
Los síntomas de la tabla 4 son bastante inespecíficos y también pueden estar relacionados con deshidratación, hipovolemia o ferropenia. La pérdida de líquidos por sudoración excesiva, vómitos, diarreas, disminución de la ingesta o las intervenciones quirúrgicas llevan a una mayor concentración de glóbulos rojos y mayor viscosidad sanguínea. Las sangrías terapéuticas disminuyen el hematocrito y pueden mejorar los síntomas de hiperviscosidad, pero no se ha demostrado que disminuyan la incidencia de complicaciones trombóticas, especialmente los accidentes cerebrovasculares (ACV). Antes bien, diferentes estudios han demostrado una mayor incidencia de accidentes vasculares trombóticos en CC con el uso excesivo de sangrías terapéuticas.
Las sangrías provocan una disminución brusca de la volemia y una importante depleción de los depósitos de hierro, que está principalmente unido a la hemoglobina sérica. La ferropenia condiciona una modificación de los hematíes, que pierden su morfología normal y se transforman en microesferocitos. Mucho se ha especulado sobre el aumento de la viscosidad sanguínea producido por la ferropenia, pero estudios recientes han mostrado que la pérdida de hierro se relaciona con valores de hematocrito más bajos y menor viscosidad de la sangre5. Sin embargo, la esferocitosis condiciona mayor dificultad de paso de los glóbulos rojos a través del lecho capilar y se relaciona con más síntomas de hiperviscosidad aunque la viscosidad real esté disminuida.
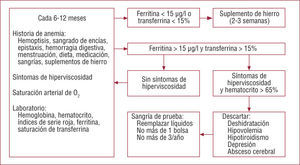
El manejo hematológico de los pacientes con CCC es delicado (fig. 2)6. Todos los pacientes con eritrocitosis deben ser evaluados cada 6 o 12 meses. Es necesario realizar una historia cuidadosa de anemia y fenómenos hemorrágicos y evaluar los posibles síntomas de hiperviscosidad. Se debe determinar la saturación arterial de O2 y realizar un control hematológico que incluya el metabolismo del hierro. Si hay depleción férrica (ferritina sérica < 15μg/l o índice de saturación de transferrina < 15%), se debe administrar cuidadosamente suplemento oral de hierro con control hematológico en 2-3 semanas para evitar fenómenos de rebote. Si no hay depleción de depósitos de hierro ni síntomas de hiperviscosidad, el paciente deberá ser reevaluado en 6 a 12 meses, independientemente del hematocrito. Si hay síntomas que indiquen hiperviscosidad, hay que descartar otras situaciones que puedan provocarlos como deshidratación, hipovolemia, hipotiroidismo, depresión o absceso cerebral. Una vez descartados estos procesos, si el hematocrito es > 65%, se realiza una sangría de prueba. La sangría no debe ser > 400-500ml y debe ir acompañada de reemplazo isovolumétrico de suero salino para evitar la hipovolemia. Si los síntomas mejoran, la sangría podrá repetirse, pero nunca más de tres veces al año7,8.
DIÁTESIS HEMORRÁGICALos pacientes con CCC presentan también frecuentes complicaciones hemorrágicas. La mayoría de las veces son hemorragias menores (gingivorragia, epistaxis, equimosis, metrorragia), pero también aparecen hemorragias graves (cerebral, gastrointestinal o pulmonar). La hemoptisis por hemorragia intrapulmonar es la complicación hemorrágica grave más frecuente, sobre todo en pacientes con síndrome de Eisenmenger, y tiene una mortalidad elevada. Estos pacientes están expuestos a complicaciones hemorrágicas graves en caso de accidente, intervención quirúrgica o durante el parto.
La diátesis hemorrágica puede estar relacionada con trombocitopenia. La trombocitopenia (< 130.000/ml) fue el principal factor predictivo de mortalidad a largo plazo en 253 adultos con CCC en el Japanese Multi-Center Study9. La causa principal de la trombocitopenia no ha sido dilucidada hasta recientemente. Las plaquetas circulantes en sangre periférica se forman por fragmentación de los megacariocitos producidos en la médula ósea. Esta fragmentación se realiza en el lecho vascular pulmonar, pero en los pacientes con cortocircuito derecha-izquierda, parte del flujo sanguíneo venoso pasa directamente a la circulación arterial sin pasar por los pulmones. En las CCC hay aumento de los megacariocitos en sangre periférica y disminución del número de plaquetas inversamente proporcionales al hematocrito y la magnitud del cortocircuito10.
No sólo hay disminución del número de plaquetas, sino que la función de las plaquetas existentes también puede estar alterada. También se ha detectado un déficit de factores de coagulación dependientes de la vitamina K (II, VII, IX, X) y del factor V, un aumento de la actividad fibrinolítica y un déficit del factor de von Willebrand11,12. Los estudios de coagulación frecuentemente están alterados, pero puede ser por un problema de método. En pacientes con hematocrito elevado, la cantidad de anticoagulante añadido a la muestra (citrato) debe ser ajustada al valor del hematocrito. La cantidad de anticoagulante añadido por mililitro de sangre se puede calcular por la siguiente fórmula12: 100 – hematocrito / 595 – hematocrito.
EVENTOS TROMBOEMBÓLICOSParadójicamente, los adultos con CCC muestran también mayor incidencia de complicaciones tromboembólicas, especialmente ACV13. Aunque la incidencia de ACV trombóticos es mucho más baja en adultos que en niños con CCC o en pacientes con policitemia vera14, datos del Euro Heart Survey on Adult Congenital Heart Disease muestran que al menos el 10% de los adultos con CCC sufren eventos tromboembólicos cerebrales2. Sin duda, las complicaciones tromboembólicas tienen un origen multifactorial. La posibilidad de una embolia paradójica es consustancial a cualquier cortocircuito derecha-izquierda. La incidencia de arritmias auriculares es alta en estos pacientes y pueden ser fuente embólica auricular. Los dispositivos intravasculares (catéteres, marcapasos, desfibriladores automáticos implantables [DAI]) pueden originar desprendimientos de trombos que circulen hacia el lado arterial. En general, son pacientes sedentarios con mala circulación venosa periférica donde pueden producirse también trombos que migren hacia el lado arterial. La administración de sueros o fármacos intravenosos sin utilizar filtros adecuados puede producir embolia aérea o de otras partículas que atraviesen directamente el corazón. No se pueden descartar factores reológicos dependientes de la eritrocitosis, la viscosidad sanguínea, la ferropenia o la hipoxia tisular como causa de trombosis intravascular.
Hasta el 20% de los pacientes con síndrome de Eisenmenger presentan trombosis de arterias pulmonares proximales15. Los trombos pulmonares tienen un origen in situ, pero se pueden desprender o migrar a la periferia y dar lugar a embolias o infartos pulmonares que comprometen aún más la circulación arterial pulmonar. Un infarto pulmonar puede causar hemoptisis, lo que da lugar a un dilema terapéutico, dar o no dar anticoagulantes. La causa más frecuente de hemoptisis grave en estos pacientes es la rotura vascular debido a la hipertensión pulmonar o a las anastomosis broncopulmonares, por lo que nosotros no somos partidarios de administrar anticoagulantes salvo que se demuestre la existencia de una embolia o infarto pulmonar. En general, las indicaciones de anticoagulación son similares a otras enfermedades cardiovasculares: flutter-fibrilación auricular, fenómenos tromboembólicos recurrentes en ausencia de deshidratación o déficit de hierro y en aquellos que portan material protésico o un catéter o electrodo intravascular. Cuando se administran anticoagulantes, deben extremarse las precauciones en aras de evitar las complicaciones hemorrágicas y el INR se debe mantener por debajo de 2,5.
FUNCIÓN RENAL Y METABOLISMO DEL ÁCIDO ÚRICOEn los pacientes con CCC se producen cambios anatómicos, estructurales y funcionales en el parénquima renal. Estudios histológicos muestran glomérulos congestivos, hipercelulares, con engrosamiento de la membrana basal, incremento de la matriz mesangial y esclerosis segmentaria16. La hiperviscosidad aumenta la resistencia en la arteriola glomerular eferente, la presión hidráulica a través del glomérulo y la fracción de filtración, lo que condiciona un aumento de la presión oncótica en los vasos posglomerulares que perfunden el túbulo proximal y promueve la reabsorción de líquidos y solutos17. Los hallazgos funcionales incluyen proteinuria, aumento del flujo sanguíneo y resistencia vascular del riñón, disminución del flujo plasmático renal y de la fracción de filtración glomerular e incremento de la reabsorción tubular de ácido úrico. También hay una marcada vasodilatación de las arteriolas aferentes y eferentes glomerulares, relacionada con incremento de óxido nítrico local (véase más adelante) y puede ser la causa principal del incremento en la proteinuria18. La hipercelularidad y el incremento en la matriz mesangial se han puesto en relación con el aumento de los megacariocitos circulantes y se manifiesta por un marcado incremento de la ecogenidad de los riñones cuando se estudian con ultrasonidos18. La etiología de la esclerosis glomerular está relacionada con la isquemia y es la causa principal del deterioro de la función renal.
Recientemente, Dimopoulos et al1 han puesto de manifiesto que el deterioro de la función renal está correlacionado con un incremento de la mortalidad precoz en adultos con CC y que la incidencia de insuficiencia renal moderada-grave es el doble en pacientes cianóticos que en los no cianóticos. Los medicamentos que afectan a la función renal, como inhibidores de la enzima de conversión de angiotensina (IECA), diuréticos, antiinflamatorios no esteroideos, y algunos antibióticos deben ser manejados con precaución y monitorización adecuada. Se debe maximizar el estado de hidratación y el uso de estrategias protectoras de la función renal como la administración de N-acetilcisteína o bicarbonato antes de realizar un cateterismo cardiaco o angiografía con contraste19. La hiperuricemia secundaria sirve como un marcador de la hemodinámica renal anormal en adultos con CCC. Está relacionada con el aumento de la reabsorción tubular de ácido úrico (disminución de la excreción), y no con la hiperproducción de uratos.
DISFUNCIÓN ENDOTELIAL Y CIRCULACIÓN CORONARIAOechslin et al han mostrado que los pacientes con CCC presentan una marcada disfunción endotelial cuando se realiza un test de hiperemia con dosis creciente de acetilcolina20. La falta de respuesta vasodilatadora está en relación con el agotamiento de la capacidad de producción de óxido nítrico por las células endoteliales. La producción de óxido nítrico depende del estrés tangencial que el flujo de sangre genera en la superficie vascular, y este estrés depende de la viscosidad y del paquete celular. La hiperviscosidad característica de estos pacientes causa una mayor producción de óxido nítrico y una respuesta vasodilatadora máxima que no puede ser aumentada por estímulos adicionales21. Esto se puede observar fácilmente en la microcirculación coronaria. Los pacientes con hipoxemia crónica presentan un marcado aumento del tamaño de las arteriolas terminales y de la densidad de vasos de pequeño calibre en el músculo cardiaco22. Más aún, estudios anatomopatológicos muestran que las arterias coronarias proximales de los pacientes con CCC están dilatadas, ectásicas y tortuosas. El estudio histológico muestra rotura de la lámina elástica interna, incremento de colágeno en la capa media, hiperplasia fibrointimal e incremento de la matriz extracelular. Las alteraciones ectásicas de las arterias coronarias y la falta de respuesta vasodilatadora a los estímulos hiperhémicos pueden ser causa de angina o infarto de miocardio23. La causa principal de la ectasia coronaria es la aterosclerosis, pero los pacientes con CCC no presentan signos de aterosclerosis y la incidencia de cardiopatía isquémica clínica es baja a pesar de la evidencia de disfunción endotelial y la mayor incidencia de complicaciones trombóticas que presentan estos pacientes. La baja incidencia de aterosclerosis coronaria y de cardiopatía isquémica puede estar relacionada con el metabolismo del colesterol. Hasta el 60% de los pacientes con CCC presentan hipocolesterolemia, con colesterol total < 160mg/l. La causa de la hipocolesterolemia no se conoce, pero no parece relacionada con la hipoxemia en sí, ya que es igualmente prevalente en pacientes con CCC operados24.
COMPLICACIONES INFECCIOSASLos pacientes con CCC tienen también una incidencia elevada de complicaciones infecciosas. Tienen una susceptibilidad elevada a las infecciones respiratorias de origen tanto viral como bacteriano. El virus de la gripe puede producir estragos en esta población y todos los pacientes deben recibir vacuna antigripal cada año. El neumococo es el principal germen causal de las infecciones neumónicas, y los pacientes con CCC deben ser vacunados también y recibir una vacuna de refuerzo antineumocócica cada 5 años. Es muy frecuente el acné cutáneo intenso, que se debe tratar precozmente para evitar infecciones secundarias y puerta de entrada de endocarditis.
Una grave complicación infecciosa frecuente en estos pacientes es el absceso cerebral25. La clínica principal suele presentar cefaleas intensas que deben ser diferenciadas de los síntomas de hiperviscosidad. Otras veces se producen déficit neurológicos o crisis focales con manifestaciones clínicas diversas dependiendo de la localización y el tamaño. En la mayoría de los casos es necesaria la aspiración inmediata y repetida, guiada por la imagen de tomografía computarizada (TC), para reducir la hipertensión intracraneal y evitar la rotura intraventricular. La administración intratecal de antibióticos es obligatoria, ya que los abscesos están densamente encapsulados y son poco permeables al tratamiento antibiótico. Lo más importante es el diagnóstico precoz. A todo paciente con CCC que presente cefaleas desacostumbradas o fenómenos neurológicos focales, se le debe realizar una TC cerebral para descartar un absceso.
Otra complicación grave y frecuente es la endocarditis infecciosa. La mortalidad derivada de la endocarditis es muy elevada en estos pacientes y el diagnóstico puede ser más difícil que en otros casos. La gravedad y la frecuencia de la endocarditis en pacientes con CCC han hecho que este grupo sea el único sin cirugía o endocarditis previa que mantiene la indicación de profilaxis antibiótica en las nuevas guías clínicas26. Pero no es suficiente con la profilaxis antibiótica. Los pacientes con CCC deben mantener escrupulosa higiene dental y de la piel, tratar precozmente el acné cutáneo, evitar morderse las uñas y no entrar en la moda de los pearcings y tatuajes27.
PROBLEMAS OSTEOARTICULARESLos pacientes con CCC con frecuencia tienen malformaciones esqueléticas que pueden agravar sus síntomas. Especialmente grave es la asociación con cifoescoliosis magna. La deformidad esquelética causa insuficiencia ventilatoria restrictiva que puede contribuir a más hipoxemia e hipertensión pulmonar. La osteoartropatía hipertrófica se caracteriza por acropaquias, pero puede haber también neoformación de hueso perióstico y derrames sinoviales. La fisiopatología de esta enfermedad no se conoce bien, pero parece relacionada también con la función plaquetaria. Los grandes megacariocitos impactan en el lecho vascular periférico y dan lugar a la liberación de factor de crecimiento plaquetario y TGFβ, provocando la proliferación de tejido conjuntivo y periostio10.
Como se ha dicho antes, la hiperuricemia es un hallazgo analítico habitual en pacientes con CCC. La incidencia de artritis gotosa es más baja que en la gota hereditaria con equivalente elevación de ácido úrico. Rara vez se acompaña de depósitos de tofos y virtualmente nunca de nefropatía gotosa, por lo que no precisa tratamiento en ausencia de síntomas. Sin embargo, los pacientes que presentan síntomas articulares relacionados con la hiperuricemia pueden ser tratados con colchicina, uricosúricos (probenecid) o alopurinol.
CINÉTICA DE LA BILIRRUBINALa eritrocitosis da lugar a un incremento del paquete de células rojas y del catabolismo del grupo «hemo». Habitualmente hay un incremento de la bilirrubina no conjugada y de la eliminación biliar de bilirrubina. La formación de cálculos biliares está aumentada y con frecuencia se presentan síntomas de colelitiasis y colecistitis. La enfermedad biliar es una de las causas principales de indicación de cirugía no cardiaca en esta población, pero los riesgos de la intervención quirúrgica pueden ser mucho más elevados que en la población general.
TUMORES NEUROENDOCRINOSSe han publicado numerosos casos de tumores neuroblásticos periféricos, como feocromocitomas, neuroblastomas, ganglioneuromas y paragangliomas en pacientes con CCC28. En nuestra serie hemos encontrado 4 casos de tumores de origen neuroblástico, entre ellos 2 feocromocitomas, 1 paraganglioma y 1 quemodectoma, entre 156 adultos con CCC, lo que implica una prevalencia del 2,5%, cuando la frecuencia esperada es del 0,1%. En una revisión de las autopsias del Johns Hopkins Hospital, se encontró una asociación altamente significativa (p < 0,001) entre estos tumores y las CCC29. El mecanismo puede estar relacionado con la hipoxemia crónica y los mecanismos que gobiernan la eritropoyesis. En cualquier caso, la aparición de tumores con actividad neuroendocrina puede alterar el débil equilibrio hemodinámico que presentan estos pacientes e incrementar la necesidad de intervenciones quirúrgicas de alto riesgo.
CIRUGÍA NO CARDIACALa anestesia y la cirugía no cardiaca en pacientes con CCC conllevan alto riesgo de eventos adversos perioperatorios, tanto en intervenciones urgentes como en las programadas, especialmente en el subgrupo con fisiología de Eisenmenger30. La intervención quirúrgica causa hipovolemia y pérdida de sangre. La anestesia produce vasodilatación arterial y depresión de la función miocárdica. Son frecuentes las arritmias supraventriculares, y el riesgo tromboembólico está incrementado. La diátesis hemorrágica que presentan los pacientes cianóticos incrementa los riesgos de sangrado quirúrgico, y la manipulación de vías venosas aumenta los riesgos de embolia aérea paradójica. La mortalidad de la cirugía no cardiaca es elevada en esta población, por lo que se debe evitarla tanto como sea posible. Hay que establecer una política de «no intervenir» salvo indicación absoluta, porque cualquier intervención conlleva el riesgo de desestabilizar una «fisiología balanceada».
Si la intervención quirúrgica no se puede evitar, debería controlarla un anestesista con conocimiento profundo de la especial fisiopatología de las CCC. Hay que anticiparse a los problemas, evitar la anestesia espinal y la vasodilatación excesiva, monitorizar en todo momento la presión arterial y la oximetría, optimizar el volumen plasmático y los flujos pulmonar y sistémico, mantener adecuada repleción de volumen plasmático, utilizar filtros de aire en las vías venosas y realizar sangría preoperatoria cuando el hematocrito sea > 65%, para disminuir los riesgos de sangrado19.
EMBARAZO Y ANTICONCEPCIÓNLos riesgos relacionados con el embarazo son muy importantes en esta población. En pacientes con síndrome de Eisenmenger la mortalidad materna es tan alta como el 30% y ocurre principalmente durante el periodo puerperal. Los pacientes con CCC sin fisiología de Eisenmenger también tienen un riesgo aumentado relacionado con el embarazo. La cianosis limita el crecimiento y el desarrollo del feto e incrementa el riesgo de insuficiencia cardiaca de la madre, parto prematuro, retraso del crecimiento intrauterino y aborto. La mortalidad materna y fetal está incrementada y se relaciona con el grado de hipoxemia31. La cianosis fue un factor de riesgo independiente de complicaciones durante el embarazo en la serie de Siu et al32 y fue el principal factor de riesgo independiente de complicaciones fetales. La anticoncepción tampoco está exenta de riesgos en esta población. Los anticonceptivos orales se asocian a riego elevado de complicaciones tromboembólicas, el DIU puede ser origen de un foco de sepsis y de endocarditis o abscesos cerebrales y la ligadura de trompas, como cualquier intervención, no está exenta de riesgos. En otro capítulo de esta monografía se describe una revisión exhaustiva de los riesgos del embarazo y los métodos anticonceptivos más eficaces en esta población.
UNA ENFERMEDAD MULTISISTÉMICAEn resumen, el síndrome hipoxémico crónico asociado a las CCC es una verdadera enfermedad multisistémica que afecta a los órganos hematopoyéticos, el sistema de coagulación, la dinámica respiratoria, la fisiología del ejercicio, el sistema nervioso central, la función renal, el metabolismo del ácido úrico, la función endotelial, la circulación coronaria, los mecanismos de infección, la secreción biliar de bilirrubina, el aparato locomotor o la neoformación de tumores neuroendocrinos (tabla 5).
Cardiopatías congénitas cianóticas: una enfermedad multisistémica
| Problemas hematológicos | Eritrocitosis secundaria y síndrome de hiperviscosidad |
| Hemostasia | Trombocitopenia y función plaquetaria alterada |
| Déficit de factores de la coagulación | |
| Función renal | Función glomerular alterada |
| Concentraciones de creatinina aumentadas | |
| Aclaramiento anormal del ácido úrico | |
| Infecciones | Acné (fuente potencial de bacteriemia) |
| Infecciones respiratorias | |
| Endocarditis infecciosa | |
| Abscesos cerebrales | |
| Sistema nervioso central | Síndrome de hiperviscosidad |
| Trombosis y hemorragia cerebral | |
| Afección de otros sistemas | Hiperventilación alveolar y dinámica respiratoria alterada |
| Acropaquias y osteoartropatía hipertrófica | |
| Disfunción endotelial, hiperemia y vasodilatación inapropiada | |
| Hiperbilirrubinemia y colecistopatías | |
| Tumores neuroendocrinos |
El tratamiento de las complicaciones debe ser individualizado, pero el médico debe tener presente el principio clásico primum non nocere y evitar alterar el débil equilibrio de una fisiología difícilmente balanceada. Es más importante lo que debemos evitar que lo que podemos tratar (tabla 6).
Decálogo para reducir riesgos
| Evitar sangrías inapropiadas y tratar el déficit de hierro |
| Evitar y tratar la anemia (los pacientes cianóticos requieren valores de hemoglobina altos) |
| Evitar antiinflamatorios, antiagregantes y anticoagulación sistemática |
| Evitar la deshidratación, ejercicio intenso, calor excesivo, saunas y cambios bruscos de temperatura |
| Evitar tabaquismo activo y pasivo |
| Evitar las embolias aéreas (filtros de aire) |
| Evitar infecciones (vacuna antigripal y neumocócica, profilaxis de la endocarditis) |
| Evitar intervenciones quirúrgicas innecesarias |
| Evitar embarazos y uso de anticonceptivos estrogénicos |
| Evitar catéteres, marcapasos o desfibriladores endocavitarios |
La cianosis crónica causada por cortocircuito derecha a izquierda persistente afecta a un 5-17% de los adultos con CC y está relacionada con elevada morbimortalidad y marcada intolerancia al esfuerzo. La mayoría presenta CC complejas en situación de Fallot o con fisiología de Eisenmenger, pero también puede originarse por cortocircuito interauricular o fístulas vasculares. El síndrome hipoxémico crónico resultante afecta a múltiples órganos y sistemas, y su manejo precisa un abordaje interdisciplinario con participación de múltiples especialistas. Son pacientes en alto riesgo cuando acuden a los servicios de urgencias, ingresan en un hospital, tienen que ser intervenidos quirúrgicamente o están gestando. Todos los pacientes con CC cianóticas deberían permanecer al cuidado de unidades clínicas especializadas en CC del adulto.