Es ampliamente reconocida la relación de una válvula bicúspide o una coartación de aorta con aneurisma, disección o rotura aórtica, hasta el punto de considerarse que estas lesiones son parte del espectro de una arteriopatía difusa. Por otra parte, cardiopatías congénitas, como el corazón univentricular, el truncus arteriosus, la transposición de los grandes vasos o, más frecuentemente, la tetralogía de Fallot, se relacionan también con dilatación de la aorta ascendente e insuficiencia aórtica secundaria. La patogenia de la dilatación de la aorta en estas cardiopatías se ha atribuido a estrés mecánico, secundario a las lesiones hemodinámicas coexistentes. Sin embargo, en no pocos casos las anomalías de la pared de la aorta no son proporcionales a la severidad de la lesión asociada, y estudios de microscopia óptica y electrónica han demostrado lesiones histológicas subyacentes. Se revisan la fisiopatología, los posibles mecanismos de la dilatación de la aorta, y si la enfermedad del tejido conectivo vascular es secundaria a la dinámica del flujo que acompaña a estas cardiopatías o si constituyen la expresión celular de un gen hasta ahora no identificado. Un mejor conocimiento de la fisiopatología contribuirá a comprender la historia natural de la dilatación de aorta asociada a las cardiopatías congénitas y elaborar las estrategias del manejo clínico de estos pacientes.
Palabras clave
La asociación entre las cardiopatías congénitas y la afección de los grandes vasos, cuya expresión clínica principal es la dilatación de aorta, ha sido objeto de numerosas publicaciones en los últimos años. En estas cardiopatías, la patogenia de la dilatación de la aorta se ha atribuido durante mucho tiempo al estrés mecánico que las lesiones hemodinámicas coexistentes producen1. Así, hay zonas de alta presión y baja velocidad proximales a la estenosis tubular de una coartación de aorta y zonas de baja presión y alta velocidad distales a la estenosis; turbulencias postestenóticas, sobrecarga de volumen y flujo pulsátil en la lesión valvular de una aorta bicúspide, o sobrecarga de volumen y aorta biventricular en las anomalías troncoconales2. No obstante, estudios al microscopio óptico y electrónico han demostrado que existe un sustrato anatómico que justifica la dilatación de la aorta y sus complicaciones, caracterizado por lesiones histológicas de la capa media3. Es más, en no pocos casos las anomalías de la pared de la aorta no son proporcionales a la severidad de la lesión asociada.
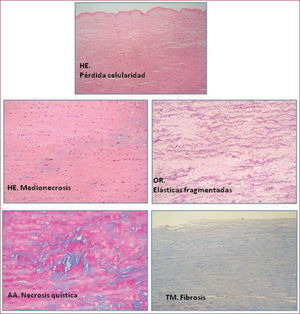
Sustrato anatómico de la afección de aorta en las cardiopatías congénitasEl análisis histológico de la aorta ascendente ha demostrado que, en la mayoría de las cardiopatías congénitas, existen alteraciones estructurales muy similares a la llamada «necrosis quística o enfermedad degenerativa de la capa media», que se ha descrito en enfermedades hereditarias del tejido conectivo, como el síndrome de Marfan (fig. 1). Éste se caracteriza por pérdida no inflamatoria de las fibras musculares lisas de la lámina elástica, degeneración mucoide y fragmentación y desorganización de las fibras elásticas, acompañadas de la aparición de áreas de fibrosis4,5. Todo ello se asocia a debilidad y pérdida de elasticidad de la pared arterial, que puede facilitar la dilatación y la formación de aneurismas.
En una serie ya clásica, publicada por Niwa et al3 en 2001, las muestras obtenidas en pacientes quirúrgicos y en necropsias de 102 pacientes con 12 cardiopatías congénitas diferentes se comparan con los que se consideran los dos extremos del espectro, los controles negativos (normales) y los controles positivos (síndrome de Marfan y anulectasia aórtica). En esta serie no se encontró ningún caso de pared aórtica normal en las cardiopatías congénitas y más del 90% de los pacientes presentaban anomalías grado 2-3 de la clasificación clásica de Schlatmann. Se han descrito hallazgos anatomopatológicos similares tanto en la pared de la aorta aparentemente normal de los pacientes de edad avanzada como en los pacientes jóvenes con síndrome de Marfan, que sufren aneurismas en edades precoces de la vida. Y lo que es aún más interesante, estas lesiones de la capa media se presentaron en los pacientes con cardiopatías congénitas en la serie de Niwa et al tanto en casos con aorta dilatada y/o cardiopatías estrechamente relacionadas con la afección de los grandes vasos (coartación o válvula bicúspide) como en pacientes con cortocircuitos en situación de Eisenmenger o transposición de las grandes arterias, en edades precoces de la vida y sin que presentasen alteraciones en las dimensiones de la aorta ascendente.
Estos resultados plantean varios interrogantes: ¿la enfermedad del tejido conectivo vascular en los pacientes con cardiopatías congénitas es intrínseca y genéticamente determinada o es adquirida?, ¿en qué grado la lesión hemodinámica tiene un papel causal o facilitador en la aparición de dilatación de aorta?, o ¿en qué grado las lesiones histológicas, por el contrario, responden a la dilatación per se?, es decir, ¿son consecuencia, y no causa, de las complicaciones arteriales? Desafortunadamente, aún no está completamente aclarada la patogenia o el mecanismo por el que ocurren estas alteraciones estructurales en la capa media de los grandes vasos, sustrato anatómico de las complicaciones aórticas en los pacientes con cardiopatías congénitas muy diversas.
ANOMALÍAS TRONCOCONALES: TETRALOGÍA DE FALLOTLas anomalías troncoconales, como la tetralogía de Fallot, el truncus arteriosus, el ventrículo derecho de doble salida o la transposición completa de grandes arterias, constituyen un grupo de cardiopatías congénitas caracterizadas por alteraciones del tracto de salida y de los grandes vasos. La fisiopatología de la dilatación de aorta en estas anomalías troncoconales probablemente sea una combinación del incremento en el flujo aórtico secundario a las lesiones hemodinámicas que existen antes de la reparación y de anomalías estructurales intrínsecas de la pared. En el caso de la tetralogía de Fallot, la dilatación de la raíz de la aorta es un hallazgo clínico característico en las cardiopatías no reparadas, pero incluso en adultos ya reparados la aorta ascendente puede dilatarse progresivamente en fases tardías6.
Patogenia de la dilatación de aortaSe han descrito anomalías histológicas, principalmente fibrosis, fragmentación de fibras elásticas y rotura de la lámina elástica, en la capa media de la pared arterial de pacientes con tetralogía de Fallot7. Además, estudios no invasivos han demostrado alteraciones de la elasticidad de la pared de la aorta en pacientes operados, que se correlacionan con la severidad de la dilatación8,9. Estas alteraciones se observan en pacientes de todas las edades (no sólo en adultos, sino también en neonatos y niños), y son más frecuentes y más severas que en controles sanos. Es más, grados avanzados de enfermedad del tejido conectivo vascular, de severidad similar a la que se presenta en los controles de edad adulta, se encuentran en neonatos con tetralogía de Fallot7. Todos estos datos indican que una aortopatía intrínseca, ya presente desde el nacimiento, constituye el sustrato anatómico de la afección de la aorta.
No obstante, el mecanismo por el que ocurren estas alteraciones estructurales en la pared de la aorta en la tetralogía de Fallot aún no se ha aclarado. Se reconoce un origen embrionario, ya que, según señalan algunos estudios, hay relación directa entre las anomalías de la función celular y el remodelado de la matriz extracelular en la capa media de la aorta y las anomalías de la septación troncal, que se derivan de la migración de subpoblaciones celulares de la cresta neural al septo aortopulmonar10,11. Se discute si existe un gen que regula la función celular de la capa media de la aorta y si este gen se relaciona con los que regulan el patrón de migración de las células de la cresta neural y con las anomalías de la embriogénesis (HOX o TBX1) o es un gen hasta ahora desconocido11,12. Finalmente, se desconoce si las lesiones hemodinámicas ya presentes también antes del nacimiento son disparadores de estos factores genéticos o tienen un papel causal.
El papel de la cianosis y de la sobrecarga de volumen, secundaria al cortocircuito y a la presencia de una aorta biventricular, como desencadenantes extrínsecos de apoptosis o de remodelado de la matriz extracelular de la capa media de la pared arterial, es una hipótesis que se apoya en observaciones publicadas sobre el efecto de la cirugía precoz en la dilatación de aorta. Niwa et al13 publicaron en 2002 que las dilataciones mayores ocurren en los pacientes reparados a edades más avanzadas, con intervalos mayores entre la cirugía paliativa y la reparación completa, y en las formas más extremas del espectro morfológico (atresia o agenesia pulmonar y arco aórtico derechos, frecuentemente asociados). Esto indica que, al menos en parte, las alteraciones en la dinámica de flujos predisponen o facilitan la dilatación. Posteriormente, Bhat et al14 demostraron en pacientes no reparados dilataciones de aorta ascendente mayores que lo esperable para su edad en cualquier época de la vida, que esa dilatación se incrementa después de la creación quirúrgica de un shunt sistemicopulmonar, al incrementar el flujo aórtico anterógrado, y que la dilatación progresa en la vida adulta cuando la reparación completa se lleva a cabo después del primer año de vida. Por el contrario, la reparación completa en la infancia precoz evita e incluso corrige la progresión de la dilatación de la raíz de aorta. Finalmente, también la hipótesis del patrón de flujo como desencadenante o facilitador del remodelado vascular explicaría por qué las lesiones histológicas y la dilatación de aorta ocurren en la aorta proximal mientras que es completamente normal la aorta torácica descendente7.
En resumen, son varias las hipótesis que podrían explicar la dilatación de aorta en la tetralogía de Fallot, probablemente multifactorial: a) anomalías en la embriogénesis, que resultan en una división inadecuada del tronco fetal, que favorece a la aorta; b) migración de células de la cresta neural al tracto de salida, secretoras de proteinasas, que favorecen la degradación de la capa media; c) sobrecarga de volumen secundaria a la aorta biventricular; d) flujo pulsátil y sobrecarga de volumen secundaria a la insuficiencia aórtica; e) anomalías estructurales intrínsecas de la capa media de los grandes vasos, y f) destrucción prematura o acelerada de la matriz extracelular mediada o no por desencadenantes extrínsecos.
Dilatación de aorta e insuficiencia aórtica en la tetralogía de FallotAunque se han publicado algunos casos aislados de disección aórtica que complican dilataciones extremas de la aorta ascendente15,16, podemos considerar más interesante, por su frecuencia, el hecho de que la dilatación de aorta tenga una prevalencia en las series publicadas de casi el 15% de los casos de tetralogía de Fallot13 y que series ecocadiográficas hayan encontrado una prevalencia realmente elevada (hasta del 76%) de anomalías en la geometría de la raíz de aorta, caracterizadas en muchos de los casos por borramiento de la unión sinotubular (UST)17.
Esta morfología de la raíz de aorta constituye el principal mecanismo de la insuficiencia valvular aórtica, que puede llegar a complicar la evolución de los adultos reparados de una tetralogía de Fallot (leve en un 15-18% de los pacientes y severa en el 2% de los casos). Se trata de válvulas con lesiones poco extensas en los velos y dilatación asociada de aorta ascendente, cuya regurgitación se explica gracias a un mejor conocimiento del papel de la raíz de la aorta en la función valvular. Los senos de Valsalva, la UST y las comisuras son estructuras muy especializadas y un verdadero aparato «supravalvular» aórtico18. Se ha demostrado que las relaciones geométricas y el comportamiento dinámico de los componentes de la raíz aseguran la competencia valvular cuando los velos no tienen lesión estructural. Por este motivo, cuando en los aneurismas de aorta ascendente de larga evolución se producen cambios geométricos que distorsionan las inserciones de los velos en las comisuras (como ocurre cuando se «borra» la UST), se modifican sus condiciones de apertura y cierre, lo que los hace incompetentes19.
La indicación de cirugía en presencia de insuficiencia aórtica significativa no difiere de la que se establece en los casos de enfermedad valvular adquirida. No obstante, en ausencia de evidencias de tratamiento médico alguno que limite la progresión de la dilatación, la decisión sobre el momento adecuado para indicar la intervención en pacientes asintomáticos con aneurismas de aorta en la tetralogía de Fallot es difícil: los casos de síndrome aórtico agudo asociados a anomalías troncoconales son anecdóticos y la insuficiencia aórtica severa que requiere cirugía es poco prevalente. Recientemente se ha publicado la experiencia de la Clínica Mayo20, que propone intervenir por encima de los 55mm en ausencia de historia familiar de aneurisma o disección o de una tasa de crecimiento rápida, documentada en estudios seriados de imagen. En cuanto a pacientes con dimensiones de aorta entre 50 y 55mm, la recomendación es individualizar el tratamiento dependiendo de la comorbilidad, la severidad de la insuficiencia aórtica y la esperanza de vida del paciente, y recurrir a aortoplastia y sustitución valvular por prótesis en los peores candidatos.
LA VÁLVULA AÓRTICA BICÚSPIDELa válvula aórtica bicúspide (VAB) constituye la anomalía congénita más frecuente, con una prevalencia que oscila entre el 0,5 y el 2%, según las series21. Se la considera un cuadro de gran interés clínico por su frecuente asociación con complicaciones potencialmente graves, como la lesión valvular (estenosis o insuficiencia), la endocarditis infecciosa y la afección de la aorta ascendente (aneurismas, disección), así como con otras anomalías vasculares, como coartación de aorta, inversión de la dominancia del árbol coronario, disección de tronco cervicocefálico o afección del arco aórtico. Precisamente la coexistencia de una VAB con otras lesiones vasculares ha conducido a la hipótesis de que existe una alteración común del desarrollo embrionario que afecta tanto a la pared arterial como a la válvula aórtica.
La dilatación de aorta ascendente supone un hallazgo extremadamente común en los pacientes con una VAB. En las series quirúrgicas y necrópsicas se encuentra en un 10-35% de los pacientes22, mientras que las series ecocardiográficas (más precisas en la población general) estiman la prevalencia de dilatación de aorta en un 45-70%; puede afectar a los distintos segmentos de la aorta ascendente en pacientes con una VAB prácticamente normofuncionante (tabla 1). Aunque la edad per se no es un factor independiente de riesgo de aorta dilatada en la VAB (presente también en niños y adultos jóvenes)23,24, es aún más prevalente en las series de pacientes de edades más avanzadas.
Prevalencia de la dilatación de aorta en pacientes con válvula aórtica bicúspide
| Autor | n | Edad | Lesión valvular | Aorta | Prevalencia, % |
| Pachulskia | 101 | Adulto | Normal y EAo leve | SV | 58 |
| Hahnb | 19 | Adulto | Normal | AA | 50 |
| Hahnc | 27 | Adulto | IAo | AA | 78 |
| Nistric | 66 | 17-19 años | Normal | SV | 44 |
| Ferencik et ald | 68 | 15-71 años | Normal, EAo, IAo | AA | 49 |
| Cecconie | 39 | > 40 años | Normal e IAo leve | AA | 77 |
AA: aorta ascendente supratubular; EAo: estenosis aórtica; IAo: insuficiencia aórtica; SV: senos de Valsalva.
La patogenia de la dilatación de aorta que ocurre en esta aparentemente benigna y frecuente lesión valvular sigue siendo controvertida. Como en las anomalías troncoconales, inicialmente se atribuyó al estrés mecánico secundario a la dinámica del flujo a través de una válvula displásica: turbulencias postestenóticas y flujo pulsátil y sobrecarga de volumen de la insuficiencia aórtica2. No obstante, en no pocos casos las anomalías de la pared aórtica no son proporcionales a la severidad de la lesión asociada. Aunque las insuficiencias valvulares severas se acompañan de mayores grados de dilatación, ésta puede ocurrir en ausencia de lesión valvular y, lo que es más, las dimensiones de la aorta proximal en la VAB se han demostrado mayores que en controles con grados comparables de lesión valvular, tanto a nivel de los senos de Valsalva como de la UST y de la aorta ascendente supratubular25. Incluso se ha publicado que persiste la progresión de la dilatación en casos en que se ha realizado previamente sustitución de la VAB por una prótesis26.
Por otra parte, en la VAB se han documentado extensamente alteraciones estructurales en la capa media de la pared de la aorta, que incluyen medionecrosis, pérdida de celularidad y fragmentación y cambios de la orientación de las fibras elásticas, similares a los descritos en el síndrome de Marfan, y que resultan en debilidad estructural de la pared27. Además, análisis morfométricos de la capa media que comparan la aorta de la VAB y de la válvula tricúspide (VAT) revelan que, junto con un menor grosor de la capa media de la pared arterial en pacientes con VAB, hay diferencias en la lámina elástica (más distancia entre las fibras y menor grosor de la lámina elástica en la VAB), y que estas diferencias se mantienen independientemente de cuál sea el grado de dilatación de la aorta ascendente28.
Se apuntan varios mecanismos patogénicos que explican estas lesiones histológicas de la pared vascular en la VAB. En primer lugar, se han descrito anomalías celulares y extracelulares en la capa media, entre las que destaca una elevada tasa de apoptosis o muerte celular programada de la célula muscular lisa, tasa que es comparable en los casos de VAB con y sin dilatación de aorta29. Precisamente esta elevada tasa de apoptosis en VAB con aortas de dimensiones normales respaldaría la hipótesis de que las alteraciones histológicas de la capa media preceden a la dilatación de aorta. Por otra parte, esta tasa de apoptosis es también comparable a la encontrada en pacientes con VAT y aorta ascendente dilatada. Sin embargo, al contrario que en la VAT, en la VAB no se han demostrado otros desencadenantes extrínsecos de la apoptosis (como la arteriosclerosis, la inflamación o la edad avanzada) distintos de la lesión valvular.
En segundo lugar, Fedak et al30 encontraron que los cambios degenerativos de la capa media en la VAB se producen por fragmentación de la matriz extracelular mediada por metaloproteinasas. Compararon a un subgrupo de pacientes con VAB, intervenidos por una lesión severa y en su mayor parte con dilatación de aorta, con un grupo de controles con VAT sin dilatación de aorta. Aunque estructuralmente normal, respecto a los controles, en los pacientes con VAB hay una reducción del contenido de fibrilina 1 que no se acompaña de diferencias en el contenido de elastina ni de colágeno y es independiente de la edad del paciente, la severidad de la lesión valvular y las dimensiones de la aorta ascendente. Esta reducción de fibrilina 1 en la VAB por debajo de cierto umbral desacopla la lámina elástica de las células musculares lisas, lo que activa el fenotipo secretor en lugar del fenotipo contráctil. En estas condiciones, la producción y la liberación de metaloproteinasas activas por la célula muscular lisa (cuya cantidad y actividad son significativamente superiores en la VAB) debilitan la pared vascular mediante la degradación de fibras de elastina y de todos los componentes elásticos de la pared arterial.
Sin embargo, la controversia persiste en cuanto a si los mecanismos patogénicos que justifican los cambios estructurales de la pared vascular se desencadenan por estímulo mecánico o son de origen genético. Son varios los argumentos que pueden esgrimirse a favor del estímulo mecánico como facilitador o desencadenante. Por un lado, no se han identificado defectos en los genes que codifican los elementos de la matriz extracelular y el gen de la fibrilina 1 es estructuralmente normal, pero los elementos transcripcionales que regulan la producción, como el gen que codifica la sintetasa del óxido nítrico (eNOS), sí podrían estar alterados en la VAB, y en este sentido trabaja actualmente la biología molecular. Tampoco se ha aclarado si la VAB es una anomalía hereditaria, y hasta la fecha no se ha identificado ningún gen causal. No obstante, unido al hecho de que hay una tasa elevada de afectados entre los varones, Fedak et al21 han informado de una alta incidencia de agrupación familiar, compatible con un patrón de herencia autosómico dominante con penetrancia reducida, y se han descrito casos de VAB en gemelos homocigóticos. Por otro lado, la evaluación de la dinámica valvular in vitro y mediante modelos de simulación computarizados indica que la VAB es intrínsecamente estenótica, tiene un patrón de flujo posvalvular no axial y turbulento, dirigido hacia la pared anterolateral de aorta, incluso aunque no haya gradiente de presión transvalvular, y que estas alteraciones en la dinámica de flujo pueden inducir lesión celular y remodelado vascular dependiente de flujo31. Finalmente, se han descrito diferencias en los patrones de dilatación y distribución espacial de los cambios en la matriz extracelular entre la VAB y el síndrome de Marfan, que comparten alteraciones histológicas similares en la capa media (fig. 2). En el síndrome de Marfan, la distribución es uniforme en la circunferencia total del vaso y la enfermedad arterial es sistémica, mientras que en la VAB la distribución es excéntrica, localizada en la convexidad y sólo en la aorta ascendente y el arco aórtico32. Este dato podría respaldar la hipótesis de que en ambas afecciones las lesiones ocurren por mecanismos diferentes y apunta contra una teoría patogénica exclusivamente genética en el aneurisma de aorta asociado a la VAB.
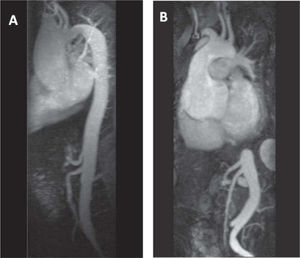
Angiorresonancia magnética de aorta. Diferentes formas anatómicas de dilatación de aorta ascendente proximal en paciente con válvula aórtica bicúspide (A) y síndrome de Marfan (B). Nótese la dilatación de la aorta ascendente supratubular, particularmente en la convexidad, del paciente con válvula bicúspide respecto a la dilatación simétrica y circunferencial de los senos de Valsalva en el síndrome de Marfan.
Estudios retrospectivos alertan sobre el riesgo de complicaciones a largo plazo en la aorta ascendente de los pacientes tras la sustitución valvular aórtica: hasta el 50% de los pacientes con aorta de dimensiones entre 4,5 y 5cm en el momento de la sustitución valvular mueren o se someten a cirugía en el seguimiento de la serie de Borer et al33. Sin embargo, en un seguimiento mediante ecocardiografía transesofágica de pacientes con dimensiones entre 4 y 6cm de aorta ascendente y válvula normofuncionante, La Canna et al34 demostraron que la progresión de la dilatación no es diferente en la VAT y la VAB. Es más, muerte y cirugía de urgencia sólo ocurrieron en los casos de VAT. Más recientemente se han publicado nuevas observaciones clínicas, como la del grupo canadiense35, que llaman la atención sobre la similitud entre la supervivencia de los pacientes con VAB y la de la población general y sobre el efecto del envejecimiento en la afección de la aorta ascendente asociada a VAB; la edad y la severidad de la lesión valvular al inicio del seguimiento son los principales predictores independientes del riesgo de complicaciones (muerte o cirugía). Finalmente, Michelena et al36 han publicado el primer estudio de historia natural en pacientes asintomáticos con VAB normofuncionante, que confirma la excelente supervivencia a largo plazo de estos pacientes, comparable a la de la población general, y la acelerada dilatación de aorta que acompaña a la VAB, incluso en ausencia de lesión valvular significativa o coartación de aorta (4 de cada 10 pacientes sufrirán aneurismas). No obstante, también demuestra que, aunque el riesgo puede ser mayor en los casos con lesiones valvulares severas o que se presentan ya con aorta dilatada (> 40mm), sólo el 27% de los pacientes requerirán cirugía (en casi todos ellos indicada por progresión o severidad de la lesión valvular), sin que ocurra ningún síndrome aórtico agudo en esta serie en un seguimiento a 20 años.
Función y morfología de la válvula aórtica bicúspide: heterogeneidadSi algún aspecto contribuye a dificultar la progresión del conocimiento de la patogenia es la enorme heterogeneidad de fenotipos que hemos de reconocerle a la enfermedad de la aorta asociada a la VAB. La aorta ascendente puede ser normal o dilatada, en cuyo caso incluso se han descrito diferentes patrones de dilatación (fig. 3): aneurismas de la aorta ascendente supratubular, que suelen acompañar a la estenosis valvular37, anulectasia aórtica y aneurismas de la raíz o de un seno de Valsalva. Finalmente, aunque no es tan frecuente, la dilatación del arco aórtico, principalmente en mayores de 40 años, también se ha descrito recientemente38. Por otro lado, la tasa de progresión de la dilatación es también muy variable. Se han publicado tasas de crecimiento de 0,2 a 0,9mm/año en válvulas con diferentes grados de lesión valvular y, recientemente, Thanassoulis et al39 han descrito a un subgrupo de pacientes con dilatación rápidamente progresiva (> 1mm/año) que se caracteriza por no combinarse con coartación de aorta y por una morfología de los velos característica (fusión de velos coronarios izquierdo y derecho). Lamentablemente, el conocimiento de marcadores clínicos y ecocardiográficos distintos de la dilatación per se o la edad que predigan dilatación en la VAB normofuncionante es aún escaso.
Precisamente la morfología y la función de la VAB deben tenerse muy en consideración cuando se intenta discriminar subgrupos de aortopatía por VAB. En el estudio de Schaefer et al40 se relaciona el fenotipo de la VAB con la forma anatómica y dilatación de la aorta ascendente. Generalmente, la fusión coronario derecho-coronario izquierdo (tipo 1), la más frecuente, se asocia en el 60% de los casos con un fenotipo normal de morfología de la aorta, pero con dimensiones de la raíz mayores. Sin embargo, más de la mitad (54%) de los casos con fusión coronario derecho y no coronario (tipo 2) se relacionan con fenotipo de aorta ascendente distendida (dimensión de la aorta ascendente mayor que la dimensión de los senos de Valsalva) y mayores dimensiones del arco aórtico. E incluso se ha publicado correlación entre la severidad de la lesión histológica en la capa media y el fenotipo valvular41. Grados más severos de enfermedad del tejido conectivo vascular aparecen a edades más precoces en el fenotipo 1, que presentan grados de dilatación de aorta ascendente similares a los de los pacientes con fenotipo 2 a edades más avanzadas y unas dimensiones de la raíz de aorta significativamente mayores, lo que parece traducir una aortopatía más grave. Igualmente, Schaefer et al también han descrito mayores índices de rigidez de la pared arterial en los pacientes con fenotipo 1, que característicamente se relacionan con dimensiones menores del arco y más frecuente asociación con la coartación de aorta42.
Propiedades elásticas de la aorta en la válvula aórtica bicúspideComo en el síndrome de Marfan, también se han publicado datos que demuestran que en la VAB hay una elasticidad anormal en la aorta ascendente, incluso en pacientes jóvenes con válvula normofuncionante y sin dilatación de aorta43. Lo que es más, se ha encontrado una enorme heterogeneidad en el grado de rigidez arterial en esta población (el 42% con elasticidad anormal y el 57% normales), lo que indica que hay una afección estructural intrínseca de la pared de la aorta en un subgrupo aún no identificado de pacientes con VAB44. Además, no se ha encontrado relación entre la rigidez arterial y la dilatación. Nistri encontró que la distensibilidad de la pared arterial en la VAB estaba reducida con respecto a los controles independientemente de cuál fuese el grado de dilatación de aorta, dato este que también traduce la existencia de una anomalía estructural primaria de la pared vascular en un subgrupo de VAB, que probablemente precede a la dilatación. Aunque los estudios no invasivos de elasticidad podrían poner de manifiesto alteraciones estructurales intrínsecas antes de que aparezca la dilatación clínica, hasta el momento no hay datos sobre el valor pronóstico de la elasticidad en la aorta de la VAB.
Riesgo de síndrome aórtico agudo en la válvula aórtica bicúspideEl riesgo de disección o rotura aórtica en la VAB varía notablemente entre las distintas series. Se ha estimado que la frecuencia del síndrome aórtico agudo es 5-9 veces más frecuente en los pacientes con VAB que en los controles. No obstante, sólo el 3% de los pacientes del registro internacional de disección aórtica tenían una válvula bicúspide45 y no hubo ningún caso de disección en la serie de Michalena en un seguimiento a 20 años36. Aún más, Davies demostró que el aneurisma de aorta ascendente asociado a una VAB no reemplazada, a pesar de caracterizarse por una progresión más rápida de la dilatación que en la VAT, presenta una tasa de complicaciones similar o incluso inferior46. En la misma línea, Basso et al47 encontraron que, respecto al síndrome de Marfan, las dimensiones de aorta de los pacientes con muerte súbita y VAB eran significativamente menores, aunque sí mayores que en controles sanos y que en la VAB sin disección. Y esto ocurría a pesar de que el grado de severidad de la enfermedad vascular del tejido conectivo en la pared era similar en la VAB y el síndrome de Marfan con muerte súbita por síndrome aórtico agudo. Por lo tanto, con base en las más recientes publicaciones, podemos concluir que el tamaño del aneurisma en el paciente con VAB no constituye un buen predictor de complicaciones aórticas agudas y que alteraciones estructurales que debilitan la pared de la aorta pueden producirse sin dilatación.
ENFERMEDAD DE LA AORTA EN LA COARTACIÓN DE AORTAHoy hay evidencia suficiente para no considerar que la coartación es sólo una lesión «focal», sino que plantea frecuentemente complicaciones en otras áreas del sistema arterial que tienen un enorme impacto en la morbimortalidad durante la vida adulta. Aunque la historia natural de la coartación de aorta ha cambiado sustancialmente con la reparación quirúrgica en la infancia, todavía hay un riesgo elevado de complicaciones cardiovasculares en la vida adulta. Oliver et al48 publicaron una incidencia de complicaciones arteriales del 16% en la población de adultos con coartación seguidos en la Unidad de Cardiopatías Congénitas del Hospital La Paz, que incluyen aneurismas, roturas, seudoaneurismas, disección, aneurismas micóticos o fístulas al árbol traqueobronquial o a las cavidades cardiacas. En esa serie ni la reparación quirúrgica previa ni el intervencionismo percutáneo se distinguieron de los pacientes no tratados en la incidencia de complicaciones de la pared arterial, ni en las que afectaban a la aorta ascendente o la descendente. La frecuencia de complicaciones tampoco dependía del gradiente residual a nivel de la coartación ni de la presión arterial en reposo. Aunque los pacientes a los que se había intervenido y tenían complicaciones habían sido intervenidos más tarde, a una media de edad de 16 años, que los que no tenían complicaciones, el análisis multivariable sólo demostró con valor predictor independiente la edad del paciente en el momento de presentarse las complicaciones y la asociación con una VAB. Así, el riesgo de complicaciones se incrementaba en 1,5 con cada década de edad y se multiplicaba por 3 en los pacientes con una VAB. La coartación de aorta se asocia con VAB en más del 50% de los pacientes, y esta asociación ya se ha demostrado factor de riesgo de aneurismas de aorta ascendente después de la reparación quirúrgica de la coartación49, pero también es factor de riesgo de complicaciones en la aorta torácica descendente o en el lugar de la reparación. El hecho de que, tanto en la VAB como en la coartación de aorta, estudios histológicos hayan demostrado lesiones en la capa media similares a la necrosis quística de la media respaldan la teoría, como ha descrito Warnes50, de que la asociación VAB y coartación podría ser parte del espectro de una enfermedad arterial difusa.
Asociación con la válvula aórtica bicúspideOliver et al51 encontraron en una serie de más de 300 pacientes con VAB una prevalencia de complicaciones aórticas que terminan en muerte o cirugía que alcanza el 4,5%, y era significativamente mayor el número de complicaciones en los pacientes con una coartación aórtica asociada a la VAB (el 11 frente al 2,2%), pese a ser pacientes más jóvenes, con menos severidad de la lesión valvular y con dimensiones de la aorta ascendente menores. Además, la incidencia de complicaciones y la supervivencia libre de eventos en el seguimiento fue igualmente superior en los casos de coartación y VAB; la coartación resultó predictor independiente de riesgo en los pacientes con VAB.
Las más recientes publicaciones apuntan que la asociación de una VAB con una coartación «protege» contra la dilatación de la aorta ascendente39,52. Además, sabemos que el fenotipo de VAB más frecuentemente asociado a la coartación es el tipo 1, que también se caracteriza por menos distensibilidad de la pared arterial. Probablemente, junto con la hipertensión arterial y la dinámica de flujo secundaria a la lesión valvular, la asociación coartación de aorta y VAB identifica a un subgrupo de pacientes con una forma más severa de enfermedad del tejido conectivo vascular en quienes la aparición de complicaciones arteriales es más frecuente.
CONCLUSIONESLas anomalías estructurales en la pared de la aorta se han descrito en un amplio espectro de cardiopatías congénitas. Durante la vida adulta de estos pacientes, puede presentarse dilatación progresiva de la raíz y de la aorta ascendente, lo que conduce a numerosas complicaciones, como la formación de aneurismas, insuficiencia valvular, disección o rotura aórtica, que en ocasiones requieren cirugía. Sin embargo, la patogenia de esta dilatación sigue siendo objeto de controversia: aún no se ha aclarado si el patrón de flujo asociado a las lesiones coexistentes induce el remodelado vascular de la pared arterial o si son factores genéticos la causa de la enfermedad degenerativa de la capa media. Un mejor conocimiento de la fisiopatología contribuirá a comprender la historia natural de la dilatación de aorta asociada a las cardiopatías congénitas, identificar marcadores de riesgo de complicaciones arteriales y elaborar las estrategias del manejo clínico de estos pacientes.