La utilidad de la ecografía pulmonar (EP) en la insuficiencia cardiaca (IC) aguda está bien definida, pero no así en la IC crónica. Este estudio investigó el valor pronóstico de la EP en pacientes estables con IC crónica.
MétodosSe incluyó a pacientes ambulatorios consecutivos con visita programada en una unidad de IC. La EP se realizó in situ, con los datos clínicos enmascarados, y evaluó 8 áreas torácicas. La suma de líneas B en todas las áreas pulmonares y los cuartiles de dicha adición se utilizaron para los análisis de regresión lineal y de Cox. Los objetivos principales fueron el compuesto de muerte por cualquier causa u hospitalización por IC y mortalidad por cualquier causa.
ResultadosSe incluyó a 577 individuos (edad, 69±12 años; el 72% varones). La media de líneas B fue de 5±6. Durante un seguimiento de 31±7 meses, en 157 pacientes se produjo el resultado compuesto y 111 fallecieron. Tener ≥ 8 líneas B (Q4) dobló el riesgo de padecer el evento compuesto (p <0,001) y multiplicó por 2,6 el riesgo de muerte (p <0,001). En el análisis multivariado, la suma de líneas B se mostró como factor pronóstico independiente del objetivo principal compuesto (HR=1,04; IC95%, 1,02-1,06; p=0,002) y de muerte por cualquier causa (HR=1,04; IC95%, 1,02-1,07; p=0,001), y mantuvo la significación independientemente de que la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) se incluyera en el modelo o no (p=0,01 y p=0,008 respectivamente), con un 3-4% de riesgo añadido por cada línea B que se suma.
ConclusionesLa EP identificó a pacientes con IC crónica estable y alto riesgo de muerte u hospitalización por IC.
Palabras clave
La insuficiencia cardiaca (IC) es una enfermedad crónica de mal pronóstico y con frecuentes ingresos hospitalarios1,2. Los pacientes con IC confirmada a menudo presentan diferentes estadios de congestión pulmonar clínica, e incluso los pacientes estables pueden padecer una congestión pulmonar subclínica asintomática que pase inadvertida3. La congestión pulmonar puede identificar a aquellos con mayor riesgo de hospitalización por IC y muerte4. Por lo tanto, el diagnóstico de cualquier grado de congestión pulmonar es clave en el tratamiento de los pacientes con IC crónica.
La evaluación clínica y las pruebas complementarias permiten valorar el estado hídrico de los pacientes, pero tienen varias limitaciones5. Las puntuaciones de riesgo de descompensación para descartar la congestión se apoyan en los síntomas y la exploración física, que son medidas subjetivas y pueden no producirse, especialmente en pacientes ambulatorios. Los péptidos natriuréticos muestran una heterogeneidad considerable, incluso entre individuos con síntomas y signos semejantes, y no siempre son fáciles de obtener en el entorno ambulatorio. Por último, la radiografía de tórax presenta una alta variabilidad interobservadores y, además, la ausencia de signos en la radiografía de tórax no excluye la existencia de una alta presión de enclavamiento de los capilares pulmonares y congestión.
En este contexto, parece que la ecografía pulmonar (EP) es una herramienta complementaria emergente para la cuantificación de la congestión pulmonar. La EP permite la evaluación de la congestión pulmonar mediante la detección de líneas B6. Las líneas B son un artefacto ecográfico causado por la interacción del aire con el agua en el espacio intersticial7. La presencia amplia y bilateral de líneas B en las exploraciones pulmonares transtorácicas anterolaterales refleja el síndrome intersticial difuso8. Por lo tanto, la EP puede ser una alternativa para la evaluación de la retención pulmonar de líquido; ya se ha demostrado que es muy sensible en la evaluación de la congestión pulmonar de los pacientes con IC9. Además, las líneas B se asocian con cambios tanto en la estructura como en la función cardiaca10 y pueden aportar información pronóstica de los diferentes pacientes con IC.
La utilidad de la EP en el diagnóstico y el tratamiento en el marco de la IC aguda está bien definida, sobre todo en urgencias y salas de cuidados intensivos, de donde proviene la mayoría de la evidencia sobre la EP hasta ahora4. Sin embargo, hay pocos datos sobre su valor como marcador pronóstico en pacientes ambulatorios con IC crónica, y la mayoría de los datos se han obtenido de pequeñas cohortes de pacientes ambulatorios4. En consecuencia, el objetivo es conocer el valor pronóstico de la EP en una gran cohorte de pacientes con IC crónica estable. Se planteó la hipótesis de que la EP, realizada in situ a pacientes ambulatorios durante las visitas programadas habituales, podría aportar información significativa sobre el pronóstico y el riesgo de hospitalizaciones por IC, junto con otras variables clínicas. Además, se investigó si las líneas B podían ofrecer información pronóstica adicional, independientemente de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) —que no siempre se puede obtener in situ durante las visitas ambulatorias—, de pacientes con IC crónica estable.
MÉTODOSDiseño del estudio y selección de pacientesSe trata de un estudio de cohortes observacional, prospectivo y unicéntrico de pacientes ambulatorios atendidos en una unidad específica de IC de un hospital universitario, realizado durante una habitual visita programada del 6 de julio de 2016 al 31 de julio de 2017, independientemente del tiempo transcurrido desde la visita inicial en la unidad. En otro lugar se ha informado de la derivación a la unidad de IC11,12. En resumen, el criterio principal es padecer IC y al menos 1 hospitalización y/o fracción de eyección del ventrículo izquierdo (FEVI) reducida (<40%), sean cuales fueren la etiología o la duración de la IC. Menos del 5% de los pacientes ingresan en la unidad de IC por FEVI reducida asintomática tras infarto agudo de miocardio. Se suele remitir a la unidad a los pacientes desde el servicio de cardiología o de medicina interna y, con menor frecuencia, el servicio de urgencias u otros servicios hospitalarios, y también por otros cardiólogos u hospitales del área de derivación. Se visita a todos los pacientes con regularidad durante el seguimiento según el programa establecido y sus necesidades clínicas. El seguimiento estructurado consiste en visitas de enfermería trimestrales y 1 visita de un médico (cardiólogo, internista o médico de familia) cada 6 meses, y visitas opcionales de especialistas en geriatría, psiquiatría, rehabilitación, nefrología y endocrinología. La visita anual comprende una determinación de NT-proBNP y se realiza un ecocardiograma Doppler transtorácico cada 2 años. Según el cuadro clínico, los pacientes pueden ponerse en contacto con la unidad espontáneamente para acordar una visita no programada en caso de sospecha de descompensación de la IC y pueden reevaluarse tantas veces como sea necesario. La unidad cuenta con la infraestructura necesaria para la administración de diuréticos y otros fármacos intravenosos a corto plazo.
A los efectos de este estudio, se evaluó a pacientes consecutivos ambulatorios no descompensados que acudieron a una visita de seguimiento programada en la unidad de IC. Los criterios de exclusión del análisis fueron: a) descompensación clínica en el momento de la visita, y b) diagnóstico previo de fibrosis pulmonar o fibrosis pleural difusa radiológica.
Todos los participantes dieron su consentimiento informado por escrito y el comité de ética local aprobó el protocolo. El estudio cumplió lo establecido en la Declaración de Helsinki de 1975 y sus actualizaciones de 1983.
Recogida de datosMédicos de la unidad de IC que desconocían el resultado de la EP (M. de Antonio, P. Moliner, E. Santiago-Vacas y J. Santesmases) realizaron las visitas de seguimiento. La evaluación clínica consistió en valorar la descompensación mediante la puntuación de gravedad de la enfermedad clínica (clinical disease severity score [CDSS]) de la IC13,14 (paciente descompensado: ≥ 2 puntos; cada uno de los criterios principales puntúa 1 [disnea paroxística nocturna, crepitantes pulmonares, presión venosa yugular elevada y tercer tono cardiaco]; cada uno de los criterios menores puntúa 0,5 [ortopnea, tolerancia al ejercicio reducida, taquicardia sinusal en reposo, presión venosa yugular> 4cm, hepatomegalia y edema periférico]). Los datos personales y clínicos se registraron a partir de la revisión de las historias clínicas electrónicas.
Las determinaciones sistemáticas de NT-proBNP anuales se analizaron en el laboratorio central mediante inmunoanálisis de electroquimioluminiscencia (Elecsys, Roche Diagnostics, Suiza). Ecocardiógrafos experimentados determinaron la FEVI con un sistema Philips iE33 con un transductor de 3,5MHz y se incluyó el último valor obtenido antes de la visita de seguimiento programada.
Evaluación de la ecografía pulmonarA cada paciente del estudio se le realizó una única EP, llevada a cabo in situ durante la visita programada por 1 de los 2 investigadores experimentados (M. Domingo o L. Conangla), que desconocían los datos clínicos y de las visitas de seguimiento, mediante un ecocardiógrafo portátil (modelo Vscan sencillo con una sonda de un solo sector, General Electrics, Estados Unidos). Se examinaron 8 áreas establecidas por un grupo de expertos anterior8 y los pacientes permanecieron en posición semisupina durante la exploración. La EP se realizó con un transductor de matriz por fases, perpendicular a las costillas y con una profundidad de imagen de 14cm, y se grabaron videoclips de 2 s. Uno de los 2 investigadores formados (M. Domingo o L. Conangla) analizó las imágenes de EP offline y registró el número de líneas B en la exploración sagital de cada área torácica. La línea B se definió como un artefacto de reverberación hiperecoica vertical semejante a un láser aislado que surge de la línea pleural, se extiende hasta la parte inferior de la pantalla sin desvanecerse y se mueve en sincronía con el deslizamiento pulmonar8. La suma de líneas B de todas las zonas pulmonares se utilizó para los análisis principales. Se consideró que existía derrame pleural con 10 líneas B.
Seguimiento y resultados del estudioLos principales criterios de valoración clínicos fueron la combinación de muerte por cualquier causa u hospitalización por IC, así como la mortalidad por cualquier causa. El seguimiento llegó a durar 36 meses. Los eventos de mortalidad se identificaron a partir de la historia clínica electrónica de los pacientes de la unidad de IC, otros documentos hospitalarios y/o de atención primaria y contactando con los familiares de los pacientes. Los datos se comprobaron mediante la base de datos del Servei Català de la Salut y el Índice Nacional de Defunciones (INDEF). Los ingresos hospitalarios se identificaron a partir de la historia clínica electrónica de los pacientes y de la base de datos del Servei Català de la Salut. Cuatro de los autores (M. Domingo, M. de Antonio, B. González y J. Lupón) supervisaron la confirmación de los eventos.
Análisis de los datos y estadísticasLas variables cualitativas se presentan en forma de número absoluto (porcentaje) y las variables continuas, como media±desviación estándar o mediana [intervalo intercuartílico], en función de que la distribución de datos fuese normal o no normal evaluada mediante gráficos Q-Q normales. Las diferencias entre los grupos de estudio se analizaron con la prueba de la χ2 para las variables cualitativas y con la prueba de la t de Student o la prueba de la U de Mann-Whitney para las variables cuantitativas. Para evaluar la relación entre los datos clínicos y el número de líneas B, se realizó una regresión lineal o comparación de medias (prueba de la t de Student), previa transformación logarítmica de las variables con distribución no normal. Se realizaron análisis de regresión de Cox univariante y multivariante (método escalonado retrógrado secundario) de los criterios de valoración clínicos definidos. La variable de interés fue la suma de líneas B en todas las zonas pulmonares como variable continua. Se diseñaron 2 modelos de análisis multivariante, uno con factores clínicos predictivos en el análisis univariante (p <0,1) o considerados clínicamente relevantes (edad, sexo, etiología de la IC isquémica, clase funcional de la New York Heart Association [NYHA] y duración de la IC) y otro modelo que también incluía la NT-proBNP como covariable. Se comprobaron los supuestos de proporcionalidad y linealidad. Para cumplir con el supuesto de linealidad, se utilizaron funciones logarítmicas de la NT-proBNP y la duración de la IC. Se trazaron las curvas de supervivencia de muerte por cualquier causa y del objetivo compuesto de muerte por cualquier causa u hospitalización por IC dividiendo a los pacientes en 2 grupos según los cuartiles (Q) de la suma de líneas B y comparando el Q4 (el 25% de pacientes con un recuento de líneas B> Q3) con el resto de los pacientes, teniendo en cuenta que este punto de corte era el mejor valor según el área bajo la curva (ABC). También se representaron las curvas de incidencia acumulada del objetivo compuesto de muerte por cualquier causa u hospitalización por IC. Por último, se construyeron modelos predictivos integrales basados en las covariables clínicas que continuaron siendo significativas en los análisis de regresión de Cox más el sexo, tanto para el objetivo compuesto como para la muerte por cualquier causa, y tanto con como sin la introducción de la NT-proBNP en el modelo. Después se añadió a los modelos el recuento total de líneas B de la EP. La bondad de ajuste se evaluó mediante la modificación de Royston del estadístico R2 de Nagelkerke para los modelos de riesgos proporcionales, se trazaron las curvas de calibración y se analizó la discriminación con el estadístico C de Harrell (que tiene en cuenta el tiempo transcurrido hasta el evento, a diferencia del ABC utilizado habitualmente). La reclasificación se evaluó con el índice de mejora de reclasificación neta (IRN) y el índice de mejora de discriminación integrada (IDI).
Los análisis estadísticos se realizaron con SPSS 24 (SPSS Inc., Estados Unidos) y STATA V.13.0 (Estados Unidos). Se consideró estadísticamente significativo un valor de p bilateral < 0,05.
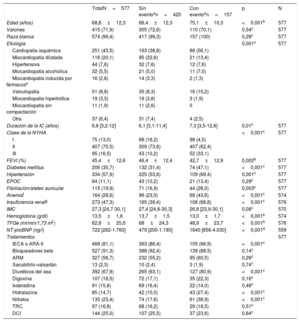
RESULTADOSAsociación de datos demográficos y ecografía pulmonar con datos clínicosSe evaluó prospectivamente a un total de 577 pacientes consecutivos. La tabla 1 muestra las características demográficas y clínicas de todos los pacientes y en relación con el objetivo compuesto de muerte por cualquier causa u hospitalización por IC. En resumen, la media de edad fue 70 años, la mayoría de los pacientes eran varones, con sobrepeso y, principalmente, en NYHA II, con IC predominantemente de etiología isquémica. La última FEVI fue del 45,4% ± 12,6%, aunque había sido del 34% ± 12,7% en el momento del ingreso a la unidad (visita inicial). La mediana de tiempo transcurrido desde el inicio de la IC fue 78,8 [37,8-144,4] meses. Se trató a los pacientes según las guías de práctica clínica internacionales y 2/3 recibieron diuréticos del asa. Los pacientes con un evento eran mayores y presentaban más comorbilidades y peor función renal, lo que explica una menor toma de inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II y una mayor administración de hidralazina.
Características demográficas y clínicas de los pacientes estudiados
| TotalN=577 | Sin eventoan=420 | Con eventoan=157 | p | N | |
|---|---|---|---|---|---|
| Edad (años) | 68,8±12,3 | 66,4±12,3 | 75,1±10,3 | <0,001b | 577 |
| Varones | 415 (71,9) | 305 (72,6) | 110 (70,1) | 0,54c | 577 |
| Raza blanca | 574 (99,4) | 417 (99,3) | 157 (100) | 0,28c | 577 |
| Etiología | 0,001c | 577 | |||
| Cardiopatía isquémica | 251 (43,5) | 163 (38,8) | 88 (56,1) | ||
| Miocardiopatía dilatada | 116 (20,1) | 95 (22,6) | 21 (13,4) | ||
| Hipertensiva | 44 (7,6) | 32 (7,6) | 12 (7,6) | ||
| Miocardiopatía alcohólica | 32 (5,5) | 21 (5,0) | 11 (7,0) | ||
| Miocardiopatía inducida por fármacose | 16 (2,8) | 14 (3,3) | 2 (1,3) | ||
| Valvulopatía | 51 (8,8) | 35 (8,3) | 16 (10,2) | ||
| Miocardiopatía hipertrófica | 19 (3,3) | 16 (3,8) | 3 (1,9) | ||
| Miocardiopatía sin compactación | 11 (1,9) | 11 (2,6) | 0 | ||
| Otra | 37 (6,4) | 31 (7,4) | 4 (2,5) | ||
| Duración de la IC (años) | 6,6 [3,2-12] | 6,1 [3,1-11,4] | 7,3 [3,5-12,6] | 0,01c | 577 |
| Clase de la NYHA | <0,001c | 577 | |||
| I | 75 (13,0) | 68 (16,2) | 98 (4,5) | ||
| II | 407 (70,5) | 309 (73,6) | 407 (62,4) | ||
| III | 95 (16,5) | 43 (10,2) | 52 (33,1) | ||
| FEVI (%) | 45,4±12,6 | 46,4±12,4 | 42,7±12,9 | 0,002b | 577 |
| Diabetes mellitus | 206 (35,7) | 132 (31,4) | 74 (47,1) | <0,001c | 577 |
| Hipertensión | 334 (57,9) | 225 (53,6) | 109 (69,4) | 0,001c | 577 |
| EPOC | 64 (11,1) | 43 (10,2) | 21 (13,4) | 0,29c | 577 |
| Fibrilación/aleteo auricular | 115 (19,9) | 71 (16,9) | 44 (28,0) | 0,003c | 577 |
| Anemiaf | 164 (28,6) | 96 (23,0) | 68 (43,6) | <0,001c | 574 |
| Insuficiencia renalg | 273 (47,3) | 165 (39,4) | 108 (68,8) | <0,001c | 576 |
| IMC | 27,3 [24,7-30,1] | 27,4 [24,8-30,3] | 26,8 [23,9-30,1] | 0,08c | 570 |
| Hemoglobina (g/dl) | 13,5±1,6 | 13,7±1,5 | 13,0±1,7 | <0,001b | 574 |
| TFGe (ml/min/1,73 m2) | 62,8±25,6 | 68±24,3 | 48,9±23,7 | <0,001b | 576 |
| NT-proBNP (ng/l) | 722 [262-1.760] | 479 [200-1.190] | 1640 [856-4.030] | <0,001d | 559 |
| Tratamientos | 577 | ||||
| IECA o ARA-II | 468 (81,1) | 363 (86,4) | 105 (66,9) | <0,001c | |
| Bloqueadores beta | 527 (91,3) | 388 (92,4) | 139 (88,5) | 0,14c | |
| ARM | 327 (56,7) | 232 (55,2) | 95 (60,5) | 0,26c | |
| Sacubitrilo-valsartán | 13 (2,3) | 10 (2,4) | 3 (1,9) | 0,74c | |
| Diuréticos del asa | 392 (67,9) | 265 (63,1) | 127 (80,9) | <0,001c | |
| Digoxina | 107 (18,5) | 72 (17,1) | 35 (22,3) | 0,16c | |
| Ivabradina | 91 (15,8) | 69 (16,4) | 22 (14,0) | 0,48c | |
| Hidralazina | 85 (14,7) | 42 (10,0) | 43 (27,4) | <0,001c | |
| Nitratos | 135 (23,4) | 74 (17,6) | 61 (38,9) | <0,001c | |
| TRC | 97 (16,8) | 68 (16,2) | 29 (18,5) | 0,51c | |
| DCI | 144 (25,0) | 107 (25,5) | 37 (23,6) | 0,64c |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; DCI: desfibrilador cardiaco implantable; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; TFGe: tasa de filtrado glomerular estimada (ecuación del CKD-EPI); TRC: terapia de resincronización cardiaca.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
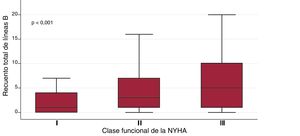
El tiempo entre la primera visita a la unidad y la realización de la EP fue de 69,5±50,8 meses (mediana, 59,6 [24,8-98,3] meses). Solo 12 pacientes habían ingresado en el hospital durante los 6 meses anteriores. El número medio de líneas B en toda la cohorte fue de 5,1±6,1. La distribución de la suma total de líneas B por paciente se muestra en la figura 1 del material adicional. Los cuartiles del recuento de líneas B fueron los siguientes: Q1=1 línea B, Q2=3 líneas B y Q3=7 líneas B. Las líneas B variaron de 0 (observadas en 1/4 pacientes) a 31. Se encontró una asociación entre la suma de líneas B y variables como la edad (coeficiente β = 0,11; p <0,001), logNT-proBNP (coeficiente β = 1,03; p<0,001), fibrilación/aleteo auricular (media, 6,4±6,5 frente a 4,7±6,0; p=0,007), diuréticos del asa (media, 5,7±6,7 frente a 4,4±5,8; p<0,05) y clase NYHA (coeficiente β = 1,87; p<0,001), y una asociación inversa con el logaritmo del índice de masa corporal (logIMC) (coeficiente 03b2 = –5,0; p=0,001). Los diagramas de cajas de la suma de líneas B en relación con la clase funcional de la NYHA se muestran en la figura 1. La asociación entre la suma de líneas B y logNT-proBNP (R=0,23; p<0,001) se muestra en la figura 2 del material adicional. En cambio, no se encontró asociación alguna con otras variables, como la FEVI (coeficiente β = 0,004; p=0,83), tiempo desde el inicio de la IC (coeficiente β = 0,14; p=0,64) o sexo (varones, 5,0±6,1, frente a mujeres, 5,3±6,4; p=0,64).
Diagrama de cajas de la suma de líneas B en todas las áreas pulmonares en relación con la clase funcional de la NYHA. La caja central representa los valores desde el cuartil inferior hasta el superior; la línea media es la mediana; las barras en T se extienden a los valores mínimo y máximo, excluidos los valores atípicos y extremos, que no se muestran. NYHA: New York Heart Association.
Durante un seguimiento medio de 31±7,1 meses, fallecieron 111 pacientes (26, por IC) y 74 tuvieron al menos 1 ingreso relacionado con IC. El objetivo compuesto de muerte por cualquier causa u hospitalización por IC ocurrió en 157 pacientes.
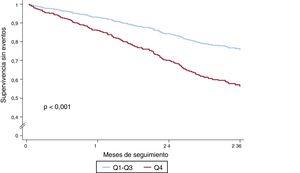
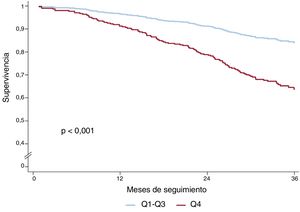
En el análisis univariante, la suma de líneas B mostró una relación significativa tanto con el criterio de valoración compuesto (hazard ratio [HR] = 1,05; intervalo de confianza del 95% [IC95%], 1,03-1,08; p < 0,001) como con la muerte por cualquier causa (HR = 1,06; IC95%, 1,04-1,09; p < 0,001). La tabla 1 del material adicional muestra los resultados de los análisis univariantes del objetivo compuesto y de la muerte por cualquier causa. La figura 2 muestra las curvas de supervivencia sin eventos del objetivo compuesto respecto al número de líneas B (Q4 frente a Q1-3) y la figura 3, las curvas de supervivencia de la muerte por cualquier causa. El hecho de tener 8 o más líneas B (Q4) duplicó el riesgo de que se produjera el objetivo compuesto (HR = 2,08; IC95%, 1,50-2,88; p < 0,001) y aumentó 2,6 veces el riesgo de muerte por cualquier causa (HR = 2,59; IC95%, 1,77-3,78; p < 0,001). En un análisis de sensibilidad, la suma de líneas B no se relacionó con eventos a corto plazo (3-6 meses), aunque el número de eventos fue demasiado bajo para extraer conclusiones sólidas.
Curvas de supervivencia sin eventos del objetivo clínico compuesto (muerte por cualquier causa u hospitalización por IC). Se dividió a los pacientes según el mejor punto de corte de la suma de líneas B en todas las áreas pulmonares: < 8 líneas B (Q1-Q3) frente a ≥ 8 líneas B (Q4).
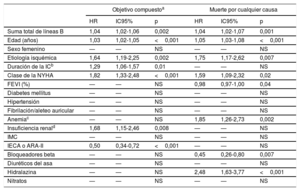
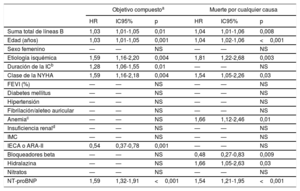
En el análisis multivariante, tanto con las variables clínicas solamente (tabla 2) como tras añadir la NT-proBNP (tabla 3), la suma de líneas B se asoció de manera independiente con el objetivo compuesto (p=0,002 y p=0,01) y con la muerte por cualquier causa (p=0,001 y p=0,008), con un aumento del riesgo de un 3-4% por cada adición de 1 línea B.
Análisis de regresión de Cox multivariante con covariables clínicas del objetivo compuesto y de la muerte por cualquier causa
| Objetivo compuestoa | Muerte por cualquier causa | |||||
|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | |
| Suma total de líneas B | 1,04 | 1,02-1,06 | 0,002 | 1,04 | 1,02-1,07 | 0,001 |
| Edad (años) | 1,03 | 1,02-1,05 | <0,001 | 1,05 | 1,03-1,08 | <0,001 |
| Sexo femenino | — | — | NS | — | — | NS |
| Etiología isquémica | 1,64 | 1,19-2,25 | 0,002 | 1,75 | 1,17-2,62 | 0,007 |
| Duración de la ICb | 1,29 | 1,06-1,57 | 0,01 | — | — | NS |
| Clase de la NYHA | 1,82 | 1,33-2,48 | <0,001 | 1,59 | 1,09-2,32 | 0,02 |
| FEVI (%) | — | — | NS | 0,98 | 0,97-1,00 | 0,04 |
| Diabetes mellitus | — | — | NS | — | — | NS |
| Hipertensión | — | — | NS | — | — | NS |
| Fibrilación/aleteo auricular | — | — | NS | — | — | NS |
| Anemiac | — | — | NS | 1,85 | 1,26-2,73 | 0,002 |
| Insuficiencia renald | 1,68 | 1,15-2,46 | 0,008 | — | — | NS |
| IMC | — | — | NS | — | — | NS |
| IECA o ARA-II | 0,50 | 0,34-0,72 | <0,001 | — | — | NS |
| Bloqueadores beta | — | — | NS | 0,45 | 0,26-0,80 | 0,007 |
| Diuréticos del asa | — | — | NS | — | — | NS |
| Hidralazina | — | — | NS | 2,48 | 1,63-3,77 | <0,001 |
| Nitratos | — | — | NS | — | — | NS |
ARA-II: antagonistas del receptor de la angiotensina II; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NS: no significativo; NYHA: New York Heart Association.
Análisis de regresión de Cox multivariante con covariables clínicas más NT-proBNP del objetivo compuesto y de muerte por cualquier causa
| Objetivo compuestoa | Muerte por cualquier causa | |||||
|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | |
| Suma total de líneas B | 1,03 | 1,01-1,05 | 0,01 | 1,04 | 1,01-1,06 | 0,008 |
| Edad (años) | 1,03 | 1,01-1,05 | 0,001 | 1,04 | 1,02-1,06 | <0,001 |
| Sexo femenino | — | — | NS | — | — | NS |
| Etiología isquémica | 1,59 | 1,16-2,20 | 0,004 | 1,81 | 1,22-2,68 | 0,003 |
| Duración de la ICb | 1,28 | 1,06-1,55 | 0,01 | — | — | NS |
| Clase de la NYHA | 1,59 | 1,16-2,18 | 0,004 | 1,54 | 1,05-2,26 | 0,03 |
| FEVI (%) | — | — | NS | — | — | NS |
| Diabetes mellitus | — | — | NS | — | — | NS |
| Hipertensión | — | — | NS | — | — | NS |
| Fibrilación/aleteo auricular | — | — | NS | — | — | NS |
| Anemiac | — | — | NS | 1,66 | 1,12-2,46 | 0,01 |
| Insuficiencia renald | — | — | NS | — | — | NS |
| IMC | — | — | NS | — | — | NS |
| IECA o ARA-II | 0,54 | 0,37-0,78 | 0,001 | — | — | NS |
| Bloqueadores beta | — | — | NS | 0,48 | 0,27-0,83 | 0,009 |
| Hidralazina | — | — | NS | 1,66 | 1,05-2,63 | 0,03 |
| Nitratos | — | — | NS | — | — | NS |
| NT-proBNP | 1,59 | 1,32-1,91 | <0,001 | 1,54 | 1,21-1,95 | <0,001 |
ARA-II: antagonistas del receptor de la angiotensina II; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NS: no significativo; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association.
La tabla 2 del material adicional resume los elementos clave metodológicos y de la EP del estudio, según el requisito de consenso de los expertos15, así como los principales resultados del estudio.
Por último, se construyeron modelos predictivos integrales, como se especifica en «Métodos». Las covariables comprendían edad, sexo, etiología isquémica, clase funcional de la NYHA, FEVI, anemia y tratamiento con bloqueadores beta e hidralazina. Tanto el objetivo compuesto como la muerte por cualquier causa se analizaron con modelos con y sin NT-proBNP. La modificación de Royston de la prueba estadística de la R2 de Nagelkerke mostró una adecuada bondad de ajuste de los modelos (todos los valores de p entre 0,44 y 0,60) y la predicción de riesgo se parecía mucho al riesgo observado (figura 3 del material adicional). El estadístico C de Harrell fue 0,74 (IC95%, 0,70-0,78) y 0,76 (IC95%, 0,72-0,79) para el objetivo compuesto (mejor si se añadía la NT-proBNP al modelo) y 0,77 (IC95%, 0,72-0,82) y 0,78 (IC95%, 0,74-0,83) para la muerte por cualquier causa (de nuevo, ligeramente mejor con la NT-proBNP). Cuando se añadió el recuento total de líneas B de la EP a estos modelos predictivos, la discriminación fue muy parecida y la reclasificación no fue significativa para el objetivo compuesto (aunque en la dirección correcta), pero para la muerte por todas las causas se observó un aumento numérico en el estadístico C de Harrell en ambos modelos, con y sin NT-proBNP: 0,79 (IC95%, 0,74-0,83) y 0,80 (IC95%, 0,75-0,84). De hecho, la reclasificación fue estadísticamente significativa, de nuevo tanto para el modelo sin la NT-proBNP (IRN, 0,29; IC95%, 0,06-0,53; IDI, 0,023; IC95%, 0,001-0,064) como para el que la contiene (IRN, 0,33; IC95%, 0,002-0,54; IDI, 0,019; IC95%, 0,002-0,059). Estos datos indican una reclasificación correcta de ∼10% de los pacientes.
DISCUSIÓNViabilidad y descripción generalLa EP se puede realizar fácilmente en el contexto ambulatorio y proporciona información in situ sobre la congestión pulmonar. La utilidad de la EP está bien definida en la IC aguda, pero hay pocos datos sobre su valor en la IC crónica. Este estudio unicéntrico sobre el uso de la EP en pacientes ambulatorios con IC crónica estable muestra que puede ser un valioso instrumento pronóstico adicional para los pacientes ambulatorios en combinación con otras variables clínicas. Los datos apuntan a que la EP podría ser más sensible en la detección de congestión pulmonar que la evaluación clínica. Además, las líneas B se mantuvieron como un factor pronóstico independiente sin tener en cuenta la NT-proBNP y mostraron que la EP podría ser útil para la estratificación pronóstica de los pacientes ambulatorios con IC y toda la gama de FEVI.
Asociación de la ecografía pulmonar con los datos clínicosAunque se consideró estables (CDSS <2) a todos los pacientes del estudio, el número medio de líneas B en la cohorte fue 5,1±6,1, lo que indica que la EP podría ser un instrumento mejor para detectar la congestión pulmonar subclínica que la evaluación clínica, de manera semejante que en publicaciones anteriores16,17. Además, al igual que en otros estudios sobre IC aguda o crónica, se observó que el número de líneas B aumentaba con el empeoramiento de la clase funcional de la NYHA y se correlacionaba significativamente con las cifras de NT-proBNP18,19, ambos criterios sustitutos para valorar la congestión. Nuestros datos muestran que la suma total de líneas B se asoció inversamente con el índice de masa corporal, como se ha citado con anterioridad6,17,20. Sorprendentemente, una publicación reciente ha demostrado que el índice de masa corporal influye menos en el número total de líneas B que la NT-proBNP en la IC aguda, con una disminución menor que la NT-proBNP con un índice de masa corporal en aumento, lo que indica que la EP puede ser útil en pacientes con IC a pesar de la obesidad21. En nuestro estudio, con el 25% de pacientes obesos, la correlación entre la suma de líneas B y la NT-proBNP fue estadísticamente significativa, pero bastante discreta. Otro hallazgo interesante de nuestro estudio es la falta de asociación con variables como la FEVI, de manera semejante que en otros informes anteriores16,17,20 que muestran que la EP es un instrumento valioso en todo el espectro de la IC.
Valor pronóstico de la ecografía pulmonarEn este estudio de una cohorte de pacientes ambulatorios con IC sistólica de leve a moderada (muchos de ellos con FEVI parcialmente recuperada), se evaluó la capacidad de la EP para detectar a pacientes con alto riesgo de sufrir un evento adverso. Para ello, se elaboró un protocolo de EP estandarizado y se exploraron 8 áreas torácicas para analizar tanto el hemitórax anterior como el lateral. Los resultados muestran que en el cuartil más alto de líneas B (8 o más líneas B) se identificó a un grupo de pacientes con un riesgo muy alto de muerte por cualquier causa u hospitalización por IC. De hecho, con un número mayor de líneas B se identificó a pacientes con un riesgo 2,6 veces mayor de muerte por cualquier causa. La suma de líneas B en todas las áreas pulmonares de la EP, junto con otras variables de pronóstico clínicamente importantes, se mantuvo como un factor pronóstico independiente, incluso cuando se incluyeron los péptidos natriuréticos en el modelo. Estos datos son relevantes, ya que la determinación de NT-proBNP no está disponible en muchas unidades de pacientes ambulatorios. Otros estudios más pequeños con un periodo de seguimiento más corto y pacientes con diferente grado de riesgo han utilizado un protocolo de exploración diferente (exploración de las líneas B de 28 regiones), pero han obtenido resultados semejantes respecto al valor pronóstico de la EP en la IC crónica16,17,22,23. La comparación directa de estos estudios no es sencilla, principalmente a causa de los diferentes protocolos de estudio con EP utilizados.
De hecho, los instrumentos de discriminación y reclasificación mostraron una ganancia incremental en la estimación del riesgo de muerte por cualquier causa tras añadir la EP a los modelos predictivos clínicos integrales, incluso en presencia de NT-proBNP. Esto no se observó en el objetivo compuesto de muerte por cualquier causa u hospitalización por IC según el diseño del estudio. Se desconocían los datos clínicos en los análisis de la EP, así como el tratamiento en los datos de la EP. Sin embargo, no puede excluirse la posibilidad de que los investigadores hayan tenido conocimiento de los resultados de la EP. Cualquier modificación del tratamiento, especialmente el tratamiento diurético, repercutiría en la hospitalización por IC. Aunque esta posibilidad es hipotética, podría ser factible en el tratamiento diario del paciente con IC. De hecho, datos recientes han demostrado que el tratamiento diurético personalizado guiado por EP mejora los resultados de los pacientes ambulatorios después de una hospitalización por IC24, especialmente los relacionados con el tratamiento de la congestión.
Según los resultados, se cree que la EP podría integrarse en la asistencia habitual de los pacientes con IC, ya que es un instrumento fácil de utilizar en las consultas ambulatorias de IC. De hecho, datos anteriores señalan que incluso los no médicos suelen ser capaces de realizar e interpretar las exploraciones de EP después de una breve formación25.
Limitaciones del estudioSe trata de un estudio unicéntrico con pacientes tratados en una unidad de IC multidisciplinaria específica de un hospital de nivel terciario, con pacientes tratados con un protocolo común. A la mayoría los derivaron tras al menos 1 ingreso hospitalario o con antecedentes de tratamiento difícil, pero muchos también presentaban una FEVI parcialmente recuperada. No puede ignorarse el sesgo de selección por gravedad y tratamiento de la enfermedad, y nuestros datos no pueden extrapolarse a toda la población con IC. El número de líneas B puede verse afectado por la duración del videoclip26. En nuestro estudio, por las características del aparato, se grabaron videoclips de 2 s que pueden subestimar el número de líneas B.
CONCLUSIONESNuestros datos muestran que la EP realizada in situ durante una visita programada de pacientes ambulatorios con IC estable es una prueba valiosa y aporta información importante sobre el pronóstico, junto con otras variables clínicas. La congestión pulmonar subclínica en la EP es habitual, incluso en pacientes clínicamente estables. La medición de líneas B con EP es un predictor independiente de muerte por cualquier causa y del objetivo clínico compuesto de muerte por cualquier causa u hospitalización por IC, aparte de la NT-proBNP.
FINANCIACIÓNEl estudio recibió una subvención competitiva de La Marató de TV3 (PI 201510.10).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
La EP es un instrumento fácil de aplicar a pacientes con IC y ofrece información in situ sobre la congestión pulmonar.
- –
La utilidad de la EP en la IC aguda está bien definida, pero hay pocos datos sobre su valor en la IC crónica estable.
- –
La EP se presentó como un instrumento mejor que la evaluación clínica para detectar la congestión pulmonar subclínica.
- –
El número total de líneas B es un factor independiente de muerte y del compuesto de muerte por cualquier causa u hospitalización por IC.
- –
Con la EP se identifica a los pacientes con IC crónica estable en alto riesgo de muerte por cualquier causa u hospitalización por IC en todo el espectro de la FEVI.
- –
La integración de la EP con los datos clínicos de pacientes ambulatorios con IC crónica mejora la estratificación pronóstica independientemente de que se disponga de péptidos natriuréticos.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2020.07.019