Palabras clave
INTRODUCCIÓN
La displasia arritmogénica de ventrículo derecho (DAVD) es una enfermedad del músculo cardíaco caracterizada, en sus estadios finales, por la sustitución del miocardio normal por grasa o tejido fibroadiposo, constituyendo el sustrato que condiciona alteraciones eléctricas y mecánicas del miocardio. Ambos ventrículos pueden verse implicados, si bien la forma habitual de presentación afecta fundamentalmente al ventrículo derecho (VD)1,2.
Las manifestaciones clínicas más frecuentes son las producidas por taquicardias ventriculares (típicamente con morfología de bloqueo de rama izquierda) secundarias a la inestabilidad eléctrica del miocardio del VD. Se puede observar desde extrasistolia aislada sin repercusión clínica hasta taquicardias sostenidas que pueden degenerar en fibrilación ventricular. También se ha descrito en fases avanzadas de la enfermedad el desarrollo de insuficiencia cardíaca derecha, y es muy poco frecuente como primera manifestación clínica3,4. La enfermedad es más frecuente en varones jóvenes (tercera o cuarta década de la vida), y se encuentran antecedentes familiares en un tercio de los casos1,5. La incidencia de la DAVD se estima en 1/5.000, aunque probablemente aumentará debido al mayor conocimiento de ésta por los clínicos6.
El diagnóstico de esta entidad se basa en los criterios electrocardiográficos, arrítmicos, histopatológicos, genéticos y morfofuncionales propuestos por el Grupo de Trabajo para la DAVD de la Sociedad Europea de Cardiología, divididos en mayores y menores, e internacionalmente aceptados7. Entre todos, los que aportan información sobre la función y morfología del VD desempeñan un papel fundamental en el diagnóstico. Estos datos los proporcionan diferentes técnicas de imagen como la ecocardiografía, la angiografía y, más recientemente, la cardiorresonancia magnética (CRM). La ecocardiografía, aun siendo una técnica útil, presenta una importante limitación en la valoración de las alteraciones segmentarias del VD, además de las posibles limitaciones derivadas de una subóptima «ventana» ecocardiográfica8. La angiografía se considera el patrón oro y puede complementarse además con la toma de biopsias para la detección de infiltración grasa; sin embargo, se trata de una técnica invasiva no exenta de complicaciones. La CRM es una técnica incruenta que permite una adecuada valoración del VD y se ha propuesto como la técnica de imagen de elección para la valoración diagnóstica de pacientes con sospecha diagnóstica de DAVD. Sin embargo existe controversia a este respecto y su utilidad no ha sido aclarada9-13.
El objetivo principal de nuestro estudio es valorar, en nuestro medio, la utilidad diagnóstica de la cardiorresonancia magnética en los pacientes con sospecha clínica de DAVD y comparar los hallazgos por CRM y por ecocardiografía en los pacientes que fueron estudiados con ambas técnicas.
MATERIAL Y MÉTODO
Se trata de un estudio retrospectivo en el que revisamos todas las peticiones de CRM en el período comprendido entre enero de 1993 y diciembre de 2002 de nuestro centro; se seleccionaron las solicitudes por sospecha diagnóstica de DAVD. Obtuvimos así una muestra de 46 estudios CRM, correspondientes a todos los pacientes que habían presentado arritmias ventriculares con morfología de bloqueo de rama izquierda y que fueron remitidos a nuestro centro con el diagnóstico de sospecha de DAVD. La edad media del grupo era de 42 ± 19 años (rango: 11-73), y estaba compuesto por 25 varones y 21 mujeres.
Los 46 pacientes fueron estudiados mediante CRM con un equipo Siemens Magnetom 1.0T (enero 1993-mayo 2001) y Philips Intera de 1.5T (junio 2001-diciembre 2002), con antena específica para estudios cardiológicos en ambos equipos. Para estudiar la anatomía y la infiltración grasa de las paredes ventriculares, en particular en la pared libre y el infundíbulo del VD, realizamos, en el equipo Siemens, secuencias Spin-Echo-T1 (tiempo de repetición [TR] variable según la frecuencia cardíaca del paciente; tiempo de eco [TE] de 30 ms; campo de visión de 400 mm; grosor de corte de 8 mm a 10 mm; matriz de 128 x 256). En el equipo Philips, secuencias Black Blood o sangre negra (TR 1 ms; TE 4,5 ms; flip angle 90°; grosor 7 mm; matriz 256 x 256). En ambos equipos se programaron estas secuencias en planos torácicos axial y oblicuo sagital orientado sobre el infundíbulo derecho. Para estudiar la función ventricular derecha e izquierda y detectar alteraciones de la contractilidad global o segmentaria, realizamos secuencias de cine en los cortes longitudinal y transversal del ventrículo izquierdo, utilizando una secuencia tipo ecogradiente en el equipo Siemens (TR 50 ms; TE 12 ms; flip angle 60°; 16 fases) y tipo balanced-Fast Field Echo (TR 3,2 ms; TE 1,6 ms; flip angle 60°; grosor 10 mm; matriz 160 x 256) en el equipo Philips.
Se clasificaron las alteraciones observadas mediante CRM según los criterios diagnósticos para DAVD establecidos por el grupo de trabajo de la Sociedad Europea de Cardiología7 (tabla 1), divididos en criterios mayores y menores. El análisis de las imágenes se realizó de manera simultánea y por consenso entre 2 cardiólogos con amplia experiencia en la interpretación de estudios CRM, que eran conocedores de la sospecha clínica de DAVD. Las medidas de los diámetros del VD se realizaron en el corte longitudinal de 4 cámaras del corazón.
Revisamos finalmente las historias clínicas de esos 46 pacientes para comprobar cuántos cumplieron los criterios establecidos por la Sociedad Europea de Cardiología para el diagnóstico de DAVD y cuáles fueron en ellos los hallazgos por CRM.
Por otra parte, 31 de estos 46 pacientes fueron estudiados mediante ecocardiografía en nuestro centro. Comparamos en ellos la capacidad en la detección de afección del VD entre la CRM y la ecocardiografía. Para ello, recogimos los criterios mayores y menores detectados por ambas técnicas en estos 31 pacientes, así como los diámetros del VD. Además, comprobamos si existieron diferencias en el diagnóstico final en caso de haberse utilizado sólo una técnica de imagen. El diámetro telediastólico del VD por ecocardiografía se midió a partir del plano paraesternal longitudinal.
Análisis estadístico
El análisis de comparación de medias de las variables cuantitativas se efectuó mediante la prueba de la t de Student, considerando como significación estadística un valor de p < 0,05.
La sensibilidad y especificidad de la infiltración grasa como criterio diagnóstico de displasia del VD quedaron definidas como la proporción de pacientes en que se demostraba su presencia o ausencia en el estudio de CRM con respecto al total de casos con y sin enfermedad demostrada, respectivamente. Considerando los resultados verdaderos/falsos positivos y verdaderos/falsos negativos se determinaron los respectivos valores predictivos positivos y negativos así como el intervalo de confianza (IC) del 95%.
RESULTADOS
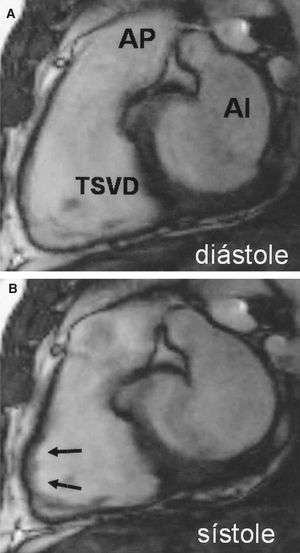
Se obtuvieron imágenes valorables por CRM en el 100% de los casos estudiados. No hubo ninguna complicación y todos los pacientes toleraron perfectamente los tiempos de apnea. En 24 pacientes (52%) detectamos alguna anomalía en el VD mediante CRM (ya fuera criterio mayor o criterio menor), mientras que en los otros 22 (48%) pacientes no se observó ningún hallazgo patológico (tabla 2). El hallazgo más frecuentemente identificado por CRM fue la presencia de una acinesia/discinesia regional del VD (14 pacientes) (fig. 1), mientras que no objetivamos ningún caso de dilatación segmentaria grave de VD.
Fig. 1. Imágenes diastólica (A) y sistólica (B) correspondientes a una secuencia de cine-RM (B-FFE) orientada sobre un plano longitudinal vertical del infundíbulo ventricular derecho. Las imágenes obtenidas permiten analizar con detalle las alteraciones de la contractilidad a este nivel, como en este caso en el que se aprecia una afectación segmentaria con una zona claramente discinética (flechas). AI: aurícula izquierda; AP: arteria pulmonar; TSVD: tracto de salida del ventrículo derecho.
Del total de 46 pacientes estudiados por CRM, se comprobó, tras la revisión de la historia clínica, que sólo 5 cumplieron finalmente los criterios generales exigidos para DAVD (3 varones y 2 mujeres, edad media de 30 años); 4 de ellos presentaron al menos un criterio mayor identificado mediante CRM y el otro paciente 2 criterios menores (tabla 3).
En los 5 pacientes que fueron diagnosticados de DAVD se observó un diámetro telediastólico del VD significativamente superior al observado en los otros 41 pacientes (45 ± 3,08 mm frente a 36,6 ± 5,16 mm, respectivamente; p < 0,01).
Infiltración grasa del ventrículo derecho
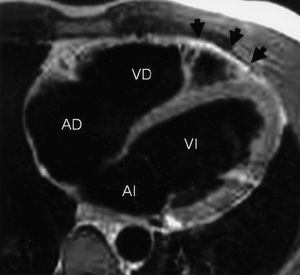
En 9 pacientes se identificaron en las secuencias Spin-Echo T1 o sangre negra imágenes compatibles con infiltración grasa del VD (fig. 2). En 6 casos constituyó el único hallazgo patológico, mientras que en los otros 3 se asociaron además alteraciones contráctiles o dilatación del VD. Estos últimos 3 pacientes pertenecían al grupo con criterios diagnósticos de DAVD. La sensibilidad del hallazgo de infiltración grasa del VD como criterio diagnóstico de DAVD fue del 60% (3/5) (IC del 95%, 23-88%) y la especificidad del 85% (35/41) (IC del 95%, 71-93%). El valor predictivo positivo fue del 33% (3/9) (IC del 95%, 12-65%) y el negativo del 95% (35/37) (IC del 95%, 82-99%).
Fig. 2. Imagen axial obtenida del ventrículo derecho mediante una secuencia Black-Blood o de sangre negra. Mediante esta secuencia la señal del tejido adiposo destaca por su gran intensidad (blanca). En este caso la señal hiperintensa señalada con las flechas identifica la presencia de grasa que infiltra al segmento apical del miocardio ventricular derecho. AD: aurícula derecha; AI: aurícula izquierda; VD: ventrículo derecho; VI: ventrículo izquierdo.
Ecocardiografía frente a CRM
En el subgrupo de 31 pacientes en los que disponíamos de estudios por ambas técnicas, la ecocardiografía detectó alguna alteración del VD (criterio mayor o criterio menor) en 18 pacientes (58%) frente a 19 por CRM (61%) (p = 1, NS). Ambas técnicas detectaron un número similar de criterios menores, 19 la CRM y 18 la ecocardiografía, pero la CRM detectó el doble de criterios mayores, 8 frente a 4, que la ecocardiografía. Tras la revisión de las historias clínicas se comprobó que 4 de estos 31 pacientes fueron diagnosticados de DAVD. En la tabla 4 se muestran los diferentes criterios diagnósticos identificados mediante CRM o ecocardiografía en esos 4 pacientes con diagnóstico final de DAVD. Vemos en esta tabla que si sólo se hubiera realizado ecocardiografía, 2 de esos 4 pacientes no habrían alcanzado criterios diagnósticos de DAVD.
Por otra parte, ambas técnicas detectaron dilatación significativa del VD en los 4 pacientes que fueron diagnosticados de DAVD. Por CRM el diámetro telediastólico del VD en los pacientes afectados de displasia fue de 45,5 ± 3,31 mm frente a 38,11 ± 5,08 mm en los pacientes sin DAVD (p < 0,05), mientras que por ecocardiografía fue de 33 ± 3,46 mm frente a 27,25 ± 7,5 mm, respectivamente (p < 0,05).
DISCUSIÓN
Este trabajo demuestra que la CRM permite una valoración adecuada del VD en el 100% de los pacientes con sospecha clínica de DAVD. La CRM es una técnica no invasiva, reproducible, que permite valorar con gran precisión la función y la morfología del VD en pacientes con sospecha clínica de DAVD14,15. Se trata probablemente de la mejor técnica de imagen para la demostración de alteraciones estructurales y funcionales del VD16. Su principal ventaja en la valoración del VD es la posibilidad de obtener imágenes en cualquier plano del espacio, permitiendo valorar con precisión regiones como el infundíbulo, de difícil visualización por otras técnicas.
En la población estudiada, la CRM permitió descartar el diagnóstico de DAVD en el 48% de los casos. Ello se debe a que todos los pacientes con criterios diagnósticos de DAVD presentan alteraciones morfológicas o funcionales del VD, potencialmente detectables por CRM. Es importante destacar que, de acuerdo con nuestros resultados, la presencia de infiltración grasa por sí misma no implica el diagnóstico de DAVD, sino que debe asociarse a otras anomalías morfológicas o de la contractilidad del VD.
Por otra parte, cuando comparamos la ecocardiografía con la CRM en el estudio de la DAVD, observamos que ambas técnicas son útiles en el despistaje inicial de la DAVD. Sin embargo, la CRM permite obtener una valoración morfológica y funcional del VD más precisa y completa, evitando la realización de otras pruebas adicionales.
Alteraciones morfológicas/funcionales del ventrículo derecho
En nuestro estudio el hallazgo más frecuente en los 5 pacientes que cumplían criterios diagnósticos de DAVD fueron las alteraciones de la contractilidad del VD (5/5) asociadas o no a infiltración de grasa intramiocárdica VD (3/5) (tabla 3). Además, y de acuerdo con lo referido en la literatura médica17, la CRM fue capaz de detectar dilatación del VD en los pacientes afectados de DAVD.
Valor de la detección de grasa intramiocárdica
La CRM permite identificar la presencia de infiltración grasa intramiocárdica del VD de for ma incruenta9,10,17-20. Sin embargo, este hallazgo no es patognomónico de DAVD. Varios trabajos han demostrado la presencia de infiltración grasa del VD en un porcentaje elevado de pacientes sanos, fundamentalmente de edad avanzada21-23. En nuestra serie, 9 de los 46 pacientes estudiados por CRM presentaron infiltración grasa del VD. En 6 de ellos, éste fue el único criterio diagnóstico identificado y ninguno de ellos perteneció al grupo diagnosticado de DAVD. De esta manera, excluyendo los 5 casos con diagnóstico de DAVD, un 14% de los sujetos estudiados (6/41) presentaba infiltración grasa de VD de significado incierto. La presencia de infiltración grasa en estos pacientes podría corresponder bien a una variante de la normalidad o bien a formas tempranas de la enfermedad que aun no cumplen los criterios diagnósticos requeridos. No obstante, el bajo número de pacientes de este estudio y la ausencia de seguimiento no permiten extraer conclusiones a este respecto. Distintos autores informan de una sensibilidad diagnóstica de la infiltración grasa del VD en casos de DAVD entre el 11 y el 100%, lo que nos indica que ésta es una cuestión que deberá estudiarse con mayor profundidad9,17,24. En concordancia con las cifras publicadas en la literatura médica17,20, en nuestro estudio encontramos una sensibilidad del 60% (3/5) para la presencia de infiltración grasa del VD en el diagnóstico de DAVD. En nuestra serie, cabe destacar que en todos los pacientes diagnosticados de DAVD la presencia de infiltración grasa se asociaba a alteraciones morfológicas o de la contractilidad del VD.
Se ha publicado una elevada variabilidad interobservador para el estudio de la infiltración grasa25,26. Por ello, este diagnóstico debe realizarse por expertos y de forma cuidadosa. Evitaremos así diagnósticos erróneos de DAVD, puesto que este hallazgo constituye un criterio mayor. Las secuencias de supresión grasa pueden ser útiles para confirmar el diagnóstico en casos dudosos. El diagnóstico de DAVD debe alcanzarse siempre basándose en los criterios diagnósticos propuestos por la Sociedad Europea de Cardiología (tabla 1) y nunca sobre la base de los hallazgos obtenidos por una sola prueba, en este caso la CRM13. Se evitarán así situaciones donde se detecta el diagnóstico erróneo de DAVD en un elevado número de pacientes debido a una aplicación poco estricta de los criterios diagnósticos establecidos26.
CRM frente a ecocardiografía
Cuando comparamos la utilidad de la ecocardiografía y la CRM para el diagnóstico de DAVD observamos que ambas técnicas son igual de sensibles en la identificación de pacientes con patología del VD. Sin embargo, como la CRM detecta mayor número de alteraciones patológicas del VD, fundamentalmente criterios mayores, permitió establecer el diagnóstico de DAVD en un mayor número de pacientes. Así, entre los 4 pacientes diagnosticados de DAVD que fueron estudiados por ambas técnicas, 2 no habrían sido diagnosticados de DAVD si sólo se hubieran tenido en cuenta los hallazgos ecocardiográficos (tabla 4). No obstante, es importante destacar que en todos los pacientes con el diagnóstico de DAVD se observa alguna alteración del funcionalismo del VD por ecocardiografía, lo cual le confiere un valor importante para el despistaje de esta afección. No obstante, dado el menor poder diagnóstico de la ecocardiografía, deberá considerarse la realización de una CRM cuando la sospecha clínica sea elevada aunque el ecocardiograma muestre un estudio de VD normal.
Limitaciones
Las principales limitaciones de este estudio son el reducido número de pacientes y que es un estudio transversal con recogida de la información de forma retrospectiva. Asimismo, no se analizó la variabilidad inter e intraobservador. Por otra parte, la ventriculografía y la biopsia del VD se consideran como el patrón oro en el diagnóstico de la DAVD; sin embargo, los pacientes estudiados en este trabajo no fueron sometidos a estas técnicas invasivas (aunque en el momento actual no se recomienda la realización de angiografía/biopsia para confirmar el diagnóstico de DAVD)20. No obstante, en nuestra opinión esta limitación no es determinante dado que existen trabajos en la literatura médica que demuestran una buena correlación entre los hallazgos entre la CRM y la ventriculografía en el estudio del VD9. Respecto de la falta de biopsias, tampoco supone una limitación importante en la valoración de los resultados, ya que no siempre hay una buena correlación entre el hallazgo de infiltración grasa mediante CRM y su detección por biopsia20. Esto se explica por varios motivos: en primer lugar, la zona más afectada por la degeneración miocárdica e infiltración grasa es el llamado triángulo de la displasia, delimitado por el infundíbulo, el ápex y la pared inferobasal (área subtricuspídea), mientras que el lugar habitual de toma de biopsias es el septo interventricular, en su segmento apical, para intentar minimizar el riesgo de perforación; en segundo lugar, la toma de biopsias no deja de ser un proceso aleatorio y puede coincidir, o no, con una zona de infiltración grasa.
Por otro lado, la ausencia de seguimiento de estos pacientes no permite descartar una posible relación entre el hallazgo de grasa intramiocárdica y la evolución de la enfermedad, por lo que no se pueden extraer conclusiones sobre su utilidad pronóstica.
La CRM puede detectar infiltración grasa del VD cuando ésta afecta al 30-40% del espesor miocárdico, utilizando las secuencias fast SE de doble inversión-recuperación y con supresión grasa20. No obstante, especialmente en los pacientes estudiados con el equipo Siemens Magnetom, las secuencias de supresión grasa no se utilizaron sistemáticamente a modo de contraprueba, ya que la excelente resolución espacial de la secuencia SE T1 del equipo Siemens no las hacía imprescindibles a criterio de los exploradores.
CONCLUSIONES
El diagnóstico de DAVD es complejo, puesto que no existe una única prueba que pueda utilizarse para establecer el diagnóstico, que deberá basarse en los criterios mayores y menores internacionalmente aceptados.
Entre las técnicas de imagen utilizadas, destaca la CRM por la calidad de la información que puede proporcionar. En nuestro trabajo, la CRM permitió, mediante una precisa valoración morfológica y funcional del VD, estudiar a pacientes con sospecha de DAVD y evitar la indicación de una angiografía/biopsia, aún consideradas en la actualidad como patrones de referencia, a pesar de todas sus limitaciones.
Aunque la ecocardiografía y la CRM fueron igual de sensibles en la identificación de pacientes con alteraciones morfológicas o funcionales del VD, la rentabilidad diagnóstica de la CRM es superior, ya que logró alcanzar el diagnóstico de DAVD en un mayor número de pacientes, gracias a la identificación de un mayor número de criterios diagnósticos.
Correspondencia: Dr. F. Carreras.
Servicio de Cardiología. Hospital de Sant Pau.
Sant Antoni M.a Claret, 167. 08025 Barcelona. España.
Correo electrónico: fcarreras@santpau.es