El síndrome de Timothy (ST) tipo 2 es una afección extremadamente rara y resistente al tratamiento. Nuestro conocimiento actual del ST tipo 2 se basa en algunos casos publicados. Hermida et al.1 comunicaron el caso de un paciente joven con ST tipo 2 y una mutación p.(Gly402Ser), al que se dio seguimiento durante 9 años en el Hospital Universitario de Amiens (Francia). Los autores hallaron que una combinación de mexiletina y nadolol fue parcialmente efectiva para reducir la administración de descargas apropiadas del desfibrilador del niño. La evolución favorable del paciente tras la sustitución de mexiletina por ranolazina nos impulsó a publicar estos nuevos datos. Los padres del paciente firmaron el consentimiento informado para la publicación de este artículo.
En diciembre de 2010, un niño de 32 meses fue reanimado tras sufrir una parada cardiaca en su domicilio. No se encontró cardiopatía estructural y los electrocardiogramas registrados inicialmente apuntaban a un síndrome de QT largo congénito. En 2016, la secuenciación de nueva generación con un grupo de 51 genes reveló una mutación heterocigota c.1204G>A; p.(Gly402Ser) en el exón 8 del gen CACNA1C. Confirmamos la existencia de la mutación analizando una muestra de saliva aislada. Ninguno de los padres era portador de la mutación en los tejidos estudiados (sangre y saliva) y ninguno de los miembros de la familia presentaba características cardiológicas semejantes. Por lo tanto, consideramos que la mutación era de novo.
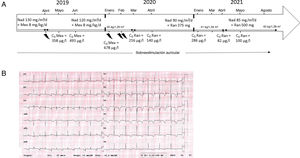
Tras el implante de un dispositivo desfibrilador cuando el niño tenía 2 años y medio, este recibió 29 descargas apropiadas durante los 10 años siguientes (figura 1A). El paciente fue tratado alternativamente con nadolol solo (2 periodos de 22 meses) y en combinación con mexiletina (un periodo de 11 meses y otro de 54 meses). También se decidió la denervación simpática cardiaca izquierda y se inició una sobreestimulación auricular a 100 lpm.
A: cronograma de los últimos 3 años de seguimiento. B: electrocardiograma típico registrado mientras el paciente tomaba nadolol y ranolazina. C0: concentración residual; DAI: desfibrilador automático implantable; Mex: mexiletina; Nad: nadolol; PA: parada cardiaca; Ran: ranolazina. El símbolo del rayo representa la descarga del DAI.
El estado del paciente empeoró a principios de 2020, con 3 descargas oportunas en 2 meses mientras el paciente tomaba nadolol más mexiletina. A principios de marzo de 2020, se reemplazó la mexiletina por una formulación de ranolazina de liberación prolongada (LP). Se empezó con una dosis de 375mg 2 veces al día; en ese momento, el paciente pesaba 35 kg. El tratamiento con esta dosis produjo una prolongación considerable del intervalo QT, con un aumento en el valor medio ± desviación estándar de 563 ± 15ms (la media de 10 electrocardiogramas [ECG] registrados de enero a febrero de 2020) a 587 ± 15ms (la media de 16 ECG registrados en marzo de 2020). Se disminuyó la dosis de ranolazina LP a 375 mg 1 vez al día y el intervalo QTc se estabilizó en un valor medio de 568 ± 17ms (con 26 ECG registrados entre marzo de 2020 y abril de 2021; figura 1B). La concentración de ranolazina en sangre del paciente se analizó 3 veces entre el cambio y el mes de abril de 2021, y siempre estuvo en el margen terapéutico esperado (126-318 ng/ml). A finales de abril de 2021, la concentración en sangre cayó por debajo del margen terapéutico, por lo que se aumentó la dosis de ranolazina LP a 500 mg 1 vez al día.
El paciente, tratado con nadolol más ranolazina, no recibió ninguna descarga apropiada durante los siguientes 18 meses; esto contrasta con 4 descargas apropiadas durante los 12 meses anteriores al cambio. Cabe señalar, por un lado, que el paciente ya no había recibido descargas los 17 meses entre noviembre de 2015 y mayo de 2017, por lo cual otros factores distintos del tratamiento (p. ej., cambios hormonales de la preadolescencia) podrían explicar la ausencia de descargas actual. Por otro lado, el paciente no ha tomado ninguna medicación concomitante y no ha habido cambios en las concentraciones de potasio en sangre o la actividad física; esto descarta una serie de factores de confusión que, de otro modo, podrían haber explicado el periodo actual sin descargas.
Los resultados de las simulaciones in vitro indican que la ranolazina es eficaz para normalizar los desencadenantes de arritmias en la arritmia dependiente de bradicardia y en el síndrome de QT largo tipo 32. En el estudio de Chorin et al.3 de pacientes con síndrome de QT largo tipo 3, el tratamiento con ranolazina provocó un intervalo QT más corto.
En 2007 se comunicaron datos in vitro que respaldan la eficacia de la ranolazina en el ST4. Los datos clínicos son escasos: el único informe sobre el uso de ranolazina para tratar a un paciente adulto con ST tipo 2 y la mutación p.(Gly402Ser) fue publicado por Shah et al.5 en 2012. A continuación, se presenta un segundo caso de tratamiento exitoso del ST tipo 2 con ranolazina, con un periodo de seguimiento de 18 meses. Consideramos que la ranolazina fue eficaz porque eliminó todos los episodios de arritmia ventricular, aunque no se observó acortamiento del segmento QTc; esto también ocurrió en el caso comunicado por Shah et al. Entre los efectos de las concentraciones terapéuticas de ranolazina en las corrientes iónicas cardiacas, se encuentran la inhibición de las corrientes IKr, INa tardías e ICa,L tardías. La inhibición de IKr por la ranolazina prolonga el potencial de acción (DPA), mientras que la inhibición de INa tardío y ICa,L tardío lo acorta. El impacto clínico neto de la inhibición de estas corrientes de canales iónicos es un discreto aumento del intervalo QTc medio, como se observa en este caso. La capacidad de la ranolazina para producir inhibición de múltiples corrientes (y en particular su capacidad para un fuerte bloqueo de la corriente INa tardía) probablemente subyace a su capacidad para prolongar el QT sin crear el sustrato o desencadenar la aparición de torsade de pointes. De hecho, esta característica podría contribuir a la supresión de los pospotenciales precoces y a una reducción de la dispersión espacial de la repolarización (el sustrato y desencadenante de torsade de pointes) y, por tanto, podría explicar la importante actividad antiarrítmica de la ranolazina. La supresión de los pospotenciales precoces también es fruto de la reducción inducida por ranolazina en [Ca2+]i, que se sabe que modula la actividad desencadenada.
Dado que no existen pautas sobre la dosis óptima de ranolazina para los niños, controlamos la concentración en sangre. Esta monitorización terapéutica del fármaco nos impulsó a administrar el fármaco 1 vez al día (en lugar de 2 como en el caso de los adultos) con eficacia clínica.
El presente caso clínico es el primero en describir el tratamiento exitoso del ST tipo 2 pediátrico con ranolazina. El fármaco ha eliminado la necesidad de descargas apropiadas durante los últimos 18 meses.
FINANCIACIÓNEsta investigación no recibió ninguna subvención específica de instituciones u organismos de los sectores público, comercial o sin ánimo de lucro.
CONTRIBUCIÓN DE LOS AUTORESDiseño, análisis formal, redacción, revisión y edición, y visualización: A. Hermida y J.S. Hermida; metodología y validación: A. Hermida, G. Jedraszak, M. Kubala y J.S. Hermida; investigación, conservación de datos: A. Hermida, G. Jedraszak, M. Kubala, M. Bourgain, S. Bodeau y J.S. Hermida; recursos: A. Hermida, M. Kubala, S. Bodeau y J.S. Hermida; redacción y borrador original: A. Hermida; supervisión: J.S. Hermida.
CONFLICTO DE INTERESESNo se declara.