Palabras clave
HACIA LA UNIFICACIÓN DE CRITERIOS EN EL DIAGNÓSTICO Y EL TRATAMIENTO DE LA HIPERTENSIÓN ARTERIAL
En las últimas décadas, varios organismos nacionales e internacionales han publicado periódicamente las directrices de diagnóstico y tratamiento de la hipertensión arterial (HTA). Las dos más importantes y que más adeptos han aglutinado clásicamente a su alrededor han sido las directrices del Joint National Committee (JNC) americano1 y las publicadas por la Sociedad Europea de Hipertensión, en conjunto con la Sociedad Europea de Cardiología2. Hasta el año 2003, en que se produjo la última publicación de ambos, ha sido evidente la diferente orientación que los hipertensiólogos americanos y europeos han dado al problema. Aunque también, lógicamente, hay muchas similitudes, se observan diferencias notables que han sido analizadas en multitud de artículos al respecto y que el lector puede consultar3,4. La orientación europea está más basada en el tratamiento de la HTA a partir de la estratificación del riesgo cardiovascular individual. La visión americana está más preocupada por los valores de la presión arterial (PA) como marcador preponderante que indicaría la necesidad de tratamiento farmacológico.
La comunión de ambas directrices internacionales ha sido harto difícil por parte de la comunidad científica de a pie que nos dedicamos a tratar a este tipo de pacientes. Es difícil entender cómo, basados en la misma evidencia científica disponible, es posible arribar a orientaciones tan dispares. Por este motivo, la propuesta de una «nueva definición» acuñada por un notable Comité de expertos americanos en representación de la Sociedad Americana de Hipertensión (ASH), encabezados por el Dr. Thomas Giles (su actual presidente) y presentada por primera vez a la comunidad científica en el 20.o Congreso de la ASH de 2005 en San Francisco, puede constituir el inicio de la esperada convergencia de ambas tendencias5. Dos años después de la publicación del JNC-VII, la ASH se ha dado cuenta de la necesidad de revisar y actualizar la definición y las recomendaciones de diagnóstico y tratamiento de la HTA. En suma, la nueva visión americana tiende a ver a la HTA como una compleja enfermedad cardiovascular y no sólo como una mera alteración de los valores de la PA. Es decir, un síndrome cardiovascular progresivo que puede obedecer a multitud de causas y que, incluso en estadios iniciales con mínimas o nulas elevaciones tensionales, ya es posible la presencia de estigmas de afección cardíaca y vascular que, en ausencia del adecuado tratamiento, pueden progresar mediante la lesión de órganos diana hasta la muerte.
Ya que el texto completo de la publicación no ha visto aún la luz, hay aspectos que no quedan totalmente claros en esta primera comunicación abreviada. Esta nueva clasificación establece 3 estadios de HTA (1 a 3), desapareciendo la anterior categoría de prehipertensión del JNC-VII (tabla 1). La normalidad es definida por la presencia de valores de PA por debajo de 120/80 en ausencia de factores de riesgo cardiovascular y/o marcadores de daño cardiovascular establecido. Se definiría como estadio 1 aquella situación en la que coexisten valores de PA 120-139/80-89 mmHg junto con varios factores de riesgo y signos sutiles de afección cardíaca y/o vascular, sin claro daño establecido de órganos diana. En el estadio 2 se detecta ya daño establecido, aunque incipiente, de los órganos diana de la HTA que coexiste con multitud de factores de riesgo y unos valores de PA habituales de 140-159/90-99 mmHg. Por último, los pacientes en estadio 3 habrían experimentado ya complicaciones cardiovasculares y/o hay evidencia de afección extensa y clara de uno o varios órganos diana, en presencia de elevación de la PA por encima de 140/90 mmHg (aunque lo habitual sería > 160/100 mmHg).
Como se puede observar, esta clasificación se aproxima a la visión europea y se distancia de la simplista visión americana, aunque también aporta algunos elementos nuevos, entre los que cabe destacar: a) mayor reducción del umbral de PA necesario para establecer cada estadio de enfermedad; desaparece el tan discutido término «prehipertensión» del JNC-VII; b) introducción del concepto de elevación ocasional y no sostenida de la PA como parte del diagnóstico y la estadificación de la HTA; c) confirmación de algunos nuevos marcadores de afección cardiovascular incipiente que establece la presencia de formas precoces de afección (proteína C reactiva, hiperuricemia, albuminuria, etc.); d) mayor preponderancia de la estratificación del riesgo global como única vía para establecer la necesidad y la agresividad del tratamiento, y e) esta nueva clasificación nos obliga a pensar en la enfermedad mucho antes de lo que lo hacemos en la actualidad.
Esta nueva visión del concepto de HTA está actualmente siendo evaluada por el Comité de expertos del National Heart, Lung and Blood Institute, autor del anterior JNC-VII. Está por ver si esta iniciativa de algunos de los miembros del anterior consenso del JNC-VII es secundada por la comunidad científica americana en general y acaba materializándose en unas guías «progresistas», en línea con la visión más clínica europea y que contribuya a acabar con la mencionada confusión generada en los últimos años.
SÍNDROME DE APNEA OBSTRUCTIVA DEL SUEÑO Y ENFERMEDAD CARDIOVASCULAR
Tradicionalmente, el síndrome de apnea obstructiva del sueño (SAOS) ha sido una enfermedad típicamente neumológica, olvidada en muchas ocasiones por el cardiólogo. Sin embargo, en los últimos años se ha ido conociendo su importancia e interrelación con otras entidades cardiovasculares, y ha sido implicada en la patogenia de la HTA, la insuficiencia cardíaca, la enfermedad coronaria y el ictus, así como en la aterosclerosis y la fibrilación auricular6. La asociación entre SAOS y enfermedad cardiovascular fue puesta de manifiesto por primera vez en estudios observacionales en pacientes roncadores, donde se observaba un incremento de los eventos cardiovasculares. Posteriormente, en otros trabajos se ha demostrado una clara relación entre la presencia y la severidad del SAOS con la HTA y el aumento de la incidencia de enfermedad cardiovascular7.
El SAOS representa la forma más común de trastorno respiratorio del sueño y se caracteriza por episodios recurrentes de cese del flujo aéreo respiratorio provocado por el colapso inspiratorio total (apnea) o parcial (hipopnea) de la vía aérea superior durante el sueño, con el consiguiente descenso de la saturación sanguínea de oxígeno8. Los períodos de apnea pueden ser repetitivos y prolongados durante la noche, y en algunos pacientes pueden sobrepasar el minuto de duración. Estas fases producen una estimulación simpática, alteraciones en la presión intratorácica, hipoxia e hipercapnia plasmática que, de forma secundaria, provocan una constricción arteriolar pulmonar y sistémica con elevación de las cifras de PA en esta localización, así como un aumento de la poscarga (estrés de la pared cardíaca)9. Los continuos períodos de apnea favorecen el desarrollo de hipoxemia grave e hipercapnia que, a largo plazo, pueden conducir a una insuficiencia respiratoria global. Estos trastornos serán los causantes del mayor riesgo de enfermedades cardiovasculares en estos pacientes, incluida la mayor incidencia de arritmias cardíacas durante las fases de apnea (paro y bradicardia sinusal, bloqueo auriculoventricular de segundo grado, fibrilación/aleteo auricular, etc.). Asimismo, se han descrito cambios inmunológicos y vasculares en los pacientes con SAOS, como el aumento en la activación plaquetaria y en las moléculas de adhesión (ICAM-1, E-selectina, etc.), lo que favorece la interacción y la migración de los leucocitos circulantes con las células endoteliales (uno de los estadios iniciales en la patogenia de la aterosclerosis)10.
La prevalencia del SAOS es bastante elevada y se estima que afecta al 2% de las mujeres y al 4% de los varones; este porcentaje aumenta a medida que se incrementa la edad del paciente (el 10% en la población > 65 años)11. Inicialmente, la descripción de SAOS fue realizada en pacientes obesos, varones de edad media. Sin embargo, actualmente las mujeres representan la tercera parte de los pacientes y un índice de masa corporal normal es frecuente, sobre todo en pacientes ancianos. De hecho, la prevalencia en mujeres posmenopáusicas tiende a igualarse a la de los varones.
La historia clínica es fundamental para establecer el diagnóstico de sospecha. El principal síntoma del paciente con SAOS es el ronquido nocturno, acompañado de fases de apnea a pesar del esfuerzo ventilatorio del tórax y abdomen. Tras ello, el silencio de la apnea se rompe con un ronquido estertoroso que refleja el restablecimiento de la permeabilidad de la vía aérea. Los gases respiratorios sanguíneos se normalizan, el sueño se recupera y se reinicia así un ciclo que se repite múltiples veces cada noche12. La reiteración de los despertares subconscientes al final de cada apnea da lugar a la fragmentación del sueño y a la dificultad de conciliar un descanso profundo y reparador. Ello origina importantes manifestaciones neuropsiquiátricas, como la somnolencia diurna excesiva que, en grados más intensos, llega a ser causa de incapacidad laboral y accidentes de tráfico, cefalea persistente, pérdida de memoria, deterioro intelectual y dificultad de concentración, irritabilidad e incluso impotencia sexual. Es importante destacar que no todo paciente roncador tiene SAOS. El ronquido se observa en un 10-30% de las mujeres y hasta en un 50-60% de los varones adultos, pero sólo en un 5-15% de los casos se debe a un SAOS; en el resto de las ocasiones se trata de una roncopatía crónica benigna.
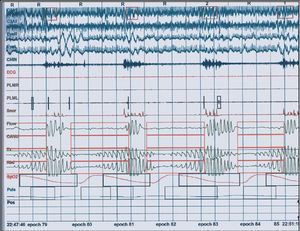
El diagnóstico definitivo se basa en la realización de una polisomnografía con seguimiento continuo durante el sueño de la saturación de oxígeno, la frecuencia cardíaca, la estadificación del sueño mediante electroencefalograma, el flujo aéreo, el esfuerzo respiratorio, el tono muscular mandibular mediante electromiografía, la posición durante el sueño y los movimientos del tórax y abdomen (fig. 1)7. La integración e interpretación de todos estos datos es utilizada para establecer el diagnóstico y la severidad del SAOS. El índice apnea-hipopnea (número de eventos obstructivos por hora) es el parámetro mas comúnmente utilizado para cuantificar el SAOS: SAOS ligero, 5 a 10 eventos/h; moderado, 15 a 30 eventos/h; y severo, > 30 eventos/h. Su mayor inconveniente es que se trata de un procedimiento complejo y laborioso que se realiza en el hospital y precisa la presencia constante de personal especializado para supervisar el estudio durante toda la noche. En los últimos años se han desarrollado equipos portátiles simplificados que pueden instalarse incluso en el domicilio del paciente y que nos permiten determinar la saturación de oxígeno durante la noche; estos equipos son una excelente herramienta de cribado en pacientes con sospecha de SAOS que permiten disminuir la lista de espera y la necesidad de una polisomnografía13.
Fig. 1. Ejemplo de polisomnografía con seguimiento de variables neurológicas y respiratorias que muestran múltiples apneas acompañadas de «arousals» (microdespertares) y desaturaciones en la hemoglobina (síndrome de apnea obstructiva del sueño severo).
SAOS e hipertensión arterial
En algunos estudios se ha mostrado que la prevalencia de HTA es mayor en pacientes con SAOS, y que en pacientes con HTA es más común el SAOS que en pacientes normotensos. De hecho, los trastornos respiratorios durante el sueño se han observado en el 22-48% de los pacientes con HTA esencial y la prevalencia de HTA en pacientes con SAOS se estima en torno al 50%6. En análisis estratificados, esta asociación se ha observado independientemente del sexo, la edad, la raza y el índice de masa corporal del paciente.
Recientes datos sugieren que el SAOS desempeña un papel en la patogenia de la HTA, independientemente de otros factores de riesgo, como la obesidad. Uno de los principales estudios que analizó dicha asociación incluyó aproximadamente a 6.000 pacientes y mostró una mayor prevalencia de HTA en pacientes con SAOS14. De hecho, en el Wisconsin Sleep Cohort Study se puso de manifiesto que la presencia de SAOS se asocia con 3 veces más riesgo de desarrollar HTA en el futuro (4 años de seguimiento)15. Un estudio relativamente reciente recoge una relación lineal entre HTA y severidad del SAOS, de tal manera que por cada episodio de apnea extra por hora aumenta el riesgo de HTA en un 1%7. El incremento en la variabilidad de la PA y la pérdida de su descenso nocturno también puede asociarse con un pronóstico cardiovascular adverso.
A pesar de la extensa investigación, los mecanismos por los que el SAOS induce HTA no son perfectamente conocidos16. Son diversos los mecanismos que se han implicado en la asociación entre SAOS e HTA17: a) aumento de la activación simpática mediada por quimiorreceptores con vasoconstricción periférica durante las fases de apnea; b) activación del eje renina-angiotensina-aldosterona con mayores valores de angiotensina II y aldosterona; c) generación de radicales libres de oxígeno durante los períodos intermitentes de hipoxia y posterior reoxigenación; d) aumento en los valores y los marcadores de inflamación (interleucina 6, factor de necrosis tumoral alfa y proteína C reactiva); e) disfunción endotelial, y f) coexistencia e interacción con la obesidad (el 50% de los varones obesos presenta SAOS), junto con la elevación en los valores plasmáticos de leptina (que ejerce un efecto presor) e hiperinsulinemia.
La prevalencia de SAOS es elevada en pacientes con HTA resistente a tratamiento farmacológico convencional11. Se calcula que el 40% de los pacientes con HTA resistente presenta SAOS18. Es posible que el SAOS contribuya al patrón nocturno non-dipper de la HTA, dado que la hipoxemia durante las fases de apnea nocturna provoca la estimulación simpática mediada por quimiorreceptores, con las consecuentes oscilaciones nocturnas en la PA6. El tratamiento del SAOS puede mejorar el control tensional en estos pacientes.
El tratamiento es multifactorial y se basa en la adopción de med idas generales, como es el abandono del tabaquismo y el alcohol y la pérdida de peso, así como la aplicación durante el sueño, a través de una mascarilla nasal, de una presión positiva continua a lo largo de todo el ciclo respiratorio (CPAP), evitando de esta manera el colapso de las vías respiratorias superiores19. La CPAP mejora la fragmentación y la calidad del sueño, atenúa los cambios hemodinámicos causados por el SAOS y puede disminuir los valores plasmáticos de leptina y la activación simpática, junto con una potencial mejora de la disfunción endotelial y un aumento del óxido nítrico. Con ello se consigue una reducción ligera de la PA, el riesgo potencial de ictus y otras complicaciones cardiovasculares, así como una mejora de la calidad de vida de estos pacientes.
El descenso de las cifras tensionales con la CPAP ha sido controvertido debido a que en varios estudios controlados, o no se demostró ningún efecto, o los cambios fueron discretos20. Sin embargo, varios estudios prospectivos recientes han mostrado un efecto llamativo de la CPAP en las cifras de PA. Así, Borgel et al20, en un estudio realizado en 540 pacientes consecutivos con SAOS moderado-severo, demostraron un descenso significativo de la PA, tanto sistólica (PAS) como diastólica (PAD), mediante la CPAP, especialmente en pacientes con valores basales más elevados y en los que no recibieron tratamiento farmacológico antihipertensivo, confirmando esa asociación entre SAOS e HTA20. Dhillon et al21 demostraron una reducción de 11,2 mmHg en la PAS y de 5,9 mmHg en la PAD en una serie de pacientes hipertensos tratados con CPAP durante 1 año, lo que debe traducirse en una disminución en el riesgo cardiovascular de estos pacientes21. Una alternativa al tratamiento en pacientes que no toleran la CPAP es la cirugía (uvulopalatoplastia, adelantamiento mandibular y, excepcionalmente, la traqueostomía).
Por desgracia, la mayor parte de los individuos con SAOS y enfermedad cardiovascular permanece sin diagnosticar. Por ello, en todos los pacientes con HTA, obesidad o insuficiencia cardíaca, el cardiólogo debe preguntar sistemáticamente sobre síntomas de SAOS y remitirlos a una unidad de referencia para estudio del sueño si son sintomáticos. La escala de somnolencia de Epworth representa un método sencillo, rápido y validado para el cribado de estos pacientes (fig. 2)22. Una puntuación > 10 debe hacernos sospechar su presencia.
Fig. 2. Escala de somnolencia de Epworth22.
ENSAYOS CLÍNICOS RECIENTES EN HIPERTENSIÓN ARTERIAL
Hipertrofia ventricular izquierda y fibrilación auricular
La fibrilación auricular (FA) se presenta con frecuencia en pacientes hipertensos, sobre todo asociada con la presencia de hipertrofia ventricular izquierda (HVI). Esta arritmia es causa frecuente de fenómenos embólicos y la coexistencia de hipertensión arterial y FA multiplica el riesgo de estos pacientes de presentar un evento de este tipo. En el estudio LIIFE (The Losartan Intervention For End Point Reduction in Hypertension study), realizado en pacientes hipertensos con HVI, se demostró que la estrategia antihipertensiva basada en losartán fue superior al tratamiento basado en atenolol, con el mismo control tensional, en el objetivo primario: prevención de muerte cardiovascular, infarto de miocardio e ictus, fundamentalmente por la disminución del riesgo de tener un evento cerebrovascular. Una de las posibles causas del menor número de ictus podría estar en relación con una menor incidencia de FA en estos pacientes.
Los datos referentes a la aparición de FA en los pacientes del estudio LIIFE han sido publicados a principios de este año23. Del total de los 9.193 pacientes incluidos, al inicio del estudio estaban en ritmo sinusal 8.851, que fueron seguidos durante 4,8 ± 1,0 años. Presentaron nueva FA, durante el seguimiento, 150 pacientes del grupo asignado a losartán y 221 de los que recibieron atenolol (p < 0,001), a pesar del mismo grado de control de las cifras de PA. En los pacientes que desarrollaron FA se duplicó el riesgo de presentar eventos cardiovasculares, se triplicó el de ictus y aumentó hasta 5 veces el de hospitalización por insuficiencia cardíaca, pero estas complicaciones fueron significativamente menos frecuentes en los pacientes que recibieron losartán. Otros fármacos antagonistas de los receptores de angiotensina II (ARA-II) habían demostrado en ensayos de insuficiencia cardíaca y de cardiopatía isquémica la protección frente al desarrollo de FA. En el caso del LIIFE, este efecto protector aparece en relación con la regresión de la hipertrofia y la disminución de la dilatación auricular, marcadores de la afección cardíaca secundaria a la hipertensión arterial y predictores de desarrollo de FA.
También en el estudio LIIFE se ha estudiado el efecto del tratamiento antihipertensivo en los pacientes que presentaban FA al inicio24. Un total de 342 pacientes hipertensos con HVI y FA fueron aleatorizados para recibir losartán o atenolol. Como sucedió en el grupo global, la estrategia basada en losartán fue superior en la prevención del objetivo primario compuesto (p = 0,009), con una significativa reducción de muerte cardiovascular e ictus, sin diferencias en la incidencia de infarto agudo de miocardio. Incluso el beneficio de losartán fue superior en los pacientes en FA respecto a los que estaban en ritmo sinusal durante el estudio, en cuanto al objetivo primario compuesto y a la mortalidad cardiovascular. Estos datos tienen gran trascendencia clínica y práctica en cuanto a la elección del tratamiento antihipertensivo, por la alta prevalencia de FA en la población hipertensa y el elevado riesgo de estos pacientes de presentar eventos cardiovasculares.
Recientemente hemos conocido más datos del estudio LIIFE, pues se ha publicado un análisis post hoc del efecto de ambos tratamientos en hipertensos considerados de bajo riesgo (4.282 pacientes sin enfermedad cardiovascular previa, sin diabetes o hipertensión sistólica aislada y con un grado de HVI en los tres cuartiles inferiores) y en los de riesgo alto (los otros 4.911 pacientes del estudio)25. De nuevo, el tratamiento con losartán mostró mayor beneficio en la reducción de ictus y en la aparición de FA y de diabetes mellitus en ambos grupos de pacientes, independientemente de su riesgo cardiovascular.
Cardiopatía isquémica e hipertensión arterial
El estudio ACTION (A Coronary disease Trial Investigating Outcome with Nifedipine GITS) se diseñó para valorar la eficacia y la seguridad del tratamiento con nifedipino GITS en la cardiopatía isquémica crónica. Se incluyó a 7.665 pacientes que presentaban angina estable a pesar de tratamiento antiisquémico óptimo. No hubo diferencias significativas en el objetivo primario de eficacia (que incluía mortalidad por todas las causas, infarto de miocardio, angina refractaria, insuficiencia cardíaca de nueva aparición, ictus invalidante y revascularización periférica) entre los pacientes asignados a nifedipino GITS o a placebo. En este estudio también se demostró que el nifedipino GITS es segura en pacientes con enfermedad coronaria estable. Cuando se analizaron los resultados en grupos predefinidos se comprobó que sí había diferencias significativas (p < 0,005) en el objetivo primario (reducción del 13%) en los pacientes que al inicio del estudio presentaban cifras elevadas de PA (> 140/90 mmHg), que representaban en 52% de la población del estudio26. Se han publicado los datos correspondientes a este subgrupo, y destaca una reducción del 38% en la aparición de insuficiencia cardíaca (un 29% de reducción en el grupo total) y del 33% de ictus debilitante, sin diferencias en la mortalidad total, cardiovascular o en la incidencia de infarto agudo de miocardio. La reducción de las cifras de PA en los pacientes asignados a nifedipino fue de 3,9/2,4 mmHg en los normotensos y de 6,6/3,5 mmHg en los hipertensos. Se refuerza la necesidad de un buen control de PA en los pacientes hipertensos, que corrobora los hallazgos de otros ensayos en cuanto a la prevención de ictus con un mejor control tensional. El efecto antiisquémico unido al antihipertensivo parece la causa del menor desarrollo de insuficiencia cardíaca27.
Enfermedad renal y enfermedad cardiovascular. Estudio DETAIL
La valoración de la función renal adquiere cada día más relevancia en el tratamiento de la enfermedad cardiovascular. La HTA y la diabetes mellitus son los principales determinantes de la aparición de la insuficiencia renal terminal. La mayoría de los pacientes con enfermedad renal establecida muere de enfermedades cardiovasculares antes de llegar a grados de enfermedad renal terminal; además, la mortalidad cardiovascular en pacientes en diálisis es entre 10 y 30 veces superior a la de la población general28. Por otra parte, la presencia de enfermedad renal crónica determina un aumento del riesgo en la población general, tanto para la mortalidad total como para la aparición de eventos cardiovasculares29. En el contexto de la cardiopatía isquémica, la tasa de filtrado glomerular (TFG) es mejor predictor, tanto de mortalidad como de eventos cardiovasculares (isquemia recurrente, infarto de miocardio recurrente e ictus), que el TIMI risk score, tanto a los 30 días como a los 6 meses30. De ahí la importancia de la determinación sistemática de la TFG en los pacientes de riesgo vascular.
La historia natural de la nefropatía en los pacientes con diabetes mellitus tipo 2 se inicia con cambios funcionales (hemodinámica renal alterada e hiperfiltración glomerular); posteriormente aparecen cambios estructurales (espesor aumentado de la membrana glomerular, expansión mesangial y cambios microvasculares), aumento de la PA, microalbuminuria y, finalmente, proteinuria, aumento de los valores de creatinina sérica y nefropatía terminal.
La hipótesis del estudio DETAIL31 (the Diabetics Exposed to Telmisartan And enalaprIL study) parte de la implicación del sistema renina-angiotensina (SRA) en la diabetes mellitus y en el desarrollo de la nefropatía diabética. Con anterioridad a este estudio, la inhibición del SRA había demostrado un beneficio nefroprotector comparado con otras estrategias antihipertensivas. Se sabe que tanto los inhibidores de la enzima de conversión de la angiotensina (IECA) como los ARA-II inhiben el SRA en un grado similar, aunque por mecanismos distintos. Mientras que los IECA bloquean la producción de angiotensina II, los ARA-II actúan en el receptor AT1 de la angiotensina. El objetivo primario del estudio era comparar los cambios en la tasa de filtración glomerular a largo plazo en pacientes con diabetes mellitus tipo 2, hipertensión y microalbuminuria, con el empleo de un IECA (enalapril en dosis de 10-20 mg) o un ARA-II (telmisartán en dosis de 40-80 mg). Se trata en realidad del primer ensayo clínico de nefroprotección en el que se empleó una medición directa de la tasa de filtrado glomerular como parámetro de evaluación. Se incluyó a 250 pacientes (120 con telmisartán y 130 con enalapril). La prevalencia de microalbuminuria fue del 82% y de macroalbuminuria del 18%. Tras 5 años de seguimiento, el declive de la TFG ajustada por la edad fue de aproximadamente 1 ml/min/1,73 m2/año, similar en ambos grupos de tratamiento.
Se sabe que en diabéticos con proteinuria no tratados, dicha tasa se reduce a un ritmo de 10-12 ml/min/1,73 m2/año. Tanto el enalapril como el telmisartán pueden reducir la proteinuria de forma similar, por debajo de 0,5 g/día, y también el deterioro de la función renal. Ambos ofrecen una eficacia antihipertensiva similar, aunque la incidencia de efectos secundarios fue menor en el grupo de telmisartán, en el que hubo, sobre todo, menos tos.
Teniendo en consideración que el 80% de los diabéticos es hipertenso y que el control de la PA en la mayor parte de ellos precisa la asociación de varios fármacos, los resultados del estudio DETAIL son un argumento más que apoya el bloqueo del SRA en el tratamiento farmacológico de los pacientes con hipertensión y diabetes mellitus.
Nuevos antihipertensivos frente a los clásicos. Estudio ASCOT-BPLA
En los últimos años ha permanecido abierta la polémica sobre si los nuevos antihipertensivos (antagonistas del calcio y bloqueadores del SRA) son superiores a los clásicos, como los bloqueadores beta y los diuréticos. En un reciente metaanálisis de 17 ensayos clínicos realizados con bloqueadores beta, diuréticos o ambos se indica que el descenso de la PA se asocia con una disminución de eventos por enfermedad coronaria; sin embargo, el beneficio que se obtenía era inferior al esperado según datos ya conocidos previamente, obtenidos de estudios observacionales prospectivos32. Además, ningún ensayo había obtenido individualmente una significativa reducción de eventos coronarios. Una posible justificación de este hecho sería el efecto deletéreo de diuréticos y bloqueadores en el metabolismo de los lípidos y de los hidratos de carbono. En este sentido, se ha especulado que nuevos agentes terapéuticos, como los antagonistas del calcio y los IECA, podrían ser más eficaces.
Por otra parte, tanto las guías europeas de HTA2 y las de la Sociedad Española de Cardiología33 como el VII Informe de JNC1 recomiendan comenzar el tratamiento con 2 fármacos cuando los valores de PA superan los 160/100 mmHg. Sin embargo, hasta el momento no se disponía de ningún ensayo clínico que se planteara resolver el dilema sobre la mejor asociación.
El estudio ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm) se diseñó para tratar de contestar a ambas cuestiones34. Se trata de un estudio multicéntrico, prospectivo y aleatorizado realizado en 19.257 pacientes hipertensos con edades entre 40 y 79 años que tenían al menos 3 factores de riesgo. Un grupo de pacientes fue tratado con amlodipino 5-10 mg asociado con perindopril 4-8 mg para conseguir el control tensional (n = 9.639), el otro grupo recibió atenolol 50-100 mg más bendroflumetiazida 1,25-2,5 mg más potasio (n = 9.618). El objetivo primario fue el infarto de miocardio no fatal (incluido el infarto de miocardio silente) y la enfermedad coronaria fatal. El estudio se detuvo prematuramente a los 5,5 años de media de seguimiento. En relación con el grupo con tratamiento basado en atenolol, un menor número de pacientes en el grupo con tratamiento basado en amlodipino presentó infarto de miocardio no fatal y enfermedad coronaria fatal (429 frente a 474), ictus fatal y no fatal (327 frente a 422; p = 0,0003) eventos cardiovasculares totales (1.362 frente a 1.602; p < 0,0001) y mortalidad de cualquier causa (738 frente a 820; p = 0,025). La incidencia de desarrollar diabetes mellitus de novo fue menor en el tratamiento basado en el amlodipino (567 frente a 799; p < 0,0001).
Los resultados del ASCOT-BPLA muestran que, en pacientes hipertensos con riesgo moderado de presentar eventos cardiovasculares, un tratamiento antihipertensivo con amlodipino, añadiendo perindopril si fuera necesario, es mejor en términos de reducción de la incidencia de cualquier tipo de evento cardiovascular y de mortalidad de cualquier causa (tabla 2)33.
Se ha discutido las razones del mayor beneficio obtenido en el grupo tratado con amlodipino con o sin perindopril, ya que no pueden atribuirse exclusivamente a un mejor control de la PA en este grupo con respecto a los tratados con bloqueadores beta y diuréticos. De hecho, durante el estudio , la diferencia media de la PA fue de 2,7/1,9 mmHg a favor del grupo de amlodipino. Sin embargo, en comparación con otros estudios realizados en poblaciones de un riesgo similar, no parece que estas pequeñas diferencias puedan explicar completamente un descenso tan marcado de los eventos cardiovasculares. Otros posibles factores que pueden explicar estos resultados serían la presencia de un peor perfil metabólico del grupo tratado con bloqueadores beta y diuréticos; de hecho, este grupo de pacientes presentaba un mayor índice de masa corporal, triglicéridos, concentraciones de creatinina y glucosa en ayunas, y menor de colesterol unido a lipoproteínas de alta densidad. Además, este grupo presentó un significativo aumento (799 frente a 567; p < 0,0001) de nuevos casos de diabetes mellitus con respecto al grupo de amlodipino.
La implicación clínica del estudio ASCOT es importante, ya que de alguna forma está en contraposición con las directrices de las guías de práctica clínica vigentes. De hecho, tanto las guías de HTA de la Sociedad Española de Cardiología34 como las guías europeas publicadas en el año 20032, en este grupo de pacientes hipertensos y con riesgo moderado (por tener 3 factores de riesgo pero sin enfermedad cardiovascular establecida), indican que puede utilizarse indistintamente cualquiera de los 5 grandes grupos terapéuticos (bloqueadores beta, diuréticos, antagonistas del calcio, IECA o ARA-II). El VII Informe del JNC va más allá e indica que puede utilizarse cualquiera de ellos, pero que en la mayor parte de los casos se recomienda la utilización de un diurético. Por tanto, claramente estas recomendaciones no están respaldadas por los resultados del estudio ASCOT que, sin duda, influirán en la próxima revisión de las nuevas guías.
Correspondencia: Dr. V. Bertomeu Martínez.
Servicio de Cardiología. Hospital Universitario San Juan.
Ctra. Alicante-Valencia, s/n. 03203. San Juan. Alicante. España
Correo electrónico: bertomeu_vic@gva.es.