Palabras clave
ESTIMULACIÓN CARDÍACA BIVENTRICULAR EN PACIENTES CON INSUFICIENCIA CARDÍACA, CONGESTIVA, AVANZADA Y REFRACTARIA A TERAPIA FARMACOLÓGICA ÓPTIMA: RESUMEN PARA LA PRÁCTICA CLÍNICA EN 2005
Desde mediados de 2005 disponemos de una completa monografía sobre el estado de la resincronización en España1. No obstante, posteriores publicaciones siguen aumentando nuestros conocimientos sobre el papel de la estimulación biventricular (EBV) o terapia de resincronización que deberán, sin duda, aportar cambios en la práctica clínica. Esta terapia afectaría a un amplio grupo de pacientes con insuficiencia cardíaca congestiva (ICC) crónica, en grado funcional avanzado refractario a tratamiento riguroso y que, además, tienen asincronía electromecánica.
Varios metaanálisis sobre los diversos estudios relativos a la utilidad de la EBV2,3 han proporcionado importante información clínica. Hasta la publicación del ensayo CARE-HF4 no se había demostrado de forma incontrovertible la incidencia en la mortalidad de esta modalidad de estimulación cardíaca (EC). Previamente a este ensayo, el estudio COMPANION5 había evidenciado la mejoría en la mortalidad de los pacientes con ICC avanzada cuando a la EBV se asociaba el implante de un desfibrilador automático implantable (DAI), dejando entrever una posible reducción de mortalidad en estos pacientes si sólo se usaba EBV (el ensayo se cerró sin alcanzar suficiente número de pacientes en el grupo de EBV sin desfibrilador).
Por otra parte, es conocido que al menos un 30% de los pacientes con ICC en grado funcional (GF) III o IV, aun correctamente tratados, permanecen en fibrilación auricular. Pocos ensayos han estudiado este tipo de pacientes y el número de individuos incluidos ha sido reducido.
Disponemos de varias series publicadas6,7 que sugieren que la EBV, en pacientes con ICC refractaria y fibrilación auricular permanente, mejora la sintomatología, reduce las hospitalizaciones y puede mejorar la supervivencia. Sin embargo, la efectividad del tratamiento es menor que en los pacientes en ritmo sinusal.
Es difícil evaluar los datos publicados sobre el coste/beneficio del tratamiento con EBV. Esto se debe a la notable diferencia en la estimación o en el valor añadido que se adjudica a aspectos sociosanitarios en países con alta protección social8 o en sistemas en los que esta garantía de asistencia pública es escasa9,10. En relación con los costes, de los datos que se desprenden de la continuación del ensayo CARE-HF, el coste medio del tratamiento con EBV es de 19.400 A/año ganado ajustado a la calidad de vida11. Este coste medio es la mitad del coste máximo aceptado para intervenciones médicas en cardiología (p. ej., intervencionismo coronario, terapia farmacológica).
Como se apuntaba al principio, las evidencias sobre la EBV aplicada a la ICC avanzada han obligado a modificar las guías de actuación que se manejaban hasta el presente año12. La Sociedad Europea de Cardiología ha publicado en 2005 la actualización de su propia guía para el diagnóstico y el tratamiento de la ICC13. Se han introducido cambios relevantes en las indicaciones de la utilización de EC con marcapasos en la ICC avanzada, recomendando el tratamiento con EBV en pacientes con las siguientes afecciones:
- Fracción de eyección reducida.
- Complejo QRS ancho, > 120 ms.
- Disincronía inter-intraventricular.
- Sintomáticos en GF III o IV, con una situación clínica refractaria al tratamiento médico óptimo.
Las indicaciones se resumen en la tabla 1.
Es probable que, a la vista de las claras indicaciones actuales, la utilización de la EBV sea más tenida en cuenta a la hora de tratar a los pacientes refractarios. Esta modalidad de intervención realmente se utiliza hasta ahora en forma muy restrictiva, y según algunos autores puede que en España se indique sólo a un 1% de los posibles candidatos.
Las nuevas indicaciones recomendadas se encuentran definidas fundamentalmente a partir de la evidencia de obtención de mejoría clínica y de un aumento en la supervivencia de este tipo de pacientes con la utilización de EBV14. Con anterioridad debe asegurarse un correcto tratamiento farmacológico y haberse descartado, además, procesos que agraven o impidan la mejoría del proceso (fig. 1).
Fig. 1. Metaanálisis del efecto del tratamiento con estimulación biventricular (EBV) en la mortalidad. Datos conjuntos de los ensayos COMPANION y CARE-HF. Modificado de Cleland et al11.
Hay un porcentaje de pacientes que, cumpliendo los criterios establecidos para ser candidatos a la EBV, no mejoran tras un implante correcto, un seguimiento adecuado y un ajuste meticuloso del dispositivo15. El porcentaje de pacientes llamados «no respondedores» se acerca en muchas series al 30%.
Aún no disponemos de un instrumento objetivo de medida acordado para valorar todos los parámetros funcionales implicados en la respuesta clínica (asincronía, remodelado, etc.) que nos permitan conocer por anticipado qué paciente va a responder o no16. Nuestros ecografistas, sobre todo, tendrán mucho trabajo que realizar para unificar criterios y técnicas de medida17-22. Una vez conseguido esto, el siguiente problema sería disponer de equipos similares en los diversos centros donde se hagan seguimientos.
No parece probable que, por métodos clínicos sencillos, se resuelva el problema de saber quién va a responder a la terapia23,24. Tampoco se reconoce universalmente un predictor de buena respuesta antes del implante, si bien había mejores expectativas en un escenario con alguna de las características que se reseñan en las diversas series.
Por otra parte, podrían considerarse diversos marcadores de respuesta positiva postimplante. Ninguno goza de aceptación universal individualmente, pero su conjunto tiene valor predictivo considerable, naturalmente, en correspondencia con la mejoría clínica. En la tabla 2 se exponen varios criterios que es necesario valorar antes y después del implante.
Como final de este apartado, cabe indicar que, en la actualidad, las indicaciones de este tratamiento están claramente establecidas en los términos reseñados por las guías y que, por lo tanto, no hay razón para no ofrecer esta posibilidad a los pacientes con ICC avanzada, refractaria, con un complejo QRS ensanchado y asincronía, siempre que no haya alguna contraindicación de peso para descartar esta terapia.
PAPEL DE LA ESTIMULACIÓN CARDÍACA PERMANENTE EN EL SÍNDROME DE APNEA-HIPOPNEA DEL SUEÑO
El síndrome de apnea-hipopnea durante el sueño (SAHS), entendido como la aparición de episodios repetidos de obstrucción completa (apnea) o incompleta (hipopnea) de la vía aérea durante el sueño, es un problema de salud pública25. Estos episodios repetitivos producen una severa alteración de la arquitectura del sueño y se puede establecer una relación directa entre ellos y la presencia de hipertensión arterial sistémica26-28, hipertensión arterial pulmonar, arritmias de diferentes tipos, insuficiencia cardíaca29,30 e incluso se relacionan con un potencial aumento de la mortalidad31-33.
El SAHS se ha relacionado con una mayor incidencia de enfermedad coronaria. La hipoxia y su principal consecuencia vascular, la hipertensión sistémica, aumentan, a través de un incremento en la disfunción endotelial, el riesgo de enfermedad coronaria en los SAHS graves. También se ha establecido una relación entre SAHS grave y miocardiopatía dilatada idiopática34 (fig. 2). De forma complementaria, el SAHS se ha asociado con arritmias rápidas auriculares en relación con un incremento en la presión telediastólica ventricular35,36.
Fig. 2. Evolución de la mortalidad o trasplante en pacientes con miocardiopatía dilatada con o sin utilización de presión positiva inspiratoria. Modificada de Leung y Bradley34. CPAP: presión inspiratoria positiva.
Se ha demostrado una elevada prevalencia de bradiarritmias en pacientes con enfermedad del sueño. Debemos recordar la relación entre la presencia de determinadas bradiarritmias nocturnas y SAHS, especialmente de grado severo. Estas arritmias son habitualmente benignas y se han relacionado con cambios en el sistema nervioso autónomo, características de las diferentes fases del sueño y propiciadas por las alteraciones típicas del SAHS37. No obstante, si hemos reconocido la alta presentación del SAHS en determinadas enfermedades cardíacas potencialmente productoras de bradiarritmias graves debemos discriminar estas arritmias benignas de las que, por la enfermedad cardíaca subyacente o por la presentación de mayor riesgo intrínseco, requieran un tratamiento específico. Por lo tanto, desde una perspectiva puramente clínica no podemos olvidar que, si estudiando un paciente con trastornos del ritmo por bradicardias, éstas son predominantemente nocturnas o asintomáticas, podemos no indicar una estimulación cardíaca definitiva, pero estaremos obligados a completar un estudio de SAHS38. Del mismo modo, se deberá evaluar desde una perspectiva puramente cardiológica a los pacientes con bradirritmias severas detectadas en estudios polisomnográficos enfocados a evaluar un SAHS35-38. El hecho de que más de un 30% de los pacientes portadores de marcapasos tenga criterios diagnósticos de enfermedad del sueño nos proporciona una aproximación a las posibles interrelaciones entre ambas entidades39.
Estos datos adquieren especial trascendencia, dado que el SAHS es muy prevalente en las edades medias de la vida. En diferentes estudios se ha encontrado que el 15-19% de los varones y el 5-15% de las mujeres presentan la enfermedad40. Además, esta distribución aumenta con la edad y se encuentra especialmente presente en los ancianos, con un 69-70% en los varones y un 56-63% en las mujeres, respectivamente41,42.
Se ha descrito que el tratamiento del SAHS mediante presión positiva espiratoria corregía de manera simultánea las bradicardias nocturnas43. De cualquier modo, recientemente hemos tenido acceso a determinados trabajos que abordaban el problema desde la perspectiva de la estimulación cardíaca definitiva.
Estos estudios se realizan en todos los casos en pacientes con indicación consolidada de estimulación cardíaca permanente y en los que se sospecha y confirma posteriormente la presencia simultánea de SAHS. La hipótesis de trabajo se centra en que las manifestaciones de la enfermedad del sueño nocturnas se caracterizan por una disminución o una ausencia momentánea de ventilación, desaturaciones de oxígeno significativas y pausas cardíacas. Se pretende, evitando las pausas cardíacas mediante el marcapasos, disminuir o anular los trastornos respiratorios y sus consecuencias en la oxigenación.
Garrigue et al44 compararon los resultados polisomnográficos en un grupo de pacientes con frecuencia cardíaca basal nocturna y tras estimulación auricular 15 latidos por encima de su frecuencia cardíaca nocturna media. Los autores concluyeron que, en pacientes con apneas del sueño, la sobreestimulación del marcapasos reduce significativamente el número de episodios de apneas centrales u obstructivas, sin reducir el tiempo total de sueño. No obstante, una revisión más cuidadosa de estos datos muestra que la mayoría de los eventos fue central (48%) (fig. 3).
Fig. 3. Resultados de polisomnografías en frecuencia basal y bajo estimulación auricular 15 latidos por encima de la media basal. AAI + 15: estimulación auricular 15 latidos por encima de la frecuencia basal; Central: apneas centrales; FC med: frecuencia cardíaca media; FC min: frecuencia cardíaca al minuto; IAH: índice apnea-hipopnea; OBST: apneas obstructivas; Sa O2 min: saturación de oxígeno. VVI: estimulación ventricular aislada; VVI-40: estimulación de seguridad VVI a 40 latidos por minuto como estimulación de seguridad; Modificado de Garrigue et al44.
El mecanismo potencial de este efecto podría ser que los eventos respiratorios (apneas e hipopneas) están asociados con hipoxemia, retención de anhídrido carbónico, reducción de la presión arterial y de la bradicardia-taquicardia que sigue al final del evento. Todo ello podría estar relacionado con cambios en el tono vagal y causaría alteraciones en la frecuencia cardíaca45,46. Por lo tanto, la reducción en la variación de la frecuencia cardíaca podría disminuir el número de eventos respiratorios. De hecho, se ha sugerido que las variaciones periódicas de la frecuencia cardíaca podrán producir cambios en el tono autonómico, el cual podría tener alguna influencia en la incidencia de apneas centrales. En consecuencia, la sobreestimulación del marcapasos funcionando a una frecuencia cardíaca mayor podría contrarrestar la influencia del tono vagal y mantener la actividad simpática.
Este posible mecanismo parece confirmarse en el estudio llevado a cabo por Balaban et al47. Los autores investigaron la media de la saturación arterial nocturna (SaO2) en pacientes con marcapasos estimulados a baja frecuencia. La SaO2 media nocturna mostró una correlación significativa (p < 0,05), tanto con la frecuencia cardíaca como con el porcentaje de estimulación auricular. El incremento de la frecue ncia cardíaca con el marcapasos mejoró la SaO2 nocturna. Los autores concluyeron que el incremento de la frecuencia cardíaca nocturna mediante estimulación auricular puede ser beneficioso en pacientes con apnea del sueño (fig. 4).
Fig. 4. Correlación entre la frecuencia cardíaca nocturna y la síndrome de apnea-hipoapea durante el sueño en pacientes con SaO2. SaO2: saturación arterial de oxígeno. Modificado de Baladan et al47.
Un aspecto no resuelto de esta hipótesis ha sido indicado por Gottlieb48. Aunque la bradicardia-taquicardia cíclica durante el sueño es común en pacientes con apnea del sueño, la disfunción del nodo sinusal se observa con más frecuencia como resultado de los cambios esclerodegenerativos en el sistema de conducción cardíaco, y este problema no se ha asociado con la apnea del sueño. Sin embargo, en una minoría de casos, la disfunción del nodo sinusal es «extrínseca» como resultado de una alteración autonóma que puede estar asociada con la apnea del sueño49. No obstante, el mecanismo potencial que explica la reducción de las apneas obstructivas y las hipopneas sigue siendo desconocido. Garrigue et al44 sugieren un mecanismo de tipo central que afectaría a ambos, al ritmo respiratorio y a la actividad de las motoneuronas faríngeas. Esto podría explicar plausiblemente la mejoría de las apneas centrales y obstructivas durante la sobreestimulación cardíaca. Sin embargo, los autores no aportan ninguna información acerca de los cambios hemodinámicos en sus pacientes. Por otra parte, como ha indicado Gottlieb48, si la presión arterial se reduce, bien como resultado de un empeoramiento de la función cardíaca, o como una respuesta a variaciones del gasto cardíaco, una disminución de los barorreflejos respiratorios podría haber incrementado el impulso central respiratorio.
Gottlieb48 añade que, mientras los efectos de las neuronas vagales aferentes pulmonares en la frecuencia cardíaca son ampliamente reconocidos y bastante bien comprendidos, los posibles efectos de las neuronas cardíacas aferentes en el aparato respiratorio han sido mucho menos estudiados. Así, permanece como una hipótesis aún no demostrada que el marcapasos auricular influya directamente en la señal de las neuronas cardíacas simpáticas aferentes. Se sabe que estas neuronas tienen un papel importante en la regulación de la presión arterial y la frecuencia cardíaca50. Así, aunque su efecto en la respiración es desconocido, las aferencias cardíacas vagales forman sinapsis en el núcleo del tracto solitario50, que es un importante componente del centro del control medular respiratorio51. Las aferencias pulmonares vagales a esta área inhiben la respiración. Por lo tanto, la especulación de que las aferencias cardíacas vagales también inhiben la respiración es una hipótesis atractiva y que debería ser estudiada. Además, las aferencias cardíacas simpáticas pueden también ser relevantes, puesto que la noradrenalina y la serotonina tienen un efecto respiratorio en las motoneuronas respiratorias, incluidas las que inervan la musculatura faríngea51.
Con objeto de comprobar estos datos, Pepin et al52 repitieron el protocolo del estudio de Garrigue et al44 en pacientes con marcapasos en modo de estimulación auriculoventricular derecha (DDD) y SAHS de mayor grado de afección que en el estudio precedente y con mayor grado de apneas obstructivas. La sobreestimulación con marcapasos no produjo modificaciones significativas en el IAH, la fragmentación del sueño o la estructura de sueño. Los autores concluyeron que en los pacientes tratados con marcapasos por bradiarritmias sintomáticas debería investigarse la posibilidad de que se presente apnea del sueño. Sin embargo, no fueron capaces de confirmar la eficacia de la sobreestimulación cardíaca para reducir el IAH.
Estos resultados difieren claramente de los obtenidos por Garrigue et al44. Sin embargo, en ambos grupos el número de pacientes evaluado fue pequeño. Además, hay diferencias significativas que mantendrían la hipótesis de que, en los casos con SAHS central, sí podría ser útil la estimulación cardíaca permanente nocturna (fig. 5).
Fig. 5. Comparación de resultados de los estudios de Garrigue et al44 y Pepin et al52. AH: apnea-hipopnea; FC: frecuencia cardíaca; FE: fracción de eyección; Ind. A. índice de apnea; NS: no significativo.
Antes de finalizar este apartado de actualización debemos recordar que en la actualidad contamos con una herramienta que nos permite realizar un seguimiento ambulatorio a largo plazo de estos pacientes con marcapasos y SAHS. Los generadores con biosensor de impedancia torácica pueden modular la respuesta de la frecuencia cardíaca para adaptarla al incremento de necesidades que acompaña a una taquipnea. Se han diseñado determinados dispositivos con este tipo de biosensor para ser capaces de detectar y almacenar la información del número de apneas e hipopneas que presenta el paciente. La validación de este sistema frente a una polisomnografía reglada simultánea permite aseverar que detecta de forma fiable las apneas y pierde fiabilidad en las hipopneas. En la evaluación clínica del sensor se estableció el punto de corte ideal en 20 en el índice apnea-hipopnea y se alcanzó con el detector un valor predictivo positivo de sólo 0,43 (intervalo de confianza [IC] del 95%, 0,20-0,69), pero con un valor predictivo negativo de 1 (IC del 95%, 0,95-1,0), una sensibilidad del 100% y una especificidad del 70%.
Se han publicado algunos trabajos en los que se ha confirmado la utilidad de este tipo de biosensores como monitores de SAHS, si bien los marcapasos utilizados no contaban con un sistema de almacenamiento específico de la señal ventilatoria y, por tanto, no ofrecían una información en el tiempo del número de apneas e hipopneas presentadas por el paciente53. Si posteriores estudios confirman el posible beneficio de la estimulación cardíaca, impidiendo las bradicardias nocturnas en los pacientes afectados de SAHS de etiología central, será muy atractivo contar con generadores capaces de incrementar la frecuencia nocturna ante la detección de apneas o hipopneas significativas.
DISMINUCIÓN DE LA ESTIMULACIÓN APICAL DERECHA
La estimulación en el ápex de ventrículo derecho altera el patrón de despolarización ventricular y puede aumentar la duración del complejo QRS, dando lugar a un patrón de activación similar al que ocurre en presencia de bloqueo de rama izquierda54, lo que conlleva una desincronización ventricular. Por ello, no es de extrañar que la estimulación apical derecha mantenida a largo plazo produzca efectos adversos sobre el ventrículo izquierdo en términos de estructura celular, geometría ventricular, disfunción sistólica y diastólica, regurgitación mitral y dilatación en los diámetros auriculares izquierdos. Todos estos cambios contribuyen a un deterioro hemodinámico.
En los últimos años, diferentes e importantes ensayos clínicos han puesto de manifiesto los efectos adversos de la estimulación apical derecha.
Ya es clásico el estudio danés de Andersen et al55, que demostró el beneficio obtenido con estimulación auricular aislada (AAI) frente a estimulación ventricular aislada (VVI) en pacientes con enfermedad del nódulo sinusal, en cuanto a disminución de fibrilación auricular, mortalidad total y cardiovascular, tromboembolismo e insuficiencia cardíaca. Este beneficio en términos de mortalidad total y cardiovascular, tromboembolismo y disminución de la insuficiencia cardíaca no se obtuvo en otros estudios, como el Mode Selecction Trial de Lamas et al56 ni en el estudio canadiense de Connolly et al57. Ambos compararon la estimulación DDD o AAI/DDD frente a la VVI en pacientes con enfermedad del seno o con enfermedad del seno y bloqueo AV (BAV), atribuyendo la falta de beneficio al efecto deletéreo de la estimulación en el ápex de ventrículo derecho.
El estudio de Nielsen et al58 comparó el tamaño auricular izquierdo y el tamaño y la función ventricular izquierda de 177 pacientes con enfermedad del seno y estimulación AAI frente a DDD con un seguimiento medio de 3 años. Mostró dilatación auricular izquierda y disminución de la función ventricular izquierda con la estimulación DDD, cambios que no se producían con la estimulación auricular.
En un subestudio del ensayo MOST59, en 1.332 pacientes con un complejo QRS de duración < 120 ms, se comprobó un porcentaje acumulado de estimulación ventricular del 90% en los pacientes con estimulación DDD, frente a un 51% con estimulación VVI. La incidencia de fibrilación auricular aumentó linealmente un 1% por cada 1% de aumento de estimulación ventricular acumulada hasta un 80-85%.
En pacientes con indicación de implantación de desfibrilador y fracción de eyección de ventrículo izquierdo < 40% sin indicación de estimulación cardíaca, el aumento de la estimulación ventricular acumulada obtenido con estimulación DDD70 frente a la estimulación VVI40 de reserva se acompañó de un aumento de la mortalidad por cualquier causa, y de la mortalidad o probabilidad de ingreso por agravamiento o desarrollo de insuficiencia cardíaca, tal como demuestran Wilkoff et al60 en el estudio DAVID.
Los pacientes con desfibrilador implantado por infarto de miocardio y fracción de eyección de ventrículo izquierdo < 30% que presentan un porcentaje de estimulación ventricular > 50% tienen mayor incidencia de desarrollo o agravamiento de la insuficiencia cardíaca, así como una mayor probabilidad de recibir terapias o descargas apropiadas por taquicardia y/o fibrilación ventricular, tal como demuestran Steinberg et al61 en un subestudio del ensayo MADIT II.
En un estudio reciente, O'Keefe et al62 demuestran que la presencia de un marcapasos permanente en la punta de ventrículo derecho es el mayor predictor independiente de deterioro de la función ventricular izquierda en un grupo de 59 pacientes con fracción de eyección basal determinada mediante tomografía computarizada por emisión de fotón único del 35%, y que era del 25% a los 18 meses.
Hasta ahora ningún estudio había examinado la importancia de la estimulación apical derecha como factor de riesgo de insuficiencia cardíaca en pacientes sin historia previa de ésta. Freudenberger et al63, en un estudio de cohorte de 11.426 pacientes, demostraron durante un seguimiento medio de 33 meses una mayor incidencia de ingresos por insuficiencia cardíaca en los pacientes estimulados frente al grupo control (el 20 frente al 12,5%).
Con todas estas consideraciones, y aunque la estimulación apical derecha haya sido la más comúnmente utilizada desde hace más de 50 años para el tratamiento de la bradicardia ligada a BAV con excelentes resultados, en la actualidad debemos intentar que el ventrículo derecho sólo sea estimulado cuando es estrictamente necesario.
Recientemente se han desarrollado 2 algoritmos que permiten la estimulación AAI siempre que se mantenga la conducción AV, con cambio automático de modo a estimulación DDD cuando esta conducción falla, aportando lo mejor de ambos modos de estimulación, como es la despolarización habitual del ventrículo a través del sistema específico de conducción y el soporte de la estimulación ventricular en presencia de BAV. Son el AAIsafeR® de Ela Medical y el Managed Ventricular PACING® (MVP) de Medtronic Inc., que están incorporados en las últimas familias de marcapasos bicamerales y desfibriladores. Describiremos brevemente el funcionamiento de estos algoritmos, comenzando por el AAIsafeR®, que fue el primero que se introdujo en el mercado.
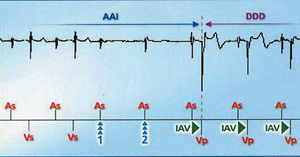
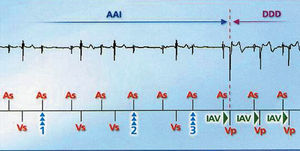
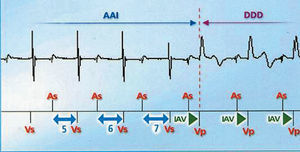
Como ya hemos mencionado, se trata de una estimulación AAI de manera que tras un evento auricular no se inicia el intervalo AV (IAV), reiniciándose el intervalo de escape auricular tras cada estimulación o detección auricular. Si hay 2 ondas p no seguidas de detección ventricular pasará a modo DDD con IAV programado, o si hay 3 ondas p de 12 sin detección ventricular. También podremos programar el cambio a DDD tras IAV demasiado prolongados en reposo o sólo durante el ejercicio, produciéndose el cambio tras 7 IAV largos consecutivos. Los algoritmos de prevención de fibrilación auricular también pueden ser activados. Una vez en modo DDD se intentará de nuevo volver a AAI tras 12 detecciones ventriculares, tras 100 ciclos en DDD o una vez al día a menos que considere BAV persistente (45 cambios de AAI a DDD en 24 h o 15 cambios AAI a DDD al día en 3 días consecutivos o más del 50% del tiempo en modo DDD durante 1 h) (figs. 6-8).
Fig. 6. Comportamiento del AAIsafeR® en presencia de BAV de tercer grado. Ante 2 ondas p consecutivas no seguidas de detección ventricular, cambio a modo de estimulación DDD con IAV programado. AAI: estimulación auricular aislada; AAIsafeR®: algoritmo de estimulación auricular a demanda seguro con respuesta en frecuencia, de Ela Medical; AS: detección auricular; DDD: estimulación secuencial auriculoventricular derecha; IAV: intervalo auriculoventricular; VP: estimulación ventricular; VS: detección ventricular.
Fig. 7. Comportamiento del AAIsafeR® en presencia de BAV de segundo grado. Ante 3 ondas p no consecutivas de 12, no seguidas de detección ventricular, cambio a modo DDD con IAV programado. AAI: estimulación auricular aislada; AAIsafeR®: algoritmo de estimulación auricular a demanda seguro con respuesta en frecuencia, de Ela Medical; AS: detección auricular; DDD: estimulación secuencial auriculoventricular derecha; IAV: intervalo auriculoventricular; VP: estimu lación ventricular; VS: detección ventricular.
Fig. 8. Comportamiento del AAIsafeR® en presencia de BAV de primer grado. Tras comprobación de 7 IAV etiquetados como «largos» cambio a modo DDD con IAV programado. AAI: estimulación auricular aislada; AAIsafeR®: algoritmo de estimulación auricular a demanda seguro con respuesta en frecuencia, de Ela Medical; AS: detección auricular; DDD: estimulación secuencial auriculoventricular derecha; IAV: intervalo auriculoventricular; VP: estimulación ventricular; VS: detección ventricular.
El otro algoritmo disponible es el MVP®, que actúa de forma similar aunque no idéntica. También consiste, como el anterior, en una estimulación AAI que emitirá un impulso ventricular de seguridad a 80 ms de la segunda onda p no seguida de detección ventricular. Si se repite en 2 ocasiones consecutivas o en 2 de 4 ciclos cambia a modo DDD con el IAV programado. Buscará de nuevo la conducción AV intrínseca a intervalos de tiempo crecientes de forma geométrica en ausencia de detección ventricular (figs. 9 y 10). También en este caso pueden activarse los algoritmos preventivos de fibrilación auricular y el cambio de modo ante taquicardias auriculares.
Fig. 9. Comportamiento del MVP® con emisión de impulso ventricular de seguridad a 80 ms de la onda p que sigue a la primera onda p que no se acompaña de detección ventricular, con cambio a modo DDD si se repite en 2 ocasiones consecutivas. AS: detección auricular; DDD(R) estimulación secuencial auriculoventricular con autorregulación en frecuencia; IAV: intervalo auriculoventricular; MVP®: algoritmo de estimulación ventricular derecha controlada de Medtronic Inc.; V: ventricular; VP: estimulación ventricular; VS: detección ventricular.
Fig. 10. Esquema de funcionamiento del MVP® en diferentes situaciones, como son las taquicardias auriculares y la búsqueda de la conducción AV tras el cambio de modo a DDD(R) en intervalos de tiempo crecientes según progresión geométrica. AAI(R): estimulación auricular aislada a demanda con autorregulación en frecuencia; AV: auriculoventricular; BAV: bloqueo auriculoventricular; DDI(R): estimulación secuencial auriculoventricular sin posibilidad de seguimiento auricular con autorregulación en frecuencia; TA/FA: taquicardia auricular/aleteo o fibrilación auricular.
La mayoría de los pacientes que son tratados con marcapasos por enfermedad del seno tiene una secuencia de activación ventricular normal, con una duración de QRS < 120 ms, por lo que no requieren estimulación ventricular continua. Además, la mayoría tiene preservada la conducción AV, que se mantiene estable con el tiempo56,64,65. Tampoco los pacientes con BAV paroxístico van a requerir estimulación ventricular durante gran parte del tiempo.
También es muy importante evitar la estimulación apical derecha en pacientes con desfibrilador implantable con conducción AV intacta.
Diferentes estudios demuestran que la estimulación ventricular desde otros puntos diferentes al ápex del ventrículo derecho (tracto de salida VD, haz de His) consigue un gran beneficio hemodinámico66-69. De todas maneras, en la actualidad parece prematuro abandonar la estimulación apical derecha en favor de otros puntos para preservar la función ventricular izquierda. Todavía necesitamos estudios más estandarizados, extensos, multicéntricos y a más largo plazo70,71.
La estimulación AAI, que por definición elimina la posibilidad de estimulación ventricular, está indicada en pacientes seleccionados con enfermedad del nódulo sinusal y conducción AV intacta. Aunque la incidencia anual de BAV es baja, la primera manifestación es el síncope en más del 50% de los pacientes. Por ello, en Estados Unidos rara vez se utiliza la estimulación AAI, y es más frecuente su utilización en Europa en pacientes con enfermedad del nódulo sinusal, conducción AV intacta y sin trastorno de la conducción intraventricular. La estimulación AAI no está indicada en pacientes con desfibrilador en los que la mayoría de las veces se implanta un sistema bicameral, por la necesidad de mantener la sincronía AV y la capacidad de discriminar arritmias supraventriculares.
Los algoritmos disponibles hasta ahora de extensión del IAV han mostrado resultados modestos en cuanto a la disminución de la estimulación ventricular72-74. Además, presentan algunos inconvenientes, como son la posibilidad de interferir con otros ciclos del marcapasos, limitar la frecuencia máxima de seguimiento, favorecer el desarrollo de taquicardias de asa cerrada y dificultar el reconocimiento de arritmias auriculares. Finalmente, en pacientes con desfibrilador puede dar lugar a defectos de detección de taquicardia ventricular debido a los períodos de blanking.
Tanto el AAIsafeR® como el MVP® han demostrado su eficacia en la reducción del porcentaje de estimulación ventricular y también su seguridad en pacientes con enfermedad del nódulo sinusal, en pacientes con BAV y en pacientes con desfibrilador75-82. Queda por demostrar el efecto sobre la función ventricular a largo plazo.
Correspondencia: Dr. R. García Calabozo.
Servicio de Cardiología. Hospital de León.
Altos del Nava, s/n. 24071 León. España.
Correo electrónico: rgcalabozo@infocarlo.es