Palabras clave
INTRODUCCIÓN
Debido al envejecimiento de la población y al empleo de nuevas técnicas de imagen cada vez más eficaces, la prevalencia de afecciones en la aorta torácica ha aumentado de forma significativa en los últimos años. Por otra parte, el conocimiento de la historia natural de estos procesos ha sentado nuevas indicaciones terapéuticas. El seguimiento periódico y los avances en el tratamiento médico han mejorado la supervivencia de estos pacientes pero, a pesar de todo, no es posible detener la progresión de la enfermedad, por lo que resulta necesario un tratamiento para impedir la expansión y rotura de la aorta. Hasta ahora, la cirugía era la única opción terapéutica disponible, pero presenta una elevada morbimortalidad. El tratamiento endovascular se presenta como una alternativa menos invasiva a la cirugía y puede utilizarse incluso en los pacientes que, por edad o por la asociación de otras enfermedades, no son considerados en la actualidad aptos para el tratamiento quirúrgico1-6.
El objetivo del presente estudio es presentar y evaluar nuestra experiencia en el tratamiento endovascular de las afecciones de la aorta torácica y mostrar, además, un trabajo de colaboración entre diferentes especialidades médicas y quirúrgicas.
PACIENTES Y MÉTODO
Unidad de Aorta Torácica del Hospital Universitario Central de Asturias
Con el fin de dar una respuesta adecuada al diagnóstico y a las diversas formas de tratamiento que se pueden aplicar a las afecciones de la aorta torácica, se creó en el año 2001 en el Hospital Universitario central de Asturias una unidad multidisciplinaria formada por 1 cirujano cardíaco, 1 cirujano vascular, 1 radiólogo vascular, 1 anestesista, 1 cardiólogo de la unidad de hemodinámica y cardiología intervencionista y 1 del área de ecocardiografía. En esta unidad se evalúa a todos los pacientes con afecciones de la aorta torácica y se decide la actitud terapéutica más adecuada para cada caso.
Pacientes
Entre diciembre de 2001 y enero de 2004 se seleccionó en la unidad a 15 pacientes para tratamiento percutáneo intraluminal. Las características de la muestra y las causas de implantación se presentan en las tablas 1 y 2.
Protocolo de estudios previos al tratamiento
Después de la evaluación clínica se realizaron los siguientes estudios en todos los pacientes:
Angio-TC
El estudio angiográfico se realizó con un tomógrafo computarizado (TC) helicoidal con cortes de 3-5 mm de grosor y 2-3 mm de intervalo. La evaluación de la aorta torácica se extendía al menos desde los troncos supraaórticos hasta las arterias renales. Los datos fundamentales buscados en la angio-TC fueron los siguientes:
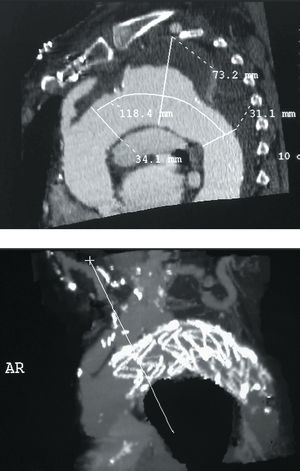
- En el aneurisma: su diámetro y longitud. Diámetro y estado de la aorta (presencia de trombo y/o calcio) en el lugar previsto de fijación proximal y distal de la endoprótesis. Distancia del aneurisma a la arteria subclavia izquierda y al tronco celíaco (fig. 1 A y B).
Fig 1. A: reconstrucción de la tomografía computarizada previa a la intervención en un paciente con aneurisma de aorta torácica que englobaba el origen de la subclavia izquierda. Diámetro proximal (34,1 mm) y diámetro distal (31,1 mm), aneurisma (73,2 mm) relleno con un gran trombo mural. Flecha grande: trombo mural. Doble flecha: bypass desde la aorta ascendente al tronco supraaórtico. B: el mismo caso, una vez implantada la endoprótesis.
- En las disecciones: relación del inicio de la disección con el origen de los troncos supraaórticos, buscándose las comunicaciones entre las 2 luces y determinando, asimismo, la relación de la íntima despegada con los orígenes de las arterias viscerales e ilíacas, el estado de la aorta abdominal y los diámetros de las 2 luces.
Arteriografía
Si tras la TC se decidía aceptar el caso para tratamiento endovascular, se practicaba una arteriografía con catéter centimetrado. En la arteriografía se consideró fundamental:
-Definir las relaciones de la lesión que se iba a tratar con el tronco celíaco.
- Estudio de la vía de acceso iliofemoral.
- Estimación de las dimensiones de la prótesis que se iba a implantar.
Resonancia magnética (RM)
Se realizó en los siguientes casos:
- Cuando había dudas acerca de la relación entre el aneurisma y los troncos supraaórticos.
- En las disecciones complejas.
Procedimiento intervencionista
Antes de la intervención se obtuvo de cada paciente el consentimiento informado aprobado por el Comité Ético de nuestro centro.
La endoprótesis utilizada fue la Talent® (Medtronic, Sunrise, Fl) (fig. 2). Es una endoprótesis recta autoexpandible formada por una prótesis de poliéster y una estructura de anillos de nitinol paralelos unidos por una barra de conexión. Para su liberación, la prótesis está montada sobre un catéter y comprimida dentro de una vaina. El diámetro externo del sistema oscila entre 22 y 25 Fr. En todos los casos se empleó una prótesis de diámetros proximal y distal un 10% mayores a los diámetros proximal y distal de la lesión, los cuales se determinaron mediante angio-TC previa.
Fig. 2. Endoprótesis torácica TALENT®. Arriba: prótesis dentro del portador. Centro: primer stent abierto. Abajo: aspecto de la endoprótesis liberada por completo.
En 2 pacientes fue necesario realizar, antes de la implantación, una cirugía vascular en los troncos supraaórticos. El primero era un paciente intervenido años antes por una disección aguda de la aorta ascendente en el que la disección había progresado por el cayado y la aorta descendente hasta la bifurcación ilíaca. El segundo paciente presentaba un aneurisma de cayado y aorta descendente que englobaba el origen de la subclavia y carótida izquierdas. En ambos casos se implantó un bypass aortobicarotídeo con ligadura del tronco innominado y la carótida y subclavia izquierdas para permitir la liberación posterior de la endoprótesis desde el tercio superior de la aorta ascendente.
Todos los procedimientos se realizaron en el laboratorio de hemodinámica bajo anestesia general y se efectuaron de forma programada, excepto 4: 1 rotura traumática de aorta, 2 disecciones agudas de tipo B con compromiso visceral y 1 aneurisma sacular roto con hematoma mediastínico. La vía de acceso fue femoral mediante disección. Siempre que fue posible se eligió la arteria femoral derecha, ya que la liberación es más fácil al estar los radios de todas las curvas en el mismo sentido. Se introdujo un catéter pigtail de 6 Fr percutáneo a través de la arteria femoral contralateral para realizar las angiografías necesarias para el control del procedimiento. Se realizó ecocardiograma (ECO) transesofágico durante la implantación para una mejor caracterización anatómica y, en los casos de disección, para conocer la relación entre la verdadera y falsa luz, así como las puertas de entrada. En los últimos procedimientos se realizó ECO intravascular con un catéter Sonicath Ultra G® de 12,5 MHz y un equipo Galaxy2® de Boston Scientific.
Tras administar anticoagulación con 10.000 U de heparina sódica se introdujo la prótesis a través de la arteriotomía y se avanzó bajo control radiológico. Una vez en la posición adecuada y antes de la liberación, se inducía una hipotensión controlada para minimizar los posibles desplazamientos de la prótesis debido al latido cardíaco. Tras la liberación, en ocasiones fue necesario inflar un catéter balón (Medtronic AVE, ReliantTM) en el interior de la prótesis para moldear sus componentes. Una vez finalizado el procedimiento y cerrada la arteriotomía, los pacientes fueron trasladados a la unidad de cuidados cardiológicos (UCC) del servicio de cardiología o a la unidad de reanimación en función de las características de cada paciente.
Se consideró que la implantación se había realizado con éxito cuando se consiguió avanzar y liberar la prótesis en la posición deseada.
Protocolo de seguimiento postimplantación
Se realizó angio-TC a la semana de la implantación. Los parámetros que se evaluaron fueron: presencia de fugas, ausencia de flujo en el saco aneurismático, posición de las endoprótesis, y diámetro y morfología de la aorta proximal y distal. Si no había fuga, se realizaba un nuevo control a los 6, 12 y 18 meses, y posteriormente de forma anual. En los pacientes tratados por disección se evaluaba de manera específica la perfusión de los vasos abdominales y, sobre todo, los dependientes de la falsa luz (fig. 3 A y B).
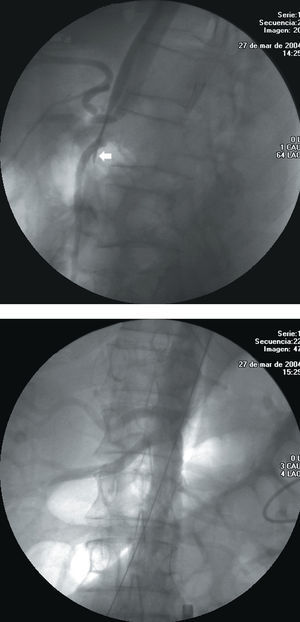
Fig. 3. A: tronco celíaco severamente afectado en un paciente con disección aórtica aguda. Puede verse el colapso de la luz verdadera que incluso llega a desaparecer (flecha). B: permeabilidad de todas las ramas después del procedimiento.
Las fugas fueron clasificadas en los siguientes tipos: tipo I cuando se producían en la inserción proximal o distal de las endoprótesis en la pared aórtica; tipo II ante la aparición de flujo en la aorta excluida por la endoprótesis a través de una rama arterial; tipo III cuando la fuga se producía a través de la unión entre las prótesis en caso de que se implantara más de 1; tipo IV, debidas a la porosidad de la prótesis (fig. 4). También fueron clasificadas en precoces cuando se detectaban entre el momento de la implantación y los primeros 6 meses de seguimiento, y tardías cuando se detectaban a partir de los 6 meses de la implantación.
Fig. 4. Endofugas de tipo III en varias localizaciones. Imagen de angio-TC en la que se aprecia un hematoma mediastínico anterior y una endoprótesis localizada en la aorta ascendente-cayado y la aorta descendente, colocada en el interior del aneurisma aórtico. El aneurisma no está excluido con relleno de contraste de luz falsa y verdadera.
En caso de que en el primer estudio se detectara una fuga, se realizaba otro al cabo de 1 mes. Si seguía habiendo escape y se sospechaba que era de un tipo diferente de una reentrada, se practicaba angiografía y se valoraba la actitud a seguir de forma individualizada. Cuando se consideraba que la fuga era debida a una reentrada, se evaluaba la evolución del aneurisma antes de proceder a nuevos procedimientos invasivos.
RESULTADOS
Inmediatos o intrahospitalarios
De los 15 pacientes seleccionados, en 1 no pudo implantarse la prótesis ante la imposibilidad de hacerla progresar a través de un bypass aortobifemoral de dacrón de 8 mm de diámetro implantado años antes. Se trataba del paciente con un aneurisma aterosclerótico roto y que fue trasladado al quirófano de cirugía cardíaca desde el laboratorio de hemodinámica para la sustitución de la aorta. En los 14 pacientes restantes se realizaron 16 procedimientos. La edad media de los pacientes fue de 64 ± 9,5 años. El resto de las características epidemiológicas se resume en la tabla 1. La longitud media de aorta cubierta fue de 230 ± 110 mm (rango, 110-440 mm). El número medio de endoprótesis implantadas por paciente fue de 2,3 (1 en 4 pacientes; 2 en 6 pacientes; 3 en 1 paciente; 4 en 2 pacientes y 5 en 1 paciente).
En 1 paciente con una prótesis en la aorta ascendente y disección crónica de la aorta descendente, durante la implantación de la prótesis se produjo, en el cayado, la rotura de la luz verdadera en la aorta descendente, con paso masivo de sangre a la luz falsa que obligó a la implantación de 2 prótesis más.
Debido a las características anatómicas, en 6 casos la endoprótesis se implantó inmediatamente distal al origen de la carótida izquierda, ocluyendo el origen de la subclavia.
La estancia media en UCC/reanimación fue de 2,4 días (rango, 2-6), con una estancia hospitalaria media de 11 días (rango, 7-25).
En la TC de control realizada a la semana de la implantación se evidenciaron 2 endofugas de tipo I, 1 de tipo II y 1 trombosis de la arteria mesentérica superior.
Complicaciones
Se produjo un fallecimiento durante el ingreso. Se trataba de un paciente de 80 años con insuficiencia renal crónica que, a la semana de la implantación, desarrolló un cuadro de disnea e insuficiencia respiratoria de rápida evolución que no respondió al tratamiento. No se pudo practicar necroscopia que confirmara el diagnóstico de sospecha de tromboembolia pulmonar. En el resto no se produjeron accidentes cerebrovasculares, tromboembolias arteriales ni ningún tipo de afección neurológica. Un paciente presentó durante la implantación una elevación del segmento ST en el electrocardiograma. En ese momento, la coronariografía mostró una oclusión de la coronaria derecha, sobre la que se realizó una angioplastia con implantación de un stent liberador de rapamicina. Tres (20%) pacientes presentaron síndrome postimplantación, con fiebre y leucocitosis, sin focalidad demostrable. Ambos se resolvieron de forma espontánea. Como complicaciones de la vía de acceso, se produjo 1 hematoma de partes blandas que no precisó drenaje. Dos (13,3%) pacientes desarrollaron anemia por hemorragia digestiva, 1 de ellos con deterioro de la función renal. En ambos casos fue necesario realizar una transfusión. Tras la implantación, ningún caso hubo de ser derivado para cirugía durante el ingreso.
Seguimiento
El seguimiento medio fue de 8,4 meses (7 días-29 meses). Un paciente consultó a los 8 meses por hemoptisis y dolor torácico, objetivándose mediante TC un hematoma intramural que fue tratado con la implantación de una nueva endoprótesis, con una evolución posterior favorable. En otro caso, el motivo de consulta fue claudicación intermitente e impotencia a los 3 meses de la implantación.
Se presentaron 2 casos de endofugas precoces detectadas más de 1 semana después de la implantación, 1 de ellas a los 31 días de la implantación en la que el paciente presentó dolor torácico y anemia. El estudio mediante TC mostró endofugas de tipo III en varias localizaciones. Tras estudiar el caso, no se consideró oportuno realizar una nueva intervención y se adoptó una actitud conservadora; el paciente permaneció estable hasta el momento del último seguimiento.
En otro paciente, en la TC realizada a los 3 meses de la implantación se observaba la presencia de una pequeña endofuga de tipo II en la parte distal de la endoprótesis, por relleno de arterias intercostales. No se detectó ningún caso de migración de prótesis ni se produjeron fallecimientos durante el seguimiento. Los datos de la evolución, junto con la etiología y el seguimiento, se resumen en la tabla 3.
DISCUSIÓN
La mortalidad de la cirugía electiva de los aneurismas de aorta torácica oscila, según las series, entre un 5 y un 20%4,5,7,8. La intervención emergente en situaciones de rotura tiene una mortalidad aún más alta9,10. La edad de la población afectada y la frecuente comorbilidad asociada determinan un elevado riesgo quirúrgico, también en términos de morbilidad, especialmente en lo relativo a las complicaciones neurológicas. Los accidentes cerebrovasculares y la paraplejía o paraparesia continúan siendo las complicaciones más temidas en este tipo de cirugía11-13. Los factores asociados al riesgo de lesión medular son la longitud del aneurisma, el tiempo de clampaje aórtico y la presencia de diabetes14,15.
En la última década, el manejo terapéutico de esta afección ha experimentado un notable avance. El tratamiento mediante prótesis endovasculares está despertando un creciente interés al tratarse de un procedimiento menos invasivo, que puede realizarse con anestesia regional e incluso local, en el caso de la aorta abdominal16,17.
Aunque los datos disponibles son limitados, la reparación intraluminal puede convertirse, como apuntan algunos autores, en el tratamiento de elección en la mayoría de los pacientes con lesiones de la aorta torácica. Hay evidencia creciente de que esta nueva técnica, en manos de un equipo coordinado, es una alternativa válida y efectiva frente a la cirugía o el tratamiento médico. Así, en diferentes series publicadas se indica una mortalidad perioperatoria entre el 0 y el 18%, esta última con el empleo de dispositivos Endofit, que mostraron resultados desalentadores3,18. En el seguimiento, la mortalidad oscila entre un 2 y un 17%19-21. En nuestra serie, tras un seguimiento medio de 8,4 meses los resultados son favorables, con una mortalidad intrahospitalaria del 6% y sin que se hayan producido más fallecimientos durante el seguimiento.
En la bibliografía, y dependiendo de las series, la incidencia de paraparesia supera el 5%. Su desarrollo parece estar en relación con la embolización, la pérdida sanguínea y una circulación colateral insuficiente2,3,22,23. La incidencia aumenta si, al mismo tiempo, se realiza una reparación torácica y abdominal24. En nuestra experiencia, sólo se presentó 1 caso de claudicación intermitente e impotencia, meses después del procedimiento. Cabe mencionar que en 2 de los casos seleccionados se realizó, antes de la implantación de la endoprótesis, una cirugía de bypass desde la aorta ascendente al tronco braquicefálico y la carótida izquierda para permitir la liberación de la prótesis, lo que abre la posibilidad de tratamiento endovascular en aquellos casos en los que el cayado aórtico se encuentra incluido.
Un aspecto que se debe tener en cuenta, en el que ya han insistido otros autores, es la gran importancia de una adecuada selección de los casos y del conocimiento preciso de la anatomía2. Un acceso vascular inadecuado o una excesiva tortuosidad del arco aórtico deben ser reconocidos y evitados.
La aparición de endofugas durante el seguimiento, como ocurrió en 2 de nuestros pacientes, parece relacionada con modificaciones en la fijación de la endoprótesis, debidas, a su vez, a cambios, generalmente dilatación, de la pared aórtica enferma. En cambio, como en la serie de Fattori et al2, tampoco encontramos complicaciones en los pacientes con aneurisma postraumático, en los que el dispositivo se fija sobre una pared aórtica normal. En los casos de disecciones de tipo B, por el momento parece prudente reservar el empleo de endoprótesis para los casos con una dilatación significativa, rotura inminente, signos de isquemia o en los que haya fracasado el tratamiento médico. Algunos autores señalan ya la necesidad de un estudio aleatorizado frente al tratamiento médico para conocer cuál sería el más adecuado para estos pacientes25.
CONCLUSIONES
Los resultados de las series publicadas y de la nuestra sugieren que la técnica endovascular es una modalidad de tratamiento posible, efectiva y segura en el tratamiento de las afecciones de la aorta torácica, y que es aplicable en pacientes de alto riesgo quirúrgico1-4,19-28. Su empleo requiere, como ya se ha señalado, una labor coordinada de varias especialidades médicas y una correcta selección de los casos.
Sin embargo, como todos señalan, se necesita un seguimiento estrecho y a largo plazo para conocer con certeza la fiabilidad y durabilidad de este nuevo procedimiento.
Correspondencia: Dr. C. Morís.
Unidad de Hemodinámica y Cardiología Intervencionista. Servicio de Cardiología. Hospital Universitario Central de Asturias.
Julian Clavería, s/n. 33006 Oviedo. España.
Correo electrónico: cesar.moris@sespa.princast.es