Palabras clave
INTRODUCCIÓN
El desarrollo del tratamiento con stents liberadores de fármacos (SLF) ha aportado una reducción significativa de las reestenosis angiográficas en el stent y de las revascularizaciones de la lesión diana clínica en comparación con las intervenciones percutáneas en las que se utilizan stents metálicos sin recubrimiento (SMSR)1,2. Los estudios iniciales realizados con SLF describieron tasas de reintervención < 10%3,4, si bien con el paso del tiempo se ha puesto de relieve que los pacientes con patrones de enfermedad más complejos y los pacientes del ámbito clínico real tienen unas tasas de reestenosis significativamente superiores5-11. Por otra parte, la adopción generalizada de la implantación de SLF ha conducido a que un número de pacientes considerable, en términos absolutos, presente reestenosis de SLF; esa cifra puede ser de unos 200.000 casos al año tan sólo en Estados Unidos. Por consiguiente, la magnitud de esta entidad clínica es considerable y su tratamiento óptimo continúa siendo un verdadero reto, en especial en los pacientes que presentan una reestenosis con un patrón difuso.
Los datos de ensayos recientes indican que la implantación de un SLF parece ser superior a la braquiterapia intravascular, al menos por lo que se refiere a la reestenosis de SMSR12,13. En las descripciones de casos de reestenosis de SLF, continúa sin estar claro si la adopción de una estrategia basada en el empleo de un tipo de SLF diferente del implantado inicialmente (el denominado tratamiento con SLF «hétero») es superior al tratamiento con el mismo tipo de SLF (el denominado tratamiento con SLF «homo»)14-17. Se ha demostrado que los stents liberadores de sirolimus (SLS) aportan unos resultados angiográficos y clínicos superiores a los de los stents liberadores de paclitaxel (SLP) en diversos subgrupos de pacientes con características clínicas de alto riesgo, como los que presentan reestenosis en stents metálicos sin recubrimiento2,18-23.
Así pues, hemos estudiado los resultados angiográficos y clínicos de pacientes con reestenosis de SLP tratados exclusivamente con SLS.
MÉTODOS
Población en estudio
En octubre de 2004, nuestro centro adoptó una política de empleo de SLS (stent Cypher) como dispositivo de elección en los pacientes que presentaban un fracaso terapéutico con un SLP (stent Taxus). Los pacientes a los que se aplicó este tratamiento entre octubre de 2004 y julio de 2005 fueron incluidos en el presente estudio. Los criterios de inclusión fueron la reestenosis en el stent, definida como la reaparición de un estrechamiento de un 50% o más de la luz en el segmento tratado con el stent o en un segmento de 5 mm proximal o distal al extremo del stent, y la presencia de signos o síntomas de isquemia recurrente o una estenosis de un 70% o más del diámetro. Se excluyó a los pacientes con una trombosis aguda del stent como causa de la reestenosis luminal. La complejidad de las lesiones reestenóticas se clasificó según el método descrito por Mehran et al24. Todos los pacientes dieron su consentimiento informado por escrito para los procedimientos del estudio y posterior obtención y análisis de los datos con fines de investigación. Se prescribió a los pacientes clopidogrel tras la intervención durante un mínimo de 1 año. El seguimiento clínico se realizó tras 1, 6, 12 y 24 meses. Se indicó a todos los pacientes que regresaran para una angiografía coronaria a los 5-8 meses del tratamiento de la reestenosis en el stent.
Evaluación cuantitativa de la angiografía coronaria y definiciones
Las angiografías coronarias basal, post-intervención y de seguimiento se almacenaron de forma digital y fueron analizadas luego en el laboratorio central de angiografía cuantitativa (Deutsches Herzzentrum München) con el empleo de un sistema automático de detección de bordes (CMS versión 6.0, Medis Medical Imaging Systems) por dos experimentados observadores independientes, que no tenían información sobre la implantación del stent inicial ni sobre el stent utilizado después en el tratamiento de la lesión de reestenosis. Todas las determinaciones se realizaron mediante cineangiografías obtenidas tras la administración intracoronaria de nitroglicerina. En todos los casos se utilizó la misma proyección de peor visualización. Se utilizó para el calibrado la punta de un catéter sin adelgazamiento, relleno de contraste. Los parámetros cuantitativos medidos fueron el diámetro de referencia del vaso, el diámetro mínimo de la luz antes y después de la intervención, el diámetro de la estenosis y la pérdida tardía de luz (diferencia entre el diámetro luminal mínimo al final de la intervención y el diámetro luminal mínimo en el seguimiento). Se realizó, además, un análisis cuantitativo del área del «segmento», que incluía el segmento en que se implantaba el stent y un margen proximal y distal de 5 mm respecto a éste. Se consideró que la intervención había tenido éxito si la estenosis residual era < 30%, con un flujo de grado TIMI 3. Las reestenosis angiográficas binarias se definieron como una estenosis 3 50% del diámetro en el área del segmento. La revascularización de la lesión diana (RLD; reestenosis clínica) se definió como cualquier intervención de revascularización, percutánea o quirúrgica, realizada sobre la lesión diana y acompañada de signos o síntomas de isquemia. Los eventos adversos cardiacos mayores (MACE) durante el seguimiento se definieron como muerte, infarto de miocardio o revascularización de la lesión diana.
Análisis estadístico
Las variables continuas se expresaron en forma de media ± desviación estándar y las variables discretas, en forma de número absoluto (porcentaje). Los análisis se llevaron a cabo con el programa informático de estadística S-Plus (Mathsoft Inc., Seattle, Washington, Estados Unidos).
RESULTADOS
Entre octubre de 2004 y julio de 2005, identificamos a 43 pacientes consecutivos (43 lesiones) con reestenosis en stents de tipo SLP que fueron tratados con una revascularización por causas clínicas, utilizando una implantación de SLS. En la tabla 1 se indican las características basales de los pacientes y sus correspondientes características angiográficas. La mayoría de los pacientes presentaban una enfermedad coronaria compleja multivaso. Tal como se preveía, hubo una proporción significativa de pacientes con diabetes (34,8%). Aproximadamente una cuarta parte de las lesiones afectaba a una bifurcación coronaria. Se observó un patrón focal de la reestenosis en 33 (76,7%) lesiones, mientras que hubo una reestenosis difusa en el resto (estenosis difusa en el stent, 8 [19%]; estenosis difusa distal al stent, 1 [2%]; estenosis difusa oclusiva, 1 [2%]). Hubo un 100% de éxitos de las intervenciones. En la tabla 2 se indican las características de las intervenciones practicadas. Las complicaciones precoces fueron escasas; sólo hubo 1 muerte en un plazo de 30 días.
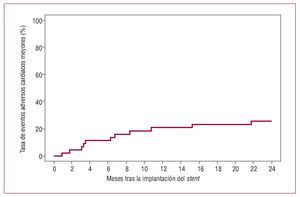
Se dispuso de seguimiento angiográfico en 36 (83,7%) pacientes. Se observó reestenosis binaria en 6 (16,7%). En la tabla 2 se presentan los resultados de un análisis cuantitativo de la angiografía coronaria en el seguimiento realizado a los 6 meses. La pérdida luminal tardía en el stent fue de 0,32 ± 0,54 mm. Se dispuso de datos sobre la evolución clínica a los 30 días y a los 2 años de todos los pacientes, tal como se presenta en la tabla 3. Se produjeron 2 fallecimientos durante el período de seguimiento. En 5 (11,6%) pacientes fue necesario repetir la revascularización percutánea del segmento tratado con stent y en 2 (4,7%) se practicó después una intervención quirúrgica de bypass coronario, con lo que la tasa total de RLD fue del 16,3%. A los 2 años, un 74,2% de los pacientes continuaban sin presentar ningún MACE (fig. 1).
Fig. 1. Tasa acumulativa de eventos adversos cardiacos mayores (MACE) a los 2 años. Los MACE se definen como muerte, infarto de miocardio o revascularización del vaso diana.
DISCUSIÓN
Los resultados más destacados de este estudio son: a) el tratamiento de la reestenosis de un SLP mediante un SLS es factible y la implantación de un segundo SLF diferente del primero no se asocia a indicio alguno de efectos nocivos; b) la ganancia luminal se preserva bien en la nueva exploración angiográfica, y c) las tasas de RLD y MACE a los 2 años continúan siendo significativas.
Los datos publicados sobre muchos aspectos relativos al tratamiento más apropiado de los fracasos terapéuticos de los SLF continúan siendo escasos25. Aunque la investigación previa ha puesto de relieve que en los fracasos terapéuticos de SMSR la implantación de SLF da mejores resultados que la angioplastia con balón18,26 y que la braquiterapia intravascular12,13, no está claro que los resultados obtenidos en el tratamiento de las reestenosis de SMSR puedan extrapolarse al tratamiento de los fracasos terapéuticos de los SLF. Si examinamos los mecanismos que se han propuesto para explicar la superioridad de los SLF respecto a la braquiterapia en ensayos recientes realizados en pacientes con reestenosis en un stent12,13 (mayor ganancia aguda inicial, preservación tardía comparable de la ganancia obtenida y atenuación del efecto de reestenosis del borde asociado a la radiación), parece razonable un enfoque terapéutico basado en el empleo de otro SLF, al menos inicialmente, para tratar la reestenosis de un SLF. En la actualidad no hay datos que respalden la superioridad de un stent liberador de un fármaco sobre otro en esta población, ni que una estrategia de uso del mismo SLF, es decir, «homo», sea mejor que usar un SLF diferente, es decir, «hétero»15-17.
Nuestro estudio tiene unas características únicas en cuanto a la presentación de los resultados en pacientes a los que se aplica un tratamiento estandarizado preespecificado (es decir, la implantación de un SLS) para la reestenosis de un SLF, y por la inclusión de un porcentaje elevado de pacientes con un seguimiento angiográfico. A este respecto, es de destacar la tasa relativamente baja de reestenosis angiográfica observada (16,7%). A pesar de unos tamaños del vaso de referencia similares o mayores tras la intervención, Lemos et al14 y Cosgrave et al16 describieron unas tasas de reestenosis binarias del 42 y el 26,4%, respectivamente, en grupos de pacientes que parecían estar bien igualados en cuanto a la complejidad de la enfermedad. El primero de estos grupos de investigación describe también una pérdida tardía de luz que se aproxima a la observada en la época de los SMSR. En ambos estudios, los pacientes con reestenosis fueron tratados con SLP o con SLS y no se indican los resultados obtenidos con cada dispositivo de manera específica. Cabe argumentar que las tasas más altas de reestenosis recurrente puedan deberse a una dilución del efecto del tratamiento con SLF como consecuencia de la inclusión de SLP y SLS en los protocolos de tratamiento y, por consiguiente, que las diferencias de eficacia en la reestenosis específicas de cada dispositivo puedan ser de especial importancia en este grupo de pacientes complejos. Esto puede interpretarse como una confirmación del concepto central de la intervención coronaria percutánea en la época de los SLF, es decir, que la persistencia de los resultados de la intervención está relacionada tanto con la optimización de la ganancia aguda en la intervención como con la reducción al mínimo de la pérdida tardía (p. ej., el uso de SLS), independientemente de que se trate de lesiones de novo o lesiones de reestenosis27,28.
Por otra parte, nuestro estudio resalta nuevamente que la revascularización percutánea de una reestenosis de un SLF se continúa asociando a unas tasas relativamente elevadas de MACE y RLD a los 2 años (el 25,8 y el 16,3% respectivamente), si bien esto puede considerarse aceptable en pacientes de una cohorte de alto riesgo, con una complejidad de la enfermedad coronaria que causa dificultades. Esto concuerda con las observaciones que indican que las reestenosis en un stent, a diferencia de las reestenosis aparecidas tras una angioplastia, no son un proceso benigno y pueden asociarse a una mala evolución a medio plazo26,29. Es interesante señalar que estos episodios se produjeron de manera progresiva durante el periodo de seguimiento, sin que hubiera ningún indicio claro de influencia de la repetición de la angiografía a los 6-8 meses que exigía el protocolo. Debe señalarse que estas cifras son más altas que las tasas descritas con el empleo de un SLS para tratar la reestenosis de un SMSR en nuestro centro18 (el 11 y el 8% respectivamente) a pesar de una complejidad de la enfermedad aparentemente similar (patrón difuso de reestenosis en un 40%; tamaño del vaso, mediana [rango intercuartílico], 2,6 [2,23-2,93] mm; longitud de la lesión, mediana [rango intercuartílico], 12,4 [7,9-18,3] mm). Aunque la validez de las comparaciones se ve limitada por el bajo número de casos y los 12 meses adicionales de seguimiento clínico en este estudio, es probable que el fracaso terapéutico del SLF represente un proceso patológico más resistente al tratamiento. La hipótesis de que los pacientes con reestenosis en SLF, y en especial los que presentan un patrón de reestenosis difuso, constituyen una subpoblación con unas características (como hipersensibilidad a polímeros y resistencia al tratamiento antiproliferativo/inmunosupresor) que predisponen al fallo de una nueva implantación de SLF. En consecuencia, nuevos estudios deberán aclarar si en estos pacientes la adopción de una estrategia de tratamiento alternativa (es decir, braquiterapia o revascularización quirúrgica) podría dar mejores resultados30.
Limitaciones del estudio
Nuestras observaciones se ven limitadas por el reducido número de pacientes estudiados. Ello impidió realizar un análisis multivariable de los factores predisponentes a un nuevo fallo de un SLF (la denominada reestenosis del stent resistente a múltiples fármacos) que tuviera sentido. No disponemos de datos de comparación de los resultados en una cohorte similar de pacientes con reestenosis de SLP que fueran tratados con una nueva implantación de SLP, puesto que consideramos a priori que esta estrategia terapéutica no era óptima.
CONCLUSIONES
Hemos puesto de relieve que, en casos de fracaso terapéutico de un SLP, la implantación de un SLS constituye una estrategia terapéutica razonable, que se asocia a una ganancia luminal persistente. Las tasas de RLD y MACE a 2 años fueron significativas pero aceptables en esta cohorte de pacientes con un proceso patológico complejo. Serán necesarios nuevos datos de ensayos aleatorizados para determinar si existe una especificidad de dispositivo en el uso de los SLF para tratar un fallo previo de un SLF y para valorar el tratamiento óptimo de los pacientes con reestenosis resistentes a múltiples fármacos.
ABREVIATURAS
MACE: eventos adversos cardiacos mayores.
RLD: revascularización de la lesión diana.
SLF: stents liberadores de fármacos.
SLP: stents liberadores de paclitaxel.
SLS: stents liberadores de sirolimus.
SMSR: stents metálicos sin recubrimiento.
Full English text available from: www.revespcardiol.org
VÉASE EDITORIAL EN PÁGS. 1120-2
Robert Byrne disfruta de una beca de formación del Irish Board for Training in Cardiovascular Medicine, financiada por A. Menarini Pharmaceuticals (Irlanda).
Correspondencia:
R. Byrne, MB MRCPI.
ISAR Research Centre.
Lazarettstrasse 36. D-80636 München. Alemania.
Correo electrónico: byrne@dhm.mhn.de
Recibido el 5 de febrero de 2008.
Aceptado para su publicación el 9 de junio de 2008.