Tras el implante de prótesis percutánea aórtica CoreValve®, pueden aparecer trastornos de conducción auriculoventricular que precisan marcapasos permanente (un 40-45% de los pacientes). El objetivo de nuestro estudio es detectar si alguna variable ecocardiográfica de 2 o 3 dimensiones podría predecir la aparición de trastornos de conducción auriculoventricular. Para ello se estudió en 26 pacientes consecutivos la relación de la prótesis con el septo interventricular; 12 pacientes (46,1%) presentaron trastornos de conducción auriculoventricular tras el procedimiento. Una penetración protésica en el tracto de salida del ventrículo izquierdo > 12 mm y una superficie de contacto del stent de la prótesis con el septo interventricular en diástole > 90% se asociaron fuertemente con la aparición de trastornos de conducción auriculoventricular (87,5%; p=0,034). La superficie de contacto del stent resultó ser el único predictor independiente de dicha complicación (odds ratio=1,12; intervalo de confianza del 95%, 1,01-1,25; p=0,03). Los resultados indican que la implantación más alta de las prótesis y la reducción de la longitud del stent podrían reducir la frecuencia de esta complicación.
Palabras clave
La implantación de prótesis biológicas aórticas por vía percutánea es una alternativa al tratamiento quirúrgico convencional de la estenosis valvular aórtica en pacientes de alto riesgo1. La prótesis CoreValve® (Medtronic-CorevalveTM, LLC; Minneapolis, Minnesota, Estados Unidos) es una de las utilizadas para este fin. Las características de la válvula nativa, el tejido perivalvular y la prótesis a implantar pueden influir en el éxito del procedimiento2. El diámetro del anillo valvular aórtico es un parámetro fundamental a la hora de escoger el tamaño de la prótesis, y es menos trascendente el tamaño del tracto de salida del ventrículo izquierdo (TSVI). La configuración de las prótesis CoreValve® y su técnica de implante hacen que una porción del stent valvular quede alojado en el TSVI (Figura 1). Tras el implante de este tipo de prótesis, es frecuente que aparezcan trastornos de la conducción auriculoventricular (TCAV) que requieren el implante de marcapasos permanente (en torno al 40% de los pacientes)3, 4, 5, 6, 7, 8, 9, 10.
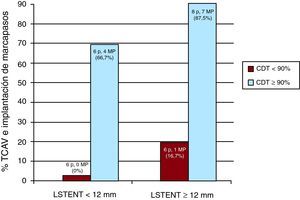
Figura 1. Incidencia de trastornos de la conducción auriculoventricular e implante de marcapasos en función de LSTENT y %CDT. CDT: porcentaje del stent protésico que contacta con el SIV en diástole final; LSTENT: longitud del stent protésico instalado en el TSVI a partir del anillo aórtico; MP: marcapasos; TCAV: trastorno de la conducción auriculoventricular.
El objetivo de nuestro estudio es detectar los parámetros de ecocardiografía transesofágica (ETE) 2D y 3D que se asocian al desarrollo de TCAV en las 48 h posteriores al implante de la prótesis aórtica percutánea CoreValve, con especial hincapié en la relación de la prótesis con la porción basal del septo interventricular (SIV), ya que es el lugar donde las vías de conducción principales pueden ser dañadas por el stent protésico1.
MétodosDesde el 14 de agosto de 2008 hasta el 30 de octubre de 2010, se implantó percutáneamente prótesis aórticas CoreValve® a 35 pacientes en nuestro centro (Hospital Clínico San Carlos, Madrid). El Servicio de Hemodinámica de nuestro centro seleccionó a los pacientes y el tipo de prótesis10. Se excluyó del estudio a los pacientes que ya tenían marcapasos previamente (n=5) o fallecieron en las primeras 48 h (n=4) tras el implante por causa diferente de los TCAV; finalmente quedaron incluidos en el análisis 26 pacientes. Los pacientes dieron su consentimiento para ser intervenidos y para que sus datos fueran utilizados con fines de investigación.
Todos los pacientes fueron monitorizados durante el procedimiento mediante ETE realizada con equipo Philips iE33 y sonda TEE X7-2t Live 3D matricial. Se realizaron archivo digital de las imágenes en el sistema Xcelera y procesamiento mediante el software QLab para imágenes 3D (Philips Electronics, Eindhoven, Países Bajos). Se utilizaron técnicas 2D, Doppler color, biplano Xplane® y 3D, escogiendo la técnica y la aproximación idóneas en cada caso para la observación y el control del proceso de implante valvular (valvuloplastia aórtica, alineamiento prótesis-anillo valvular, despliegue protésico y control inmediato tras el implante en planos a 120-140° o con técnica Xplane de 40-120°). Se determinaron con especial cuidado las siguientes medidas ecocardiográficas: a) longitud del stent protésico instalado en el TSVI a partir del anillo aórtico (LSTENT); b) la contractilidad septal previa al implante, definida como el porcentaje de excursión del SIV en el TSVI en sístole final (%SIV), y c) el porcentaje del stent protésico instalado en el TSVI que contacta con el SIV en sístole final (%CST) y en diástole final (%CDT). La medición de la penetración y zonas de contacto del stent (LSTENT, %CST, %CDT) se hicieron con ETE 2D, en planos de 120-140°, que ofrecen la mejor observación del TSVI y el stent protésico. Mediante ETE 3D, se comprobó la situación correcta de la prótesis en múltiples proyecciones inmediatamente después del implante. El %SIV expresa la reducción del TSVI producida por la contracción del SIV. El %CST y el %CDT se obtienen midiendo la porción de stent en contacto con el SIV en sístole final y diástole final respectivamente, y se expresan como porcentaje, correspondiendo al 100% el contacto total del SIV y el stent alojado en el TSVI tanto en sístole como en diástole. Se estudió la aparición de TCAV e implante de marcapasos permanente en las primeras 48 h siguientes al procedimiento.
Análisis estadísticoLas variables cualitativas se describen con su frecuencia relativa y las cuantitativas, en media±desviación estándar o mediana [intervalo intercuartílico] en caso de asimetría. Las diferencias entre grupos se analizaron con el test de la t de Student para variables cuantitativas y la de la χ2 para variables cualitativas. Se evaluó la interacción entre las variables independientes (%SIV, LSTENT, %CST, %CDT) para explorar si el cambio conjunto de dos variables modificaba el efecto estudiado. Para evaluar el poder predictivo de dicha interacción sobre la aparición de TCAV e implante de marcapasos, se categorizaron las variables cuantitativas por su mediana. Se realizó análisis de regresión logística multivariable para detectar los predictores independientes de la aparición de TCAV. Se analizó la variabilidad interobservador de las medidas de dos cardiólogos con amplia experiencia en la toma de dichas medidas ecocardiográficas, aplicando el índice kappa. El análisis se realizó con SPSS 15.0 (SPSS Inc., Chicago, Illinois, Estados Unidos).
ResultadosLa media de edad de los pacientes fue 82,8±6 años; 15 pacientes eran mujeres (57,6%). Los principales resultados se muestran en la Tabla 1. El %CDT se asoció a la aparición de TCAV tras el procedimiento. También hubo tendencia a la asociación entre TCAV y LSTENT, si bien no alcanzó significación estadística. El análisis de la interacción entre las variables mostró un valor añadido para la asociación entre %CDT y LSTENT (Figura 1) No aparecieron TCAV en 6 pacientes con %CDT < 90% y LSTENT < 12 mm; ocurrieron en 1 de 6 pacientes (17%) con %CDT < 90% y LSTENT ≥ 12 mm, 4 de 6 (67%) con %CDT ≥ 90% y LSTENT < 12 mm y en 7 de 8 (87,5%) con %CDT ≥ 90% y LSTENT ≥ 12 mm (p=0,034). El estudio de la contractilidad septal (%SIV) no se asoció a la aparición de TCAV. En el análisis multivariable (Tabla 2), el %CDT resultó ser el único predictor independiente de dicha complicación (odds ratio=1,12; intervalo de confianza del 95%, 1,01-1,25; p=0,03). La variabilidad interobservador fue κ=0,71.
Tabla 1. Características de los dos grupos según se implantara o no marcapasos tras el procedimiento
| Sin MP | Con MP | p | |
| Pacientes | 14 (53,8) | 12 (46,1) | |
| Edad (años) | 83±7,1 | 82,5±4,9 | 0,930 |
| Mujeres | 8 (57,1) | 7 (58,3) | 0,820 |
| FEVI (%) | 63,9±11,5 | 67,8±10 | 0,470 |
| Gradiente medio | 52,8±12,9 | 46,8±13 | 0,420 |
| Calcio anillo mitral | 14 (100) | 13 (100) | 1 |
| SIV (cm) | 1,5±2,8 | 1,6±1,1 | 0,910 |
| TSVI | 18±1,7 | 18±2,3 | 0,980 |
| LSTENT (mm) | 10,3±5 | 13,5±5,1 | 0,100 |
| %SIV | 15±9,1 | 13,9±7,3 | 0,680 |
| %CST | 73±37 | 91,9±27,7 | 0,140 |
| %CDT | 52±34,5 | 89,2±27,3 | 0,005 |
| ECG normal | 12 (85,7) | 7 (58,3) | 0,210 |
| ECG BRI | 1 (7,1) | 1 (8,3) | 0,820 |
| ECG BRD | 0 | 1 (7,6) | 0,520 |
| ECG HMB | 1 (7,1) | 2 (16,7) | 0,520 |
| ECG BAV I | 0 | 1 (8,3) | 0,700 |
| EuroSCORE | 18,3±8,3 | 18,6±7,5 | 0,900 |
| CoreValve n.o 26 | 12 (85,7) | 9 (69,2) | 0,210 |
| CoreValve n.o 29 | 2 (14,2) | 3 (25) | 0,260 |
%CDT: porcentaje del stent protésico que contacta con el SIV en diástole final; %CST: porcentaje del stent protésico que contacta con el SIV en sístole final; %SIV: porcentaje de excursión del SIV en el TSVI en sístole final; BAV I: bloqueo auriculoventricular de primer grado; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; HBM: hemibloqueo; LSTENT: longitud del stent protésico instalado en el TSVI a partir del anillo aórtico; MP: marcapasos; SIV: septo interventricular; TSVI: tracto de salida del ventrículo izquierdo.
Los datos expresan n (%) o media±desviación estándar.
Tabla 2. Análisis de regresión logística multivariable para el estudio de las variables predictoras de trastornos de conducción auriculoventricular tras el procedimiento
| OR (IC95%) | p | |
| Edad | 0,94 (0,74-1,18) | 0,62 |
| Fracción de eyección | 1,06 (0,83-1,35) | 0,60 |
| Gradiente medio | 0,87 (0,70-1,07) | 0,20 |
| Diametro TSVI | 0,59 (0,13-2,67) | 0,49 |
| Número de prótesis | 0,95 (0,43-2,09) | 0,90 |
| LSTENT | 1,22 (0,86-1,72) | 0,20 |
| %CST | 1,46 (0,83-2,56) | 0,20 |
| %CDT | 1,12 (1,01-1,25) | 0,03 |
%CDT: porcentaje del stent protésico que contacta con el septo interventricular en diástole final; %CST: porcentaje del stent protésico que contacta con el septo interventricular en sístole final; IC95%: intervalo de confianza del 95%; LSTENT: longitud del stent protésico instalado en el TSVI a partir del anillo aórtico; OR: odds ratio; TSVI: tracto de salida del ventrículo izquierdo.
La aparición de TCAV es una complicación frecuente4, 5, 6, 9, 10 tras el implante de prótesis aórtica percutánea tipo CoreValve®. El proceso de implante pretende alinear la prótesis lo mejor posible con el anillo valvular nativo. Una vez se realiza el despliegue de la prótesis, se produce una penetración del stent protésico en el TSVI (Figura 2, Figura 3) de hasta 17 mm, según los resultados obtenidos en nuestra serie. Este hecho ocasiona un contacto del stent con el SIV basal en una extensión variable. Es en esta región donde la porción distal del haz de His y la inicial de la rama izquierda son más superficiales y vulnerables a la compresión1. Existe además el factor añadido de que en estos pacientes suele haber hipertrofia de la porción basal del SIV. Dependiendo del grado de hipertrofia del septo basal, su contractilidad y el tamaño protésico, varía la incidencia de TCAV e implante de marcapasos permanente4, 5. El análisis ecocardiográfico pone de manifiesto el contacto entre el stent y el SIV tanto en sístole como en diástole. El grado de contacto podría explicar la incidencia de TCAV. En nuestro estudio el %CDT fue el mejor predictor de TCAV y de implante de marcapasos, superando a la LSTENT, si bien la interacción del %CDT y la LSTENT se asoció fuertemente a la aparición de TCAV (Figura 1). La contractilidad septal (%SIV) no se asoció a la aparición de TCAV en nuestro estudio. En función de nuestros datos, parece más determinante que el contacto entre el SIV y el stent se mantenga en diástole. Los resultados de nuestro estudio podrían explicar el menor número de pacientes que precisan marcapasos tras el implante de prótesis tipo Edwards8, ya que la penetración en el TSIV y, por ello, su contacto con el SIV son menores que con las prótesis tipo CoreValve. En nuestra serie la ETE en 3D fue una herramienta de utilidad que facilitó la observación de la prótesis, sus relaciones con la raíz aórtica nativa y también la propia configuración de la raíz aórtica. Sin embargo, no aportó ventajas sobre la ETE en 2D en las mediciones del anillo aórtico, TSVI, LSTENT, CDS y CDT, ya que estas mediciones no se pueden realizar directamente en la imagen 3D, sino que precisan de análisis offline.
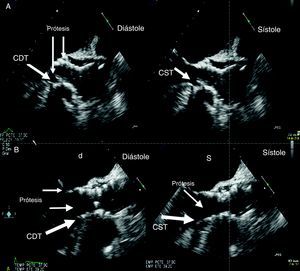
Figura 2. Superficie de contacto del septo interventricular con el stent protésico. A: paciente sin contacto. B: paciente con contacto en sístole y escaso contacto en diástole. CDT: contacto diastólico; CST: contacto sistólico.
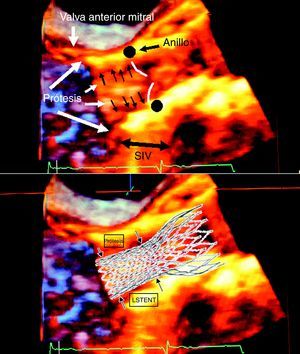
Figura 3. Ecocardiograma transesofágico en 3D de una prótesis CoreValve® y esquema de esta superpuesta a la imagen ecográfica. LSTENT: protrusión del stent protésico en el tracto de salida del ventrículo izquierdo; SIV: septo interventricular.
La principal limitación de este trabajo reside en la incapacidad para predecir la aparición de TCAV antes del implante valvular, ya que no se puede estimar la porción del stent que va a quedar en contacto con el SIV. Otra limitación es el pequeño tamaño de la muestra, si bien hay que tener en cuenta que se trata de un procedimiento terapéutico poco frecuente y todavía en investigación. Por otro lado, cabría pensar que alguno de los TCAV aparecidos podrían haber remitido en plazo mayor que el adoptado para la implantación del marcapasos permanente.
Nuestros resultados indican que un amplio contacto diastólico del SIV con el stent de la prótesis CoreValve®, en especial si se asocia a mayor penetración del stent en el VI, se relaciona con la aparición de TCAV y la necesidad de implante de marcapasos definitivo.
La implantación más alta de las prótesis y la reducción de la longitud del stent podrían disminuir la incidencia de esta complicación. Se requieren nuevos estudios que confirmen esta hipótesis.
Conflicto de interesesNinguno.
Recibido 20 Febrero 2011
Aceptado 28 Agosto 2011
Autor para correspondencia: Unidad de Imagen Cardiovascular, Servicio de Cardiología, Instituto Cardiovascular, Hospital Clínico San Carlos, Martín Lagos s/n, 28040 Madrid, España. calmeria.hcsc@salud.madrid.org