La extrasistolia ventricular originada en el tracto de salida de ventrículo derecho puede tener una respuesta pobre a fármacos y ser compleja de ablacionar mediante un sistema convencional con guía fluoroscópica debido a la dificultad en la inducibilidad. Describimos la ablación de extrasistolia ventricular de difícil inducibilidad originada en el tracto de salida de ventrículo derecho, mediante un sistema de cartografía sin contacto. Se realizó ablación de cinco focos extrasistólicos originados en tracto de salida de ventrículo derecho en una serie prospectiva de 4 pacientes. Los pacientes presentaban pobre calidad de vida y falta de respuesta a antiarrítmicos. Se realizó una media de tres aplicaciones de radiofrecuencia por foco, con un tiempo medio de aplicación de 113±15 s. Se obtuvo un 100% de éxito agudo y no hubo complicaciones. En un seguimiento medio de 30±16 meses, los pacientes se mantienen asintomáticos sin tratamiento farmacológico. El sistema de cartografía sin contacto permite una alta eficacia en la eliminación de extrasistolias ventriculares aisladas de difícil inducibilidad.
Palabras clave
La extrasistolia ventricular (EV) del tracto de salida de ventrículo derecho (TSVD) suele aparecer en pacientes sin cardiopatía estructural. La presentación puede ser aislada, incesante o en forma de taquicardias (constituyen el 80% de las taquicardias ventriculares idiopáticas). El principal mecanismo causal es el de actividad desencadenada, pero también se han postulado los mecanismos de reentrada o de automatismo anormal.
Los pacientes suelen presentar síntomas relacionados con el ejercicio, situaciones de estrés o toma de excitantes. Los síntomas pueden afectar a la calidad de vida y los incesantes pueden causar el desarrollo de taquimiocardiopatía.
El control con bloqueadores beta o verapamilo suele ser limitado. La ablación mediante radiofrecuencia puede ser eficaz, pero está dificultada por la escasa e impredecible inducibilidad de esta EV. Esto supone una limitación en procedimientos convencionales con guía fluoroscópica si la EV es escasa, pues la cartografía de activación es compleja y la cartografía de estimulación tiene una reducida resolución espacial.
El sistema de cartografía sin contacto (SCSC) se ha demostrado útil en la localización de los latidos ectópicos y como guía en su ablación1, 2. En el presente artículo describimos la ablación de EV del TSVD mediante un SCSC, el Ensite Array (St. Jude Medical; St. Paul, Minnesota, Estados Unidos). Es un sistema en el que se obtiene la localización gracias a un catéter multielectrodo Array (MEA). Este posee un balón de 7,5 ml con 64 microelectrodos que permiten adquirir simultáneamente más de 3.000 electrogramas unipolares virtuales a partir del análisis de un solo latido y los muestra en una imagen tridimensional de la cámara de interés.
MÉTODOSCaracterísticas de los pacientesEntre enero de 2006 y diciembre de 2009, se realizó una ablación mediante SCSC a 4 pacientes sin cardiopatía estructural y EV incesante sintomática del TSVD. La media de edad de los pacientes era 43±6 años y el 50% eran varones.
Todos presentaban pobre calidad de vida debido a EV muy sintomática y frecuente (media, 30.763±4.710 EV/día) con fracaso de al menos dos antiarrítmicos, uno de los cuales siempre era un bloqueador beta. En 2 pacientes se había intentado previamente, sin éxito, la ablación con un sistema convencional.
En todos ellos, el día del procedimiento sólo había una actividad extrasistólica escasa. Los fármacos antiarrítmicos se suspendieron al menos 5 vidas medias antes del procedimiento y se evitó la sedación.
Estudio electrofisiológicoUn catéter de ablación de 4 mm (Livewire TC; St. Jude Medical) se emplazó en el ventrículo derecho (VD) y, si tras perfusión de isoproterenol y estimulación ventricular no se lograban EV suficientes para realizar una cartografía de activación, se introducía el catéter MEA.
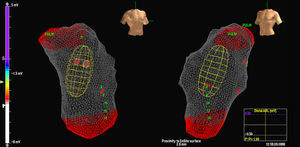
El catéter MEA se progresó mediante fluoroscopia sobre una guía de 0,035″ y el balón se situó en el TSVD a 2-3cm de la válvula pulmonar. En ese momento se iniciaba anticoagulación con heparina sódica. Tras ello, se reconstruía la anatomía del VD, prestando especial interés al TSVD y a la situación de la válvula pulmonar (Figura 1). Se requiere una distancia del centro del balón al foco < 4 cm (en distancias mayores disminuiría la exactitud de la reproducción de los electrogramas).
Figura 1. Imagen del catéter multielectrodo Array en tracto de salida de ventrículo derecho.
Posteriormente, se analizaban 3 latidos extrasistólicos para cada morfología de EV que presentara el paciente y se obtenían off-line los mapas de isopotenciales y de isocronas. Se emplearon filtros para los electrogramas bipolares de 30-500 Hz y para los electrogramas unipolares virtuales, un filtro de paso alto a 2 Hz.
El mapa de isopotenciales representa de manera dinámica la activación por zonas de máxima amplitud de voltaje, y se puede ver cómo se desplaza el frente de ondas. El punto de activación más precoz se define como el punto que presenta la activación más precoz respecto al inicio del QRS y posee un electrograma unipolar con morfología QS, con una deflexión negativa rápida. También se identifica mediante el mapa de isopotenciales el lugar de salida del frente de onda al resto del miocardio. El mapa de isocronas es un mapa convencional del tiempo de activación de la superficie endocárdica, empleando la señal unipolar virtual.
Se tomó como objetivo para la ablación tanto el área de activación más precoz como la salida del frente de activación. En estas localizaciones se realizaban aplicaciones puntuales de radiofrecuencia. Las aplicaciones se realizaron con control de temperatura con potencia limitada a 50 W, temperaturas inferiores a 55°C y una duración de 60 s. La ablación se consideraba exitosa si la EV desaparecía durante la aplicación y no se conseguía reinducir.
Todos los procedimientos fueron realizados por el mismo electrofisiólogo, que dirigía al ingeniero que manejaba el SCSC.
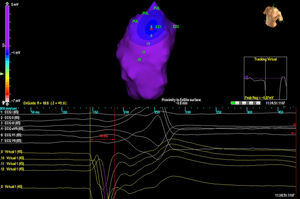
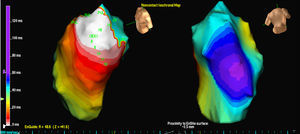
RESULTADOSTres pacientes presentaban una única morfología de EV, pero hubo un paciente que tenía dos morfologías. La localización fue en 3 casos septal y en 2 la pared libre del TSVD. En todos los casos, el mapa de isopotenciales (Figura 2) es lo que permitió localizar con precisión el foco de origen, y el valor del mapa de isocronas fue escaso (Figura 3).
Figura 2. Imagen del mapa de isopotenciales en paciente con dos extrasistolias ventriculares diferentes originadas en tracto de salida de ventrículo derecho. Cada salida se representa con las siglas EX (1 y 2). Aparece representado el punto de activación más precoz en EX1, con la imagen de QS en las unipolares virtuales (abajo).
Figura 3. Imagen del mapa de isocronas para la salida EX1 de la misma extrasistolia ventricular analizada en la figura 1. El blanco indica activación más precoz y el morado indica la activación más tardía.
Siempre se confirmaba que la EV no fuese originada mecánicamente y que coincidiese con la morfología de la EV clínica. En un paciente hubo que resituar el balón porque no permitía la adecuada movilización del electrocatéter de ablación, por estar muy cerca de la superficie endocárdica en la que se originaba la EV.
Una vez identificado el foco de origen, se realizó una media de tres aplicaciones de radiofrecuencia por foco, ablacionando tanto el punto de activación más precoz como la salida del frente de activación. El tiempo medio de aplicaciones fue de 113±15 s para cada foco. Durante las aplicaciones se observó aumento de la actividad ectópica precediendo a su interrupción, aunque este dato es inespecífico.
El tiempo medio de escopia fue 31±11 (21-46) min y el tiempo total de procedimiento, 136±38 min. Se redujeron los tiempos del procedimiento a medida que se superaba la curva de aprendizaje, pasando de 190 min en la duración del primer procedimiento a 100 min en el cuarto.
Se obtuvo un 100% de éxito agudo sin complicaciones; no reapareció la EV con perfusión de isoproterenol y se repitió el protocolo de estimulación. Tras un seguimiento medio de 30±16 meses, los pacientes continúan asintomáticos sin tratamiento farmacológico, y en el Holter de control al año, el número medio de EV fue 159±113/día.
DISCUSIÓNAunque otros autores han mostrado la utilidad del SCSC para ablacionar EV del TSVD2, 3, su uso no está extendido4. Presentamos nuestra experiencia obteniendo excelentes resultados desde los primeros casos. En la ablación de taquicardias ventriculares del TSVD se suele comunicar un éxito superior al 80%5, pero nuestro porcentaje de éxito fue mayor a pesar de que sólo podíamos cartografiar EV aisladas. Nuestro endpoint agudo fue la desaparición de EV, y se encontraba limitado por la escasa densidad de las EV durante el procedimiento. Por lo tanto, hubo que confirmar en la evolución la eficacia de la ablación con la disminución de la densidad EV en los Holters de seguimiento.
Nuestros pacientes tenían un origen focal de la arritmia, lo cual coincide con lo observado por otros autores2, 6. La ablación no se limitó al punto de activación más precoz, lo cual puede haber influido en nuestra elevada tasa de éxito.
El SCSC permitió identificar con un único latido el lugar preciso de origen de la EV. Aunque preferimos corroborar esa localización cartografiando otras EV idénticas, el sitio de origen no se modificaba. En nuestra experiencia, se logró la ablación con éxito basándonos únicamente en el mapa de isopotenciales.
Respecto a las limitaciones del sistema, este localiza el punto más precoz de activación del endocardio en la cámara explorada, aunque dicho punto no se localice en el endocardio, sino que proceda del epicardio u otra cámara anexa. En estos casos, lo que nos orienta a que el origen no está en el endocardio del VD es el análisis de las unipolares virtuales, ya que el punto endocárdico más precoz presentaría un rS.
Por otra parte, el catéter MEA puede producir EV mecánicas y, al estar localizado en el TSVD, nos podría confundir con la EV clínica. Para diferenciarlo, analizamos la correspondencia electrocardiográfica con la EV clínica y confirmamos que el punto de origen de la EV no contacte con el balón.
También puede darse que la EV se origine muy cercana a donde está situado el catéter MEA y no permita acceder al catéter de ablación. En estos casos, puede ser necesario resituar el balón.
En nuestra serie, el SCSC permitió la eliminación de EV del TSVD aisladas y de difícil inducibilidad de una forma eficaz y segura, reduciendo la complejidad de los procedimientos.
CONFLICTO DE INTERESESNinguno.
Agradecimientos
Agradecimiento por su revisión crítica a Joaquín Panduro.
Recibido 21 Enero 2011
Aceptado 1 Mayo 2011
Autor para correspondencia: Unidad de Arritmias, Servicio de Cardiología, Hospital Universitario Virgen Macarena, Avda. Dr. Fedriani 3, 41009 Sevilla, España. erdiazin@gmail.com